
33)絶食するとミトコンドリアが増える
体がみるみる若返るミトコンドリア活性化術33
ミトコンドリアを活性化して体を若返らせる医薬品やサプリメントを解説しています。
【生命はATPを使ってエネルギーのやり取りを行う】
生物は、細胞が活動するエネルギーとしてATPという物質を使います。ATPはAdenosine Triphosphate(アデノシン3リン酸)の略です。ATPはアデニンという物質にリボースという糖がついたアデノシンに、化学エネルギー物質のリン酸が3個結合したものです。
ATPは分子内に2個の高エネルギーリン酸結合を持ち、ATPがエネルギーとして使用されるとADP(アデノシン2リン酸)とAMP(アデノシン1リン酸)が増えます。リン酸1分子を放出する過程でエネルギーが産生されます。このようにリン酸分子が離れたり、結合したりすることで、エネルギーの放出や貯蔵を行うことができます。(下図)。
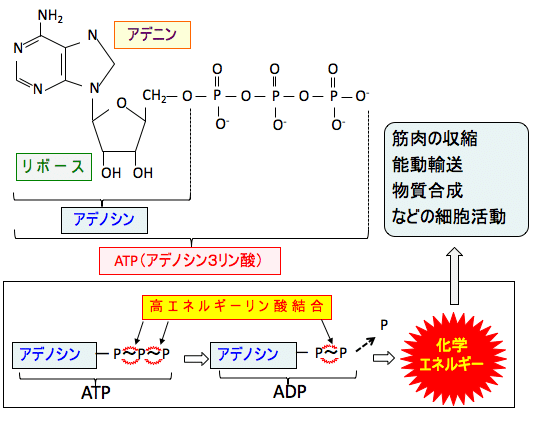
図:ATP(アデノシン3リン酸)は塩基のアデニンにリボースが結合し、そのリボースに3つのリン酸基が並んで結合している分子。ATPから加水分解によってリン酸基が外れるときにエネルギーが放出される。細胞は化学的な仕事を行うために必要なエネルギーの獲得と移動に関してATPを使用しており、ATPは生体内のエネルギー通貨として機能している。
【1日に自分の体重以上のATPを再合成している】
ATPの貯蔵量は少なく数秒程度で使い切ってしまうため、体内ではエネルギーを使って絶えずATP合成が行われています。ATPの産生が止まると、心臓は止まり、数分で死にます。青酸カリ(シアン化カリウム)はミトコンドリアでの酸素呼吸を阻害してATP産生をできなくするので、数分で死に至るのです。
1日に産生されるATPの総量は体重に匹敵する(あるいはそれ以上)と考えられています。
グルコース(ブドウ糖)の分子量は180で、ATPの分子量は507です。1分子のグルコースがミトコンドリアで酸素を使って完全に分解されると、32〜38分子のATPが産生されます。
グルコース1gは約4キロカロリーの熱量を産生しています。2000キロカロリーを全てグルコースで賄うと500gのグルコースになります。500グラムのグルコースは2.8モルになり、1モルのグルコースから32モルのATPが作られるとすると約90モルのATPが作られ、これは507g x 90モル=約45kgになります。つまり、この計算だと1日に45kgのATPを産生していることになります。
ATPの加水分解で得られるエネルギーは、ATP1モル当たり7.3キロカロリーです。ATP → ADP + リン酸 + 7.3キロカロリー/mol
です。
1日の消費カロリーを2000キロカロリーとすると、274モルのATPが必要になり、274モルのATPは約140kgになります。
いずれにしても、人間は1日に自分の体重に相当する量のATPを産生していることになります。しかしこれは、ATPをゼロから1日に数十kgを生成しているのではなく、ADPを使い回して、ADPにエネルギーとリン酸を使ってATPを再合成しているだけです。
実際に体内に常時存在するATPは約100グラム程度です。つまり、ATP ⇆ ADP + りん酸という回路反応を繰り返し、ADPは1日に1000回以上使い回されていてATPに再合成されています。(下図)。

図:食物の分解(異化)によって生成されるエネルギー(①)を使ってADPにリン酸を結合させてATPが合成される(②)。ATPが加水分解されてリン酸を放出する過程でエネルギーが産生され(③)、生命活動に使用される(④)。細胞はADPを再利用してATPを再合成している。ATPは瞬時に使用され、1日に再合成されるATP量は数十kgになる。
【体内のエネルギー不足を感知するAMP活性化プロテインキナーゼ】
運動や絶食でエネルギー(ATP)が減少すれば、ATPの産生を増やさなければなりません。そのためには、体内でATPが低下していることを感知するメカニズムと、感知したあとにATP産生を増やすメカニズムが必要です。この役割を担っているのがAMP活性化プロテインキナーゼというタンパク質です。
AMP活性化プロテインキナーゼ(AMPK)は細胞のエネルギー代謝を調節する因子として重要な役割を担っています。
AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇させるようなストレスに応答して活性化されます。
AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在します。
γサブユニットにはATPが結合していますが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わります。その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化されます。 活性化したAMPKは異化を亢進してエネルギー産生を亢進し、物質合成を抑制するように代謝をシフトします。(下図)。

図:AMPKはα、β、γの3つサブユニットからなり、細胞内のATPが減少するとγサブユニットに結合していたATPがAMPに置換する。これによってAMPKの構造変化が起こると、LKB1というリン酸化酵素の親和性が高まり、αサブユニットのスレオニン172がリン酸化されると、さらにAMPKの活性が高まる。カルモジュリンキナーゼキナーゼβ (CaMKKβ)もスレオニン172をリン酸化してAMPK活性を亢進する。活性化したAMPKは異化を亢進してエネルギー産生を亢進し、物質合成を抑制するように代謝をシフトする。
運動やカロリー制限や絶食はATPを減らし、AMP/ATP比を高めることによってAMPKを活性化します。糖尿病治療薬のメトホルミンはミトコンドリアの呼吸酵素複合体Iを阻害してATPの産生を低下させ、AMP/ATP比を上昇させてAMPKを活性化します。
LKB1以外のルートでのAMPKの活性化として、カルモジュリンキナーゼキナーゼβ (CaMKKβ)もAMPKの活性化にとって重要であることが示されています。ビタミンD3は細胞内のフリーのカルシウム濃度を上昇させてCa2+/カルモジュリン依存性プロテインキナーゼ・キナーゼ(CaMKKβ)を活性化します。したがって、メトホルミンとビタミンD3の併用はAMPKの活性を相乗的に高めることが指摘されます。(下図)。

図:運動やカロリー制限はATPが減少してAMP/ATP比を上昇してAMPKを活性化する。メトホルミンはミトコンドリアの呼吸鎖を阻害してATP産生を低下させる機序とLKB1を活性化する両方の機序でAMPKを活性化する。ビタミンD3は細胞内のフリーのカルシウムを増加させ、カルモジュリンキナーゼキナーゼβ (CaMKKβ)を活性化させてAMPK活性を亢進する。
【絶食やカロリー制限はサーチュインを活性化する】
体内のエネルギー不足を感知するメカニズムとして前述のAMP/ATP比の上昇によって活性化されるAMP活性化プロテインキナーゼの他に、NAD+/NADH比の上昇を感知して活性化されるサーチュインがあります。
ミトコンドリアのTCA回路によりNADHやFADH2の形で捕捉された水素は、ミトコンドリアのクリステに存在する一連の酵素系(呼吸鎖複合体 I~IV)とATP合成酵素(呼吸鎖複合体Vとも言う)の連鎖を経て、最終受容体である酸素(O2)に渡されて水 H2Oになります。 複合体 I~IVの段階は、ミトコンドリア内膜のタンパク質や補酵素間で電子のやり取りが起こる過程であるため電子伝達系(呼吸鎖)と呼ばれます。
電子伝達系によってミトコンドリアマトリックスから膜間空間にプロトン(水素イオン)がくみ出され、輸送されたプロトンによってミトコンドリア内膜の内外にΔΨと呼ばれる電気化学的ポテンシャル(プロトンによって生じるpH差および電荷の差)が作り出されます。マトリックス側に戻るプロトンの駆動力を利用してATP合成酵素がADPと無機リン酸からATPを合成します。これを酸化的リン酸化と言います。
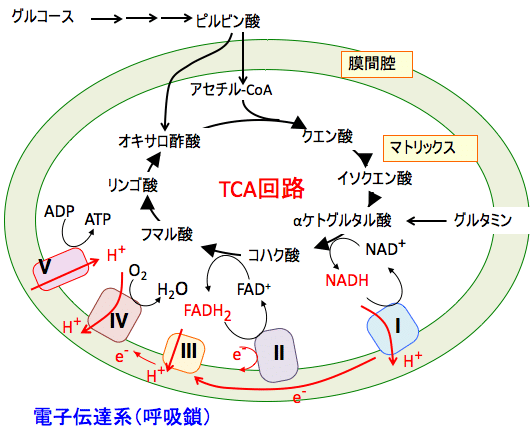
図:ミトコンドリアのTCA回路によりNADHやFADH2の形で捕捉された水素は,電子伝達系(呼吸鎖複合体 I~IV)によって、ミトコンドリア・マトリックスから膜間空間にプロトン(水素イオン)がくみ出され、ミトコンドリア内膜の内外に電気化学的ポテンシャル(プロトンによって生じる電荷の差)が作り出される。マトリックス側に戻るプロトンの駆動力を利用してATP合成酵素がADPと無機リン酸からATPを合成する。これを酸化的リン酸化と言う。
グルコース(ブドウ糖)や脂肪酸の分解によって産生したアセチルCoAがTCA回路(クエン酸回路)で段階的に代謝される過程で、エネルギーの元になる電子が発生し、NADH(還元型ニコチンアミドアデニンジヌクレオチド)とFADH2(還元型フラビンアデニンジヌクレオチド)として捕捉されます。
このTCA回路ではATPは1分子も生成されませんが、TCA回路で生成されたNADHとFADH2は、ミトコンドリア内膜に埋め込まれた酵素複合体に電子を渡し、この電子は最終的に酸素に渡され、まわりにある水素イオンと結合して水を生成します。
このようにTCA回路で産生されたNADHやFADH2の持っている高エネルギー電子をATPに変換する一連の過程を酸化的リン酸化と呼び、ミトコンドリア内膜の蛋白質や補酵素間で電子のやり取りを行うシステムを電子伝達系と呼びます。
電子伝達系は呼吸鎖とも呼ばれ、酸素の存在下に電子伝達体(NADHとFADH2)の再酸化によって大量のATPが合成されます。こうしてつくられたATPはミトコンドリアから細胞質へ出て行き、そこで細胞の活動に使われます。
NAD+の構造の中で酸化還元反応に関与しているのはニコチンアミドの部分です。酸化型のNAD+が水素と電子を受け取って還元型のNADHになります。(下図)。

図;NAD+が水素(H+)と電子(e-)を受け取ってNADHになる(①)。NAD+は還元型基質から水素を受け取り(②)、その基質を酸化し、還元型のNADHとH+を生成する(③)。NADH+H+は、他の物質の還元に使われる(④)。
NAD+は、全ての真核生物と多くの古細菌、真正細菌で用いられる電子伝達体です。さまざまな脱水素酵素の補酵素として機能し、酸化型 (NAD+) および還元型 (NADH) の2つの状態を取ります。
NAD+は生物の酸化還元反応の多くにおいて必須成分(補酵素)であり、好気呼吸(酸化的リン酸化)の中心的な役割を担っています。
以上の化学反応から分かるように、絶食や飢餓で食物が入ってこないと、NADHの産生が減少し、NAD+/NADH比が上昇します。NAD+/NADH比の上昇を感知して活性化するのがサーチュインです。
サーチュイン(sirtuin)は長寿遺伝子として、酵母からヒトまで進化的によく保存された遺伝子です。サーチュイン(サーチュインファミリー)は食物不足(飢餓状態)の時に活性化される遺伝子群で、NAD依存性脱アセチル化酵素です。哺乳類では七つのサーチュイン(SIRT1~7)が存在し、SIRT1、 6、7は核内、SIRT3、4、5はミトコンドリア、SIRT2は細胞質に局在します。

これらのサーチュインは NAD(nicotinamide adenine dinucleotide)依存性の脱アセチル化酵素としての活性をもっています。つまり、細胞内のNAD+量が増えるとサーチュインの活性は更新します。
サーチュインによって活性が制御されているタンパク質としてヒストン、P53、FOXO、PGC1α、LKB1などがあり、細胞周期、代謝、抗酸化システム、オートファジーなどの細胞機能に影響します。その結果、細胞老化や発がんを抑制し、寿命を延長する効果を発揮するのです。(下図)

図:サーチュインはNAD+/NADHの比率の変動を感知することによって、細胞内の栄養素の供給状況や物質代謝の状況を把握している(①)。絶食やカロリー制限などによって栄養素、特に糖が減少すると、NAD+が増え、サーチュイン(SIRT)が活性化する(②)。サーチュインは細胞質や核に存在するSIRT1(③)やミトコンドリアに存在するSIRT3(④)など7種類が知られている。サーチュインはタンパク質の脱アセチル化(アセチル基を除去する)によって様々な転写因子や酵素などの活性を調整する(⑤)。サーチュインによって活性が制御されているタンパク質としてヒストン、P53、FOXO、PGC1α、LKB1などがあり、細胞周期、代謝、抗酸化システム、オートファジーなどの細胞機能に影響する(⑥)。その結果、細胞老化や発がんを抑制し、寿命を延長する効果を発揮する(⑦)。
【AMPKとサーチュインはPGC1-αを活性化してミトコンドリアを増やす】
細胞内でミトコンドリアが新しく発生することをミトコンドリア新生(Mitochondria Biogenesis)といいます。通常、既存のミトコンドリアが増大して分かれて増えていきます。
ミトコンドリア新生で最も重要な働きを担っているのが、PGC-1α(Peroxisome Proliferative activated receptor gamma coactivator-1α)です。日本語訳は「ペルオキシソーム増殖因子活性化受容体γコアクチベーター1α」です。
PGC-1αは転写因子のPPAR-γと結合して、PPAR-γの転写活性を高める因子として見つかりました。PGC-1αは核内受容体を中心とするさまざまな転写因子と結合し標的遺伝子の発現を制御する転写コアクチベーターです。骨格筋、心筋、脂肪、脳などの臓器においてミトコンドリアの生合成および酸化的リン酸化を促進するなど細胞のエネルギー産生を制御する役割が知られています。
運動すると骨格筋のPGC-1α量が増えます。運動や絶食やメトホルミンがAMP活性化プロテインキナーゼ(AMPK)を活性化し、AMPKはサーチュインを活性化して転写因子のPGC-1αとFOXOファミリータンパク質を活性化し、ミトコンドリア機能や代謝を制御することが知られています(下図)。

図:絶食やカロリー制限や運動は体内のエネルギー低下によってAMP/ATP比とNAD+/NADH比を高める(①)。AMP/ATP比の上昇はAMP活性化プロテインキナーゼ(AMPK)を活性化し(②)、NAD+/NADH比の上昇はサーチュイン1(Sirtuin 1)を活性化する(③)。サーチュイン1はセリン・スレオニン・キナーゼのLKB1を活性化し、LKB1はAMPKを活性化する(④)。LKB1はAMPKを活性化し(⑤)、AMPKはサーチュイン1を活性化する(⑥)。サーチュイン1はPGC-1αの活性を亢進する(⑦)。PGC-1αは、ミトコンドリア新生を亢進して数を増やし、脂肪酸β酸化やTCA回路や酸化的リン酸化などミトコンドリア機能を亢進する(⑧)。その結果、抗老化と寿命延長の効果を発揮する。
カロリー制限(栄養不良を伴わない低カロリー食事療法)で、霊長類を含む多岐にわたる生物種において老化を遅延させ、寿命を延長させることが知られていますが、このカロリー制限のときに活性化されて寿命延長と抗老化作用に関与するのがサーチュイン遺伝子です。
サーチュイン1はPGC-1αを脱アセチル化することによって活性化します。活性化したPGC-1αはミトコンドリア新生を亢進します。
サーチュイン1はAMPK(AMP活性化プロテインキナーゼ)やPPAP(ペルオキシソーム増殖因子活性化受容体)によって活性化されます。さらに絶食時に発現が亢進するFGF21というホルモンによっても活性化されます。
【絶食するとPPARα/FGF21を介してPGC-1αが活性化してミトコンドリアが増える】
FGF21(Fibroblast growth factor 21;線維芽細胞増殖因子21)は他の線維芽細胞増殖因子と構造上の相同性を持っていますが、細胞増殖を促進する「増殖因子」としての活性はなく、糖や脂質代謝を制御するホルモン様作用を示すタンパク質です。肝臓・脂肪・筋肉・膵臓などで産生され、FGF21の主要な標的組織は肝・膵・脂肪組織と考えられています。
FGF21の生理的役割は、飢餓に対する適応と考えられています。空腹に反応して肝の脂質代謝が亢進し、さらにケトン体が産生されると、FGF21が放出されます。
FGF21を全身的に投与すると、血糖・中性脂肪が低下し、膵臓β細胞の機能が改善し、肥満と脂肪肝が改善し、アディポネクチンが増加し、心血管リスクファクターマーカーが減少するなどの効果が見られます。
ケトン食では血中FGF21が増加します。ケトン食が様々な健康作用を持つことは、FGF21を介してAMP活性化プロテインキナーゼ(AMPK)とサーチュイン1を活性化し、さらにサーチュイン1がPGC-1αを活性化して、ミトコンドリアを増やし、脂肪酸β酸化や酸化的リン酸化を亢進するというメカニズムが関与しています。(下図)。

図:絶食とケトン食はPPARα(ペルオキシソーム増殖因子活性化受容体α)を活性化してFGF21の発現を亢進する。FGF21はLKB1を活性し、LKB1はAMPK(AMP活性化プロテインキナーゼ)を活性化し、AMPKはサーチュイン1(Sirtuin1)を活性化する。サーチュイン1はPGC-1αを活性化し、PGC-1αはミトコンドリア新生を亢進し、ミトコンドリア機能を高める。
絶食やカロリー制限がミトコンドリアを増やす目的は、エネルギーが低下したので、細胞はエネルギー産生器官のミトコンドリアを増やそうとするためです。本当は食物摂取を増やすことが最善の解決策なのですが、食糧が手に入らなければ、自分でできることはエネルギー消費を減らし、エネルギー産生工場を増やすことが当面の対応というわけです。
ミトコンドリアを増やすために、AMP/ATP比の低下を感知して活性化されるAMP活性化プロテインキナーゼ(AMPK)と、NAD+/NADH比の増加を感知して活性化されるサーチュイン1の2つのメカニズムが作動し、PGC1-αが活性化されてミトコンドリアの数を増やし、機能を高めるのです。
このメカニズムを理解すれば、絶食やカロリー制限をしなくても、ミトコンドリアを増やせます。つまり、AMPKとサーチュインを活性化し、PGC-1αを活性化する化合物を使うと、それを達成できます。(下図)。

図:絶食やカロリー制限や運動は体内のエネルギー低下によってAMP/ATP比とNAD+/NADH比を高める(①)。AMP/ATP比の上昇はAMP活性化プロテインキナーゼ(AMPK)を活性化し(②)、NAD+/NADH比の上昇はサーチュイン1(Sirtuin 1)を活性化する(③)。AMPKはサーチュイン1を活性化する(④)。サーチュイン1はPGC-1αの活性を亢進し(⑤)、PGC-1αはミトコンドリア新生を亢進して数を増やし、脂肪酸β酸化やTCA回路や酸化的リン酸化などミトコンドリア機能を亢進する(⑥)。その結果、抗老化と寿命延長の効果を発揮する(⑦)。メトホルミン、プテロスチルベン、ビタミンD3はAMPKを活性化する(⑧)。ニコチンアミド・モノヌクレオチド、ニコチンアミド・リボシドはサーチュイン1を活性化する(⑨)。ケトン体のβヒドロキシ酪酸とベザフィブラートはPGC1-αを活性化する(⑩)。これらを組み合えせて服用すると、絶食やカロリー制限をしなくてもミトコンドリアの数を増やし、機能を高めることができる。
この記事が気に入ったらサポートをしてみませんか?
