老年学メモ:高齢者総合機能評価 (CGA)、転倒、高齢者がん診療ガイドライン 2022 年版/2023年度に出た第3版のSTOPP/START(PIMs-STOPP基準、PPOs-START基準)/DOAC,SGLT-2/高齢者の血圧・血糖・脂質・心房細動などの管理/健康寿命の国際比較/老衰・最期の4パターン/ACP/認知症/マルモ、多疾患併存
*有料化していますが無料でほぼ全文読めます。お金を支払っても追加で見れる分はほぼないです苦笑 面白いじゃん!と思って課金してくれると、今後私がこの内容を追記や変更した時にお知らせが届きます。関連のネタを見たり思いつくたびに追記予定です。
なぜ老年学が必要か?
高齢者は、若い人と比べるといろいろ違うので、考え方や対応も異なる
詳細は老年学の教科書読んでねといいたいですが、ざっくり言えば、
・若い人は病気や課題が1つだけでシンプルだが、高齢者は色々抱えている(いわゆる老年症候群とかマルモ。➡ポリファーマシー・相互作用などの問題)。
・高齢者は、臓器の力・代謝が落ちている。
・高齢者は、余命が限られており、何でも医学的な介入(手術・投薬など)をやればやるほどいいってわけでもない:高齢になるとメリットが小さくなり、デメリットが相対的に大きくなりがち。例)期待余命が1年の人に、侵襲が大きい手術や検査をやる意義・意味は?
・上記にも関連して、QOL/QODやコスパのことも考えることが重みを増す。これは個人的な視点でも社会としての視点でも。
・日本でいえば介護保険、グローバルにはLTC(後述)との関連で考える必要が出てくることが多いので、純粋な医学的な知識経験だけでは不十分になってくる。
・上記にも関連して、ACP/SDMなど意思決定支援も重要になってくる。
などの視点が重要かなと。
昔の高齢者と今の高齢者は中身が全然違う

脳血管障害や虚血性心疾患が10歳若い年齢群と同等レベルになるなど慢性疾患の受療率が低下していた。厚労省の国民生活基礎調査、人口動態調査では要介護認定率、死亡率も低下。秋下氏は「5~10歳の生物学的年齢の低下を示唆する」と分析した。
鈴木隆雄氏(国立長寿医療研究センター)は、東京都老人総合研究所の研究から、65歳以上の身体能力を92年と02年で比較。握力は男性4歳、女性は10歳若い年齢群と同等レベルに向上したほか、歩行速度が男女とも0.1~0.2m/秒上昇。鈴木氏は特に歩行速度について「ものすごく大きな改善」と強調し、「11歳の若返りが認められた」と説明した。
内藤佳津雄氏(日大心理学)は、国立長寿医療研究センターの研究を用いて知的機能の変化を調査。「現在の70代の知能検査の平均得点は、10年前の60代に相当する」と評価した。
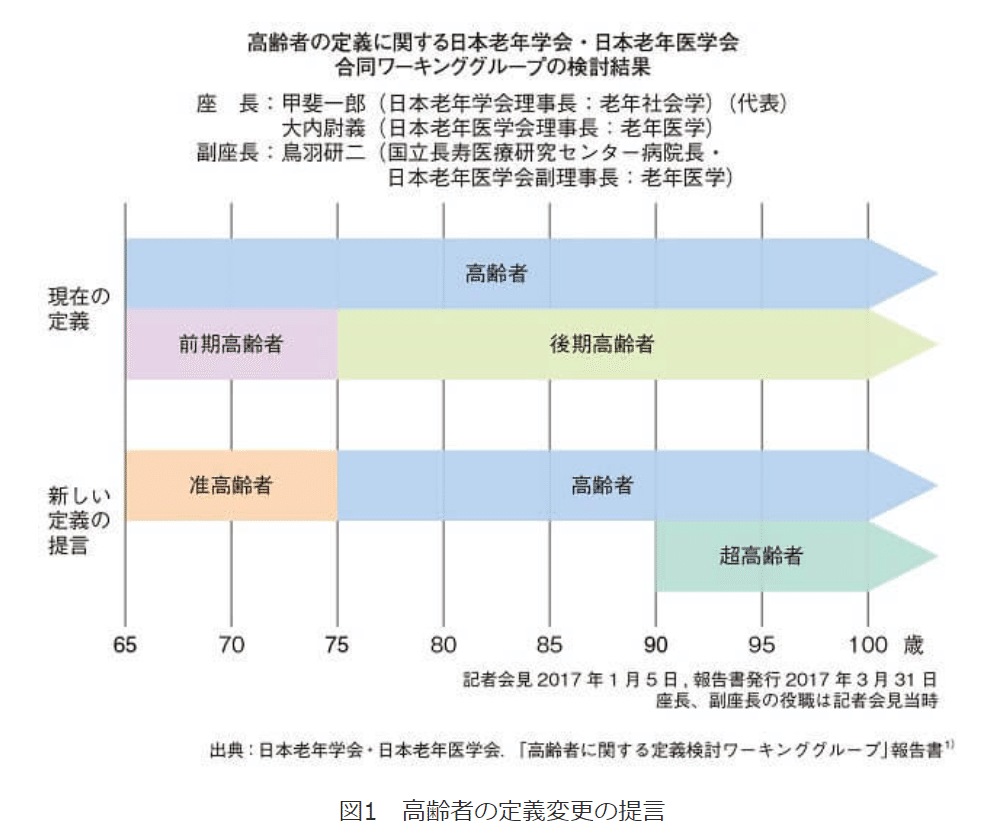

臨床的な感覚としても、65-74歳はあまり高齢者という感じはしない。その年代の人が重篤は疾患になっても、よほどベースが悪い感じじゃなければ、フルファイトだよね、と思ってしまいそう。
~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
高齢者総合的機能評価 CGA
Comprehensive. 総合的、包括的
Geriatric. 高齢者、老年医学
Assessment. 評価
➡老年学的な視点で、1つの臓器な病気だけにとらわれるのではなく、その人全体を評価したうえで、どうすべきかを考えることが重要である。
高齢者がん診療ガイドライン 2022 年版
http://www.chotsg.com/saekigroup/goggles_cpg_2022.pdf

http://www.m-junkanki.com/kennsinn/kennsinn_tenntou.html

どんなに頑張っても転倒はゼロにはできない


https://www.jpn-geriat-soc.or.jp/info/important_info/pdf/20210803_01_01.pdf
https://www.jpn-geriat-soc.or.jp/info/important_info/pdf/20210803_01_02.pdf
老年学専門医
令和元年時点で1500人くらいしかいない。=人口100万人当たり12.5人くらい
https://jmsb.or.jp/wp-content/uploads/2020/01/gaiho_2019.pdf

欧州の老年医は人口100万人当たり15~50人くらいらしい。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7685957/

米国には7~8000人くらいいそう
https://www.americangeriatrics.org/geriatrics-profession/about-geriatrics/geriatrics-workforce-numbers
日本の4~5倍いることになる。米国の人口は日本の3倍くらいなので、人口当たりでみれば日本よりも老年医は多そう。

~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
よくある議論:経管栄養や胃ろうについて
米国老年学会のステートメント
https://agsjournals.onlinelibrary.wiley.com/doi/10.1111/jgs.12924
摂食困難が生じた場合、進行した認知症高齢者には経管栄養は勧められない。なぜなら、死亡、誤嚥性肺炎、機能的状態、快適さの転帰において、経管栄養と同等であることが示されているからである。さらに、経管栄養は興奮、身体的・化学的拘束の増加、経管栄養に関連した合併症による医療利用、新たな褥瘡の発生と関連している。環境を変化させ、患者中心の摂食へのアプローチを作成することによって経口摂食を強化する努力は、進行した認知症高齢者に対する通常のケアの一部であるべきである。経管栄養は、個人の代理意思決定者が事前指示書や以前に述べた希望、あるいは本人が望むと思われることに従って、拒否したり受け入れたりできる療法である。経管栄養に関して、事前に表明された本人の希望を理解し(事前指示書の確認や代理意思決定者との面談を通して)、その希望をケアプランに取り入れることは、長期療養環境の入居者をケアする医療チームの全メンバーの責任である。病院、介護施設、その他の介護施設は、選択を促進し、共有されたインフォームド・デシジョンメーキングを支持し、経管栄養に関する希望を尊重すべきである。施設は、経管栄養を実施するよう個人または提供者に義務を課したり、圧力をかけたりすべきではない。
ポジション
進行した認知症の高齢者には経管栄養は推奨されない。進行した認知症患者に対しては、死亡、誤嚥性肺炎、機能的状態、快適さなどの転帰において、経管栄養と少なくとも同等である。経管栄養は、興奮、身体的・化学的拘束の増加、経管栄養に関連した合併症による医療利用の増加、新たな褥瘡の発生と関連している。
環境を変化させ、個々人を中心とした摂食へのアプローチを作成することによって経口摂食を強化する努力は、進行した認知症高齢者に対する通常のケアの一部であるべきである。
経管栄養は、個人の代理意思決定者が事前指示書や以前から表明されていた希望、あるいは本人が望むと思われることに従って、拒否したり受け入れたりできる医療療法である。
経管栄養に関して、(事前指示書の確認や代理意思決定者との面談を通して)本人が以前に表明した 希望を理解し、その希望をケアプランに取り入れることは、長期療養環境の入居者をケアする医療チー ムの全メンバーの責任である。
病院、介護施設、その他の介護施設は、選択を促進し、共有されたインフォームド・デシジョンメーキングを支持し、経管栄養に関する個人の希望を尊重すべきである。施設は、経管栄養を実施するよう、個人または提供者に義務を課したり、圧力をかけたりすべきではない。
~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
STOPP/STARTがversion3になった

https://link.springer.com/article/10.1007/s41999-023-00777-y
要旨
目的
STOPP/STARTは、潜在的に不適切な薬剤(PIMs-STOPP基準)と潜在的な処方漏れ(PPOs-START基準)に関する臨床的に重要な処方問題を定義しようとする、生理学的システムに基づいた明示的な基準セットである。STOPP/START基準の前2バージョンは2008年と2015年に発表された。本研究では、改訂され更新された第3版の基準について述べる。
方法
2014年4月から2022年3月までに発表された文献をシステムごとに詳細にレビューし、臨床的に重要な新しい明示的PIMおよびPPO基準を含め、もはや正しくないと考えられる基準や時代遅れと考えられる基準を削除することを目的とした。欧州8カ国から老年薬物療法の専門家として認められた11名の学識経験者からなるパネルがデルファイパネルに参加し、基準案の妥当性を検証する作業を行った。パネルには、SurveyMonkey®のオンラインプラットフォームを使って新しい基準案が提示され、パネリストは5段階のリッカート尺度で同意のレベルを示すよう求められた。
結果
24のエビデンスに基づく基準案(145のSTOPP基準、59のSTART基準)がパネリストに提示され、デルファイ検証法を用いて評価された。4ラウンドのデルファイ検証の過程で、パネルは133のSTOPP基準と57のSTART基準、すなわち合計190のSTOPP/START基準でコンセンサスを達成し、2015年に発表されたSTOPP/STARTバージョン2と比較して基準数が66.7%増加した。
結論
STOPP/START基準の完全に改訂された最新版が、デルファイ合意プロセスを用いたヨーロッパの専門家パネルによって検証された。
~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
背景
2018年、Pharmaceutical Care Network of Europeは、服薬レビューを「医薬品の使用を最適化し、健康アウトカムを改善する目的で、患者の医薬品を構造的に評価すること、薬物関連の問題を検出し、介入を推奨することを伴う」と定義した[1]。高齢者における潜在的に不適切な処方(PIP)の明確な基準は、1991年にBeers基準が初めて発表されて以来、大きな注目と影響力を得ている [2]。このような基準は、日常臨床においても、高齢者における薬物療法に関連した危害を最小化するために一般的に避けるべきPIPに関する研究においても、ますます重要な役割を果たしている。PIMsの発見と回避は、日常的な薬物療法の見直しの基本的な側面であり、包括的な老年医学的評価を受ける多疾病とそれに伴うポリファーマシーを有する高齢者において有益であると考えられている。STOPP/START基準の第1版と第2版がそれぞれ2008年と2015年に発表されて以来[3, 4]、日常診療における基準の適用に対する関心は着実に高まっている。STOPP/START基準は、ポリファーマシーを有する多疾患合併高齢者における日常的な薬剤レビューの一環として、有害な薬剤の非処方や有益な薬剤の導入(不適切に未処方である場合)を特定し、支援することを目的としている。PIMsを検出するためのSTOPP基準は、ほとんどの薬剤処方と同様に生理学的システムに基づいており、転倒リスクのある患者、オピオイド鎮痛薬を服用している患者、抗コリン作用を有する薬剤を服用している患者に関するカテゴリーが追加されている。START基準は、不適切な処方のもう一つの重要な側面である潜在的な処方漏れ(PPO)、すなわち、明確で有効な適応症にもかかわらず適切な治療が行われなかったり、適切な薬剤が処方されなかったりすることを検出するように設計されている。START基準では、PPOも使いやすいように生理学的システムに従って整理され、不適切に省略される可能性のある有益な薬剤について、より重要で一般的な事例が含まれている。2008年のSTOPP/STARTの最初のバージョンには、65のSTOPPと22のSTART基準が含まれていた[3]。2015年のSTOPP/STARTバージョン2は、80のSTOPP PIM基準と34のSTART PPO基準を含むように拡張された[4]。STOPP/STARTバージョン2基準は、英国国立臨床卓越研究所(NICE)[5]、英国王立総合診療医学会(Royal College of General Practitioners)と英国老年医学会(British Geriatrics Society)[6]によって、高齢者の日常的な服薬レビューに使用することが承認されている。2021年、British National Formularyは、高齢者というリスクの高い集団における不適切な処方(IP)を特定し、最小限に抑える手段として、高齢者の日常的な服薬レビューの際にSTOPP/START基準を使用することを推奨した[7]。STOPP/START基準は、高齢者のポリファーマシーに関するオランダの学際的ガイドラインにも導入されている[8]。STOPP/START基準は、様々な臨床場面における複数の集団で検証され、多くの異なる国の様々な場面における有効性に関連して評価されている[9]。2008年以降、STOPP/START基準を参照した研究発表の数は着実に増加しており、STOPP/START基準が欧州及び欧州以外の多くの国々の日常的な処方実践において、実践的な臨床的妥当性を有していることを示している。
高齢者の薬物療法に関するエビデンスベースの拡大に伴い、明確なPIMとPPO基準の定期的な更新と改訂が必要であることは、老年薬物療法の専門家の多くが認めている。近年、高齢者の薬物療法に関するエビデンスの進展を反映して、Beers基準 [10] やFORTA基準 [11] の更新版も発表されている。さらに、高齢者における薬物療法の最適な組み合わせを達成するためには、PIMの減薬とPPOの導入の組み合わせが必要となることが多く、このプロセスは「再処方」 [12] と呼ばれ、最新の明確なPIMとPPOの基準によって促進される。
STOPP/START第2版の発行から7年が経過し、高齢者のPIMとPPOに関する文献が大幅に増加していることを考慮すると、高齢者の薬物療法に関するエビデンスベースの継続的な進化を反映するために、いくつかの新しいPIMとPPOの基準が必要であることが予想された。そこで、STOPP/START基準を改訂し、更新することを目的とした。
方法
(i)構造に関するコンセンサス、(ii)継続的な妥当性と正確性のためのバージョン2基準の改訂、(iii)既存および提案された新基準をサポートするための文献の包括的なレビュー、(iv)このコンサルテーションエクササイズから生成されたバージョン3基準案のリストに関するコンセンサスを得るためのデルファイ検証エクササイズ。我々は、STOPP/START基準の2つ前のバージョンで用いられたのと同じシステムベースのデザインを、バージョン3でも維持することで合意した。
取られたアプローチは、システムごとに、バージョン2の基準とそのエビデンスベースを検討し、また、パネルメンバーが2014年4月から2022年3月までの間、すなわち、バージョン2の基準が完成し、バージョン3の基準案のタイムリミット以降に発表された文献に基づいて、新しい基準を提案することであった。まず、2015年のSTOPP/START第2版基準を検討し、日常的な処方実践においてもはや有効でないと考えられる基準があるかどうかを評価した。これは、以前に有効であったバージョン2の基準が、バージョン3の基準に含めるのにまだ適切であることを確認し、時代遅れであったり、もはや正しいとみなされない基準を削除するために重要であると考えられた。次に、より新しい治療ガイドラインをバージョン3の基準に取り入れるべきかどうかを判断するために、各生理学的システム内の様々な薬物クラスを評価した。より新しい治療ガイドラインが利用可能であることが明らかな場合は、新しい基準案をサポートするために採用した。第三に、デルファイ・パネルの各メンバーは、STOPP/START第3版におけるデルファイ検証のために考慮することが重要であると思われるその他の新基準を提案するよう求められた。
STOPP/START第2版に含まれるすべての基準について、また2014年以降の薬物療法の進歩を反映した新基準の可能性を特定するために、PubMed、Embase、Cochrane Libraryのオンラインリソースを中心に包括的な文献レビューを行い、提案された各新基準を支持する重要な文献を特定した。可能な限り、既存および新たに提案された各基準を含めることを支持する、査読付き学術誌に掲載されたシステマティックレビュー、メタアナリシス、ランダム化比較臨床試験を優先し、2名の査読者(DO'MとDC)が関連性を確認するために支持文献を調査した(オンライン補足参照)。同じ査読者がSTOPP/START version 2を評価し、2022年3月31日までの最新の発表されたエビデンスに基づき、もはや正しいとみなされない基準や適用できない基準があるかどうかを判断した。彼らはまた、2014年3月(STOPP/START第2版の基準提案のために設定された期限)以降の公表されたエビデンスに基づく潜在的な新しい基準を特定するために、STOPPおよびSTART基準の対応するセクションで表される各生理系を調べた。それぞれの生理学的システムの中で、最も一般的な疾患の治療に使用される薬物クラスに関する最新の発表文献が、心不全におけるSGLT-2阻害薬(ダパグリフロジン、エンパグリフロジン)のような特定の薬物の新規使用を支持するエビデンスと同様に評価された。提案された新しい基準についてコンセンサスが得られなかった場合、それらの基準はデルファイによる検証のためにさらに検討されることはなかった。
STOPP/START基準の前バージョンと同様に、STOPP/STARTバージョン3の基準案のデルファイ検証プロセスが実施された。この目的のために、ヨーロッパ8カ国から老年薬物療法において学術的に認められた11名の医師からなる専門家パネルが募集された(AC、ARG、MD、JBB、GO、AG、AJC、WK、GB、NV、MP)。これらの医師は、開業臨床医であると同時に、それぞれの地域の大学医学部で上級学術職を務めていた。
各パネルメンバーには、STOPP/START第3版基準案の全リスト(n=204、すなわち、STOPP145項目とSTART59項目の基準案)が提示され、基準を検討するよう求められた。さらに、各パネルメンバーは、(i)臨床的に重要であり、(ii)明確なエビデンスに基づき、(iii)STOPP/START第3版の基準に含めることを正当化できるほど臨床で頻発していると考えられる場合、追加的に新しいPIMまたはPPO基準を提案するよう求められた。
デルファイによる検証では、SurveyMonkey®オンラインプラットフォームを使用した。基準は記述として提示され、各記述は1(強く同意する)から5(強く同意しない)までの5段階のリッカート尺度で評価された。スケールの他のポイントは、これらの正反対の意見の中間の範囲、すなわち、賛成(=2)、中立(=3)、反対(=4)を表している。各パネルメンバーは、提案された基準を表す145のSTOPPと59のSTARTの各記述に対して、リッカート尺度を適用するよう求められた。提案された基準を受け入れる/含めるためのルールは以下の通りである: (i)リッカート尺度の中央値が1または2であること、(ii)リッカート尺度の75%値が2.0を超えないこと。リッカート尺度の中央値が2.0を超える基準は除外された。リッカート尺度の中央値が2.0であるが、一致する割合が75%未満である提案された基準は、さらなるデルファイ検証ラウンドでコンセンサスパネルによって再評価された。提案されたすべての基準について、明確な賛否のコンセンサスが得られるまで、順次コンセンサス・デルファイ・ラウンドを続ける予定であった。
結果
STOPP/STARTバージョン2基準114項目のうち、3項目が時代遅れまたは冗長であるとデルファイ評価委員会が判断したため、これら3項目、すなわちSTOPP C2とH7、START B1が削除された。これらの基準の具体的な内容は以下の通りである:
(i)
STOPP C2: (i) STOPP C2:消化性潰瘍の既往歴があり、PPIを併用しないアスピリン(消化性潰瘍再発リスク
(ii)
STOPP H7:心血管系疾患を合併しているCOX-2選択的NSAIDs(心筋梗塞と脳卒中のリスク増加)。
(iii)
B1 を開始する: 軽度から中等度の喘息またはCOPDに対する通常の吸入β-2作動薬または抗ムスカリン気管支拡張薬(例えば、イプラトロピウム、チオトロピウム)。
93の新しいSTOPP/START基準がデルファイ検証のために推奨された。コンセンサスラウンド1では、提案された204の基準のうち183(89.7%)が採用された。専門家パネルによる受諾基準に達しなかった21の基準案のうち、3基準は完全に却下され、残りの18基準がコンセンサスバリデーションの第2ラウンドのために専門家パネルに提示された。コンセンサス第2ラウンドでは、18の基準のうち5つの基準が受け入れられ、3つの基準がコンセンサスパネルによって却下された。残りの10項目が第3ラウンドで検討され、2項目が受け入れられ、4項目が却下された。残りの4項目のうち、1項目は第4ラウンドで採用され、残りの3項目は却下された。図1は、デルファイによる検証ラウンドのプロセスをまとめたものである。最終的に検証されたSTOPP/START基準の総数は190項目であった(STOPP基準133項目、START基準57項目;基準は付録1、各基準の参考文献は付録2を参照)。STOPP/STARTバージョン2と比較して、各生理学的システムにおけるクライテリアの数と増加率を表1に示す。不採用となった基準の詳細を表2に示す。
考察
バージョン3におけるSTOPP/START基準の大幅な増加は、心臓病、糖尿病、慢性閉塞性肺疾患(COPD)のような高齢者で遭遇する一般的な疾患の薬物療法に関する2014年から2022年の間に発表されたエビデンスの増加を反映している。STOPP基準の数はバージョン2の80からバージョン3では133と66.25%増加している。同様にSTART基準もバージョン2の34項目からバージョン3の57項目に67.6%増加している。バージョン2と比較したバージョン3におけるSTOPP/START基準の全体的な増加、すなわち114基準から190基準への増加は66.7%の増加を表している。STOPP/START基準全体の数の増加は、ほとんどが過去10年間のエビデンスベースの拡大を反映している。
多疾患合併高齢者における一般的な疾患の治療選択肢が拡大することは歓迎すべきことであるが、薬物関連の問題が生じる可能性が高まる。STOPP/START第3版に追加された基準は、現在の臨床現場で遭遇する、より一般的で重要な薬物-薬物、薬物-疾患間の有害相互作用を反映している。STOPP/START第3版で追加された基準項目は、STOPP/START第3版以前の基準項目と比較して、ルーチンの薬物レビューにおいて、より多くの有害な薬物-薬物および薬物-疾患の相互作用とその結果を検出し、予防することを目的としている。
しかし、このようにSTOPP/STARTの基準が増えたことは、ルーチンの投薬レビューにおける適用のしやすさという点では課題となる。STOPP/STARTのバージョン1(87の基準)からバージョン3(190の基準)へと増加する基準の数を考慮すると、適切な電子アプリケーションを使用して基準を展開することは、使用を容易にするために非常に望ましい。基準数の増加に対応するソフトウェア・アプリケーションがなければ、基準数の拡大は日常臨床での使用を阻害する可能性がある。STOPP/START基準を介入として用いたこれまでの多施設臨床試験、特にSENATOR試験とOPERAM試験 [13, 14] は、STOPP/STARTバージョン2基準の展開のために特注の電子アプリケーションに依存している。OPERAM試験で導き出された特定のSTOPP/START基準に関する最近の分析によると、ソフトウェアツールによって生成されたSTOPP/START推奨事項の半数以上は、個々の症例において臨床的に適切であるとは考えられていないことが示されている [15] 。したがって、電子的に導入されたSTOPPとSTARTの基準は、適切な訓練を受けた医療専門家によって臨床的妥当性を解釈される必要がある。
様々な臨床判断支援ソフトウェア(CDSS)ツールが、多疾患を有する高齢者の服薬レビューにおいて薬物療法を最適化するために設計されてきた。Damoiseaux-Volmanらによる最近の系統的レビュー [17] では、18の異なるCDSSに基づく介入が、この集団におけるプロセス関連の転帰と患者関連の臨床転帰の両方に及ぼす影響について検討された。彼らは、CDSS介入は明らかにプロセス関連の転帰を改善しうるが、患者関連の転帰に対するその効果は不明確なままであると結論づけた。これらの知見は、CDSSが支援する服薬レビューが、高齢患者および(関連する場合には)その介護者のための訓練された臨床的観察および解釈と組み合わされる必要性をさらに強調している。高齢の入院患者の薬物療法レビューにおける明示的PIM基準の役割を検討したAlshammariらによる最近の別の系統的レビュー [18] では、Beers基準とSTOPP/START基準が明示的PIM基準のセットとして最も広く使用されていることがわかった [22] 。同じ著者らは、Beers基準やSTOPP/START基準のような明示的PIM検出ツールは、薬物療法レビューのプロセスには有用であるが、より良い臨床転帰を確保するという点での価値や、費用対効果は依然として不確実であると結論づけている。Daltonらによる以前の系統的レビューでは、CDSSが支援する服薬レビューは、入院中の高齢患者におけるPIMの有病率を有意に減少させることができることが示された [19] 。しかし、PIMの有病率の減少が、転倒に関連した傷害の減少やせん妄の発生率の低下など、患者の転帰の改善につながるかどうかは、依然として不明であると結論づけている。
SENATORとOPERAMの多施設共同試験 [13, 14] では、STOPP/STARTバージョン2が試験された介入の中核的要素として用いられた。これらの試験の焦点は、CDSSに基づく介入が主要な患者関連エンドポイント、すなわちSENATORでは院内有害反応(ADR)の発生、OPERAMでは薬剤関連の入院再入院に及ぼす影響を検討することであった。しかし、介入の影響は、主治医による個々の症例での服薬指導の実施に完全に依存していた。SENATORの介入集団では、STOPPとSTARTの基準に関連した助言ポイントの実施度は非常に低く、約15%であった。OPERAMでは、1つ以上のSTOPP/START第2版の推奨事項が、STOPP/START基準が適用された介入集団の患者の約62%で実施され、SENATOR試験よりは改善されたが、それでもなお実質的に最適ではなかった。これらの所見は、訓練された医師または薬剤師が主治医と対話し、個々の症例においてCDSSが作成したSTOPPおよびSTART基準を説明または修飾し、特定の基準の臨床的妥当性に関する助言を提供する必要性を強調するものである。STOPP/STARTバージョン1基準の非電子的適用が、多疾患合併高齢患者の急性期入院中のADR発生に及ぼす影響を検討した1件の先行単施設単盲検臨床試験の結果は注目に値する [20] 。その研究では、特定のSTOPPおよびSTART基準の臨床的妥当性を強調し説明するために、主治医と主治医が直接対面した。STOPPおよびSTART基準の実施率はそれぞれ81%および87%であり、それに関連して介入患者コホートでは対照コホートと比較して院内ADRが極めて有意に減少した。興味深いことに、STOPPおよびSTARTの推奨事項の主治医による実施には、推奨事項が医師によって提示されるか薬剤師によって提示されるかによって有意差があるようである。
PIMを避けることは、重篤なADRや有害事象(ADE)のリスクを減らすことになる(STOPP基準)。同様に、PPOの回避(START基準)は、未治療の高齢患者が心房細動を持続している場合、抗凝固薬を開始することによって、大脳虚血性脳卒中などの予防可能な罹患率を減少させるはずである。つまり,多疾患を合併し,ポリファーマシーを有する高齢者という異質な集団に対する臨床的意義の範囲は,依然として非常に広い。STOPP/START第3版の基準の大部分は、系統的レビューと臨床試験のエビデンスに基づいている。過去10年間で、多疾患合併高齢者によく処方される多種多様な薬物療法の臨床試験発表数は大幅に増加した。それにもかかわらず、近年、高齢者が臨床試験から除外される割合が以前と比べて減少したという明確な証拠はない [22] 。したがって、日常診療において、処方者は、個々の多疾患合併高齢患者、特に虚弱度の高い高齢患者に対する臨床試験結果の関連性を解釈する際に注意を払うべきである。とはいえ、STOPP/START基準の現在の更新版は、デルファイプロセスに参加した上級学術医の専門家コンセンサスパネルによって支持された老年薬物療法のベストプラクティスを反映することを目的としている。更新された基準は、慢性心房細動を有し、同時に出血のリスクが高まっている患者への抗凝固薬の処方(STOPP基準C10、C12、C14)など、多疾患合併高齢者において注意を要する状況に引き続き焦点を当てている。STOPP/STARTで定義されたPIMsとPPOsが特定されたときに処方者がどの程度服薬調整を行うかは、多疾患合併症とそれに伴うポリファーマシーを経験する高齢患者の臨床転帰を左右すると思われる。
このデルファイ検証には、いくつかの重要な長所がある。デルファイ検証パネルのメンバーは全員、薬物療法に特別な関心と専門性を持つ老年医学の上級学術医師であった。11名のパネルは、北欧、南欧、東欧、西欧を代表する8カ国から選出され、すなわち、ヨーロッパの幅広い臨床実践と視点がデルファイパネルに反映された。更新された基準は、エビデンスに基づくものであり、現在のヨーロッパの臨床治療実践を反映したものである。我々は、一般的で臨床的に重要なPIMとPPOのほとんどが、主に専門家パネルのコンセンサスに基づいて、このSTOPP/START基準の新版に組み込まれていると主張する。
現在のデルファイによる検証プロセスと結果の限界もいくつか認められている。第一に、STOPP/STARTのバージョンが従来よりも大幅に大きくなったことで、日常診療において新バージョンの基準を適用することが難しくなった。第二に、本研究で採用されたコンセンサス方法は、Beers基準 [10] のような他の明確なPIM基準の開発に使用されてきたような、個々の基準を議論するためのライブのコンセンサスパネル会議を使用しなかった。しかしながら、STOPP/START基準の以前のバージョンと同様に、基準評価の初期段階は、現在の臨床で遭遇するPIMとPPOの最も一般的で重要な事例の検討であり、その後、提案された基準を支持する質の高い証拠を特定するために文献を慎重に検討した。ライブのコンセンサス・パネル会議ではなく、オンライン・コンセンサス方式を採用したことは、権威バイアスや集団バイアスの要素を回避し、各基準に関連する公表されたエビデンスに基づいて、提案された基準について、個々のパネル・メンバーが独自の結論に達することができるという利点があった。最後に、リソースの制約から、個々の基準を支持するための正式なシステマティックレビューは採用しなかった。
結論として、高齢者の服薬レビューに関連する臨床的に重要で不適切な可能性のある薬剤と潜在的な処方漏れを定義するSTOPP/STARTの明確な基準の改訂・更新版を提示する。これらの基準は、個々の症例における臨床的判断に取って代わることはできないが、医師による処方や脱処方の指針となり、高齢者における薬剤処方の質の向上を目指した今後の臨床研究や介入の基礎となるであろう。STOPP/START第3版の基準数の増加は、発表されたエビデンスの増加と、過去10年間に急性および慢性疾患を治療するためのいくつかの新しい薬剤が利用可能になったことを反映している。今後の研究では、これらの基準の適用が高齢者の臨床転帰の改善につながるかどうかを評価すべきである。
~~~~~~~~~~~~~~~~~~~~~~~~
具体的な内容は以下
前半がSTOPP

後半がSTART

新薬の代表SGLT2は両方にいた
STOPPの方では

症候性の低血圧になったらSGLT2は中止しろと
一方で

DMの有無に関係なく・EF低下の有無に関係なく、症候性心不全にはいれろと、製薬会社が泣いて喜びそうな文章あり。
他には、STOPPの方に

85歳以上や期待余命3年以下だったりしたら、一次予防としてのスタチンはやめとけ
とか
心血管の既往のある人に漫然とNSAIDSやめろ
とかもあり
後者は日本の整形外科外来にもたくさんいそうな気がする・・・・
ちなみに「期待余命3年以下」って日本では何歳かといえば、85歳ではなく、男女ともに90歳以上ですね。
https://www.mhlw.go.jp/toukei/saikin/hw/life/life21/dl/life21-02.pdf

なので、一次予防としてのスタチンもなかなか止めることはできなさそうです。
DOACも新薬とのことで、抗凝固もみてみると以下のような記述がSTOPPにあり

心房細動に対する第一選択抗凝固薬としてのビタミンK拮抗薬。ただし、金属製の心臓弁が存在する場合、中等度から重度の僧帽弁狭窄症がある場合、またはeGFR<15 mls/min./1.73m2 (直接トロンビン阻害薬または第Xa因子阻害薬はビタミンK拮抗薬と同等の効果があり、安全である。ビタミンK拮抗薬よりも安全である)。
ビタミンK拮抗薬とはワーファリンのことですね。ワーファリンよりもDOAC使っておけと。
これに関連してググっていたら興味深い資料を見つけました。
https://www.kyorin-pharm.co.jp/prodinfo/useful/doctorsalon/upload_docs/220766-1-10.pdf




85歳以上で見ても、抗凝固(-)で、100人を1年追いかけても、脳梗塞は6.3人
抗凝固(+)で、100人を1年追いかけても、脳梗塞は4.3人と2人しか減らない
裏から見ると、抗凝固(-)で、94%は脳梗塞なし。抗凝固(+)で、96%が脳梗塞無
85歳未満だとその差はたったの0.5人だ。
まぁ生存曲線を描いてHRを出すと、こういうのでもHR=0.7とか0.8なのかもしれないが・・・
この研究では、大出血は、抗凝固ありの方がむしろ少ない(まあ有意差はないんでしょうけど)



一方でワルファリンも超高齢になってくるとコントロール結構難しい。


内科学会雑誌にも似たようなテーマがあった
https://www.jstage.jst.go.jp/article/naika/107/5/107_856/_pdf



保存期CKD






保存期CKDなら、ワルファリンは死亡含めてリスク低下させそうだ。アスピリン単剤はほぼ意味なさそうだ。ワーファリンにアスピリンを上乗せする意味もなさそうだ。使うにしてもワーファリン単剤でよさそう。

AVKDIAL試 験(NCT02886962
https://ichgcp.net/ja/clinical-trials-registry/NCT02886962

とここまで読んでいると、「年齢に関係なく、まずはDOAC、腎機能的にDOACが無理ならWfでやむなし」となりそうだが、そうじゃないという驚きの知見が2023年サーキュレーションで報告されている。しかもRCT。これは虚弱後期高齢者をたくさん診ている老年学的には極めて重要だなと。
虚弱後期高齢者では、ワーファリンからNOAC(DOAC)に切り替えたほうが大出血が2倍くらいになっちゃうよ(しかもRCT)

https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.123.066485
要旨
背景
ビタミンK拮抗薬(VKA)で管理されている心房細動(AF)の虚弱患者を非ビタミンK経口抗凝固薬(NOAC)に切り替えるべきかどうかは曖昧である。
方法
実用的な多施設共同非盲検無作為化比較優越性試験を行った。虚弱(年齢75歳以上+GFI(Groningen Frailty Indicator)スコア3以上)を有する高齢AF患者を,INRガイド下VKA治療からNOAC治療に切り替える群と,VKA治療を継続する群に無作為に割り付けた。糸球体濾過量が30mL/min/1.73m2未満の患者や弁膜症患者は除外された。追跡期間は12ヵ月であった。死亡を競合リスクとして考慮し、主要転帰である大出血または臨床的に関連性のある非大出血合併症のどちらか先に発生した場合の原因特異的ハザード比(HR)を算出した。解析はintention-to-treatの原則に従った。副次的アウトカムには血栓塞栓イベントが含まれた。
結果
2018年1月から2022年6月までに、合計2,621例の患者が適格性のスクリーニングを受け、1,330例が無作為化された(平均年齢83歳、GFI中央値4)。無作為化後、NOACへの切り替え群6例、VKA継続群1例が除外基準の存在により除外され、intention-to-treat集団ではVKAからNOACへの切り替え群662例、VKA継続群661例が残った。163例の主要転帰イベント(切り替え群101例、継続群62例)の後、事前に規定された無益性解析により試験は無益性のため中止された。主要転帰のHRは1.69(95%CI 1.23-2.32)であった。血栓塞栓イベントのHRは1.26(95%CI 0.60~2.61)であった。
結論 虚弱な高齢心房細動患者においてINRガイド下VKA治療をNOACに切り替えることは,VKA治療を継続することと比較して出血性合併症の増加と関連したが,血栓塞栓性合併症の減少は関連しなかった。
・虚弱後期高齢者では、NOAC(DOAC)の方が大出血が多い。
・12か月の追跡で、ワーファリンでは62/661≒約1割、NOACでは101/662≒2割弱、も出血起きている・・・多すぎじゃない?w



フレイルの指標:Groningen Frailty Indicator
https://www.tyojyu.or.jp/kankoubutsu/gyoseki/frailty-yobo-taisaku/R2-2-2.html


上で引用した図を再掲するが、ここでは出血しているのは、85歳以上でも1年で4%(➡)と報告されているがこの違いは??




概要
目的 認知症の人々における抗精神病薬使用に関連する複数の有害転帰のリスクを調査すること。
デザイン 人口ベースのマッチドコホート研究。
設定 イングランドのClinical Practice Research Datalink (CPRD)からのプライマリケア、病院、死亡データのリンク。
対象 1998年1月1日から2018年5月31日までの間に認知症と診断された成人(50歳以上)(n=173,910、女性63.0%)。各新規抗精神病薬使用者(n=35,339、女性62.5%)は、発生率密度サンプリングを使用して最大15人の非使用者とマッチングされました。
主要評価項目 主要な評価項目は、抗精神病薬使用期間ごとに層別化された脳卒中、静脈血栓塞栓症、心筋梗塞、心不全、心室性不整脈、骨折、肺炎、および急性腎障害であり、絶対リスクは抗精神病薬使用者とマッチド比較群の累積発生率を使用して計算されました。潜在的な未測定の交絡を検出するために、関連性のない(ネガティブコントロール)転帰として虫垂炎と胆嚢炎も調査されました。
結果 非使用と比較して、抗精神病薬の使用は心室性不整脈を除くすべての転帰のリスク増加と関連していました。現在の使用(処方後90日)は、肺炎(ハザード比2.19、95%信頼区間(CI)2.10〜2.28)、急性腎障害(1.72、1.61〜1.84)、静脈血栓塞栓症(1.62、1.46〜1.80)、脳卒中(1.61、1.52〜1.71)、骨折(1.43、1.35〜1.52)、心筋梗塞(1.28、1.15〜1.42)、および心不全(1.27、1.18〜1.37)のリスク増加と関連していました。ネガティブコントロールの転帰(虫垂炎と胆嚢炎)についてはリスク増加は観察されませんでした。薬物開始後90日間の肺炎の累積発生率は、抗精神病薬使用者で4.48%(4.26%〜4.71%)対マッチドコホートの非使用者で1.49%(1.45%〜1.53%)(差2.99%、95% CI 2.77%〜3.22%)でした。
結論 認知症の成人において、抗精神病薬の使用は非使用と比較して、脳卒中、静脈血栓塞栓症、心筋梗塞、心不全、骨折、肺炎、および急性腎障害のリスク増加と関連していましたが、心室性不整脈とは関連していませんでした。有害転帰の範囲は、規制の警告で以前に強調されたものよりも広く、治療開始直後に最高のリスクが見られました。
~~~~~~~~~~~~~~~~~~~~~~~~
高血圧/血糖値・糖尿病/コレステロールはどうあるべきか?
●高齢者における血圧コントロールはどうあるべきか?
日本のガイドライン
高齢者でも原則として積極的な降圧治療が推奨される。高齢者高血圧の降圧目標について、日本高血圧学会による「高血圧ガイドライン(JSH2014)」では、74歳までは140/90mmHg未満、75歳以上では150/90mmHg未満(忍容性があれば140/90mmHg未満)としている。
JSH2014以降に発表された重要な大規模臨床試験としてSPRINTが挙げられる。SPRINTは糖尿病、脳梗塞の既往のない患者に対する積極治療(収縮期120mmHg未満)と標準治療(収縮期140mmHg未満)が心血管イベントや予後に及ぼす影響を比較検討した研究である2)。同研究では積極治療が標準治療に比べて心血管イベントや予後を改善させることが早期に示されたため、平均5年の追跡期間を3.2年に短縮して打ち切られたが、SPRINTにおける積極治療の優越性は75歳以上においても認められている1)。


Rethinking the association of high blood pressure with mortality in elderly adults: the impact of frailty

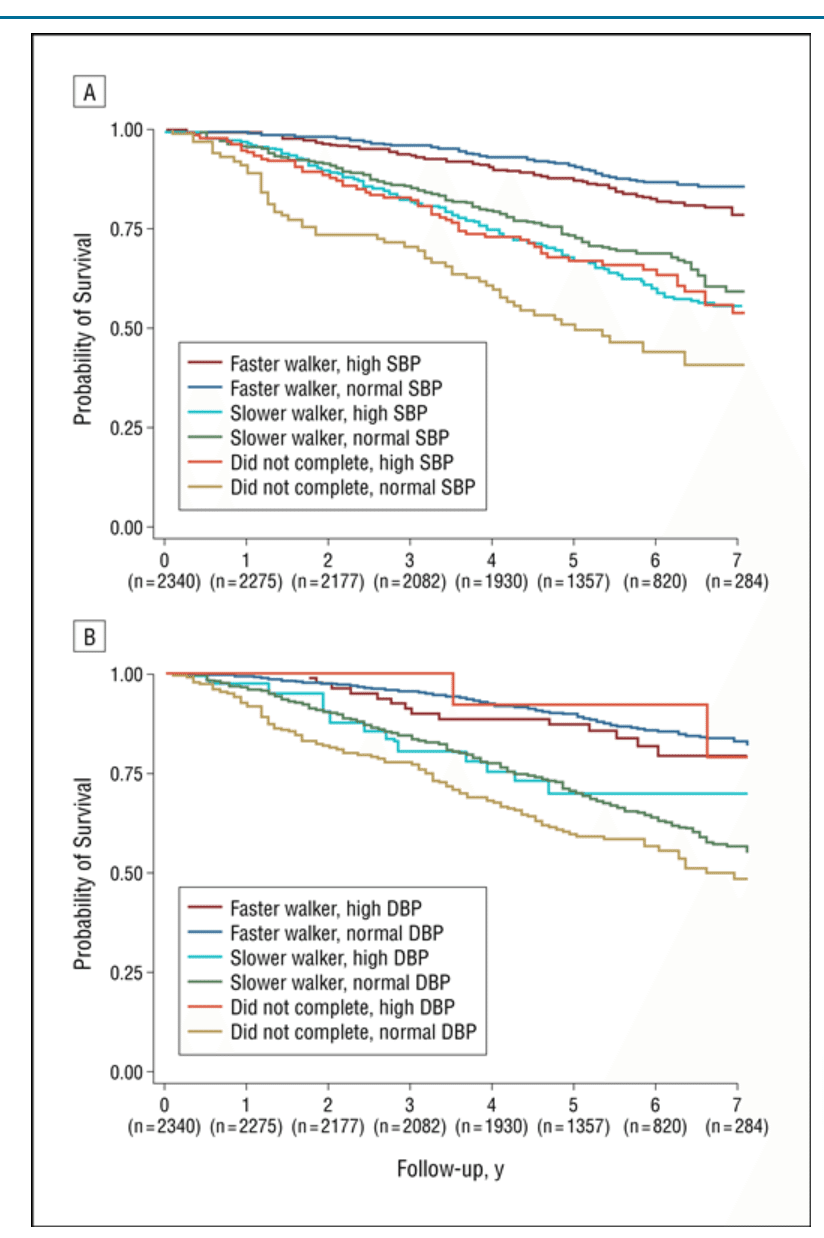
歩行速度が速い人➡高血圧があると死亡リスク高い➡治療したほうがいいかも?
歩行速度が遅い人➡血圧関係なし
歩けない人➡血圧高い方が死亡リスクが低い!?→下げているのは無駄どころか有害!?
~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~

~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
HYVET: Treatment of hypertension in patients 80 years of age or older


83歳くらい

積極的な治療をしている方が血圧も下がっている。下がっているとはいえ140くらいである。

心血管イベント・死亡はもちろん、総死亡も介入群で減っている。

➡80歳を過ぎても血圧高いのを放っておいてもよいということはなさそう。ただし下げると言っても140程度である。
~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
血糖値と頚部骨折

~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
Effect of Statin Treatment vs Usual Care on Primary Cardiovascular Prevention Among Older Adults: The ALLHAT-LLT Randomized Clinical Trial



➡一次予防としてのプラバスタチン介入はむしろ有害。
~~~~~~~~~~~~~~~~~~~~~~~
LTC(long-term care)
ロングターム・ケア(LTC/長期介護サービス)とは
ざっくりしたイメージは、「加齢に伴って変化する高齢者のニーズに対応するサービス」(National Institute on Aging米国国立老化研究所 2017)。LTCで最も一般的なのは、高齢者の日常生活動作(ADL)の支援。日本語ではこのLTCはほぼ耳にしない概念と思います。医者含めて医療者でもほぼ知らないのでは。LTCを知っている日本人は、おそらく、この分野をちゃんと研究している研究者くらいじゃないでしょうか。でも要するに介護保険のことじゃないの?という声が聞こえてきそうですが、介護保険は制度であり、その制度の中で確かにLTCが提供されていますが、LTCは介護保険外でも提供されうるので必ずしもそのままイコールとはなりません。介護保険外で提供されるLTCとしては、保険外の自費サービスもありますし(家政婦さんや送迎サービスが一般的に知名度が高そうですが、他には医療重症度が高い人が旅行に行きたいという時に看護師や医師が同行するサービスも日本でもありますね)、日本の医療保険でカバーされている療養入院も世界的に見ればLTCでしょうね。
LTCの例:
在宅医療:医者・歯科医師が訪問して診療することが医療保険でカバーされている。
在宅での介護:家事、移動、衛生面や着替えの介助、話し相手等。訪問リハビリや訪問介護の大多数も介護保険でカバーされている。訪問栄養指導や訪問薬剤というのもある。
高齢者向けデイケア・サービス:在宅にいる人が送迎付きで利用するプログラム。これも介護保険カバー。多くの場合、入浴とランチがセット。
食事宅配サービス:自宅に食事が配送される。100%自費。
高齢者施設:
養護老人ホーム(公費)・グループホーム(LTC)・特別養護老人ホーム(LTCメイン)・老健(LTCメイン)・サービス付き高齢者住宅・有料老人ホーム(LTCもカバーするが自費分も結構多い、ホテルフィー)などなど
CCRC (Continuing Care Retirement Community)
ここら辺の議論をしているとCCRCという概念に出会うことがある。CCRCとは高齢者が健康なうちに入居し、終身で過ごすことが可能な生活共同体、とされ、米国では、そういうものがたくさんある。イメージ的には元気な金持ち高齢者が、仕事を引退して喧噪の都会生活を離れて、自然豊かな田舎に移住してゴルフなどを楽しむという感じ。日本も一時期、地方創生と都市部の医療介護問題(特に介護はサービス提供者がいない、公定価格が安過ぎて)を一気に解決する手段として注目を集めていたが、かなり下火になっている印象。
https://www.chisou.go.jp/sousei/meeting/ccrc/ccrc_soan.pdf

CCRCについてはネット上でも民間シンクタンクだけではなく政府系資料もかなり出されているので、それだけでも勉強ができるとは思うが、以下の本がお勧め。日本各地の取り組みが紹介されている。出版は2018年のようなので、ちょうどピークの時の様子を取材された内容なので、その後、数年たって取材された各地が今どうなっているかを調べたり見に行くのも面白そうではある苦笑

LTCについてのWHOレポート

https://iris.who.int/bitstream/handle/10665/373610/9789240077874-eng.pdf
健康寿命
健康寿命の定義
健康寿命とは、心身ともに自立し、健康的に生活できる期間
2000年にWHO(世界保健機関)が健康寿命を提唱して以来、寿命を延ばすだけでなく、いかに健康に生活できる期間を延ばすかに関心が高まっています。
健康寿命が「健康上の問題で日常生活が制限されることなく生活できる期間」と定義されているため、平均寿命と健康寿命との差は、日常生活に制限のある「健康ではない期間」を意味します。

https://www.gender.go.jp/about_danjo/whitepaper/h30/zentai/html/zuhyo/zuhyo01-00-26.html

日本は不健康期間が長い?
「日本は、過剰な医療で延命治療してばかりいるから、不健康期間が長い!」
「この不健康期間を短く!」
とかよく見かけますが、欧州と比べると、日本はかなり変更寿命が長い印象です・・・・・欧州の女性で70歳を超えているところは皆無ですかね・・?(ノルウェイの男性が70.5) 。
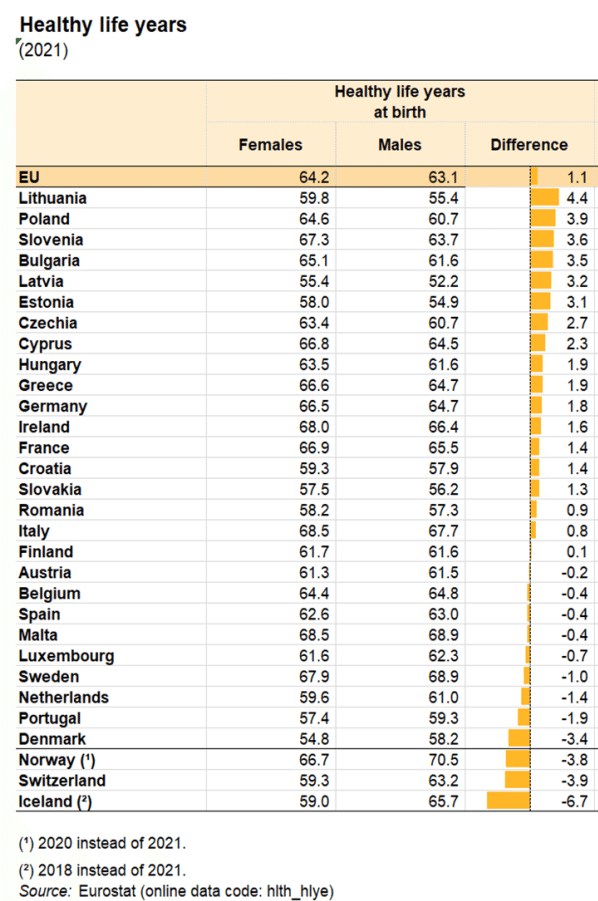
https://ec.europa.eu/eurostat/statistics-explained/index.php?title=Healthy_life_years_statistics
平均寿命ランキングを見れば、スペインや北欧はかなり上位で日本と同じくらいなのに
https://www.globalnote.jp/post-3764.html
健康寿命がこんなに短いとなると、不健康期間は、欧州の方がむしろ長そうですよね。
そういう視点でこういう健康寿命ランキングを見直すと、欧州の国は出てこない(スイスはいる)
https://www.tyojyu.or.jp/net/kenkou-tyoju/tyojyu-shakai/sekai-kenkojumyo.html
あれ?実は、日本の方が元気に長生きで、欧州の方が、早々に元気じゃなくなり不健康な状態が日本よりも長くて、最期を迎えるってことですかね?
最期(死に方)のパターンについて論じている有名な論文@JAMA
Patterns of Functional Decline at the End of Life
June R. Lunney, PhD, RN; Joanne Lynn, MD, MA, MS; Daniel J. Foley, MS; Steven Lipson, MD; Jack M. Guralnik, MD, PhD
https://www.medschool.umaryland.edu/profiles/Guralnik-Jack/
JAMA. 2003;289(18):2387-2392. doi:10.1001/jama.289.18.2387
https://jamanetwork.com/journals/jama/fullarticle/196538
「まだまだフルファイトでしょ」と思ってしまいそう。

最期のパターンについて論じた有名な論文

と思ったら、この図はもともとは以下の論文からとっているとのこと。
https://pubmed.ncbi.nlm.nih.gov/12110073/
J Am Geriatr Soc. 2002 Jun;50(6):1108-12. doi: 10.1046/j.1532-5415.2002.50268.x.
Profiles of older medicare decedents
June R Lunney, Joanne Lynn, Christopher Hogan
RAND Center to Improve Care of the Dying, 1200 South Hayes Street, MSC 6352, Arlington, VA 22202-5050, USA.
PMID: 12110073 DOI: 10.1046/j.1532-5415.2002.50268.x
要旨
背景 臨床医は終末期における機能低下の様々なパターンを観察しているが、大規模集団においてこれらのパターンを検証した実証的データはほとんどない。
目的 突然死、がん死、臓器不全による死亡、虚弱の4種類の疾病経過の間で機能低下が異なるかどうかを明らかにすること。
デザイン、設定、参加者 前向き、縦断的なEstablished Populations for Epidemiologic Studies of the Elderly(EPESE)研究における米国4地域のデータのコホート解析。ベースライン時(1981~1987年)に面接を行った65歳以上の参加者14456人のうち、4871人が最初の6年間の追跡期間中に死亡し、このうち4190人(86%)が死亡前1年以内に面接を行った。これらの死亡者は、最終面接から死亡までの月数に基づいて12のコホートに均等に分配された。
主要アウトカム評価項目 死亡前1年以内に自己または代理人が報告した身体機能(7つの日常生活動作[ADL]の遂行);死亡前のADL依存の予測。
結果 12のコホートで平均機能が低下し、人生の最終年における個人の低下をシミュレートした。突然死の死亡者は、死亡前1ヵ月でも高い機能を有していた(ADL依存度の平均[95%信頼区間{CI}]数:0.69[0.19-1.19]): 死亡前12ヵ月では0.69[0.19-1.19]であったのに対し、最終月では1.22[0.59-1.85]であった、P=0.20);がん死亡者は、最終年の初期には高い機能性を示したが、死亡の3ヵ月前には顕著に障害度が増加した(0.77[0.30-1.24] vs 4.09[3.37-4.81]、P<. 001);臓器不全の被死者では、機能低下のパターンが変動し、死亡前最後の3ヵ月間の機能がかなり低下した(2.10[1.49-2.70] vs 3.66[2.94-4.38]、P<.001);虚弱の被死者では、最終年の障害が比較的多く、特に最後の1ヵ月間の依存度が高かった(2.92[2.24-3.60] vs 5.84[5.33-6.35]、P<.001)。年齢、性別、人種、学歴、配偶者の有無、最終面接から死亡までの間隔、その他の人口統計学的差異を統制した後、虚弱な死亡者は突然死死亡者よりもADL依存になる可能性が8倍以上高かった(OR、8.32[95%CI、6.46-10.73]);がん死亡者は1.5倍高かった(OR、1.57[95%CI、1.25-1.96]);臓器不全死亡者は3倍高かった(OR、3.00[95%CI、2.39-3.77])。
結論 終末期の機能低下の軌跡は非常に多様である。予想される軌跡と関連するニーズを区別することは、オーダーメイドの戦略や死亡前のより良いケアプログラムの形成に役立つであろう。
イントロ
臨床的な観察から、死に至る前の機能低下には差があることが支持されている。このような違いは、終末期のケアの組織や提供にとって重要な意味を持つかもしれないが、大規模な集団におけるこのようなパターンを調査した実証的研究はほとんどない。1968年、GlaserとStrauss1 は3つの異なる死の軌跡について述べた:突然の不意打ち的な死、予期された死(短期的な死と長引く死の両方)、そして入退院を繰り返す死である。最近では、これらの考え方は一連の機能的軌跡2-4として表現され、短期的な予期死(終末期疾患)は長引く予期死(フレイル)とは別に描かれている。図1の4つの理論的軌跡群は、メディケアの請求データの分析で定式化されたもので、人口統計学的特徴、ケア提供、メディケア支出のパターンが明確に異なっていた2。しかし、われわれの知る限り、これらの4群の患者が実際に死亡前の身体機能の低下の勾配に違いがあるかどうかを評価した研究はない。
また、慢性疾患患者では、病状が機能障害のパターンに影響する8-15。最近の研究では、他の慢性疾患による死亡者と比較して、がん死亡者では、人生の最後の数カ月における機能の低下がより急激であることが明らかになった。
ここから先は
¥ 300
この記事が気に入ったらチップで応援してみませんか?
