塩基性とは何か?その特徴と役割を詳しく解説
化学の基本的な概念の一つである「塩基性」について、詳しく解説します。塩基性は、酸性と対立する性質であり、多くの化学反応や日常生活における現象に深く関わっています。本記事では、塩基性の定義や特徴、酸との関係、具体的な例について掘り下げていきます。
塩基性とは?基本的な定義
塩基性とは、化学において「塩基が持つ特性」を指します。特に重要なのは、以下の2つの性質です:
1. 水に溶けると水酸化物イオン(OH⁻)を生成する性質
2. 水素イオン(H⁺)と結合する性質
この性質に基づき、塩基性は酸性と対立する概念として位置付けられています。例えば、酸が水素イオン(H⁺)を供給する性質を持つのに対し、塩基はその水素イオンを受け取る性質を持っています。
塩基性の定義とその広がり
塩基性を説明する際には、主に以下の3つの化学的定義が用いられます:
1. アレニウスの定義
アレニウスの定義によれば、塩基は「水に溶けた際に水酸化物イオン(OH⁻)を放出する物質」です。例えば、水酸化ナトリウム(NaOH)は水中で次のように解離します:
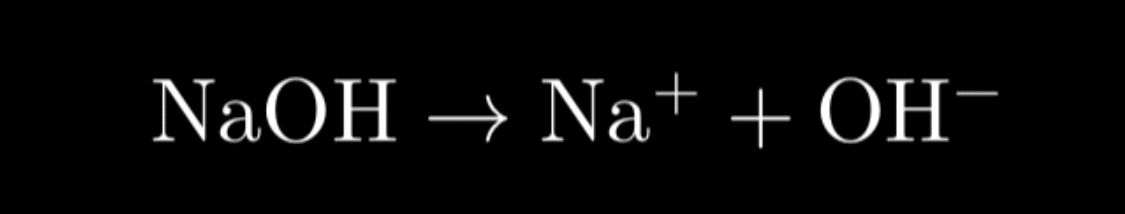
この解離により水溶液が塩基性を示すようになります。
2. ブレンステッド・ローリーの定義
ブレンステッド・ローリーの定義では、塩基を「水素イオン(H⁺)を受け取る物質」として捉えます。この定義は水溶液以外の環境でも適用可能で、より広い範囲で化学反応を説明できます。
3. ルイスの定義
ルイスの定義では、塩基は「電子対を供与する物質」とされています。この考え方は、より複雑な反応や化合物の性質を説明する際に有用です。
酸性との関係:中和反応
塩基性は酸性と密接に関わりを持ちます。その典型例が「中和反応」です。中和反応とは、酸と塩基が反応して塩と水を生成する反応のことです。例えば:

この反応により、酸性や塩基性が打ち消され、中性の溶液が生成されます。
塩基性の具体例
以下は、日常生活や産業における塩基性の具体例です:
• 家庭での使用: アンモニア水(掃除用品)や重曹(ベーキングソーダ)は塩基性を示します。
• 産業用途: 水酸化ナトリウム(苛性ソーダ)は製紙や石鹸製造に利用されます。
• 自然界での塩基性物質: 海水は弱い塩基性を持っており、pHは約8です。
塩基性の測定:pHスケール
塩基性はpHスケールを用いて測定されます。pH値が7より大きい場合、その物質は塩基性であるとされます。例えば:
• 中性水:pH 7
• アンモニア水:pH 11
• 水酸化ナトリウム溶液:pH 14
まとめ
塩基性は化学の基本的な概念であり、私たちの生活や産業に多大な影響を与えています。その定義や特徴を理解することで、化学反応の仕組みをより深く知ることができるでしょう。次回は、塩基性と酸性の応用についてさらに詳しく解説します!
