
湿疹の皮膚マイクロバイオームにおける黄色ブドウ球菌の飼いならし
3月15日、2022
湿疹の皮膚マイクロバイオームにおける黄色ブドウ球菌の飼いならし
アトピー性皮膚炎は、一般に湿疹として知られ、世界中で何百万人もの人が罹患している皮膚疾患です。この症状には、皮膚マイクロバイオーム(微生物群)の一種である黄色ブドウ球菌(Staphylococcus aureus)が関与していることが示唆されています。米国ミシガン大学のGabriel Núñez博士と中川清太郎博士が率いるチームは、アムウェイ社のGreg Hillebrand博士と共同で、湿疹やその他の皮膚炎症のかゆみ、かさつき、赤みに関与する黄色ブドウ球菌の病原性メカニズムを破壊できるローズマリーの天然抽出物を開発するトランスレーショナル・リサーチを実施しました。
アトピー性皮膚炎(またはアトピー性湿疹)は、先進工業国では成人の約5%、小児の15~30%が罹患する皮膚疾患です。アトピー性皮膚炎は、最も一般的な湿疹の一種であり、生涯を通じて多くの人が罹患する、慢性的な再発性の疾患です。湿疹の正確な原因は不明ですが、皮膚バリア機能の低下や皮膚マイクロバイオームのアンバランスなど、複数の要因が関与していると考えられています。湿疹は通常、小児期に始まり、米国では約960万人の子どもが経験し、1650万人の成人が2歳以降に始まったアトピー性皮膚炎を経験しています(National Eczema Association, 2021)。
手や肘の内側、首、足などに発症することが多く、皮膚の痛み、炎症、かゆみ、乾燥などが生じます。特に、湿疹が悪化しているときは、かゆみのある皮膚をかきむしることで皮膚のバリア機能が破壊され、細菌やウイルスに感染するリスクが高くなります。アトピー性皮膚炎の人の多くは、絶え間ないかゆみのために睡眠不足になり、肌の見た目が恥ずかしいと自意識過剰になり、気分やQOL(生活の質)にも影響を及ぼします。

Barks/Shutterstock.com
皮膚マイクロバイオームとアトピー性皮膚炎
皮膚の主な役割は、外界に対する物理的・生化学的バリアとして、侵入する病原体を含む環境ストレス要因から私たちを守ることです。そのため、皮膚には細菌や酵母を含む数多くの友好的な微生物が生息しています。この共存には悪影響はなく、私たちにとって有益なことが多いのです。しかし、この友好的な微生物が私たちに敵対することもあるのです。状況によって敵にも味方にもなりうる菌のひとつに、黄色ブドウ球菌がある。
黄色ブドウ球菌は、集団で存在する丸い細菌で、人間のかなりの割合で皮膚マイクロバイオームの無害な一部として存在することができます。このような形態では、宿主に害を与えることなく皮膚に定着し、常在菌として働きます。しかし、黄色ブドウ球菌は、ジキル博士からハイド氏のように人格が入れ替わり、有害な存在(病原性)になることがあり、「日和見病原体」と呼ばれる。その現れとしてよく知られているのが、2017年に米国で2万人の死者を出したメチシリン耐性黄色ブドウ球菌(MRSA)感染症です。
黄色ブドウ球菌は、ジキル博士からハイド氏のように人格が入れ替わり、有害な存在となることがあり、「日和見病原体」の称号を得ることができます。
また、黄色ブドウ球菌はアトピー性皮膚炎などの肌荒れにも関与していると考えられています。これまでのデータでは、アトピー性皮膚炎患者の90%が病変部の皮膚にこの細菌のコロニーを有しており、黄色ブドウ球菌のバイオフィルムが症状の悪化に直接関連していることが示唆されている。
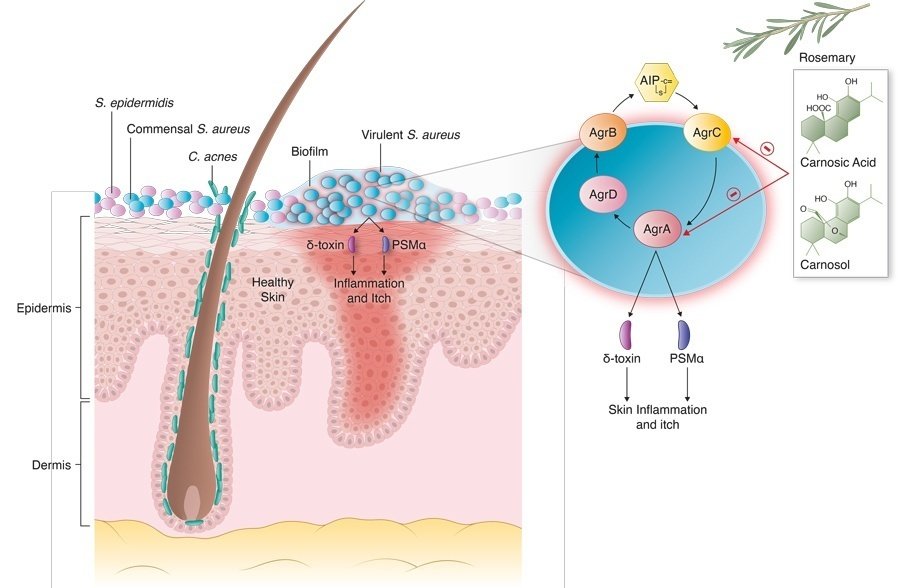
図1. カルノシン酸による黄色ブドウ球菌の湿疹病巣におけるクオラムセンシング阻害の模式図。
黄色ブドウ球菌はどのようにして無害なものから有害なものへと変化するのだろうか?
黄色ブドウ球菌が無害な常在菌から悪性の病原体に変わるには、クオラムセンシングと呼ばれる細菌細胞間の情報伝達が関わっている。黄色ブドウ球菌の密度があるレベル(クォーラム)に達すると、コロニー全体が友好的な常在菌から病原体へとその行動を変えます。クォーラムセンシングに関わる生化学的メカニズムはよく理解されているので、クォーラムセンシングを標的として阻害することは、黄色ブドウ球菌の病原性を防ぐための魅力的なアプローチであることが分かってきている。
黄色ブドウ球菌では、クォーラムセンシングは細菌ゲノムの一部であるagr(アクセサリー遺伝子制御因子)により制御されている。agrは、RNAIIとRNAIIIという2つの転写ユニットをコードしている。RNAIIとRNAIIIは生産された後、病原性因子を生産するきっかけとなる。その中には、肥満細胞の脱顆粒とヒスタミンの放出を引き起こすδ-毒素やPSMα、皮膚の炎症とかゆみをもたらすケラチノサイトアラミンが含まれる。したがって、黄色ブドウ球菌のagr活性化を抑制する化合物は、皮膚の炎症や湿疹の症状を治療・緩和するのに有用であると考えられる。
ローズマリーが黄色ブドウ球菌のクォーラムセンシングを抑制するのに役立つ仕組み
手に負えないバクテリアの攻撃にさらされるのは人間だけではありません。植物もまた、共通の病原性メカニズムによるバクテリア感染の脅威に直面しており、したがって、我々の味方でもあるのです。重要なのは、進化のスケールで見ると、植物は私たちよりもずっと長い間この戦争に参加しており、細菌感染と戦うための洗練された戦略や化合物を進化させてきたことで、私たちはそれを研究して自分たちのために役立てることができるのです。そのような植物のひとつがローズマリーです。
ミシガン大学医学部の分子生物学者・免疫学者であるガブリエル・ヌニェス教授は、agr阻害活性を持つ4,000種以上の化合物をスクリーニングした。その中で、カルノシン酸は最も強力な化合物の一つであることがわかった。カルノシン酸は、ローズマリーの葉に3〜10%含まれるジテルペンであり、抗酸化作用や抗菌作用があることが知られており、食品産業で使用されるいくつかの添加物にも自然に含まれているものである。
カルノシン酸が強力なAGR阻害剤であるというこの発見により、ヌニェス氏と同僚のミシガン大学の中川清太郎博士、アムウェイ社のグレッグ・ヒルブランド博士は、この化合物と、カルノシン酸を含むローズマリーの葉の天然抽出物についてさらなる研究を行うことになりました。彼らの研究成果は、2020年に『Antibiotics』誌に発表されました。
ローズマリーからの抽出物を使用すると、黄色ブドウ球菌の病原性と関連するアトピー性皮膚炎に良い結果が出るようです
図2. ローズマリー抽出物を含む製剤による局所治療で手湿疹に良好な反応
研究チームは、ローズマリーの葉に含まれる3種類の化合物について、黄色ブドウ球菌のagr刺激による病原性を抑制する効果を高濃度で試験した(1つ目はカルノシン酸)。2つ目の化合物はカルノソールで、これもカルノシン酸の誘導体であるジテルペンである。3つ目の化合物はロスマリン酸で、ローズマリーの名前の由来になっていると思われる。
研究チームはまず、3種類の純粋な化合物が、実験室の黄色ブドウ球菌のagr RNAIII遺伝子の発現を抑制する効果を個別に評価した。その結果、カルノシン酸とカルノソールはともに、5マイクロモル(μM)という低い濃度でagr遺伝子の発現を有意に阻害し、これらの化合物が非常に強力であることがわかった。また、これら2つの化合物は、病原性因子PSMαをコードするpsmα遺伝子の発現を有意に阻害することがわかった。rosmarinic acidを試験したところ、100μMまででもagr RNAIIIやpsmα遺伝子の発現を有意に抑制することはなかった。つまり、ローズマリー中の最も顕著な3つの化合物のうち、カルノシン酸とカルノソルのみがクオラムセンシング阻害剤であったのである。どの化合物も、互いに組み合わせても相乗効果を示さず、つまり、単独で使用した場合よりも効果的な阻害効果を発揮しなかったのである。研究チームは、3種類の化合物すべてを含む9種類のローズマリー抽出物を試験したところ、1mlあたり5μgという低濃度で、いずれもRNAIII遺伝子の発現を有意に阻害した。
これらの植物由来の分子を用いて黄色ブドウ球菌のクオラムセンシングを阻害することは、大きな可能性を持っている。
次に研究グループは、アトピー性皮膚炎患者から分離した実験室以外のS. aureus株を用いて、ローズマリー抽出物、カルノシン酸、カルノソールの有効性を検証した。研究チームは、これらの「実世界」の細菌を刺激し、さまざまな濃度の試験化合物の存在下および非存在下でagrの発現を活性化させた。3時間後、彼らは細菌を回収し、mRNAを単離した。定量的リアルタイムPCR(qPCR)を用いて、RNAIIIとpsmαの発現を測定した。その結果、3つの試験化合物すべてが、これらの病原性遺伝子を阻害することがわかった。また、各化合物存在下での菌の増殖も測定した。その結果、抽出物と化合物はagrの発現とクオラムセンシングを特異的に阻害しており、菌の増殖を阻害することで抗菌作用のメカニズムで作用しているのではないことが分かりました。このことは、細菌を死滅させるのではなく、病原性を特異的に標的とする化合物は、抗生物質の使用に伴う深刻な問題である細菌耐性を誘発する可能性が低いため、重要であると言えます。

Tatiana Shepeleva/Shutterstock.com
カルノシン酸とカルノソールがagrの活性化をブロックする正確なメカニズムは分かっていない。カルノシン酸は、自動誘導ペプチド(AIP)の合成(AgrD)と輸出(AgrB)から、AIPのキナーゼ受容体(AgrC)または遺伝子調節因子(AgrA)までのクオラムセンシングシグナル経路のいくつかのステップのうち1つかそれ以上を阻害する可能性が考えられる。しかし、カルノシン酸はAIPによるRNAIIIとpsmαの両方の発現を阻害することから、AgrDとAgrB(AIP合成と輸出)の下流でRNAIIIとpsmα両方の遺伝子発現の上流で作用するAgrCまたはAgrAを阻害すると考えられる(図1参照)。
アトピー性皮膚炎をはじめとする皮膚刺激性のある人の治療法
現在、アトピー性皮膚炎に対する治療法の多くは、効果が限定的であったり、副作用があったり、高価であったりする。例えば、第一選択薬の副腎皮質ステロイド外用薬は、湿疹が悪化したときに炎症を抑えるために使用されますが、皮膚を薄くし、ダメージを受けやすくする可能性もあります。また、かゆみを抑えるために抗ヒスタミン剤を使用することもありますが、眠気や頭痛などの副作用があります。注射剤(デュピルマブなど)は非常に効果的ですが、非常に高価です。健康なヒトの皮膚に存在する有益な細菌を用いた有望な新しい医薬品が開発中であるが、承認までには数年かかりそうである。
安全性が確立されている天然植物由来の分子を用いて黄色ブドウ球菌のクオラムセンシングを阻害することは、実用的で費用対効果の高い方法で湿疹を治療・予防できる大きな可能性を持っている。将来的には、カルノシン酸やカルノソール(またはローズマリー抽出物)などの化合物を有効成分としてスキンケア製品に配合し、この細菌が手に負えなくなった湿疹や時折起こる皮膚の炎症に特異的に作用させることができるようになるかもしれない。実際、アムウェイとミシガン大学のチームによって、湿疹の治療を目的としたローズマリー外用剤の最初の車両対照無作為化臨床試験が完了したところです。結果は非常に有望で、2021年11月にボストンで開催された皮膚マイクロバイオーム学会で発表され、その結果を記した査読付き論文も間もなく出版される予定です。ローズマリー抽出物を配合した新製剤の手湿疹への有効性の一例を図2に示します。
個人の反応
これらの化合物の臨床効果を検証するために、次にどのようなステップを踏めばよいのでしょうか?
湿疹に悩む人々に、湿疹の症状に対する様々な便利な解決策を提供するために、いくつかの異なるローズマリー外用剤を開発します。その有効性は、大人と子供の両方において、湿疹の悪化、かゆみ、肌荒れの治療と予防を目的とした車両対照無作為二重盲検試験で証明されるでしょう。
参考文献
Nakagawa, S, Hillebrand, G, Nunez, G, (2020) Rosmarinus officinalis L. (Rosemary) Extracts Containing Carnosic Acid and Carnosol are Potent Quorum Sensing Inhibitors of Staphylococcus aureus Virulance. 抗生物質, 9(4), 149.
Kourtis, AP, Hatfield, K, Baggs, J, et al, (2019) Vital Signs: メチシリン耐性およびメチシリン感受性黄色ブドウ球菌血流感染症における疫学と最近の傾向-米国. MMWR Morb Mortal Wkly Rep, 68, 214-219. dx.doi.org/10.15585/mmwr.mm6809e1
Birtić, S, Dussort, P, Pierre, F-X, Bily, AC, Roller, M, (2015) Carnosic acid.(カルノシン酸). フィトケミストリー, 115, 9-19, ISSN 0031-9422. doi.org/10.1016/j.phytochem.2014.12.026.
全米湿疹協会(2021).Eczema Stats [online]. nationaleczema.org/research/eczema-facts/ [Accessed 18/06/2021].
研究の裏側
グレッグ・ヒルブランド博士
グレッグ・ヒルブランド博士は生化学者で、現在はアムウェイの上級主任研究員、シンシナティ大学の化粧品科学非常勤教授を務めています。化粧品業界で35年以上の経験を持ち、アムウェイの微生物を利用したスキンケア技術や製品の研究開発をリードしています。
研究目的
グレッグ・ヒルブランド博士、ガブリエル・ヌニェス博士、中川清太郎博士は、ローズマリーに含まれる、黄色ブドウ球菌による皮膚トラブルを予防する可能性のある化合物を研究しています。
資金提供
アムウェイ・コーポレーション(米国ミシガン州エイダ
共同研究者
中川誠太郎(ミシガン大学)
Gabriel Núñez (ミシガン大学)
この記事を引用する
DOI: 10.32907/RO-129-2419626386
