
25 抗核抗体、抗DNA、ヒストン、ヌクレオソーム抗体 Antinuclear Antibodies, Antibodies to DNA, Histones, and Nucleosomes
Dubois' Lupus Erythematosus and Related Syndromes, Tenth Edition
Myth:抗核抗体(ANA)の間接蛍光抗体法の主な染色パターンは、各々の自己抗体や疾患に特異的・診断的である
reality:Crucial to the interpretation of the ANA test is the recognition that the main patterns of staining on indirect immunofluorescence are rarely specific or diagnostic of any individual
autoantibody or disease, apart from the centromere pattern that is seen with anti kinetochore antibodies in limited cutaneous scleroderma.
・ANA 検査の解釈において極めて重要なのは、間接蛍光抗体法の主な染色パターンは、限局性皮膚強皮症の抗動原体抗体で見られるセントロメアパターンを除き、個々の自己抗体または疾患に特異的または診断的であることはほとんどないということである。ANA の染色の存在とパターンは自己抗体の存在を示しているのみで、より特異的な検査で検証し、臨床状況で検討して SLE、別の自己免疫疾患、または別の疾患の診断を検討する必要があるかどうかを判断する必要がある。
・ANAの染色パターンはあくまで参考程度で、実臨床では、抗核抗体が陽性であったら、次に、疑わしい膠原病の特異抗体+染色パターンから想起される自己抗体を提出する、というのがセオリーだと思います。
Pearl:抗核抗体の存在を確認するための基質として使用されるHEp-2細胞は、もともとヒト喉頭癌の上皮細胞に由来する
comment:Since then, human cell lines, especially epithelial cells (HEp-2) from human laryngeal carcinoma, have been widely adopted.
・1957年以来、陽性ANAの存在を確認するためにさまざまな基質が使用されてきた。初期の研究では、さまざまな種類のげっ歯類組織が普及した。
・現在はヒト細胞株、特にヒト喉頭癌由来の上皮細胞(HEp-2)が広く採用されている。HEp-2 細胞の利点は、核と核小体が大きいため、間接免疫蛍光法で幅広い染色パターンを認識できることである。
・ただし、パターン、強度、さらには免疫蛍光の存在の分析には非常に時間がかかり、訓練を受けた技術者または病理学者による慎重な解釈が必要であり、ANA 検査の実施において依然として検査間および観察者間の大きなばらつきが生じる可能性がある。
・ANAの染色パターンの報告は、検者間の差が大きいから、あまり信用しすぎるな、と教えられたものです。あと、細胞質パターン(cytoplasmic)は赤色にならないから注意しておきましょう、とも教えられました。
Myth:間接免疫蛍光法によるANA検出は、過去においてはANA検査のゴールドスタンダートであった
reality:Consequently, ANA detection by indirect immunofluorescence remains the gold standard for ANA testing in several international recommendations.
・ANA 検査の標準化を改善する試みは、主に酵素結合免疫吸着測定法 (ELISA)、蛍光酵素結合免疫測定法、化学発光免疫測定法、またはマイクロアレイ システムなどの他の新しい固相法に基づく、固相アッセイを使用して導入されてきた。利用可能なアッセイと方法論(ELISAプレートを核全体の抽出物でコーティングするものもあれば、特定の抗原のみを使用するものもある)の増加により、品質管理(再現性、感度、特異性)、標準化、臨床的解釈に問題が生じている。これらの異なるアッセイの結果は互いに大きく異なり、場合によっては、同じ血清の間接免疫蛍光法で測定したANAの結果とも異なる。
・その結果、間接免疫蛍光法によるANA検出は、いくつかの国際的推奨事項においてANA検査のゴールドスタンダードであり続けている。
・ANA検出は、現在も間接免疫抗体法で行うのが一般的です。
Pearl:抗La(SS-B)抗体をもつSLE患者は、腎炎を発症しづらい
comment:Anti-La antibodies are particularly associated with SLE and Sjögren syndrome, frequently in conjunction with anti-Ro antibodies;21 patients with lupus with anti-La antibodies are less likely to have renal disease.
・Smに対する抗体は、事実上SLEの診断に役立ち、Lupusの黒人患者の30%、白人患者の5%に見られ、抗U1-RNP抗体と併せて見られることが多い。
・抗La抗体は、特にSLEおよびシェーグレン症候群に関連しており、抗Ro抗体と併せて見られることが多い。
・抗La抗体を持つループス患者は腎疾患を発症する可能性が低い。
Myth:抗PCNA抗体はSLEに特異的である
reality:Historically, anti-PCNA antibodies were known as a marker for SLE;
however, they have been found in various other conditions, and their
disease association has been questioned
・PCNA 抗体は、細胞周期の調節に関与する抗原であり、歴史的に、抗 PCNA 抗体は SLE のマーカーとして知られていたが、他のさまざまな病状でも発見されており、疾患との関連性は疑問視されている。
・MBLから間接蛍光抗体法による抗核抗体写真集がでています(https://ivd.mbl.co.jp/diagnostics/print/pdf/autoimmune/254064/254064.pdf)。そこからPCNA抗体の染色パターンです。綺麗ですが、見分けは素人には難しいです。。


Pearl:抗DFS70抗体は、抗核抗体関連膠原病の可能性を低くする
comment:In addition, there have been advances in understanding the significance of the dense fine speckled (DFS) indirect immunofluorescence pattern and its cognate target, the DFS70 protein. Currently, prevailing evidence indicates that the presence of monospecific anti-DFS70
antibodies exclude the diagnosis of an ANA-associated rheumatic disease.
・DFS (Dense Fine Speckled) 間接免疫蛍光パターンとその同族標的である DFS70 タンパク質の重要性の理解も進んでいる。現在、単一特異性抗 DFS70 抗体の存在により ANA 関連リウマチ性疾患の診断が除外されることを示している。
・これは名古屋大学皮膚科の先生方の仕事です(https://www.med.nagoya-u.ac.jp/derma/research.html)
・anti-DFS70(dense fine speckled pattern)抗体は、健常人でも陽性にみとめられ、high titerでみられることがあります。このanti-DFS70抗体は健常人の1-8%でみられ、女性に多いことが分かっており、むしろリウマチ膠原病にはprotectiveと言われています(Nat Rev Rheumatol . 2020 Dec;16(12):715-726.)。
Pearl:ANA 染色型に関する国際的コンセンサス(ICAP)は、染色パターンを、核小体、細胞質、有糸分裂の3つの大きなカテゴリーに分けている
comment:Moreover, during this workshop, ANA staining patterns were divided into three broad categories: nucleolar, cytoplasmic and mitotic.
・2014〜 2015 年の抗核抗体 HEp-2 細胞パターンに関する最初の国際コンセンサス (ICAP) では、より適切な新しい命名法が提案された。抗細胞抗体(Anticellular antibodies:AC)と特異抗体は、それぞれANAとENA(extractable nuclear antigens)の命名法に取って代わる。さらに、このワークショップでは、ANA染色パターンが核小体、細胞質、有糸分裂の3つの大まかなカテゴリーに分けられた。各カテゴリーには、AC1-28でコード化された個々の染色パターンが含まれる( 図25.2 )。2019年にICAPコンセンサスで各染色パターンの臨床的関連性が提示され、全身性強皮症に非常に特異的な29番目のパターン(AC-29)が追加された。

Myth:ANAの力価が高いと、SLEの予後が悪い
reality:The absolute level of the titer itself does not carry any prognostic significance; however, higher titers are more likely to be significant in making a diagnosis of disease.
・20 歳から 60 歳の健康な人では、HEp-2 細胞に対する免疫蛍光法による ANA 検査で、ANA 力価が低下するにつれて陽性結果の頻度が増加することが示されている。したがって、一般人口の 3.3% は 1:320 希釈で ANA 陽性であり、健常人の最大 31.7% は 1:40 希釈で陽性と報告される。
・ANA 検査は、ほとんどの全身性 ARD で程度の差はあれ陽性であることがわかっているが、SLE ではその頻度と力価が最も高くなる ( 表 25.2 )。
・力価の絶対値自体には予後的な意味はないが、力価が高いほど疾患の診断に重要な意味を持つ可能性が高くなる。

Pearl:dsDNAに対する抗体の検出方法のうち、RIA(radioimmunoassay)法はSLEに最も特異的で、糸球体腎炎の再発を予測できる可能性が最も高い検査法である
comment:Among the currently available methods of detecting antibodies to dsDNA, the Farr test (a radioimmunoassay) may be the most specific test for SLE and is the assay most likely to predict occurrence of disease flare, especially glomerulonephritis.
・SLE の疾患特異的抗体のうち、最も診断力があり臨床応用が進んでいるのは、dsDNA を標的とする抗体である。現在利用可能な検査法で検査すると、ループス患者の 60%〜 83% に抗 dsDNA 抗体が見つかる。一部の患者では、これらの抗体の力価が疾患活動性の優れた指標となる。
・現在利用可能な dsDNA に対する抗体の検出方法のうち、Farr 検査 (放射免疫測定法)≒RIA法 は SLE に最も特異的な検査である可能性があり、特に糸球体腎炎などの疾患の再発を予測できる可能性が最も高い検査法である。
・ELISA は広く利用でき、比較的簡単に実行でき、dsDNA に対する高親和性および低親和性の免疫グロブリン (Ig) G 抗体の両方を検出できる。国際的な勧告ANA 検査に関するガイドラインでは、検査室がC. luciliaeアッセイや Farr テスト などの臨床特異度の高い抗 dsDNA 検査を使用して検出し 、抗体価の測定を通じて疾患活動をモニタリングするための定量検査 (ELISA など) を使用することを推奨している。
・実際は、コマーシャルベースで提出できるDNA抗体(RIA法)と、ELISA法のdsDNA抗体を同時に出すことがあります。他の先生に聞くと、まずはRIA法を出して、陰性の場合にELISA法のdsDNA抗体を提出している、とのことです。
Pearl:ANA陰性のSLE患者は、2%で存在する
comment:True negative ANA tests in patients with lupus, perhaps 2% of sera at most, are very rare with the advent of human tissue culture cells as the substrate.
・ループス患者におけるANA検査の真の陰性は、おそらく血清の2%程度である。以前は、げっ歯類(主にマウスとラットの肝臓)の組織基質を使用した場合、より多くの患者が誤って ANA 陰性(最大 5%)と分類されていた。
・間接蛍光抗体法で血清が ANA 陰性である患者では、Jo-1、リボソーム P、抗 dsDNA、または Ro に対する特定の抗体が検出されることがある。
・ループス患者の場合、以前は陽性であった ANA 検査は、自然にまたは免疫抑制治療後に病気が寛解すると陰性になることがある。このような ANA 陰性は、診断後 10 年間の追跡期間中に SLE 患者の 17% で報告されている。以前に陽性であった ANA が消失しても、病気の今後の経過が消滅したとは想定できないため、病気の臨床マーカーと検査マーカーを注意深く監視する通常の必要性は残る。抗 dsDNA 抗体、およびおそらく抗リボソーム P 抗体を除き、その他の自己抗体と ANA の力価は、病気の活動性の指標にはならない。
・いわゆるshort-lived形質細胞から産生されるDNA抗体(とおそらくリボソームP抗体)は疾患活動性の指標となり上がり下がりするけど、Long-lived形質細胞から産生されるSm抗体、Ro/SS-A抗体、La/SS-B抗体(いわゆるtype1 IFNとの関連強そうなほうという感じ)は疾患活動性の指標にはできない、ということだと思います。
・以下の図は、そのあたりを説明したレビューです(J Am Soc Nephrol 29: 741-758, 2018)

Myth:ELISA法で検出された抗dsDNA抗体の特異度は高い
reality: In contrast, ELISAs that are supposed to detect anti-dsDNA often cross-react with anti-ssDNA and capture low-affinity antibodies of little pathologic consequence.
・抗 dsDNA 抗体の初期スクリーニングでは、通常、免疫蛍光法または ELISA による ANA の存在の検査が行われる。C . luciliae免疫蛍光アッセイも広く使用されている。このテストは、 C. luciliae のキネトプラスト内のdsDNAに結合する抗体を検出し 、抗dsDNA抗体に対して比較的特異的である。特に、キネトプラストはdsDNAのみで構成されているため、抗ssDNA抗体は結合しない。
・対照的に、抗dsDNAを検出するはずのELISAは、抗ssDNAと交差反応し、病理学的影響がほとんどない低親和性抗体を捕捉することがよくある。
・歴史的に、抗 dsDNA 抗体は Farr テスト(≒RIA法)で測定されており、この検査法の利点は、正確性と、臨床的に重要とされる高い親和性を持つ抗体を検出できることである。
・少し古いですが、2012年のSLICCのSLE分類基準でも、ELISAの場合はdsDNA抗体は上限の2倍以上で陽性とカウントすることになっていました。(Arthritis Rheum . 2012 Aug;64(8):2677-86)

Myth:抗dsDNA抗体は、血中のdsDNAと免疫複合体を形成し、組織に沈着する
reality:Although initial theories proposed that immune complexes of anti-dsDNA with dsDNA would be deposited in tissues, this now seems unlikely because there is very little circulating free dsDNA in human serum.
・循環する抗dsDNA抗体が腎臓などの組織に沈着し、炎症を引き起こすメカニズムは研究されており、多くの理論が存在する。患者の中で、これらの抗体は、異なる組織、あるいは単一の組織内でも、異なるメカニズムによって沈着する可能性がある。
・初期の理論では、抗dsDNAとdsDNAの免疫複合体が組織に沈着すると提案されていたが、現在では、ヒト血清中に循環している遊離dsDNAが非常に少ないため、この可能性は低いと思われる。
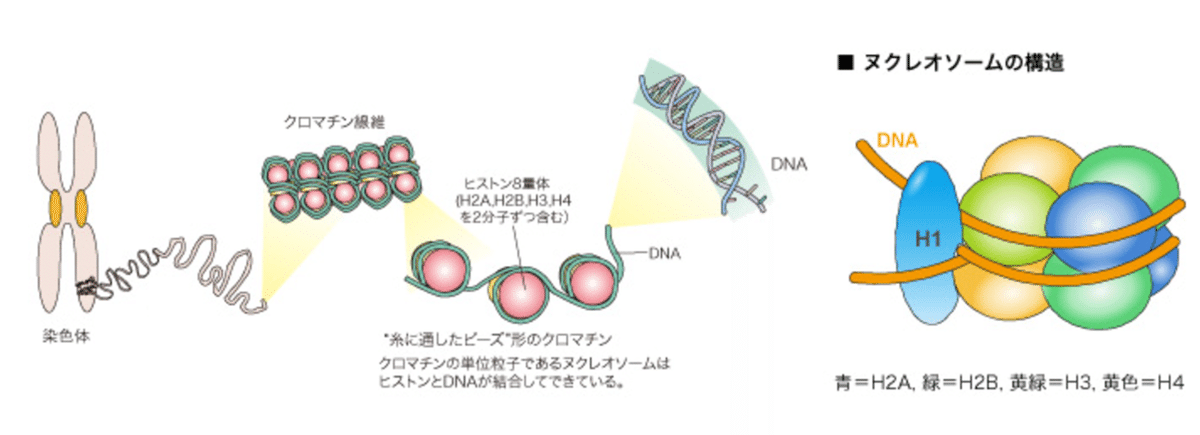
・SLE患者の循環中に見つかったDNAの分子量を分析したところ、200bp(またはその倍数)の断片で存在していることがわかった。このdsDNAは、アポトーシス細胞の崩壊による破片として形成されたオリゴヌクレオソーム(2〜10個のヌクレオソームの集まり)の形をしているという説明がつく。ヌクレオソームは核クロマチンの基本単位で、ヒストンコアの周りに巻かれた約200bpのdsDNAから構成される。ヌクレオソームの同定は、SLE において抗 dsDNA 抗体によって認識される主要な抗原が遊離 dsDNA ではなく ヌクレオソームであることは、多くの疑問を解決する。
・まず、dsDNAは細胞の核内に存在するため、抗dsDNA抗体がどのようにして抗原にアクセスできるのか理解するのは困難であった。しかし、アポトーシス細胞は、ヌクレオソームなどの細胞内にあった抗原が表面に露出したブレブ(細胞膜が球状に膨らんだ構造)を放出する。このアポトーシス破片の除去は、SLE患者では健康な対照群よりも遅いことが知られている。そのため、SLE患者は、抗ヌクレオソーム抗体と相互作用する可能性のある、循環ヌクレオソーム物質をより多く保有することになる。第2に、SLE の病原性抗体がヌクレオソーム/アンチヌクレオソーム複合体の形で循環するという概念は、これらの複合体が腎臓や皮膚に沈着する可能性のあるメカニズムを提供した。ヌクレオソーム/アンチヌクレオソーム複合体のヌクレオソーム内の正に帯電したヒストンが、腎基底膜内の負に帯電したヘパラン硫酸と相互作用することが報告されている。これらは抗体-ヌクレオソーム相互作用がループス腎炎の発症に重要であるというモデルと一致する発見である。
・これらの組織学的所見は、抗ヌクレオソーム抗体が SLE 患者に高頻度で存在し、疾患活動性に関連している可能性があることを示す血清学的研究の結果によって裏付けられている。さまざまな研究で、SLE 患者の 56% から 86% で抗ヌクレオソーム抗体のレベルの上昇が示されている。
・というわけで、現在のところ、ヌクレオソームとの相互作用が、ループス腎炎における病原性抗体の腎臓沈着の主なメカニズムである可能性が高いと考えられます。dsDNAの単位でなく、もう少し大きい単位のヌクレオソームと自己抗体が免疫複合体を形成して、SLEの臓器障害を引き起こしている、ということです。
・染色体、クロマチン繊維、ヌクレオソーム、DNAの順で小さくなっています。
Myth:抗体は、生きている細胞には浸透できない
reality:However, the existence of naturally occurring cell-penetrating antibodies is now widely accepted.
・抗体はこれまで、生きた細胞に浸透できないと考えられていた。そのため、SLEの病態生理学における抗DNA抗体の関与に関する理論のほとんどは、抗DNA抗体が生きた細胞の核に到達してその中に含まれるDNAにアクセスできないと推定されたため、死んだ細胞や死にかけている細胞から放出された細胞外DNAとの相互作用に歴史的に焦点を当ててきた。
・しかし、現在では自然に発生する細胞浸透抗体(cell-penetrating antibodies)の存在が広く認められている。実際、一部のループス抗 DNA 抗体は生きた細胞の核に浸透して DNA と相互作用することができる。SLEにおけるこれらの細胞浸透変異の正確な発生率はまだ決定されていないが、まれであると思われる。
・例えば、小規模な研究では、 SLE 患者の 14% が核浸透抗体の検査で陽性であった。核透過性抗 DNA 抗体は、その珍しい存在であるにもかかわらず、DNA に影響を及ぼすことから、SLE の病態生理学にとって重要な可能性がある。実際、細胞透過性抗体はアポトーシスを促進し、サイトカインの産生と炎症の増殖を促進する。
・核浸透性ループス抗 DNA 抗体の中には、特定の細胞で DNA 損傷の蓄積を引き起こすものがあることがわかっている。
Pearl:抗ヌクレオソーム抗体は、ヒストンに結合できるが、抗ヒストン抗体という用語は用いない
comment:Although antinucleosome antibodies can bind to histones, the term antihistone antibodies is generally used to refer to a different type of antibody detected by ELISA using histones as the test antigen.
・抗ヌクレオソーム抗体はヒストンに結合するが、抗ヒストン抗体 という用語は、 通常、ヒストンを検査抗原として ELISA で検出される別の種類の抗体を指すために使用される。抗ヒストン抗体は、ヒドララジンやプロカインアミドなどの薬剤への曝露によって引き起こされる薬剤誘発性ループスの患者に特に特徴的である。
・日本で抗ヌクレオソーム抗体は保険診療での測定はできません。以下にdsDNA抗体、ヌクレオソーム抗体、ヒストン抗体の特徴の違いをまとめてもらいました。

Myth:IgG抗dsDNA抗体は全てLupus腎炎を引き起こす能力を持つ
reality:In these studies, a consistent finding was that only some antibodies would cause nephritis.
・血清学的研究により、IgG 抗 dsDNA 抗体が SLE 患者の疾患活動に特に密接に関連していることが示された。マウスでモノクローナルヒトまたはマウス抗 dsDNA 抗体の受動的な移行が糸球体腎炎を引き起こした研究が報告されてる。
・これらの研究から、一部の抗体のみが腎炎を引き起こすという一貫した結果が得られている。
・前述のように、モノクローナルヒト IgG 抗 dsDNA 抗体を分泌する 6 つの異なるハイブリドーマ(抗体を多量に産生できる細胞)を重症複合免疫不全マウスに導入した実験では、そのうち 2 つがループス腎炎で見られるものと同様の沈着を引き起こした。結論としては、病原性はクラス スイッチと体細胞変異のプロセスを経た抗体の特性である可能性が高いということであった。
・高親和性の体細胞変異 IgG 抗体の生成を促進する抗原はどれだろうか。この目的の理想的な抗原は、SLE 患者に多く存在し、B 細胞と T ヘルパー細胞の両方のエピトープを持つ抗原であり、つまりヌクレオソームはまさにその条件を満たしている。
・前述のように、ヌクレオソームはアポトーシス小胞の表面に存在し、SLE 患者ではすぐには除去されない。したがって、この物質はリンパ組織に運ばれ、そこで T ヘルパー細胞 (ヒストン エピトープ経由) と B 細胞の両方を刺激し、抗ヌクレオソーム抗体を分泌することができる。
*ということで、抗dsDNA抗体と、抗ヌクレオソーム抗体の関係が難しくなってきたので、竹之内先生にChatGPTで質疑応答をしてもらいました:
抗dsDNA抗体と抗ヌクレオソーム抗体の関係
抗dsDNA抗体は、従来からループス腎炎の病態の中心と考えられてきました。
dsDNA(二本鎖DNA)は、核内の主要な構成要素であり、抗dsDNA抗体はそのDNAに結合する自己抗体です。
抗dsDNA抗体は診断や疾患活動性のマーカーとして重要であり、病態にも関与するとされています。
一方で近年の研究では、実際に腎炎を引き起こす免疫複合体の主要な構成要素は、dsDNA単独ではなく、ヌクレオソームであることが明らかになっています。
ヌクレオソームは、DNAがヒストンタンパク質に巻き付いた構造体であり、細胞のアポトーシスやネクローシスの過程で血中に放出されます。
抗dsDNA抗体は、このヌクレオソーム全体に結合する能力を持ち、結果として免疫複合体が形成されます。
抗dsDNA抗体と抗ヌクレオソーム抗体の違い
抗ヌクレオソーム抗体という用語は、ヌクレオソーム全体(DNAとヒストンを含む構造)を標的とする抗体を指します。
抗dsDNA抗体も、ヌクレオソームのDNA部分に結合できるため、抗dsDNA抗体が抗ヌクレオソーム抗体の一部とみなされることがあります。
ただし、抗ヌクレオソーム抗体には、DNA以外にヒストン部分を認識する抗体も含まれるため、両者は完全に同じではありません。
ループス腎炎の病態における抗体の役割
抗dsDNA抗体だけではなく、抗ヌクレオソーム抗体が病態形成の中心:
dsDNA単独は血中で安定ではなく、抗dsDNA抗体との免疫複合体が形成されるのは稀。
アポトーシスや細胞死で放出されるヌクレオソーム(DNA+ヒストン)が抗体の標的となり、腎炎を引き起こす免疫複合体を形成する。
免疫複合体の腎への沈着メカニズム:
ヌクレオソーム内のヒストンが正電荷を持つため、腎糸球体基底膜(負電荷を持つ)に結合しやすい。
その結果、免疫複合体が腎糸球体に沈着し、補体活性化と炎症を引き起こす。
抗dsDNA抗体の役割:
抗dsDNA抗体はヌクレオソーム内のDNAに結合し、免疫複合体形成の一部を担う。
しかし、ヒストン部分を認識する抗体も重要であるため、単に「抗dsDNA抗体」だけで説明しきれない部分がある。
抗ds-DNA抗体の抗原認識特性
抗ds-DNA抗体は、主に**二本鎖DNA(ds-DNA)**を標的とするものの、その多くがDNAの単独部分だけではなく、DNAが結合している他の構造要素(例えばヒストンやヌクレオソーム全体)にも結合する能力を持っています。
原因:交差反応性: 抗ds-DNA抗体の一部は、ds-DNAの塩基配列や構造だけでなく、ヒストンやヌクレオソーム内の他のタンパク質部分と相互作用できるように設計されています。
高い抗原親和性: ヌクレオソームは、DNAがヒストンに巻きついた状態で細胞内に安定的に存在するため、免疫系にとってヌクレオソーム全体が「抗原の実体」として認識される可能性が高いです。
まとめ:
ループス腎炎の病態の中心は、抗ヌクレオソーム抗体とヌクレオソームとの免疫複合体です。
抗dsDNA抗体もこの過程において重要な役割を果たしますが、病態形成にはヒストン部分を含むヌクレオソーム全体を標的とする抗体が関与しています。
抗ヌクレオソーム抗体という広い概念の中に、抗dsDNA抗体が含まれると考えると理解がしやすいです。
Pearl:抗dsDNA抗体価の上昇のみで治療を強化することはデメリットがメリットを上回る可能性がある
comment:Bootsma group followed a cohort of 156 patients with SLE and identified 46 who experienced a rise in dsDNA. These 46 patients were randomly allocated to receive either conventional treatment (i.e., the dose of steroids was increased only if clinical symptoms of a flare developed) or increased prednisolone dose right away (the increase was 30 mg/day, followed by tapering over 18 weeks). The group in whom prednisolone dose was increased
straightaway whenever the anti-dsDNA level rose did have significantly fewer flares of disease but also experienced more adverse effects of steroids, and more than one-quarter of this group discontinued the trial.
・抗dsDNA抗体のレベルが上昇した時点で、臨床症状が明らかになる前に患者を治療することで、SLE患者の管理が改善される可能性があることは以前から考えられていた。
・Bootsma グループは SLE 患者 156 名のコホートを追跡調査し、dsDNA の上昇を経験した 46 名を特定した。これらの 46 名の患者は、従来の治療 (すなわち、ステロイドの投与量は、再燃の臨床症状が現れた場合のみ増加) を受けるか、またはプレドニゾロンの投与量を直ちに増加させるか (増加量は 30 mg/日で、その後 18 週間かけて漸減) のいずれかに無作為に割り当てられた。抗 dsDNA レベルが上昇するたびにプレドニゾロンの投与量を直ちに増加させたグループは、疾患の再燃が有意に少なかったものの、ステロイドの副作用も多く、このグループの 4 分の 1 以上が試験を中止した。
・リツキシマブによる治療は多くのSLE患者に有効であり、抗dsDNAレベルの低下につながることが示唆されている。
・ベリムマブ試験の患者1684人を対象としたサブグループ解析で、ヴァン・ヴォレンホーフェンと同僚らは、ベースラインでの高い抗dsDNAレベルと低い補体の組み合わせがベリムマブに対する反応の予測因子であることが示された。
・他の研究では、リツキシマブ療法後に血清中のB細胞活性化因子レベルが上昇し、抗dsDNA抗体レベルの増加と疾患の再発につながる可能性があることが示された。
・BEAT LUPUSは、リツキシマブ療法の4〜8週間後にベリムマブまたはプラセボをランダムに投与された52人のSLE患者を含む第II相ランダム化比較試験(Ann Intern Med . 2021 Dec;174(12):1647-1657.)であり、主な評価項目はIgG抗dsDNA抗体レベルだった。52週目に、ベリムマブ群ではプラセボ群と比較してIgG抗dsDNA抗体の減少がより顕著で、重度の炎症のリスクも低かった。
・BLISS-BELIEVE studyでも、RTX+BELは、BEL単独に比べて活動性について優位差はなかった、ということでまだスタンダードにはならない印象です(Ann Rheum Dis 2024;83:1502–1512.)
・dsDNA抗体上昇をもって、少なくともステロイドで治療強化するのは避けたほうがよさそうです。dsDNA抗体上昇(+補体低下)に対して、belimumabを追加する、というのはありかもしれません。
