
軽度外傷性脳損傷(TBI)が脳内潜伏単純ヘルペスウイルス1型(HSV-1)を再活性化させ、神経変性やアルツハイマー病(AD)の病理発生に寄与する可能性
軽度の外傷性脳損傷(TBI)が脳内で潜伏している単純ヘルペスウイルス1型(HSV-1)を再活性化させ、神経変性やアルツハイマー病(AD)の病理発生に寄与する可能性があることを、新たな研究が示唆した。
研究者らは、三次元(3D)のヒト脳組織モデルを用いて、脳震盪を模倣した機械的衝撃が休眠状態のHSV-1を再活性化させ、神経炎症、アミロイドベータやリン酸化タウ(p-tau)の生成、神経膠症(gliosis)など、ADの特徴的なマーカーを引き起こすことを観察した。この現象は、繰り返される頭部外傷によってさらに悪化することが確認された。
「この研究は、頭部外傷後にHSV-1の再活性化を食い止め、アルツハイマー病のリスクを低減するために、抗ウイルス薬や抗炎症薬が早期予防治療として有用である可能性を問うものです」と、タフツ大学生物医学工学部の主任研究者ダナ・カイアンズ博士(PhD)は声明で述べている。
しかし、外部の専門家はさらなる研究が必要であるとして、確固たる結論を下す際には慎重を期すべきであると警告している。
この研究は、2025年1月7日に学術誌「Science Signaling」にオンライン掲載された
Cairns, Dana M., Brooke M. Smiley, Jordan A. Smiley, Yasaman Khorsandian, Marilyn Kelly, Ruth F. ItzhakiとDavid L. Kaplan. 「Repetitive Injury Induces Phenotypes Associated with Alzheimer’s Disease by Reactivating HSV-1 in a Human Brain Tissue Model」. Science Signaling 18, no. 868 (2025年1月7日): eado6430. https://doi.org/10.1126/scisignal.ado6430.
アポリポプロテインE4(APOE4)を持つキャリアの脳内での単純ヘルペスウイルス1型(HSV-1)感染は、アルツハイマー病(AD)のリスクを増加させる。我々は以前、APOE4ヘテロ接合型ヒト脳組織の三次元in vitroモデルにおいて、潜伏していたHSV-1が他の病原体への曝露による神経炎症に応答して再活性化することを発見した。外傷性脳損傷も神経炎症を引き起こすため、脳損傷が同様に潜伏状態のHSV-1を再活性化させる可能性があると推測した。
本研究では、潜伏状態のHSV-1感染が存在する場合と存在しない場合で、ヒト脳モデルに対する一度または複数回の制御された衝撃の影響を検討した。繰り返される軽度の制御された衝撃後、潜伏感染した組織ではHSV-1の再活性化が確認され、βアミロイドやリン酸化タウ(これらはシナプス機能障害や神経変性を促進する)の産生および蓄積、破壊的な神経炎症に関連する活性化した神経膠症(gliosis)が観察された。これらの効果は、AD、認知症、慢性外傷性脳症(CTE)に共通して見られる特徴であり、追加の損傷によってさらに増加したが、偽感染(mock-infected)組織では見られなかった。
また、潜伏感染した単層培養モデルで傷つけ処理を行った際、サイトカインIL-1βを阻害することでアミロイドおよび神経膠症の誘導を防ぐことができた。この結果から、頭部への直接的な衝撃や揺さぶり動作などによる繰り返しの機械的損傷の後、脳内のHSV-1の再活性化が、一部の個体においてADや関連疾患の発症に寄与する可能性があると提案する。
序文
TBIと神経変性疾患: 外傷性脳損傷(TBI)は、慢性外傷性脳症(CTE)、アルツハイマー病(AD)、認知症などの神経変性疾患の主要なリスク因子であるが、そのメカニズムは未解明である。
TBIの分類: TBIは貫通性(頭蓋骨を破壊する外力による)と非貫通性(頭蓋骨が破壊されないが脳が揺さぶられる外力による)に大別される。軽度の非貫通性TBI(脳震盪)は通常、完全回復するが、繰り返されるとCTEの発症につながる可能性がある。
初期損傷と二次損傷: 初期の損傷は不可逆的であるが、二次損傷は可逆的であり、神経炎症やアストロサイトの膠症、マイクログリアの活性化などを引き起こし、神経変性疾患に進行する。
繰り返しの軽度TBIの影響: 繰り返しの軽度TBIは脳機能に累積的な影響を与え、神経症状を慢性的に悪化させる。神経細胞死は通常、単一の軽度TBIでは見られないが、繰り返しのTBIではアポトーシスを通じた神経細胞死が報告されている。
HSV-1とADの関連性: 単純ヘルペスウイルス1型(HSV-1)は高齢者の脳内で潜伏感染し、APOE4キャリアではADのリスクを高めるとされる。TBIによる神経炎症が潜伏しているHSV-1を再活性化し、AD関連の病態を引き起こす可能性がある。
HSV-1の再活性化: TBIは神経炎症を通じてHSV-1の潜伏DNAを再活性化し、βアミロイドや神経原線維変化の形成、さらには神経膠症を引き起こす。これらの変化はADやCTE、認知症の病理学的特徴である。
臨床的証拠: TBI後のHSV-1の再活性化は臨床的に観察されており、重度の脳損傷患者ではHSV-1の肺での再活性化が悪い神経学的予後と関連している。
治療の可能性: HSV-1の再活性化を抑制する治療は、TBI後のAD発症リスクの低減に寄与する可能性がある。特に慢性脳震盪を経験した個人において有望であると考えられる。
研究の意義: 本研究では、TBIがHSV-1の再活性化を引き起こし、AD関連の表現型を悪化させることを示した。これにより、頭部外傷の治療戦略がADや関連疾患の発症を抑えるための重要な一歩となる可能性がある。
方法
3Dヒト組織モデルによるTBI研究
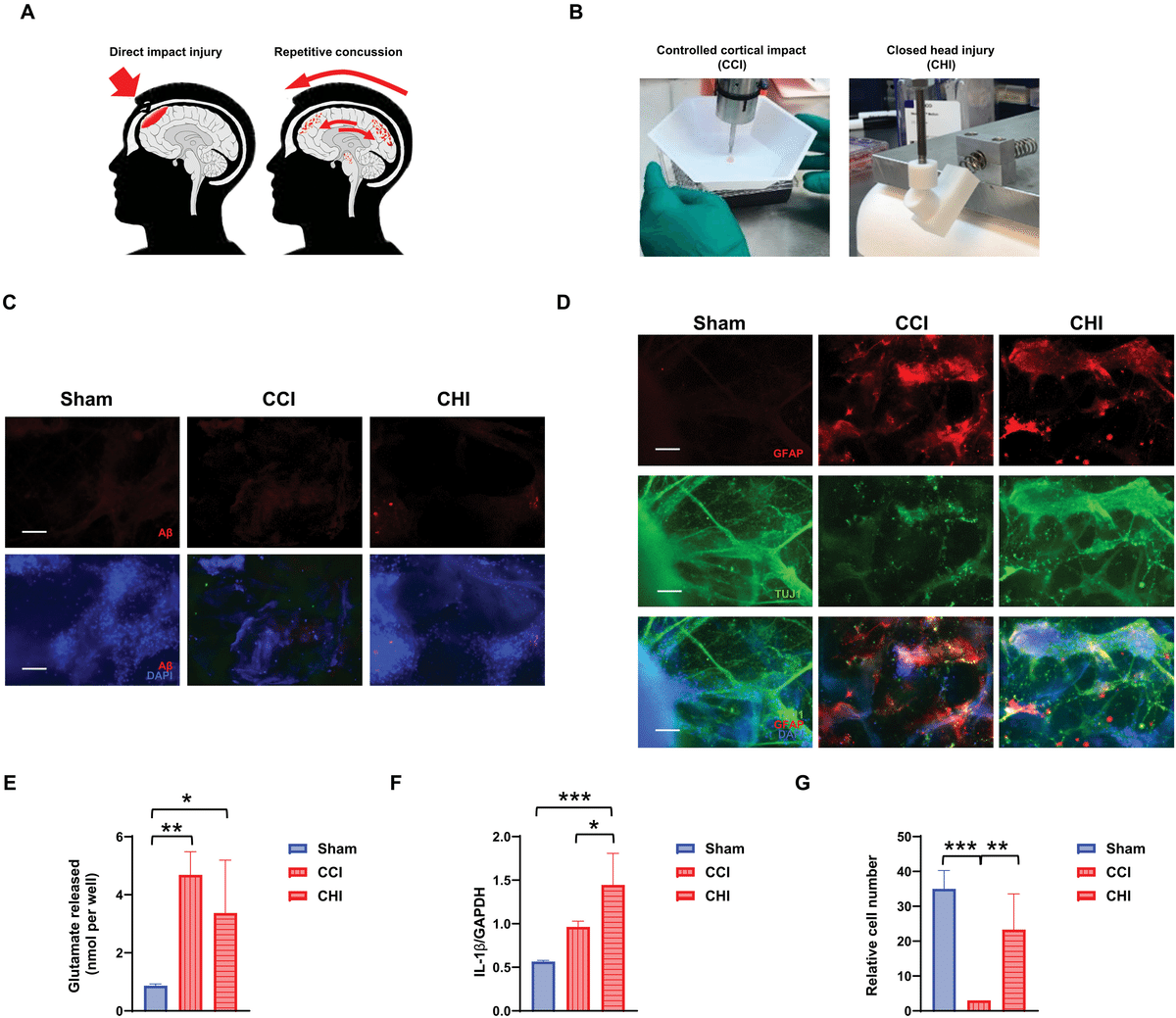
(A) ヒト脳における直接的な衝撃損傷および反復的な脳震盪による異なるTBIタイプを示す模式図。
(B) CCI(直接的皮質衝撃; 3 m/s)およびCHI(閉鎖性頭部損傷; 30 psi, 206,843 Pa)の誘導装置の画像。
(C) CCIまたはCHIによる単一の衝撃を受けた3D APOE3/4ヒト脳組織におけるβアミロイドの免疫染色結果(対照としてのシャム組織: 機械シミュレーション装置内に同じ時間配置)。各条件について、独立した3つの実験から5つの視野を代表する画像。
(D) CCIまたはCHIに応答した神経膠症をGFAP免疫染色で評価((C)と同様の条件)。ニューロンはTuj1抗体で、細胞核はDAPIで染色。各条件について、独立した3つの実験から5つの視野を代表する画像。
(E-G) CCIまたはCHI後の細胞外グルタミン酸放出量の評価(E)、qPCRによるIL1B発現量の測定(F)、および処置ごとの視野あたりのhiNSCs数の評価(G)。
(E)-(G)のデータは、3つの生物学的複製から得られた平均値 ± SDを示す。*P ≤ 0.05、**P ≤ 0.01、***P ≤ 0.001(分散分析後のTukey検定)。 スケールバー: 100 μm [(C)および(D)]。
TBIによる神経損傷と炎症: 3Dヒト脳組織モデルを使用し、直接的な皮質衝撃(CCI)および閉鎖性頭部損傷(CHI)を再現。いずれも神経膠症(GFAP増加)、神経損傷、炎症(IL-1β増加)を引き起こした。
グルタミン酸の増加: TBIモデルではグルタミン酸の急激な放出が観察され、臨床で報告される神経伝達物質異常と一致。
損傷モデルの違い: CCIは細胞の壊滅的損失を引き起こし、CHIは軽度から中等度の反復損傷を模倣する適切なモデル。
HSV-1感染によるAD関連表現型の誘導
HSV-1の影響: 低レベルのHSV-1感染がアミロイドβ生成、リン酸化タウ(p-tau)の蓄積、神経膠症(GFAP増加)を誘導し、AD関連表現型を示した。
炎症マーカーの増加: HSV-1感染後、IL-1βの発現が大幅に増加。
グルタミン酸の低下: HSV-1感染によりグルタミン酸放出が顕著に減少。
HSV-1潜伏感染の誘導と再活性化
潜伏状態の確立: HSV-1感染後、抗ウイルス薬(VCV)でDNA複製を抑制することで潜伏状態を誘導。
潜伏感染時の表現型: 潜伏HSV-1感染モデルではAD関連表現型は観察されなかった。
損傷による再活性化: CHIや傷モデル(scratch assay)で潜伏状態のHSV-1が再活性化し、アミロイドβ生成や神経膠症を誘導。
反復損傷の影響
損傷回数とAD表現型: CHIの反復処理により、潜伏HSV-1感染モデルでアミロイドβ、リン酸化タウ、炎症(IL-1β、GFAP増加)が顕著に誘導。
HSV-1の再活性化: 単一のCHIではHSV-1の再活性化は限定的だが、3回の反復損傷で20倍以上のHSV-1 UL29発現増加が観察。
炎症抑制効果: IL-1β阻害抗体を用いることで、傷モデルにおけるアミロイドβ生成と神経膠症が抑制。
結論
TBIはHSV-1の再活性化を引き起こし、AD関連の病理学的変化を誘導する。
特に反復的な軽度損傷はAD表現型を顕著に促進する。
HSV-1再活性化を抑制する治療法が、ADや関連疾患の予防に有用である可能性が示唆される。
Discussion
3Dヒト組織モデルによるTBI研究
TBIによる神経損傷と炎症: 3Dヒト脳組織モデルを使用し、直接的な皮質衝撃(CCI)および閉鎖性頭部損傷(CHI)を再現。いずれも神経膠症(GFAP増加)、神経損傷、炎症(IL-1β増加)を引き起こした。
グルタミン酸の増加: TBIモデルではグルタミン酸の急激な放出が観察され、臨床で報告される神経伝達物質異常と一致。
損傷モデルの違い: CCIは細胞の壊滅的損失を引き起こし、CHIは軽度から中等度の反復損傷を模倣する適切なモデル。
HSV-1感染によるAD関連表現型の誘導
HSV-1の影響: 低レベルのHSV-1感染がアミロイドβ生成、リン酸化タウ(p-tau)の蓄積、神経膠症(GFAP増加)を誘導し、AD関連表現型を示した。
炎症マーカーの増加: HSV-1感染後、IL-1βの発現が大幅に増加。
グルタミン酸の低下: HSV-1感染によりグルタミン酸放出が顕著に減少。
HSV-1潜伏感染の誘導と再活性化
潜伏状態の確立: HSV-1感染後、抗ウイルス薬(VCV)でDNA複製を抑制することで潜伏状態を誘導。
潜伏感染時の表現型: 潜伏HSV-1感染モデルではAD関連表現型は観察されなかった。
損傷による再活性化: CHIや傷モデル(scratch assay)で潜伏状態のHSV-1が再活性化し、アミロイドβ生成や神経膠症を誘導。
反復損傷の影響
損傷回数とAD表現型: CHIの反復処理により、潜伏HSV-1感染モデルでアミロイドβ、リン酸化タウ、炎症(IL-1β、GFAP増加)が顕著に誘導。
HSV-1の再活性化: 単一のCHIではHSV-1の再活性化は限定的だが、3回の反復損傷で20倍以上のHSV-1 UL29発現増加が観察。
炎症抑制効果: IL-1β阻害抗体を用いることで、傷モデルにおけるアミロイドβ生成と神経膠症が抑制。
結論
TBIはHSV-1の再活性化を引き起こし、AD関連の病理学的変化を誘導する。
特に反復的な軽度損傷はAD表現型を顕著に促進する。
HSV-1再活性化を抑制する治療法が、ADや関連疾患の予防に有用である可能性が示唆される。
