
便のエネルギー密度は腸管通過時間に正の相関があり、微生物腸型と関連している
オープンアクセス
公開日:2022年12月12日
便のエネルギー密度は腸管通過時間に正の相関があり、微生物腸型と関連している
https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-022-01418-5
Jos Boekhorst, Naomi Venlet, ...Henrik M. Roager 著者紹介
マイクロバイオーム10巻 記事番号:223(2022) この記事を引用する
2403 アクセス
308 Altmetric
指標詳細
概要
背景
腸内細菌叢は、食事からエネルギーを抽出する能力を介して肥満に影響を与えるという仮説がある。しかし、特定のヒト微生物群構造の役割や微生物群に依存したエネルギー収穫の決定要因を明らかにする証拠は不足している。
研究成果
本研究では、85人の過体重成人において、乾燥便エネルギー密度によって推定される食事からのエネルギー抽出が、腸管通過時間および腸内タイプとして層別した微生物群集の多様性と全体構造の変動と関連しているかどうかを調査した。我々は、腸管通過が遅ければ遅いほど、より多くのエネルギー抽出が可能になると仮定した。しかし、予想に反して、便のエネルギー密度は腸管通過時間と正の相関があった。腸内細菌型に層別すると、Bacteroides腸内細菌型(B型)はRuminococcaceae腸内細菌型(R型)に比べ、便エネルギー密度が有意に低く、腸管通過時間が短く、α多様性も低かった。プレボテラ(P型)個体は、B型とR型の中間に出現した。腸型間の便エネルギー密度の差は、習慣的な食事、食物繊維の摂取量、便中細菌数の差では説明できなかった。しかし、R型はB型に比べ、微生物由来のタンパク質分解代謝物の尿中および糞便中の濃度が高く、R型では大腸のタンパク質分解が亢進していることが示唆された。このことは、R型ではB型に比べて、大腸のエネルギー抽出効率が低いことを示唆している可能性がある。また、R型はB型に比べ、体重が有意に少なかった。
結論
腸内細菌によるエネルギー獲得は、腸管通過時間およびそれに伴う腸内細菌生態系の変動によって個人間で多様化することが示唆された。これらの関連性をより深く理解することで、個人に合わせた栄養の開発や減量戦略の改善を支援できる可能性がある。
ビデオ アブストラクト
背景
10年以上前のげっ歯類の研究から、腸内細菌叢が宿主のエネルギーバランスに影響を与える可能性があることが示され[1、2]、肥満に関連する腸内細菌叢が食事からエネルギーを採取する能力を高めることによって宿主の生理機能に影響を与えることが提案されました[3]。これらの顕著な観察を受けて、いくつかの研究により、肥満関連腸内細菌叢をgnotobioticマウスに移植すると、痩せ型関連腸内細菌叢を移植したマウスと比較して、実際に体重または脂肪量が増加することが確認されました[4,5,6]。この考えは、ヒトマイクロバイオティクスを移植したgnotobioticマウスの体重増加が糞便総エネルギーと負の相関があるという発見によって裏付けられ[3, 5]、食事からエネルギーを抽出する腸内細菌群の能力の違いが体重管理に関連し得ることを示唆している。もともと、腸内細菌叢の2つの主要な門、ファーミキューテスとバクテロイデテスの間の比率は、肥満のマーカーであることが示唆されていた [7]。しかし、Firmicutes/Bacteroidetesの比率はエネルギー収穫マーカーと相関がなく [8]、今日ではもはや肥満の関連マーカーとは考えられていない [9]。その代わりに、Prevotella(P型)、Bacteroides(B型)、Ruminococcaceae(R型)のいずれかが著しく豊富な微生物群集構造に従って、それぞれ微生物腸型に層別化すること[10, 11]は、これらが世界中で強固であると思われ [12] 、個人において長期にわたって全体的に安定していると報告されていることから、関連性があると考えられます [13].さらに、これらの腸型は、炭水化物、タンパク質、脂質の分解に対する代謝能力が異なることが示唆されている[14]。しかし、腸型が食事からエネルギーを獲得する能力に違いがあるかどうかは、まだ知られていない。さらに、腸内細菌の組成、多様性、代謝に関連する腸管通過時間 [15,16,17,18,19] が、腸内細菌叢に依存したエネルギー収穫の決定因子であるかどうかは分かっていない。そこで、体重過多の成人85名を対象に、乾燥便エネルギー密度に反映される腸内微生物のエネルギー採取が、腸管通過時間およびマイクロバイオームコミュニティ構造と関連しているかどうかを調査した。
研究方法
研究および被験者
Gut, Grain and Greens (3G) Center [20]内の2つのヒト介入試験に参加した、代謝リスクの上昇を示す85人の被験者(女性53人、男性32人、年齢22~66歳、中央値52)(図1a)から収集したベースラインデータとサンプルを本研究に組み入れた(表1)。参加者は、体重が安定しており、肥満度指数が25-35 kg/m2および/またはウエスト周囲径の増加(男性で≥ 94 cm、女性で≥ 80 cm)であった。さらに、非糖尿病性血糖値(空腹時血糖値 6.1-6.9 mmol/L)、脂質異常症(空腹時血清高密度リポ蛋白(HDL)コレステロール ≦ 1.03 mmol/L、女性 ≦ 1.29 mmol/L)、高血圧(収縮期血圧 (BP) > 130 mm Hg または高血圧の内科的治療)の少なくとも1つを満たしている。除外基準および組み入れ基準は、以前に詳しく説明されている[21, 22]。参加者は、食品サプリメントや腸管通過時間に影響を与える薬物を摂取しておらず、身体活動もモニターされていなかった。補足図S1の参加者とデータのフローチャートを参照。
Fig.
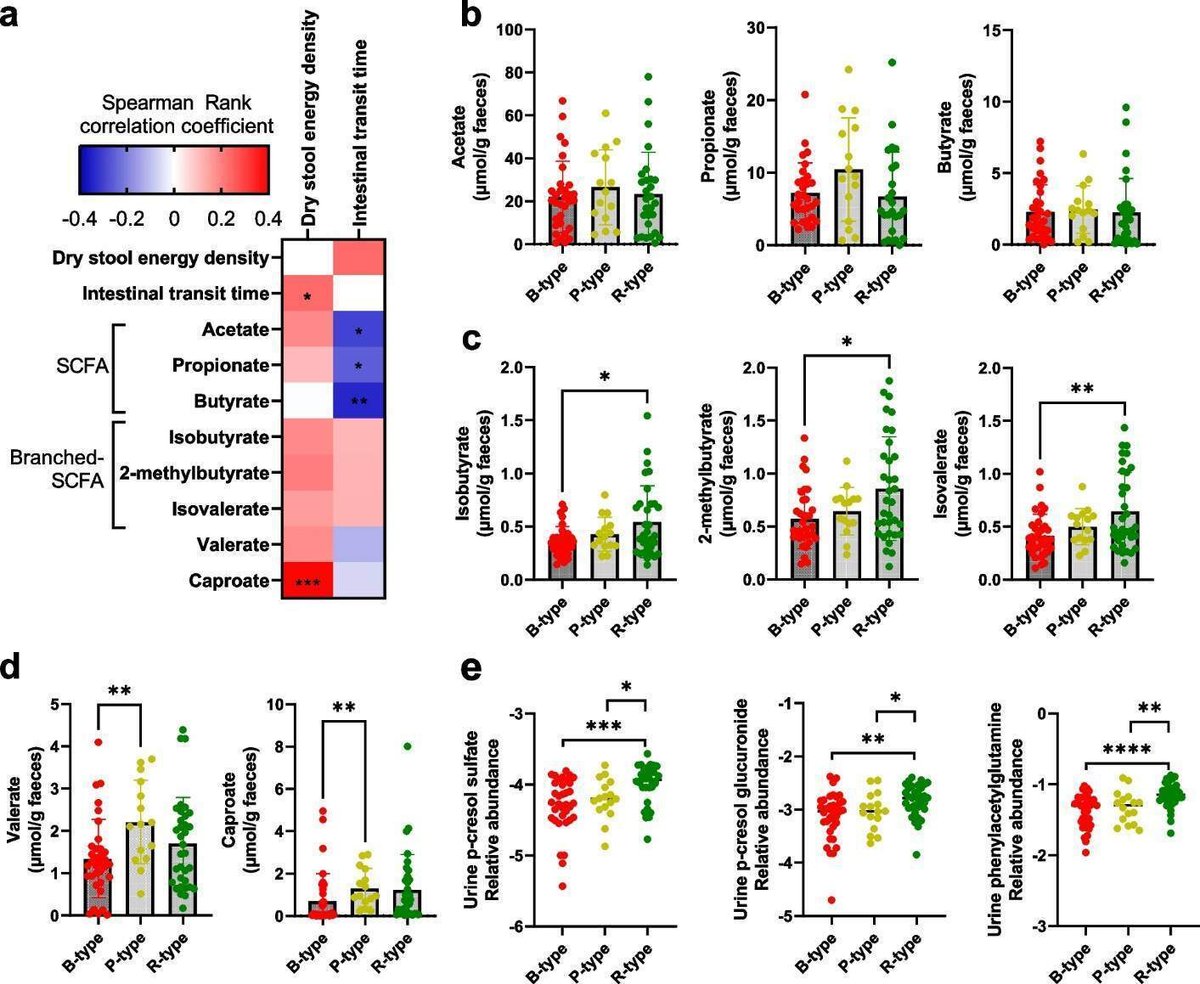
図1
腸型は、便のエネルギー密度、腸管通過時間、微生物のα多様性、および体重において異なる。 a この研究では、体重過多の被験者 85 人のベースライン測定を行った。便および尿サンプルの採取に先立ち、4日間の食事記録から習慣的な食事摂取量を推定し、習慣的な食事とライフスタイルを維持した1〜6日目の腸管通過時間をラジオ・オパーキング・マーカーで推定した。採取した便サンプルを用いて、腸内細菌のエネルギー抽出の指標となる乾燥便エネルギー密度、細菌細胞数、腸内細菌叢構造、短鎖脂肪酸を推定した。尿サンプル中の微生物由来代謝物を測定した。 b 属レベルの細菌相対量の Bray-Curtis 距離を距離指標とした主座標分析プロット。記号はサンプルで、形状・色は割り当てられた腸型(赤丸。赤丸:Bacteroides(Bタイプ)、n = 35、黄菱形:Prevotella(Pタイプ)。Prevotella(P-type)、n = 16、緑色の四角形。Ruminococcaceae(R-type)、n = 34)。腸型分類に用いた分類群の相対的存在量(黒矢印)、乾燥エネルギー、シャノン指数、通過時間(紫矢印)は補足的にプロットした(すなわち、順序付けの後に投影した)。横軸と縦軸はそれぞれ変動の20%と12%を説明する。3つの腸型に層別した被験者では、c便エネルギー密度(n = 77)、d腸管通過時間(n = 85)、eシャノン指数とf観察された豊かさ(n = 85)で反映されるマイクロバイオームのアルファ多様性、さらに(g)体重(n = 85)が異なっていた。腸型間の差は、Mann-Whitney U 検定を用いて検出した。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001
フルサイズ画像
表1 参加者の特徴(数値は平均値±SD、n=85で表示)
フルサイズの表
試料採取と習慣的食事および腸管通過時間の測定
詳細な実験手順とデータ解析については、我々が以前に発表した論文[16]を参照されたい。簡単に言えば、各参加者は、平日2日と週末2日の検査日前の4日間の事前コード化された食事登録によって、習慣的な食事摂取量を記録した[20]。質問票は、典型的なデンマークの食事パターン(朝食、昼食、夕食、間食)に従って整理された。総エネルギー、大栄養素、特定の食品成分および食品群の1日の摂取量は、Danish Food Composition Databank [23] を用いて計算された。さらに、食物摂取量は各参加者の総エネルギー摂取量(g/日/kJ)により調整した。腸管通過時間は、以前に発表されたように、検査日(7日目)前の連続した6日間(1〜6日目)に摂取された放射性不透過性マーカーを用いて推定された[16]。この6日間、参加者は習慣的な食事とライフスタイルを維持した。検査日(7日目)に、各参加者は便サンプルをビニール袋に入れ、5℃で最大24時間保存した後、滅菌水1:1で均質化し、分注してさらに処理するまで-80℃にて保存した。さらに、参加者は朝到着し、体重を測定し、血圧を測定し、空腹時の血液サンプルを採取した。血液サンプルは、グルコース、インスリン、Cペプチド、総コレステロール、LDLコレステロール、HDLコレステロールの濃度について、以前に発表されたように分析された[21, 22]。さらに、尿サンプルは、以前に発表されたように、検査日の標準的な飲料と朝食の後、標準的な方法で4時間採取した[21, 22]。
便のエネルギー密度、細胞数、およびマイクロバイオームの特性評価
ホモジナイズした便サンプルのアリコート(1 mL)を、50 ℃のオーブンで 72 時間、または乾燥するまで乾燥させた。その後、4桁の秤(AG204 Delta Range)を用いて、乾燥した便の重量を測定した。便サンプル(n = 80)の総エネルギー密度は、安息香酸を校正物質とする爆弾熱量計C6000(IKA、シュタウフェン、ドイツ)で約100 mgの乾燥便物質を燃焼させることにより測定した(C723 IKA)。便の細菌細胞数および腸内細菌叢組成は、以前に発表されている[16, 24]。簡単に説明すると、便サンプルのアリコート(n = 83)は、フローサイトメトリー分析によって細菌細胞数を推定するために使用され[24]、便のアリコート(n = 85)は、微生物DNAの抽出、16S rRNA遺伝子のV3-V4領域の増幅、およびIllumina MiSeqプラットフォームでの腸内マイクロバイオータの配列決定に使用し、以前発表した[16]とおりである。マイクロバイオームシーケンスデータをサンプルあたり21,000リードに希釈し、属レベルのマイクロバイオーム組成とアルファ多様性(Shannon指数と観察された豊かさ)を、既報のようにQIIMEを用いて計算した[16]。腸型は、主座標分析(PCoA)プロットにおけるサンプル位置に基づいて割り当てられ、3つの腸型に特徴的な分類群が補助変数としてプロットされた。配列解析データは、NCBI SRA データベースにアクセッション番号 SRP070699 として登録した。SRP070699
尿メタボロームと糞便中短鎖脂肪酸の解析
尿メタボロームデータは、以前に発表されています[16]。簡単に言うと、採取したすべての尿サンプルを液体クロマトグラフィー質量分析でプロファイリングし、微生物叢由来のタンパク質分解産物(p-クレゾール硫酸、p-クレゾールグルクロニド、フェニルアセチルグルタミン)を同定した。糞便中の短鎖脂肪酸(SCFA)は、以前に記載されたように、標的液体クロマトグラフィー質量分析によって定量化された[25]。簡単に言えば、SCFAは、2つの異なる希釈(それぞれ、1:240および1:2400希釈)の糞便サンプルにおいて定量化された。ホモジナイズした糞便サンプルは、3-ニトロフェニルヒドラジン(3NPH)を用いて誘導体化した。誘導体化した13C6-SCFA-類似体(酢酸、プロピオン酸、酪酸、イソ酪酸、2-メチル酪酸、イソ吉草酸、吉草酸、カプロン酸)を生成し、同位体標識内部標準として使用しました。サンプルはランダム化し、既報の通り UPLC-QTOF-MS (Waters) を用いて負イオン化モードで分析した [25]。UPLC-MS の生データは QuanLynx (Waters Corporation) を使用して分析した。検量線は、個々のSCFA分析物と標識内部SCFA標準物質の間のピーク面積比を、検量線標準物質の濃度に対してプロットすることによって確立された。検量線は線形回帰に適合させた。すべての外部標準の検量線の平均 R2 は 0.98 であった。
統計解析
統計解析はGraphPad Prism (version 9.1.0)で実施した。便エネルギー密度の異常値(n = 3)は、最大希望誤検出率を1%に設定したROUT法を用いて同定された[26]。相関は Spearman の順位相関を用いて計算した。エンテロタイプ間の差は、Mann-Whitney U 検定を使用して検出した。0.05以下のp値は統計的に有意であるとみなした。PCoAは、Canoco version 5.12 [27]でデフォルトの設定で行い、補助変数の欠損データは対応する中央値に置き換えた。
結果
腸管通過が遅ければ、理論的にはより多くのエネルギー抽出が可能になるが、便のエネルギー密度は、予想とは逆に、腸管通過時間と正の相関を示した(Spearman rho = 0.23, P = 0.027;補足図S2)。さらに、腸内細菌の3つの特徴的な分類群[10]に基づいて個体を層別化すると(図1bおよび補足図S3)、バクテロイデス(Bタイプ)の腸内細菌は、ルミノコックス(Rタイプ)の腸内細菌の個体と比較して、便のエネルギー密度が著しく低く、Pタイプよりも低い傾向があった(P = 0.06)(Fig. 1c)。3つのシグネチャー分類群に相関する細菌属を追加ファイル2に、細菌属と便のエネルギー密度および通過時間との相関をそれぞれ追加ファイル3に示す。便エネルギー密度と腸管通過時間の正の相関と一致し、B型個体はR型個体に比べて腸管通過時間が有意に短く、P型個体はその中間であった(Fig.1d)。腸型間の便エネルギー密度の違いは、習慣的な食事パターン(補足図S4)や便サンプル中の細菌数(補足図S5)の違いでは説明できなかった。その代わりに、便エネルギー密度の違いは、マイクロバイオームの生態系構造の違いに関連していた。というのも、Shannon indexと観察された豊かさで評価したマイクロバイオームのアルファ多様性は、腸型間で著しく異なり、B型は最も多様性が低く、R型は最も多様性が高かった(図1e、f)。また、便エネルギー密度は、観察された豊かさおよびシャノン指数と正の相関があった(それぞれSpearman rho = 0.32, P = 0.0037 および Spearman rho = 0.24, P = 0.030; 補足図 S6)。この関連を各腸型内で検討すると、便エネルギー密度・リッチネスとシャノン指数との正の関連はB型内のみで見られ(それぞれSpearman rho = 0.51, P = 0.0042, Spearman rho = 0.49, P = 0.0058) 、P型とR型ではこの関連は見られなかった(補足図S6)。特に、B型はR型に比べて体重が多かった(図1g)。腸型間の潜在的な機能的差異を評価するために、糞便中のSCFAと尿中のタンパク質分解性の宿主-微生物共代謝産物のレベルを腸型間で比較した。一般に、糞便中のSCFAは便のエネルギー密度とは有意な相関がなく(図2a)、酢酸、プロピオン酸、酪酸の糞便中レベルも腸型間で差がなかった(図2b)。しかし、R型個体の糞便中には、B型個体に比べて分岐型SCFA(イソ酪酸、2-メチル酪酸、イソバレレート)のレベルが高く、(図2c)、P型個体ではB型個体に比べてバレレートとカプロン酸のレベルが高く観察された(図2d)。さらに、R型の尿中には、微生物由来のタンパク質分解代謝物(p-クレゾールグルクロニド、p-クレゾール硫酸塩、フェニルアセチルグルタミン)がB型およびP型に比べて非常に高いレベルで安定して観察され(図2e)、腸型による大腸タンパク質分解の違いが示唆された。腸型の割り付けは容易ではないため[12]、最終的に腸型への割り付けがあいまいな人(n = 28)を除外し、観察された腸型間の違いの頑健性を評価した(図1bおよび補図S7a)。被験者のサブセットを分析したところ、観察された腸型間の差は強固なままであり、サンプルサイズが小さいにもかかわらず、統計的有意性と効果量は増加さえした(補足図S7b-f)。
図2

図2
腸型は糞便および尿中のタンパク質分解代謝産物において異なる。 a 乾燥便エネルギー密度、腸管通過時間および糞便短鎖脂肪酸(SCFAs)の間の関連性のスピアマン相関係数を示すヒートマップ。b酢酸、プロピオン酸、酪酸、c酪酸イソブチレート、2-メチルブチレート、イソバレレート、dバレレート、カプロン酸。 e微生物由来のタンパク質分解代謝物p-クレゾール硫酸、p-クレゾールグルクロニド、フェニルアセチルグルタミンの尿中相対レベルを腸型でログ変換したもの。腸型間の差は、Mann-Whitney U 検定を用いて検出した。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001
フルサイズ画像
考察
腸内細菌の種類によって、エネルギー抽出能力に違いがあることを明らかにした。興味深いことに、この仮説は、B型個体がR型個体に比べて高い体重を持つという発見によって一応支持された(図1g)。しかし、この体重の差は、便のエネルギー密度の差と直接関連づけることはできない。なぜなら、考えられる関係は複雑で、非常に異なるタイムスケールで作用しているからである。しかし、B型の便エネルギー密度の低さと体重の多さは、R型やP型に比べてより効率的にエネルギーを抽出していることを示唆している可能性がある。B型の便エネルギー密度が低いことは、B型が他の腸管型に比べて糖質代謝とタンパク質代謝の両方で高い代謝能力を持つことを示した以前の研究とも一致する[14]。実際、以前の研究では、B型はP型に比べて繊維質/全粒穀物が豊富な食事で体重が減少しにくいことが示唆されている [29, 30]。B型は微生物がアクセスできる炭水化物の少ない西洋的なライフスタイルと繰り返し関連しており、一方、P型はMACsを多く含む繊維食と関連している[31]。しかし、我々は腸型間の習慣的な食事の違いを観察しなかった。このことは、以前に示唆されたように、腸型は人生の早い時期に確立されることを示唆しているのかもしれない[32]。その代わりに、R型ではB型やP型に比べてα多様性が高く、糞便や尿中の微生物叢由来のタンパク質分解代謝物量が多かったことから、R型では大腸のタンパク質分解が増加し、より複雑な微生物生態系が形成されていることが示唆された。これは、R型では腸管通過時間が長いことが原因である可能性がある。なぜなら、我々や他の研究者は、腸管通過時間が長いと、α多様性とタンパク質分解発酵の増加が関連し[16、17]、一方、短い通過時間では糖分解の増加が関連することを以前に明らかにしているからである[33]。今回、通過時間と糞便中の酢酸・プロピオン酸・酪酸の間に負の相関が見られたが、これらの代謝物には腸型による違いは見られなかった。P型とB型はPrevotellaのバイモーダルな分布から繰り返し同定されているが[12]、本研究ではR型とB型があまり明確に分かれていないのは通過時間の勾配によるものではないかと考えている(図1b, d)。また、通過時間は便のエネルギー密度と正の相関があることを示し、これまでの知見を拡張した。このことは、腸管通過時間が長いことが必ずしも食事性基質の完全な消耗につながるわけではなく、微生物発酵が糖質分解代謝からタンパク質分解代謝に移行することを伴い、それが腸内細菌叢のエネルギー抽出にマイナスの影響を与え、高い便エネルギー密度に反映されているように食事性基質の完全な消耗が少なくなることを示唆している。このことは、トランジットタイムの長い人は炭水化物が枯渇するという一般的な概念に疑問を投げかけるものである。一般的な考え方は、容易にアクセスできる炭水化物資源の枯渇に基づいているが [34] 、我々は、食物から得られるより複雑な炭水化物は、R型生態系によって容易に発酵可能な単純炭水化物に効果的に分解されず、その結果、生態系はタンパク質分解エネルギー生成に切り替え、炭水化物枯渇を不完全にするという仮説を立てている。我々の知見は、ヒトのボランティアにおいて通過時間が遅くなると糞便の糖質分解活性が低下することを示した以前の研究と明らかに一致しており、これはin vitro発酵における短鎖脂肪酸産生および食物繊維の分解が著しく低下したことに反映されている[35]。
今回の観察研究では、因果関係を明らかにすることを目的としていないが、腸管通過時間が腸内細菌叢の構造を多様化し、それによって食物からエネルギーを抽出する腸内細菌叢の全体的な効率に影響を与えることが示唆された(図3)。このことは、これらの関係の根底にある生態学的基盤について重要な問題を提起している。腸内細菌の機能解析の結果、B型はR型(高速増殖と基質の浪費)に比べ、K型(低速増殖と高い基質エネルギー効率)に富んだ生態系を反映しているとされ [14, 36] 、これはR型と比較してB型の平均微生物増殖速度が高いと推定されていることと一致する [14] 。しかし、R型の生態系ではK-ストラテジストが相対的に多く存在するため、B型に比べて高いエネルギー抽出能力を示すと予想されるが、これは便サンプルのエネルギー密度で観察されたこととは対照的である。この明らかな矛盾は、腸内細菌生態系を形成する駆動力をさらに解読する必要がある。本研究にはいくつかの限界がある。まず第一に、マイクロバイオーム組成と便のエネルギー密度との関連を調査するようには設計されていない。さらに、食事評価ツールの固有の限界のため、エネルギー摂取などの潜在的な交絡因子を補正することができなかった。したがって、今後の研究では、総摂取カロリーおよび排泄物を制御する、十分に制御された環境において、提案された仮説を検証する必要がある。そうすれば、便のエネルギー密度だけでなく、便のエネルギー排泄量を評価することができるだろう。さらに、糞便中の細菌数とは別に、残った固形残便の組成を調査することは本研究では不可能であった。最後に、サンプル数が限られているため、性別などの潜在的交絡因子を調整することができなかった。
図3

図3
ヒトの腸内細菌叢に依存したエネルギー抽出の提案。我々は、腸管通過時間が腸内細菌叢の構造を多様化させ、腸型(B型、Bacteroides、R型、Ruminococcaceae、P型、Prevotella)によって捉えられた好ましいコミュニティ構造を形成し、B型とR型は通過時間とアルファ多様性の点で最も異なることを提案する。B型とR型の腸内細菌は、α多様性と大腸発酵に違いがあり、これは要するに、糖質分解代謝とタンパク質分解代謝のトレードオフであり、食物からエネルギーを抽出する腸内細菌の総合効率に影響を与える可能性がある。このことは、体重の違いにつながる可能性がある。星印(*)は、腸型は代謝能力と成長力に差があることを示す既報の論文の知見を示す[14]。
フルサイズ画像
結論
結論として、我々の研究は、腸内細菌のエネルギー収穫の代理として、便のエネルギー密度が腸管通過時間およびマイクロバイオームコミュニティ構造と関連していることを実証しています。本研究は、腸型によって反映されるヒト腸内細菌群集構造の違いが、食物からエネルギーを抽出する腸内細菌叢の能力に影響を与えることを示唆する最初の証拠のいくつかを提供するものである。因果関係はまだ確立されていませんが、この観察は興味深いもので、体重管理における個人別の食事反応を予測する上で極めて重要なものになる可能性があります。
データおよび資料の利用
配列解析データは、NCBI SRAデータベース(accession no. SRP070699。本研究中に含まれ、生成され、分析された残りのデータは、補足データファイルとして本論文に含まれている(追加ファイル1)。
略号
B型。
Bacteroides enterotype(バクテロイデス・エンタータイプ
P-type。
Prevotella腸内細菌型
Rタイプ
ルミノコッカス属菌エンテロタイプ
PCoA
主座標分析
参考文献
Bäckhed F, Manchester JK, Semenkovich CF, Gordon JI. 無菌マウスにおける食事誘発性肥満に対する抵抗性の基礎となるメカニズム。2007;104:979-84。
論文
Google Scholar
Bäckhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, et al.脂肪蓄積を制御する環境因子としての腸内細菌叢. Proc Natl Acad Sci U S A. 2004;101:15718-23 Available from: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=524219&tool=pmcentrez&rendertype=abstract [cited 20 Mar 2014].
論文
Google Scholar
ターンボーPJ、レイRE、マホワルドMA、マグリニV、マーディスER、ゴードンJI。エネルギー収穫のための増加した容量を持つ肥満に関連する腸内細菌叢。Nature. 2006;444:1027-31 Available from: http://www.ncbi.nlm.nih.gov/pubmed/17183312 [cited 10 Jul 2014].
論文
Google Scholar
Ridaura VK, Faith JJ, Rey FE, Cheng J, Duncan AE, Kau AL, et al. 肥満で不和な双子からの腸内細菌叢は、マウスの代謝を調節する。Science. 2013;341:1241214. https://doi.org/10.1126/science.1241214 American Association for the Advancement of Science. [2021年6月17日引用].
論文
CAS
Google Scholar
Zhang L, Bahl MI, Roager HM, Fonvig CE, Hellgren LI, Frandsen HL, et al. 環境における微生物の広がりは、ヒト由来の微生物コミュニティを移植したマウスにおける代謝表現型の発達に影響を与える。ISME J. 2017;11:676-90 Available from: https://pubmed.ncbi.nlm.nih.gov/27858930/ Nature Publishing Group [cited 1 Oct 2020].
掲載記事
Google Scholar
Duca FA, Sakar Y, Lepage P, Devime F, Langelier B, Doré J, et al. 肥満傾向のラットからの微生物叢の移植による肥満および関連するシグナル伝達経路の再現性。Diabetes. 2014;63:1624-36 Available from: https://diabetes.diabetesjournals.org/content/63/5/1624. アメリカ糖尿病協会株式会社 [2021年6月7日引用]。
論文
CAS
グーグルスカラー
Ley RE, Bäckhed F, Turnbaugh P, Lozupone CA, Knight RD, Gordon JI. 肥満が腸内細菌の生態系を変化させる。Proc Natl Acad Sci U S A. 2005;102:11070-5 Available from: https://pubmed.ncbi.nlm.nih.gov/16033867/ [cited 16 Jun 2021].
論文
CAS
Google Scholar
Murphy EF, Cotter PD, Healy S, Marques TM, O'Sullivan O, Fouhy F, et al. Composition and energy harvesting capacity of the gut microbiota: Relationship to diet, obesity and time in mouse models.腸内細菌の組成とエネルギー収穫能力:マウスモデルにおける食事、肥満、時間との関係。Gut. 2010;59:1635-42 Available from: https://pubmed.ncbi.nlm.nih.gov/20926643/ [cited 16 Jun 2021].
論文
CAS
Google Scholar
Magne F, Gotteland M, Gauthier L, Zazueta A, Pesoa S, Navarrete P, et al.固形物/バクテロイデテス比。肥満患者における腸内細菌叢の関連マーカー?Nutrients. 2020;12(5):1474 より入手可能。/pmc/articles/PMC7285218/. MDPI AG [cited 16 Jun 2021].
論文
CAS
Google Scholar
Arumugam M, Raes J, Pelletier E, Paslier DL, Yamada T, Mende DR, et al. Human gut microbiomeのEnterotypes。Nature. 2011;473:174-80.
論文
CAS
Google Scholar
ファロニーG、ヨーセンスM、ヴィエイラ-シルバS、ワンJ、ダージY、ファウストK、ら、腸内細菌群の変異の母集団レベルの分析。Science. 2016;352:560-4 Available from: http://www.ncbi.nlm.nih.gov/pubmed/27126039 [cited 29 Apr 2016].
論文
キャス
Google Scholar
Costea PI, Hildebrand F, Manimozhiyan A, Bäckhed F, Blaser MJ, Bushman FD, et al. Enterotypes in the landscape of gut microbial community composition.腸内細菌群集の景観における腸内細菌型。Nat Microbiol. 2017;3:8-16. https://doi.org/10.1038/s41564-017-0072-8 Nature Publishing Group [cited 16 Jun 2021].
掲載記事
キャス
グーグル スカラー
ローガーHM、リヒトTR、ポールセンSK、ラーセンTM、バールMI. プレボテラとバクテロイデスの比率から推測される微生物腸型は、新ノルディック・ダイエットによる6ヶ月間のランダム化制御食事介入中も安定したままであった。Appl Environ Microbiol. 2014;80:1142-9 Available from: http://www.ncbi.nlm.nih.gov/pubmed/24296500 [cited 25 Jan 2014].
論文
グーグルスカラー
Vieira-Silva S, Falony G, Darzi Y, Lima-Mendez G, Garcia Yunta R, Okuda S, et al. Species-function relationships shape ecological properties of the human gut microbiome.(種と機能の関係は、ヒト腸内細菌の生態学的特性を形成する。Nat Microbiol. 2016;1:1-8 Available from: www.nature.com/naturemicrobiology. Nature Publishing Group [引用:2021年6月16日].
論文
グーグルスカラー
Vandeputte D, Falony G, Vieira-Silva S, Tito RY, Joossens M, Raes J. Stool consistency is strongly associated with gut microbiota richness and composition, enterotypes and bacterial growth rates. Gut. 2015;65:57-62. 公開元:http://www.ncbi.nlm.nih.gov/pubmed/26069274。[引用:2015年6月13日].
Roager HM, Hansen LBS, Bahl MI, Frandsen HL, Carvalho V, Gøbel RJ, et al. Colonic transit time is related to bacteria metabolism and mucosal turnover in the gut.大腸通過時間は腸の細菌代謝と粘膜のターンオーバーに関連している。Nat Microbiol. 2016;1:16093 Available from: http://www.nature.com/articles/nmicrobiol201693. Nature Publishing Group.
掲載記事
キャス
Google Scholar
Nestel N, Hvass JD, Bahl MI, Hansen LH, Krych L, Nielsen DS, et al. The Gut Microbiome and Abiotic Factors as Potential Determinants of Postprandial Glucose Responses.食後グルコース反応の潜在的な決定要因としての腸内細菌と生物学的因子。A Single-Arm Meal Study. Front Nutr. 2021;7:594850 Available from: https://pubmed.ncbi.nlm.nih.gov/33585532/ Frontiers Media S.A. [cited 4 May 2021].
記事
Google Scholar
Müller M, Hermes GDA, Canfora EE, Smidt H, Masclee AAM, Zoetendal EXG, et al. Distal colonic transit is linked to gut microbiota diversity and microbial fermentation in humans with slow colonic transit.腸内細菌叢の多様性と微生物発酵は、大腸通過が遅いヒトにおける遠位大腸通過と関連している。Am J Physiol Gastrointest Liver Physiol. 2020;318:G361-9 Available from: https://pubmed.ncbi.nlm.nih.gov/31869241/. American Physiological Society [cited 16 Jun 2021].
論文
Google Scholar
Procházková N、Falony G、Dragsted LO、Licht TR、Raes J、Roager HM. 腸管通過時間を考慮したヒト腸内細菌叢研究の進展。Gut. 2022;0:gutjnl-2022-328166 Available from: https://gut.bmj.com/content/early/2022/09/28/gutjnl-2022-328166. BMJ Publishing Group [cited 30 Sep 2022].
記事
Google Scholar
Ibrügger S, Gøbel R, Vestergaard H, Licht T, Frøkiær H, Linneberg A, et al. 食事のグルテンまたは全粒粉が腸内マイクロバイオームと宿主代謝の健康に与える影響を評価する2つの無作為クロスオーバー試験。J Clin Trials. 2014;4:2167-0870 Available from: http://omicsgroup.org/journals/two-randomized-crossover-trials-assessing-the-impact-of-dietary-gluten-or-wholegrain-on-the-gut-microbiome-and-host-metabolic-health-2167-0870.1000178.php&&aid=30184 [cited 8 Jan 2015].
論文
Google Scholar
Hansen LBS, Roager HM, Søndertoft NB, Gøbel RJ, Kristensen M, Vallès-Colomer M, et al. 低グルテン食はデンマークの健康な成人の腸内マイクロバイオームに変化を誘発する. Nat Commun. 2018;9:4630 Available from: http://www.nature.com/articles/s41467-018-07019-x [cited 24 Apr 2019].
論文
Google Scholar
Roager HM, Vogt JK, Kristensen M, Hansen LBS, Ibrügger S, Mærkedahl RB, et al. Whole grain-rich diet reduces body weight and systemic low-grade inflammation withoutducing major changes of the gut microbiome: a randomised crossover trial.全粒粉リッチダイエットは腸内細菌の大きな変化を誘発することなく、体重と全身性低悪性度炎症を減少させる。Gut. 2019;68:83-93 Available from: http://www.ncbi.nlm.nih.gov/pubmed/29097438 [cited 24 Apr 2019].
論文
キャス
グーグル・スカラー
Biltoft-Jensen A, Matthiessen J, Rasmussen LB, Fagt S, Groth MV, Hels O. Validation of the Danish 7-day pre-coded food diary among adults: Energy intake v. energy expenditure and recording length.デンマーク成人における7日間のプレコード食品日記の検証。Br J Nutr. 2009;102:1838-46 Available from: http://www.ncbi.nlm.nih.gov/pubmed/19650967 [cited 6 Jun 2016].
論文
CAS
Google Scholar
Søndertoft NB, Vogt JK, Arumugam M, Kristensen M, Gøbel RJ, Fan Y, et al. 腸内マイクロバイオームは食後血糖応答の共同決定因子である。PLoS One. 2020;15:e0238648 から入手可能です。/pmc/articles/PMC7500969/. Public Library of Science [cited 17 Jun 2021].
論文
Google Scholar
Meslier V, Laiola M, Roager HM, de Filippis F, Roume H, Quinquis B, et al. 過体重および肥満の被験者に対する地中海食介入は血漿コレステロールを低下させ、エネルギー摂取とは独立して腸内マイクロバイオームおよびメタボロームに変化を引き起こす。Gut. 2020;69:1258–68. https://doi.org/10.1136/gutjnl-2019-320438 Available from: http://gut.bmj.com/lookup/doi/10.1136/gutjnl-2019-320438. BMJ Publishing Group [cited 20 Feb 2020].
論文
CAS
グーグルスカラー
Motulsky HJ, Brown RE. 非線形回帰でデータをフィットさせる際の外れ値の検出-ロバスト非線形回帰と偽発見率に基づいた新しい方法。BMC Bioinformatics. 2006;7:1-20 Available from: https://bmcbioinformatics.biomedcentral.com/articles/10.1186/1471-2105-7-123. BioMed Central [引用:2021年8月6日].
論文
Google Scholar
Canoco reference manual and user's guide: software for ordination, version 5.0. Ithaca: Microcomputer Power; 2012. 利用可能な場所: https://research.wur.nl/en/publications/canoco-reference-manual-and-users-guide-software-for-ordination-v [引用: 7 Jul 2021].
Google Scholar
Lund J, Gerhart-Hines Z, Clemmensen C. ヒトの体重調節におけるエネルギー排泄の役割。Trends Endocrinol Metab. 2020;31:705-8 Available from: https://pubmed.ncbi.nlm.nih.gov/32674987/ [cited 12 Jan 2022].
論文
CAS
グーグルスカラー
Christensen L, Vuholm S, Roager HM, Nielsen DS, Krych L, Kristensen M, et al. Prevotella abundance predicts weight loss success in healthy, overweight adults consuming a whole-grain diet ad libitum: a post hoc analysis of a 6-wk randomized control trial. J Nutr. 2019;149:2174-81.
論文
Google Scholar
Hjorth MF, Roager HM, Larsen TM, Poulsen SK, Licht TR, Bahl MI, et al. 前処置の微生物プレボテラ対バクテロイデス比、6ヶ月間のランダム化比較食事介入中の体脂肪減少成功を決定する。Int J Obes. 2018;42:580-3.
論文
キャス
グーグルスカラー
Wu GD, Chen J, Hoffmann C, Bittinger K, Chen YY, Keilbaugh SA, et al. Linking long-term dietary patterns with gut microbial enterotypes.(長期的な食事パターンを腸内細菌の腸型に関連付ける)。Science. 2011;334:105-8 アメリカ科学振興会.
論文
CAS
Google Scholar
Bergström A, Skov TH, Bahl MI, Roager HM, Christensen LB, Ejlerskov KT, et al. 幼児期における腸内細菌叢の確立:デンマーク人乳児の大規模コホートにおける縦断・探索的研究. Appl Environ Microbiol. 2014;80:2889-900.
論文
Google Scholar
ルイスSJ、ヒートンKW. 腸管通過の促進による遠位結腸の酪酸濃度の増加。Gut. 1997;41:245-51 Available from: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1891451&tool=pmcentrez&rendertype=abstract [cited 16 Nov 2015].
論文
CAS
Google Scholar
Macfarlane GT, Macfarlane S. Bacteria, colonic fermentation, and gastrointestinal health(細菌、大腸発酵、および胃腸の健康)。J AOAC Int. 2012;95:50-60 Available from: http://www.ncbi.nlm.nih.gov/pubmed/22468341. [引用:2015年9月14日].
論文
CAS
Google Scholar
El Oufir L, Barry JL, Flourié B, Cherbut C, Cloarec D, Bornet F, et al. 人における通過時間と糞便細菌による食物繊維のin vitro発酵の関係。Eur J Clin Nutr. 2000;54:603-9 Available from: https://pubmed.ncbi.nlm.nih.gov/10951507/ [cited 12 Jan 2022].
論文
CAS
Google Scholar
Pianka ER. r-とK-Selectionについて。Am Nat. 1970;104:592-7.
論文
Google Scholar
参考文献のダウンロード
謝辞
Sarah Fleischer Ben Soltane(コペンハーゲン大学栄養・運動・スポーツ学部)には糞便中の短鎖脂肪酸測定に協力してもらい、Bodil Madsen(デンマーク工科大学国立食品研究所)には爆弾熱量測定に協力してもらい、3Gコンソーシアム全体、特にMette Kristensen(コペンハーゲン大学栄養・運動・スポーツ学部)、Morten H. Christensen(同大学放射線学部)、Morten F. Christensen(同大学放射線学部)に謝辞を贈りたい。Sparholt、Anders F. Christensen (Department of Radiology, Bispebjerg Hospital, Copenhagen)には腸管通過時間の測定と手配をお願いした。
資金提供
本研究は、ノボ ノルディスク財団(NNF19OC0056246;PRIMA-toward Personalised dietary Recommendations based on the Interaction between diet, Microbiome and Abiotic conditions in the gut)の助成を受けて実施した。研究助成機関は、研究のデザイン、データの収集・分析・解釈、原稿の執筆には一切関与していない。
著者情報
著者名および所属
Wageningen University and Research, Host-Microbe Interactomics, Wageningen, The Netherlands
Jos Boekhorst、Naomi Venlet、Michiel Kleerebezem
デンマーク、フレデリクスベルグ、コペンハーゲン大学、栄養・運動・スポーツ学科
Nicola Procházková, Mathias L. Hansen, Christian B. Lieberoth, Lotte Lauritzen & Henrik M. Roager
デンマーク国立食品研究所、デンマーク工科大学、Kgs. Lyngby, Denmark
マーティン・I・バール&ティネ・ラスク・リヒト
ノボ ノルディスク財団メタボリック基礎研究センター、コペンハーゲン大学、コペンハーゲン、デンマーク
Oluf Pedersen
寄稿
NV、MIB、HMR が実験計画を立案した。NVは便サンプルのボムカロリメトリーを実施した。NP、MLH、CBLは糞便中のSCFAsの定量を行った。JB、MK、HMRはデータ解析を行った。LL、OP、TRLは、ヒト試験の設計と開始を行った。HMR、JB、MKは原稿を執筆し、全著者が査読とフィードバックを行った。最終原稿は全著者が読み、承認した。
共著者
Henrik M. Roagerに連絡する。
倫理に関する宣言
倫理的承認と参加への同意
研究プロトコルは、デンマーク首都圏自治体倫理委員会(H-2-2012-064およびH-2-2012-065)により承認され、すべての参加者が書面での参加に同意した。
論文発表の同意
該当なし
競合する利益
著者らは、競合する利害関係を有しないことを宣言する。
追加情報
出版社からのコメント
Springer Natureは、出版された地図の管轄権の主張および所属機関に関して、中立的な立場をとっています。
補足情報
40168_2022_1418_MOESM1_ESM.xlsx
追加ファイル1.
40168_2022_1418_MOESM2_ESM.xlsx
追加ファイル2.
40168_2022_1418_MOESM3_ESM.xlsx
追加ファイル3.
追加ファイル4: 補足図S1.
研究参加者と利用可能なデータのフローチャート。本研究では、同じ施設で実施された2つの人間介入研究の参加者のベースライン測定値が含まれた。通過時間、腸内細菌叢、尿中代謝物、および習慣的な食事に関する測定が可能な合計85人の成人が対象となった。便のエネルギー密度(n=80)、便中細菌数(n=83)、便中短鎖脂肪酸(SCFA、n=83)について、便のアリコートを分析した。便エネルギー密度の異常値(n=3)は、最大希望偽発見率を1%に設定したROUT法を用いて同定した。補足図S2. 腸管通過時間と便エネルギー密度との関連。腸管通過時間と便エネルギー密度との間のスピアマン順位相関。線は線形回帰を示し、点線間の灰色の網掛けで最適適合線の95%信頼帯を示す。補足図S3. 微生物腸管型による層別化。(a) 3つの腸型に寄与する3つの特徴的な細菌分類群の相対的な存在量。箱ひげ図は、下限値と上限値の四分位値と中央値を示し、ひげは最小値と最大値を示す。赤色。Bacteroides(Bタイプ)、n=35、黄色。プレボテラ(P型), n=16; 緑: Ruminococcaceae(R-type)、n=34。(b)属レベルの細菌相対量のBray-Curtis距離を距離指標とした主座標分析プロット。記号はサンプルで、形と色は割り当てられた腸型(赤丸:B型、黄菱形:P型、緑四角:R型)を示す。平均相対量が0.1%以上の属(計21種)はすべて補助変数としてプロットした(奥の矢印)。属レベルまで割り当てられなかったOTUは、そのOTUについて利用可能な最も具体的な分類でラベル付けされたダミー「属」に割り当てられた。各矢印の最初の文字がそのレベルを示す(g: 属、f: 科、o: 目)。補足図S4. 腸型は習慣的な食事に差がなかった。(a) 食生活データ(g/day/kJ)の主成分分析で、微粒子(n=85)を腸型別に色分けしてスコアプロットしたもの。(b) さらに、大栄養素と異なる食品群および成分の摂取量を比較した場合、食事パターンにおける腸型間の差は認められなかった。腸型間の差は、Mann-Whitney U検定を用いて評価した。補足図S5. 便の細菌細胞数に腸型タイプ間の差はない。腸型に層別化した被験者では、便サンプルの細菌細胞数に差はなかった(n=83)。腸型間の差は、Mann-Whitney U 検定を用いて評価した。補足図S6. 便のエネルギー密度とマイクロバイオームα多様性の関連性。便のエネルギー密度と、(a)観察された豊かさおよび(b)シャノン指数によって評価されたマイクロバイオームα多様性との間のスピアマン順位相関をそれぞれ示す。個体は微生物の腸型指定によって色分けされ、腸型固有のスピアマン順位相関はグラフの横に示されている。線は線形回帰を示し、最適回帰直線の95%信頼帯を示す。補足図S7. 被験者のサブセットにおける腸型差の再解析。(a) 観察された腸型間の違いの頑健性を評価するために、腸型への割り当てが曖昧な個体(すなわち、主座標分析(PCoA)プロットの中央部、またはより人口密度の高い領域の間に位置する)を除外した(n=28)。PCoAプロットは、属レベルでの細菌の相対的存在量のBray-Curtis距離を距離指標として作成した。記号はサンプルで、形と色は割り当てられた腸型を示している(赤丸。赤丸:Bacteroides(B-type)、n=21、黄菱形:Prevotella(P-type)。プレボテラ(P型), n=15; 緑の四角。緑色の四角:Ruminococcaceae (R-type), n=21; 灰色の点:未分類, n=28)。腸型分類に用いた分類群(黒矢印)の相対量を補足的にプロットした(すなわち、順序付けの後に投影した)。横軸と縦軸はそれぞれ変動の20%と12%を説明する。3つの腸型に層別された被験者のサブセットは、(b) 便のエネルギー密度 (n=51), (c) 腸管通過時間 (n=57), (d) Shannon Index と (e) observed richness (n=57) で表されるマイクロバイオームのアルファ多様性、および (f) 体重 (n=57) で異なっていた。腸型間の差は、Mann-Whitney U 検定を用いて検出した。* p < 0.05, ** p < 0.01, *** p < 0.001, **** < 0.0001.
権利と許可
この記事は、原著者と出典に適切なクレジットを与え、クリエイティブ・コモンズ・ライセンスへのリンクを提供し、変更を加えたかどうかを示す限り、いかなる媒体や形式での使用、共有、適応、配布、複製を許可するクリエイティブ・コモンズ 表示 4.0 国際ライセンスの下に提供されています。この記事に掲載されている画像やその他の第三者の素材は、素材へのクレジット表示で別段の指示がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれます。もし素材が記事のクリエイティブ・コモンズ・ライセンスに含まれておらず、あなたの意図する利用が法的規制によって許可されていない場合、あるいは許可された利用を超える場合には、著作権者から直接許諾を得る必要があります。このライセンスのコピーを見るには、http://creativecommons.org/licenses/by/4.0/。クリエイティブ・コモンズ・パブリック・ドメインの献呈放棄(http://creativecommons.org/publicdomain/zero/1.0/)は、データへのクレジットラインに特に記載がない限り、この記事で利用可能になったデータに適用されます。
転載と許可
この記事について
CrossMarkで通貨と真偽を確認する
この記事の引用
Boekhorst, J., Venlet, N., Procházková, N. et al. Stool energy density is positively correlated to intestinal transit time and related to microbial enterotypes. Microbiome 10, 223 (2022)。https://doi.org/10.1186/s40168-022-01418-5。
引用元をダウンロード
受付終了
2022年7月6日
受理済
2022年11月08日
掲載
2022年12月12日
DOI
https://doi.org/10.1186/s40168-022-01418-5
