
原子と周期表
ワイは原子、ようわからんけど、電子が軌道周りに存在しとるらしい。
KLMN殻ってのがあってなあ、電子が存在出来る場所みたいなのを、区分して、教えてるらしい。
電子殻っていってな、電子が存在できる特定の場所ってわけやな、基本原子核の周りなんやわ。
2n²っていう数が、それぞれの電気殻に入るんやわ。KLMNな。
最も外側を最外殻っていって、最外殻に存在する電子を最外殻電子っていうらしいけれど、仰山、単語を作って、憶えさせようとするのは、負担になるし、酷い話やで。
ヘリウムとかネオンとかの希ガスは、最外殻の電子が一杯一杯で埋まっとる、最外殻が埋まっとる状態を閉殻っていうよ。
ちな、中性原子では、基本、陽子の数は電子の数やからな。
陽子の数は原子番号でもあるのよ。
メンデレーエフさんは、元素を原子量の順に並べてみると似た性質のものが周期的に現れるのを発見して、周期表を作ったんや。
まあ、並べようとよう思ったな、で周期性がある!って気づいたのだね。
世界中で使われ愛されている、元素周期表は、作られはじめたわけだ。
今では、原子番号の順に電子配列をもとにして、作られとるから、メンデレーエフさんの時代とは若干違うけれどね。
周期表は、縦を族、横を周期というのですわよ。
アルカリ、アルカリ土類、ハロゲン、希ガスというのは、周期表の族の中でも、特別な名前が付いとるやつなんやわ。
水素以外の1族がアルカリで、2族がアルカリ土類、17がハロゲン、18が希ガスって内容やですわよ。
1、2、12~18族は典型元素っていってな、HとHe以外の最外殻以外の電子数が希ガスになっとるというという特徴があるで。
3~11族は遷移元素っていってな。
最外殻数が、殆どの場合2で、時々、CrとかCuとかは1になるわよ。
ちな、大学で勉強するらしんやが、電子には軌道があるんやわ。
というのも、1s軌道やら、2s軌道2p軌道、3s軌道3p軌道3d軌道といった名称がついとるわけなんやが、sは球体みたいな形で、pは鉄アレイのような無限みたいな形で、ⅾは、よつばのクローバーみたいな、軌道をしてるわ。
2022年から、新課程になって、どうやら、spdf軌道やら、パウリの排他律、とかフントの規則を勉強するらしいですわ。量子力学まではやらんやろがね。
それぞれの軌道には2個ずつ、電子が入るってのがあってね。
例えば、s軌道には2つ電子が入る。
s1軌道
s2軌道 p2軌道
p軌道は、3種類あって、ⅾ軌道は5種類、f軌道は7種類ある。
それぞれ、2ずつ電子が入る。
s2軌道 p2軌道は、2×1+2×3=8で、8個電子が入る。
k殻とⅬ殻に対応しているってわけ。
s3軌道 p3軌道 d3軌道は、2×1+2×3+2×5=18で、18個電子が入る。
K殻とL殻、M殻に対応するってわけだ。
18個というのは、つまり、2n²でいうと、2×3²で18だ。
下記の図は、電子殻と、電子軌道を対応させた表です。

斜めの線は、電子の入って行く順です。
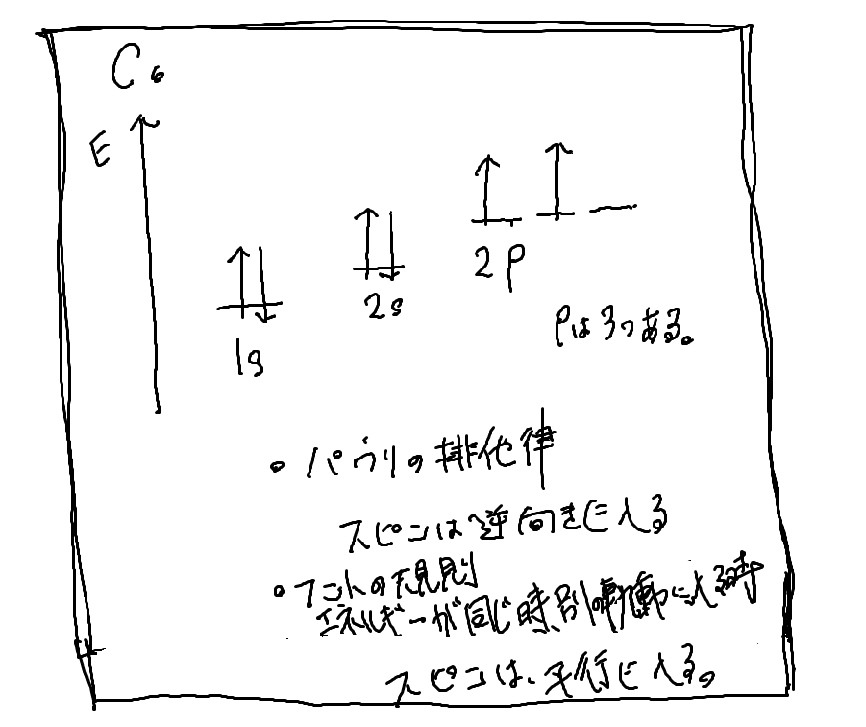
炭素原子の、電子の入り方の図です。
表1の通り、下から斜めの順に、電子が入って行きます。
6個電子があるので、6つ入ってます。
2pの軌道に入る時は、別々の軌道に平行に入って行きます。
量子力学を勉強すると、詳しいことがわかるらしいです。
₂₁Sc 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d¹
K2 L8 M9 N2
4sの方が3ⅾよりエネルギーが低いから先に電子が入って行きます。
M殻にまで、電子がまだ9個入ることが出来るが、軌道をみると、先にN殻の4s軌道に2つ電子が入る。
Zn亜鉛まで、N殻の個数は変わらず、ずっとM殻に電子が入り続ける。
₃₀Zn 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3ⅾ¹⁰
K2 L8 M18 N2
例外としてCrとCu、クロムと銅がある。
4sと3ⅾはエネルギーの差が非常に小さい。
クロムは、4s¹ 3ⅾ⁵となる。
どうして、4s軌道に2つ電子が入らないのかというと、ⅾ軌道は5つ電子が入ると安定するという性質があるからだ。
銅は、 4s¹ 3ⅾ¹⁰となるのだが、ⅾは電子の数が10個でも安定するからなのだという。
