
DDS(Drug Delivery System)とは?
みなさん、こんにちは~!
数ある記事の中から、ご覧いただきありがとうございます!新薬開発/薬剤師のからすまです。今日は「DDS(Drug Delivery System)」について解説します!
近年は医薬品の有効性、安全性の面で体内動態を制御すべきものに対して「DDS(Drug Delivery System)」といった新しい投与方法が工夫され臨床で用いられています。DDSは放出制御型製剤(コントロールドリリース)、標的指向型製剤(ターゲティング)があります。

放出制御技術
① 拡散による放出制御
●「マトリックス制御システム」・・・薬物を高分子やワックスのような基剤(マトリックス)中に分散させたもので、薬物の放出制御は拡散速度(Higuchi式)に従う。
※Higuchi式 Q={D(2A-Cs)・Cs・t}1/2

●「膜透過制御システム」・・・貯槽(リザーバー)に入れた薬物を高分子膜で包み、リザーバーから薬物放出を膜により制御する。この薬物放出は0次速度で一定である。コーティング剤としてエチルセルロール、エチレン酢酸ビニル共重合体など。
※エチレン・酢酸ビニル共重体

●OROS(オロス)・・・半透膜で作られた殻内に薬物および電解質を封入したもので、この薬物を経口投与すると水が浸入し殻内の薬物が溶解して生じた浸透圧によりオリフィス(殻内にあいた穴)から0次速度で薬物を放出させる。
例インヴェガ錠(パリペリドン)
統合失調症治療薬SDAの1つリスペリドンは活性代謝物である9ヒドロキシリスペリドン(パリペリドン)に代謝され、陽性症状並びに陰性症状を改善する薬効を発揮する。インヴェガ®錠はパリペリドンの半減期が約20 〜23 時間と長いことに加えて米国ALZA 社の浸透圧を利用した放出制御システム(Osmotic controlledRelease Oral delivery System:OROS®)により24 時間にわたってパリペリドンを放出し、血漿中薬物濃度を安定させることで、1 日1 回投与による統合失調症治療を可能にした放出制御型徐放錠である。

経口投与型コントロールドリリース製剤
●シングルユニットタイプ(全体が徐放性を持つ)
① レペタブ・・・内核錠に腸溶性コーティングを施した糖衣錠 (図3)
例:デパケンR錠

② スパンタブ・・・速放性と徐放性の2層錠。
●マルチユニットタイプ・・・顆粒一つ一つが徐放性を持つ。
③ スパンスル・・・速放性顆粒と徐放性顆粒を混合して、硬カプセルに充填したもの。(図4)
例:ヘルベッサーR、インテバンSP

④ コンチンシステム・・・マトリックス制御型製剤で、ワックスセルロースマトリックス中に薬物を分散させたもの。例:MSコンチン錠、オキシコンチン、ユニフィルLA錠、リスモダンR
例ユニフィルLA錠(テオフィリン徐放錠)Long Actingの略
基材:ヒドロキシエチルセルロース+セトステアリルアルコール(高級脂肪アルlコール)からなるマトリックス
→ヒグチ式に従って薬物が放出される。
※テオフィリン徐放性製剤(テオドール)はRound the clock(RTC)療法(24時間血中濃度を持続的に一定に保つ投与方法)に適している。RTC療法では目標血中濃度を5~15μg/mL(2歳未満は5~10μg/mL)に設定してコントロールすることが多い。
※気管支喘息は早朝から朝方にかけて悪化するので、テオフィリン徐放製剤は夕食後に服用する。ユニフィルLA錠の消失半減期は10時間であり発作を予防できる。新しい治療法であるChronotherapy(クロノセラピー)に適した製剤。

※モルヒネは消失半減期が2~3時間と短いため徐放化に適している。
(消失半減期が短い薬物の方が徐放化に適している。MSコンチンは6~9時間の半減期。小腸のphや酵素活性とは無関係に消化管内で水分を吸収することで薬物が外層から次第に放出される)
例パキシル錠とパキシルCR錠(CR:Controll release)
SSRI(選択的セロトニン再取り込み阻害剤)は「気分障害の薬物治療アルゴリズム」においてうつ病性障害の第一選択薬に推奨されているがその一方で副作用の一つである消化器症状が発現すること、またそれが治療継続を困難とする一因となっていると言われている。またSSRI 投与にともなう悪心および嘔吐の発現メカニズムの一つに、消化管でのセロトニン再取り込み阻害による5-HT3 受容体刺激が引き金となり、嘔吐中枢が刺激される経路が考えられている。この副作用に対し、腸溶性フィルムコーティングを用いて消化管内での薬物放出部位を限定し、速放性製剤と比べ血中濃度の立ち上がりがゆるやかであり、反復投与時の血中濃度の変動が小さくなることで全般的忍容性の向上が期待でき治療継続に寄与する。

薬物層:パロキセチンを含む徐放層

→パキシルCR 錠では4 時間前後の吸収 のタイムラグが存在し、Tmax は遅延し、Cmax は低下した。
TTS製剤
TTS製剤とは皮膚適用型コントロールドリリース製剤のことで貼付剤に分類される。
●膜透過型
① ニトロダームTTS(ニトログリセリン)
② デュロテップタッチ(フェンタニル)
③ エストラダーム(エストラジオール)
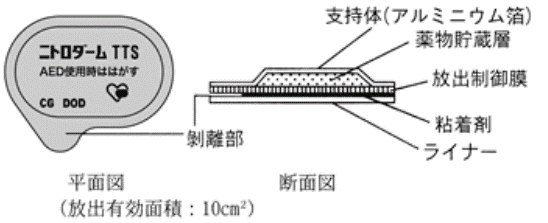

マトリックス制御型
① ニコチネルTTS(ニコチン)
② フランドルテープ(硝酸イソソルビド)
③ ホクナリンテープ(ツロブテロール)
→ヒグチ式に従う

注射剤
●インスリン製剤について
①NPH(Neutral Protamine Hagedorn)
→中間型、混合型
例 ノボリンN注フレックスペン
ヒューマリンNミリオンペンなど
① 遺伝子組み換え持続型溶解インスリンアナログ製剤
ランタス〔一般名:インスリン グラルギン(遺伝子組換え)〕は、ドイツへキスト社(現サノフィ社)において、遺伝子組換えにより生合成された持効型溶解インスリンアナログ製剤である。ヒトインスリンのA 鎖21位のアスパラギンをグリシンに置換し、B 鎖C 末端に2個のアルギニン残基を付加し、結果的に等電点がヒトインスリンの約pH5.5から約pH6.7に移行した。
これによりランタスは、皮下投与後に生理的pH で等電点沈殿を起こし、徐々に溶解、吸収されるため、ランタスは1日1回の皮下投与でほぼ1日にわたり明らかなピークがなく、安定した血糖降下作用を示す。



速効性、超速効性製剤
ヒトインスリン製剤は、膵臓から分泌されるヒトインスリンと同様のアミノ酸配列をもつことから、構造的には最も生理的なインスリンといえるが、皮下吸収に時間を要するため、食事の30~45 分前投与が必要である。そこで米国イーライリリー社は、作用動態がより生理的なインスリンとして、超速効型インスリンのインスリン リスプロインスリンを開発した。
リスプロは製剤中では六量体として存在するが、皮下注射後速やかに単量体へと解離するため、皮下から血中への移行が速い。
<インスリン療法が絶対的適応になる人>
インスリン依存状態(1型糖尿病)
高血糖性の昏睡(糖尿病ケトアシドーシス、高浸透圧高血糖症候群、乳酸アシドーシス)
重症の肝機能障害、腎機能障害を合併しているとき
重症感染症、外傷、中等度以上の外科手術(全身麻酔施行例など)のとき
糖尿病合併妊婦(妊娠糖尿病で、食事療法だけでは良好な血糖コントロールが得られない場合も含む)
静脈栄養時の血糖コントロール
<インスリン療法が相対的適応になる人>
インスリン非依存状態でも、著明な高血糖(たとえば、空腹時血糖値250mg/dL以上、随時血糖値350mg/dL以上)を認める場合
経口薬療法では良好な血糖コントロールが得られない場合(SU薬の一次無効、二次無効など)
やせ型で栄養状態が低下している場合
ステロイド治療時に高血糖を認める場合
インスリン療法の考え方は、インスリン注射によって体の外からインスリンを補って、健康な人の血中インスリンの変動をできるだけ忠実に再現すること。
1型糖尿病では、病気がみつかった時期と状態・進行状況によって多少の差はありますが、インスリンの分泌が非常に低下しているか、または全くないので、現在では基礎分泌と食後の追加分泌をともに補う強化インスリン療法(Basal-Bolus法)が主として用いられています。インスリン療法の開始時には、原則として入院して治療を開始する。2型糖尿病では、インスリン分泌能が保たれている場合は、基礎分泌、追加分泌のいずれかを補うことで血糖コントロールの改善がみられることもある。一般に妊婦の方や妊娠を希望する場合や、清涼飲料水ケトーシスなどでは強化インスリン療法を用いるが、その他にも状態に応じてさまざまな投与方法がある。患者さんの年齢、血糖コントロールの目標値、インスリンの分泌能とさらに、インスリン療法への理解、ライフスタイルなどを総合的に加味して、最も適した投与方法が決定される。
インスリン療法が必要と判断された場合にまず選択される治療法ですが、自己注射と自己の血糖管理が必要ですので、治療への理解と低血糖になったときにきちんと対処できることが重要です。
強化インスリン療法を用いて徹底的に健康な人のインスリン分泌を再現することで、インスリンを分泌する働きの回復や、さらなる分泌する働きの低下を予防することができます。また、特に1型糖尿病では強化インスリン療法によって的確に血糖コントロールすることで糖尿病合併症の発症や進展の予防にもなります。
インスリン基礎分泌を中間型または持効型溶解インスリン製剤1日1~2回、インスリン追加分泌を超速効型または速効型インスリン製剤1日3回を組み合わせて、1日3~5回注射する方法です。原則として1日4回(4回法)が用いられ、並行して1日1~7回程度の血糖自己測定を行います。

運動量が多い、または激しかった日などには低血糖症状がみられていなくても必ず就寝前に血糖測定すること、また、血糖値が変動しやすいのでライフスタイルにあわせて捕食の時間や回数を臨機応変に考慮することが大切です。
持続皮下インスリン注入(CSII)療法
一般的に、インスリン頻回注射でも良好な血糖コントロールが得られず、より厳格な血糖管理が必要な場合、特に小児・思春期の1型糖尿病、妊婦などに考慮されます。
CSIIは、体の外に小型のポンプを取り付けて、腹部の皮下に留置した針・チューブから超速効型または速効型インスリンを持続的に注入して健康な人のインスリン分泌を模倣する投与方法です。ポンプ機器管理と取り扱いは患者さんが自分で行います。超速効型または速効型インスリンを電動で持続的に注入して(基礎分泌)、各食前には手動で追加注入(追加分泌)を行いますので、皮下に長くインスリンが留まることがなく、夜間の低血糖などのリスクが低いとされています。
※インスリン注射や投与量の調整、血糖管理は自分で行いますが、注射の基本操作や血糖自己測定による血糖管理は、医師の指導をきちんと受けた上でできるものです。投与回数や医師の設定を超える投与量の変更が必要なときなどは、特に自己判断で変更せず、必ず医師と相談の上でそのときにあった投与方法を行っていけるようにしましょう。
その他のインスリン療法
2型糖尿病など、インスリン分泌がある程度保たれている場合では、基礎分泌から治療するのか追加分泌から治療するかといった、決まった治療方針は現在のところありません。
また、頻回の注射が難しい、強化インスリン療法が使えないなどの場合もあるため、
たとえば、
1.混合型または中間型インスリン製剤のみ、
または
2.基礎分泌が保たれているようであれば追加分泌の不足分だけ補う(超速効型または速効型インスリン製剤の投与)、
あるいは
3.持効型溶解インスリンで基礎分泌を補い追加分泌にはSU薬を用いる(BOT:basal supported oral therapy)という経口薬のみで血糖コントロールが不良な場合にインスリン基礎分泌をインスリン注射で補う方法など、基本的に患者さん個々の状態にあわせたさまざまな注射方法が用いられています。
※インスリン注射や投与量の調整、血糖管理は自分で行いますが、注射の基本操作や血糖自己測定による血糖管理は、医師の指導をきちんと受けた上でできるものです。投与回数や医師の設定を超える投与量の変更が必要なときなどは、自己判断で変更せず、必ず医師と相談の上でそのときにあった投与方法を行っていけるようにしましょう。
本日は以上となります。お忙しいところ、ご覧頂きありがとうございました!
からすま
