2025年度 大学入学共通テスト 問題解説「化学」
注釈者コメント
第1問 問1、問2、問4は基本的な知識問題。問3は状況がわかりにくいかも。問5aで、容器Aは解答に無関係なので、問題文と図から除外すべきです。問5bは逆浸透法ですが、初見でその原理を理解して問題を解くのは難しいです。1行目に「逆浸透を用いる方法」とあるだけで、とても不親切です。それと、NaClが水溶液中で完全に電離して溶質としての濃度が2倍になる、というのがポイントで、これも要注意です。
第2問 問1、問2、問4は基本問題。問3は問題文にlogの値を与えておく必要があると思います。選択肢1と2はありえないので除外して、3か4を選ぶときに、pHが1変化=[H+]が10倍変化=平方根の中が100倍変化=体積100倍。したがって選択肢3を除外、という考え方でいいのかもしれませんが。
第3問 問1、問2は知識問題ですが、沈殿の色やシリカゲルの製法といった細かい知識が要求されます。問3は反応式から生成する気体の化学式がわかるので、その後は知識問題です。問4aは細かい知識が要求されます。問4bの反応式は見たことがないと思いますが、係数を決めるのがややこしいだけの問題です。問4cは単純な計算問題です。
第4問 問1、問2、問3、問4a、bは基本問題。問4cはユニットごとの式量を求めて割合を計算するだけです。教科書の例題ではビニロンが題材になっていることが多いですが、この問題ではポリビニルブチラールになっていて、式量の計算がややこしいです。
第5問 リード文の、日本では古くから〜と江戸時代の話には意味がありません。受験生の時間を奪っているだけです。問1、問2は基本問題。問3はバナジウムが出てきて一瞬焦りますが、解答するにはバナジウムの性質は無関係で、問3aは酸化数を求める、問3bはナフタレンの酸化、問3cは反応エンタルピーを求めるだけです。問3dですが、EDTAは高校の教科書に出てこない物質なので、不適切な出題です。
総括 大問が5つなので、ひとつあたり12分かけるとして、それぞれ小問が6ずつあるので1問あたり2分で解答しなくてはなりません。例年どおり問題数が多すぎます。じっくり考える時間がありません。すべて解答できたひとはほとんどいないと思います。
2023年はランベルトベールの法則、2024年は質量分析、と高校で学習しない内容が出題されて、批判を受けて反省したのか、2025年は高校で学習しない内容は出題されませんでしたが、EDTAが出てきました。相変わらず、初見での対応力を測定する意図があるようですが、多くの生徒が受験する共通テストで、このような出題意図には疑問に感じます。
知識問題についてもけっこう細かい内容を出題している問題があります。
第1問 次の問い(問1〜5)に答えよ。
問1 固体がイオン結晶である物質として最も適当なものを、次の1〜4のうちから一つ選べ。
1 p-ジクロロベンゼン
分子結晶
2 酸化マグネシウム
イオン結晶
3 ダイヤモンド
共有結合の結晶
4 アルミニウム
金属結晶
答:2

記述(I)正しい。分圧の法則より、気体の分圧はそれぞれの気体の体積に比例する。
記述(II)正しい。圧力を高くすると、気体の体積に占める気体分子の体積の寄与が相対的に大きくなるため。
記述(III)正しい。温度を高くすると、分子の運動エネルギーが大きくなり、分子間力の寄与が相対的に小さくなるため。
答:1

蓋を緩めて再び閉めたとき、容器内のCO2の圧力は1.0×10^5 Paなので、このとき炭酸水500 mLに溶けているCO2の物質量は0.02 molである。蓋を緩めたときに出て行ったCO2の物質量が0.060 molなので、蓋を緩める前に炭酸水に溶けていたCO2の物質量は
0.02 + 0.06 = 0.08 mol
である。ヘンリーの法則によると、一定量の溶媒(水)に溶ける気体(CO2)の物質量はその気体の圧力に比例するので、0.02 molに対して0.08 mol溶けているということは、圧力は4倍だったということがわかる。
答:4.0×10^5 Pa(5)
問4 コロイドに関する記述として誤りを含むものはどれか。最も適当なものを、次の1〜5のうちから一つ選べ。
1 親水コロイド溶液に多量の電解質を加えたときに沈殿が生じる現象を塩析という。
正しい
2 分散媒が液体で分散質も液体のコロイドを懸濁液(サスペンション)という。
誤り(懸濁液はコロイド溶液とは限らない)
3 コロイド粒子が電荷を帯びていれば、コロイド溶液に直流電圧をかけると、コロイド粒子は自身が帯電している電荷とは反対符号の電極側に移動する。
正しい
4 水に分散したコロイド粒子が不規則に運動するのは、分散媒である水分子がコロイド粒子に不規則に衝突するためである。
正しい
5 コロイド溶液に強い光線を当てると光の通路が明るく見えるのは、コロイド粒子が光を散乱するためである。
正しい
答:2
問5 海水は塩化ナトリウムNaClや淡水を得るために利用される。海水の利用に関する次の問い(a・b)に答えよ。ただし、海水はNaCl水溶液と考えられるものとする。

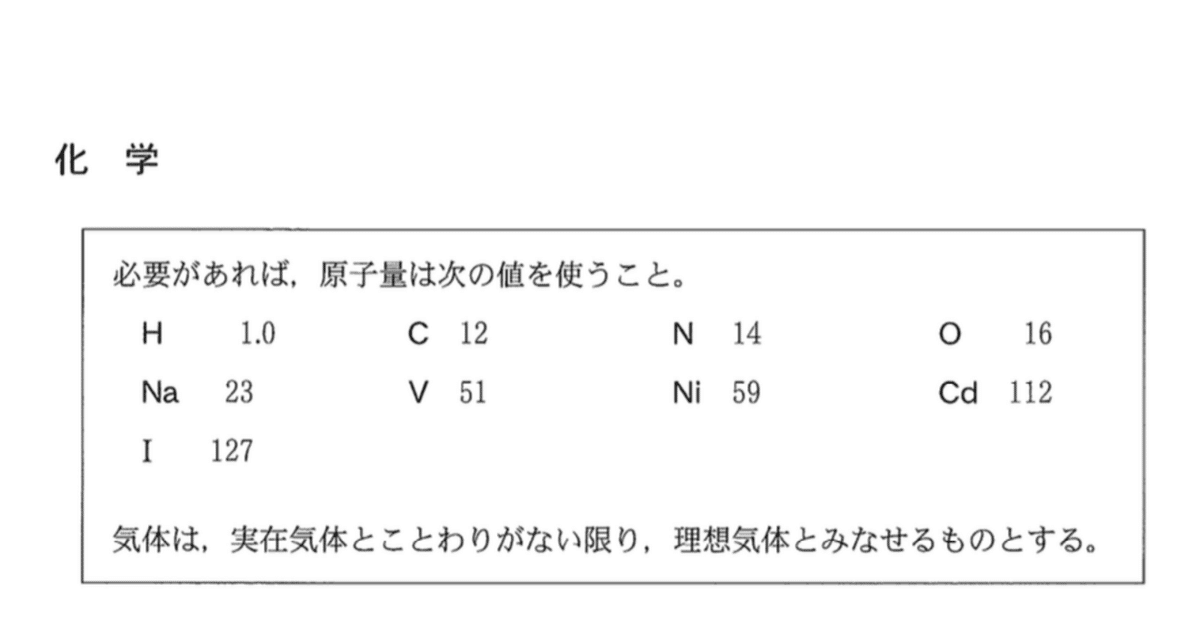
容器Bに純粋な水が入っているとすると、沸騰するときの温度が82°Cである。溶質としてNaClが溶けているので水の蒸気圧が下がり、沸点が90°Cになっている。したがって、容器B内の圧力は82°Cのときの水の蒸気圧と同じになる。蒸気圧曲線から読み取る。
答:5.1×10^4 Pa(1)

大気圧下で濃度の異なる溶液を半透膜で仕切っておくと、濃度の薄いほうから濃いほうに水だけが移動して、濃度の高い溶液の液面を押し上げる。これが浸透圧で、これとは逆に、浸透圧に逆らって濃度の濃いほうから薄いほうに水を移動させる方法が逆浸透法である。逆浸透法では、平衡状態に達したとき、
ピストンを左から押す力=浸透圧+ピストンを右から押す力
が成り立つ。したがって、
浸透圧 (π) = 3.1×10^6 - 3.0×10^5 = 3.0×10^6 Pa
である。
ファントホッフの式 πV = nRT より、
(n/V) = π / (RT) となって、π、R、Tを代入すると、
(n/V) = (3.0×10^6) / (8.3×10^3 × 300) = 1.20 (mol/L)
この値が平衡時の溶質の濃度になる。ただし、NaClは水溶液中で完全に電離しているので、NaClとしての濃度は、その半分の 0.60 mol/L である。
もとのNaCl水溶液は0.50 mol/L、10 Lなので、この水溶液を0.60 mol/Lに濃縮するために減らす水の体積は、
10 (L) - (0.5/0.6)×10 (L) = 1.666…
よって、1.7 L
答:1
第2問 次の問い(問1〜4)に答えよ。

1 ルミノール反応は化学発光。
2 ケミカルとあるので化学発光。
3 ネオンサインはNe原子の励起現象なので化学発光ではない。
4 蛍の発光はルシフェラーぜによる化学発光。
答:3

負極での質量増加分は(OH)2に相当するので、生成したCd(OH)2の物質量は
1.7 / 34 = 0.05 mol
このとき電子は2 mol流れているので、正極では0.05 × 2 = 0.1 molのH2Oが消費された。したがって、消費されたH2Oの質量は
0.1 (mol) × 18 (g/mol) = 1.8 g
答:1.8(2)

弱酸の水素イオン濃度[H+]は次の式で近似できる。
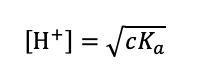
この式より、平方根の中の値が1/4 (=4V) になればpHはlog 2(=0.3) だけ上がり、pH 4.3になり、1/16 (=16V) になればpHはlog 4 (=0.6) 上がり、pH 4.6になる。その変化を表すグラフは、4である。
答:4

この反応の濃度平衡定数Kcは、

これより、圧平衡定数Kpを濃度平衡定数であらわすと、5の式になる。
答:5

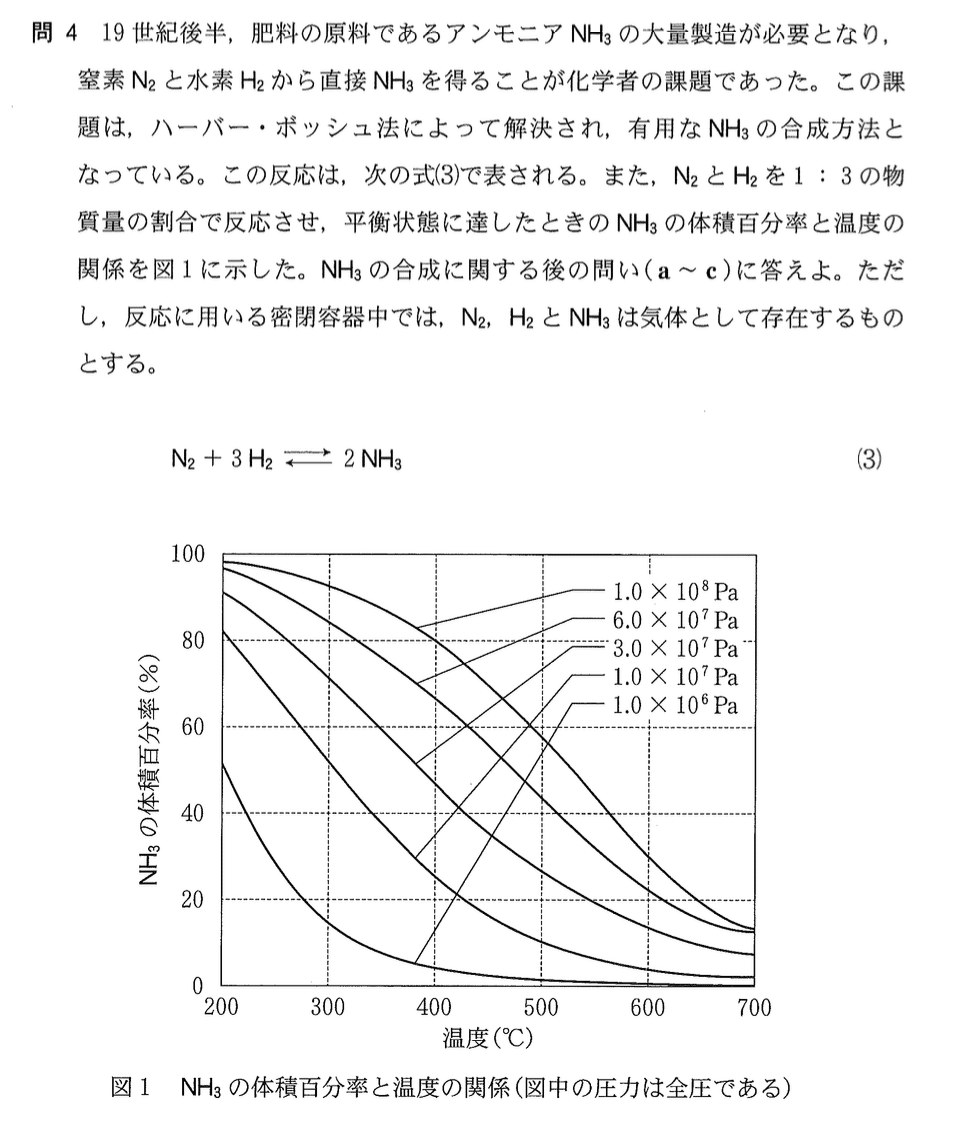
反応式より、反応前と平衡時の量的関係を表にする。

この表より、平衡時の全物質量が 5.0 molとわかるので、NH3の体積百分率は、3.0/5.0 = 60%とわかる。グラフより、該当する温度は約490°Cと読み取る。
答:490(3)


グラフより、いずれの圧力においても温度を上げるとNH3の体積百分率は減少するので、選択肢1、2、3は除外できる。また、一般に温度が高くなると反応速度が速くなり、その結果、平衡に達するまでの時間が短くなる。したがって、4である。
答:4
第3問 次の問い(問1〜4)に答えよ。

1 正しい。Cu(OH)2の沈殿が生成する。
2 誤り。沈殿は青白色ではなく暗褐色。
3 正しい。
4 正しい。[Ag(NH3)2]+の錯イオンが生成する。
答:2

1 正しい。
2 正しい。酸化数はNaが+1、Oが-2なので、Siの酸化数は+4になる。
3 誤り。シリカゲルはケイ酸を乾燥させたもの。
4 正しい。
答:3

1 正しい。(ア)は二酸化窒素NO2である。NO2 + H2O → HNO3
2 誤り。(イ)は一酸化窒素NOである。水上置換で捕集する。
3 正しい。(ウ)はフッ化水素HFである。フッ化水素の水溶液(フッ化水素酸)はガラスを溶かす性質がある。
4 正しい。(エ)はオゾンO3である。
問4 日本とチリは世界有数のヨウ素の生産国である。ヨウ素I2の生成・製造について、次の問い(a〜c)に答えよ。

1 正しい。ヨウ素は電子を失った(=酸化された)ので、H2O2は酸化剤である。
2 正しい。ヨウ素I2は水に溶けにくいので無極性有機溶媒のヘキサンに溶けると推定される。
3 誤り。SnCl2は還元剤なので、I2は生成しない。
4 正しい。ClのほうがIよりも陰イオンになりやすいので、ClからIに電子を与える。
答:3

式(7)に係数を当てはめて反応式を完成させると、下の式になる。
2 NaIO3 + 5 NaHSO3 → 3 NaHSO4 + 2 Na2SO4 + H2O + I2
したがって、NaHSO3は 5 mol 消費される。
(係数の決定方法)それぞれの原子について以下のとおり方程式を立てる。
O:6 + 3a = 4b + 4c + 1
S:a = b + c
H:a = b + 2
Na:2 + a = b + 2c
SとHの式より、c=2 がわかる。Oより、3a = 4b + 3 がえらえる。この式とHより、aを消去すると、b=3 がわかる。Hより、a=5がわかる。
答:5

I2の分子量は254なので、25.4 kgのI2は 100 mol に相当する。式(8)(9)より、100 molのI2を生成するには200 molのNaIが必要である。地下水の体積より、NaIの濃度は、
200 / (2.50×10^5) = 8.0×10^(-4) mol/L
答:8、0、4
第4問 次の問い(問1〜4)に答えよ。
問1 酸素を含む有機化合物の反応に関する記述として誤りを含むものはどれか。最も適当なものを、次の1〜5のうちから一つ選べ。
1 エチレングリコール(1,2-エタンジオール)にナトリウムを加えると、水素が発生する。
正しい。
2 希薄なフェノールの水溶液に少量の炭酸水素ナトリウム水溶液を加えると、二酸化炭素が発生する。
誤り。
3 エタノールの分子間の脱水反応により、ジエチルエーテルが生成する。
正しい。
4 アセトンにヨウ素と水酸化ナトリウム水溶液を加えて反応させると、ヨードホルムが生成する。
正しい。
5 無水酢酸とフェノールを反応させると酢酸フェニルが生成する。
正しい。
答:2

条件Iより、3と4は除外される。
条件IIより、6は除外される。
条件IIIより、1の分子量は177、2の分子量は177、5の分子量は179となる。
答:5
問3 天然に存在する化合物に関する記述として誤りを含むものはどれか。最も適当なものを、次の1〜4のうちから一つ選べ。
1 タンパク質のポリペプチド鎖は、ペプチド結合どうしに間にできる水素結合により二次構造をつくる。
正しい
2 アミノ酸は、結晶中では双性イオンになっている。
正しい
3 グルコース分子は、水溶液中では2種類の環状構造と1種類の鎖状構造の合計3種類が平衡状態で存在する。
正しい
4 フルクトースはグルコースの立体異性体である。
誤り
答:4
問4 アセチレンのその利用に関する次の問い(a〜c)に答えよ。
a アセチレンに関する記述として誤りを含むものはどれか。最も適当なものを、次の1〜5のうちから一つ選べ。
1 アセチレンは、炭化カルシウム(カルシウムカーバイド)に水を加えると発生する。
正しい
2 アセチレンに酸素を十分に供給して完全燃焼させて得られる炎は、金属の切断や溶接に用いられるほど高温である。
正しい
3 アセチレンに水を付加させると、アセトアルデヒドが生成する。
正しい
4 アセチレンにシアン化水素HCNを付加させると、繊維の原料であるモノマーが得られる。
正しい
5 アセチレンが重合したポリアセチレンは、三重結合と単結合で交互に炭素原子をつないだ高分子である。
誤り
答:5

反応(ア)は、付加重合
反応(イ)は、加水分解(教科書にはけん化と書かれている)
化合物(B)は、ポリ酢酸ビニル
答:6、1、9

アセタール化された部分の組成式C8H14O2より、その式量は142である。アセタール化されていない部分の組成式C4H8O2(PVAの2ユニットに相当する)より、その式量は88である。アセタール化された割合をxとすると、以下の式が成り立つ。

この式を解くと、x = 0.6 が得られる。したがって、60%である。
答:60(3)
第5問


沸点の低い物質ほど上の層に留出するので、A:ナフサ、B:灯油、C:軽油である(軽油は重油よりは軽い油という意味で、石油製品のなかでは沸点は高い部類になる。ディーゼル燃料のこと)。
答:3


化合物Dはシクロヘキサンである。ε-カプロラクタムが開環して分子間でアミド結合を作ると、そのあいだの炭素鎖は(CH2)5になる。
答:4

2価の陽イオンなので全体の酸化数は+2、酸素の酸化数は-2なので、V原子の酸化数は+4になる。
答:+4(4)

ナフタレンを酸化すると無水フタル酸が生成するので(1)。
答:1


反応エンタルピー=(生成物の生成エンタルピー)ー(反応物の生成エンタルピー)より、
式(1)
V2O5 + 5Ca → 2V + 5CaO
経路I:ΔH1 = 5×(-636) - (-1550) = -4730 kJ/mol
経路IIはヘスの法則より、式(2)と式(3)の反応エンタルピーを足したものになる。式(2)と式(3)の化学反応式の両辺を足すと、
V2O5 + 2H2 +3Ca → 2V + 2H2O +3CaO
経路II:ΔH2 = 3×(-636) + 2×(-286) - (-1550) = -4030 kJ/mol
(注:単体のVとCaとH2の生成エンタルピーは0とする)
したがって、ΔH1 < ΔH2 <0 の関係になる。
答:1

1.00×10^(-2) mol/L、4.00 mLのEDTA水溶液中のEDTAの物質量は、
1.00×10^(-2) × 4.00×10^(-3) = 4.00×10^(-5) mol
である。この水溶液中のVO2+の物質量はEDTAの物質量と等しい。もとの水溶液が250 mLに含まれるVO2+の物質量は、
4.00×10^(-5) × (250/10) = 1.00×10^(-3) mol
である。VがすべてVO2+に変換されているので、燃焼灰1.00 gに含まれるVの物質量はVO2+の物質量と等しい。Vの原子量は51なので、その質量は、
1.00×10^(-3) (mol) × 51 (g/mol) = 5.10×10^(-2) (g)
答:3
