2024年度 大学入学共通テスト 問題解説「化学基礎」
注釈者コメント
第1問
問1から問9は基本的な問題です.問10はグラフからそれぞれの気体のモル質量を読み取るのがポイントです.
第2問
ややこしそうな設定「宇宙ステーションの空気制御システム」と初見の反応名「サバティエ反応」が出てきて一瞬あせりますが,設問そのものは設定とはあまり関係のない基本的な内容です.図に惑わされず,式(1)と式(2)だけをよく見て解答すればいいでしょう.
講評
知識を問う問題は基本的な化学の知識で解答できると思います.計算問題も複雑な計算は不要なので短時間で解答できると思います.全体的に「化学反応の量的関係」「酸化と還元」の問題が多いですが,化学基礎としては適切な分量と難易度だと思います.
第2問の設定を読むと,人間が生活できる環境を人工的に作り出すのはとてもたいへんなことがわかります.地球の環境を守ることの重要さと化学が貢献できることについて考える機会にもなりますね.
第1問 次の問いに答えよ.
問 1 単体が常温・常圧で気体である元素はどれか.最も適当なものを,次の1〜4のうちから一つ選べ.
1.リチウム 固体
2.ベリリウム 固体
3.塩素 気体
4.ヨウ素 固体
答:塩素
問 2 第4 周期までの典型元素に関する記述として誤りを含むものはどれか.最も適当なものを,次の1〜4のうちから一つ選べ.
1.アルカリ金属元素は,炎色反応により互いを区別することができる.
正しい
2.2族元素の原子は,2個の価電子をもつ.
正しい
3.17族元素は,原子番号の小さい元素ほど電気陰性度が大きい.
17族(ハロゲン)は原子番号が小さい=原子核と最外殻電子が近い=電子を引き寄せる力が強い=電気陰性度が大きい.
正しい
4.貴ガス(希ガス)元素の原子は,8個の最外殻電子をもつ.
ヘリウム(He)の最外殻電子は2個.
誤り
答:4
問 3 次の記述ア〜ウのうち,物質の状態変化(三態間の変化)が含まれている記述はどれか.すべてを正しく選択しているものとして最も適当なものを,後の1〜7のうちから一つ選べ。
ア 海水を蒸留して淡水を得た.
液体から気体を経てふたたび液体になるので状態変化である.
イ 降ってきた雪を手で受けとめると,水になった.
固体から液体への状態変化である.
ウ ドライアイスの塊を室温で放置すると,小さくなった.
固体から気体への状態変化である.
答:ア,イ,ウ
問 4 化学電池に関する記述として正しいものはどれか.最も適当なものを,次の1~4のうちから一つ選べ.
1.二次電池は,充電により繰り返し利用できる電池である.
正しい
2.燃料電池は,燃料の燃焼により生じる高温気体を利用して発電する電池である.
誤り
3.電子が流れ込んで酸化反応が起こる電極を正極という.
誤り.正極には電子が流れ込んで還元反応が起こる.
4.鉛蓄池の電解質には,希硝酸が使われている.
誤り.鉛蓄池は希硫酸が使われている.
答:1
問 5 ケイ素と二酸化ケイ素に関する記述として誤りを含むものはどれか.最も適当なものを,次の1〜4のうちから一つ選べ.
1.ケイ素の結晶は,ダイヤモンドの炭素原子と同じように,ケイ素原子が正 四面体構造を形成しながら配列している.
正しい
2.ケイ素は,金属元素ではない.
正しい.半金属である.
3. 二酸化ケイ素の結晶は,半導体の性質を示す.
誤り.半導体の性質を示すのは高純度のケイ素である.
4.二酸化ケイ素の結晶では,ケイ素原子と酸素原子が交互に共有結合している.
正しい.二酸化ケイ素は共有結合結晶である.
答:3
問 6 純物質の気体が,常温・常圧で容器に詰められている.この気体は,酸素O2,窒素N2,アンモニアNH3,アルゴンArのいずれかである.この気体には,次の記述ア〜ウの性質がある.この気体として最も適当なものを,後の1〜4のうちから一つ選べ.
ア 無色・無臭である.
該当するのは,酸素,窒素,アルゴン
イ 容器の中に火のついた線香を入れると,火が消える.
該当するのは,窒素,アンモニア,アルゴン
ウ 密度は,同じ温度・圧力の空気と比べて大きい.
該当するのは,酸素,アルゴン(空気よりも分子量が大きい)
答:アルゴン
問 7 メタンCH4を完全燃焼させたところ,18gの水H2Oが生成した.このとき,生成した二酸化炭素CO2は何gか.最も適当な数値を,次の1〜5のうちから一つ選べ.
反応式は,CH4 + 2O2 → CO2 + 2H2O
反応式より,生成するCO2とH2Oのモル比は1:2である.18gのH2Oは1 molであるから,このとき生成したCO2は0.5 molになる.CO2の分子量は44なので,生成したCO2は22gである.
答:22 g
問 8 酸と塩基,および酸性と塩基性に関する記述として,誤りを含むものはどれか.最も適当なものを,次の1〜4のうちから一つ選べ.
1.水は反応する相手によって酸としてはたらいたり,塩基としてはたらいた りする.
正しい
2.酸の価数および物質量が同じ強酸と弱酸では,過不足なく中和するのに必要な塩基の物質量は強酸の方が多くなる.
誤り.価数および物質量が同じであれば,中和するのに必要な塩基の物質量は強酸と弱酸で同じである.
3. 水素イオン濃度を用いると,水溶液のもつ酸性や塩基性の強さを表すことができる.
正しい.pHのことである.
4.酸の水溶液を水でいくら薄めても,25°C ではpHの値は7より大きくな ることはない.
正しい
答:2
問 9 下線を付した原子の酸化数を比べたとき,酸化数が最も大きいものを,次の 1〜4のうちから一つ選べ.

それぞれの原子の酸化数は,
1:+6
2:+5
3:+4
4:-3
答:1
問 10 純物質の気体アとイからなる混合気体について,混合気体中のアの物質量の割合と混合気体のモル質量の関係を図1に示した.0℃,1.0✕10^6 Paの条件で密閉容器にアを封入したとき,アの質量は0.64 gであった.次に,アとイをある割合で混合し,同じ温度・圧力条件で同じ体積の密閉容器に封入したとき,混合気体の質量は1.36 g であった.この混合気体に含まれるアの物質量の割合は何%か.最も適当な数値を,後の1〜6のうちから一つ選べ.ただし,アとイは反応しないものとする.

グラフより,気体アが100%のときの気体のモル質量は16 g/molと読み取れる.また,気体イが100%のときの気体のモル質量は40 g/molと読み取れる.
密閉容器に封入したアの質量が0.64 gなので,そのときの物質量は
0.64 ÷ 16 = 0.04 molである.
同じ温度・圧力では容器内の気体の物質量は同じなので,アとイの混合気体の全物質量は0.04 molである.この混合気体の質量が1.36 gなので,混合気体のモル質量は
1.36 ÷ 0.04 = 34 g/molである.
アの物質量の割合をAとすると,以下の式が成りたつ.
16A + 40(1 - A) = 34
これを解いて,A = 0.25.したがって25%となる.(グラフから混合気体のモル質量34 g/molから気体アの割合を読み取ってもよい)
答:25%
第2問 宇宙ステーションの空気制御システムに関する次の文章を読み,後の問い(問1〜3)に答えよ.
宇宙ステーションで人が生活するには,宇宙ステーション内の空気に含まれる酸素O2と二酸化炭素CO2の濃度を適切に管理する空気制御システムが必要である.
空気制御システムでは,次の式(1)に示すように,水H2Oの電気分解を利用してO2が供給される.また,補充するH2O の量を削減するために,式(2)のサバティエ反応の利用が試みられている(図1).この反応では,触媒を用いてCO2と水素H2からメタンCH4とH2Oを生成するため,人の呼気に含まれるCO2の酸素原子をH2Oとして回収できる.

問 1 式(1)の電気分解に関する記述として誤りを含むものはどれか.最も適当なものを,次の1〜4のうちから一つ選べ.
1.陽極側ではO2が発生する.
正しい
2.発生するO2は,水上置換法で捕集できる.
正しい
3.式(1)の反応は酸化還元反応である.
正しい
4.電気分解で発生するH2とO2の質量比は1:16となる.
誤り.式(1)によると水素2 molと酸素1 molが発生するので,質量比は2:16 = 1:8である.
答:4
問 2 サバティエ反応の反応物であるCO2および生成物であるCH4に関する次の問い(a 〜c)に答えよ.
a 式(2)において、CO2のC原子とO原子が酸化されるか,還元されるか.酸化も還元もされないかの組合せとして最も適当なものを,次の1〜6のうちから一つ選べ.

式(2)によると,炭素原子は,酸素が外れて水素が結合しているので,還元される.酸素原子は,酸化も還元もされない.
答:6
b 次の化学反応式ア〜エは,いずれも2種類の反応物からCO2が生じる化学反応を示している.ア〜エの反応において,2種類の反応物をいずれも1 molだけ用いて反応させるとき,生成できるCO2の物質量が最も多い反応はどれか.最も適当なものを,後の1〜4のうちから一つ選べ.ただし,いずれも記された反応のみが進行するものとする.
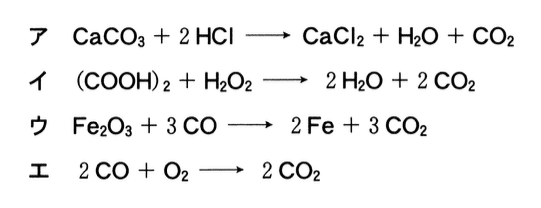
それぞれの化学反応において,反応物をいずれも1 molずつ反応させたときに生成するCO2の物質量は以下のとおりになる.
ア 0.5 mol
イ 2 mol
ウ 1 mol
エ 1 mol
答:イ
c CH4は常温以下の温度で安定である.しかし,十分な量の塩素と混合し て光(紫外線)を照射するとCH4の水素原子を塩素原子に置き換えた化合物 CH3Cl,CH2Cl2,CHCl3,CCl4ができる.CH4を含めた五つの化合物のうち,無極性分子はどれか.最も適当なものを,次の1〜5のうちから二つ選べ.ただし,解答の順序は問わない.なお,図は分子の形であり,球の大きさはそれぞれの原子の大きさを反映している.

塩素と炭素は電気陰性度の差が大きいので分子内に極性を生じる原因になる.
1:CH4 無極性分子
2:CH3Cl 極性分子
3:CH2Cl2 極性分子
4:CHCl3 極性分子
5:CCl4 無極性分子(塩素ー炭素間には極性があるが,4個の塩素が結合しており全方向に対称性があるので分子全体としては無極性になる)
答:1と5
問 3 図1で示した空気制御システムにおけるH2Oの量に関する,次の問い(a〜c)に答えよ.
a 宇宙ステーション内の4人が1日に消費するO2の総質量は,およそ3.2 kg である.式(1)の電気分解で3.2 kgのO2を供給するのに必要なH2Oの質量は何kgか.最も適当な数値を,次の1〜6のうちから一つ選べ.
3.2 kgのO2の物質量は,
3200 g ÷ 32 g/mol = 100 mol である.
反応式(1)は 2H2O → 2H2 + O2 であるから,2 molのH2Oから1 molのO2が生成する.したがって必要なH2Oの物質量は200 molである.
200 molのH2Oの質量は,
200 mol × 18 g/mol = 3.6 kg である.
答:5
b 式(2)の反応において1 mol のCO2 を使用するとき、使用したH2 と生成したH2Oの物質量の関係を表したグラフとして最も適当なものを,次の1〜4のうちから一つ選べ.

式(2)によると,CO2とH2とH2Oの物質量比は1:4:2である.よって,1 molのCO2を使用して反応させた場合,H2は最大4 molまで消費される.また,H2Oは最大2 molまで生成される.この条件を満たすグラフは3である.
答:3
c 式 (1)の反応によって3.2 kgのO2が生成したとき,同時に生成したH2だけを用いると,式(2)の反応で得られるH2Oの質量は何kgか.最も適当な数値を,次の1〜6のうちから一つ選べ.ただし,式(2)の反応に用いるCO2は十分な量があるものとする.
式(1)の反応において,O2が1 mol生成したときに,H2は2 mol生成する.
3.2 kgのO2の物質量は問3aより100 molなので,生成したH2の物質量は200 molである.
式(2)の反応において,H2 1 molあたりH2Oが0.5 mol生成するので,生成したH2Oの物質量は,200 × 0.5 = 100 molである.
H2Oの物質量を質量に変換すると,
100 mol × 18 g/mol = 1800 g = 1.8 kg となる.
答: 1.8 kg
