【GLP/GCP/GPSP/GVPの違い】登録販売者第一章
GLP/GCP/GPSP/GVPの違いを分かりやすく解説
医薬品の開発や販売後の管理において、「G~P」と呼ばれる基準はそれぞれ異なる段階や目的に応じたルールを定めています。以下に、それぞれの特徴を簡単に説明します。
1. GLP(Good Laboratory Practice)
日本語名称: 非臨床試験の基準
対象: 動物実験や試験管内での研究
目的: 人間に投与する前に、安全性を確認するための試験。
主な場所: 製薬企業の研究所やラボ(Laboratory)。
覚え方: Lはラボ(研究所)。人間の前段階、動物などを使った試験基準。
2. GCP(Good Clinical Practice)
日本語名称: 臨床試験の基準
対象: 人間を対象とした試験(知見や臨床試験)。
目的: 薬の安全性や有効性を病院やクリニックで確認する。
主な場所: 病院、クリニック。
覚え方: Cはクリニック(臨床現場)。人間を対象とする臨床試験基準。
3. GPSP(Good Post-marketing Study Practice)
日本語名称: 製造販売後の調査・試験の基準
対象: 市販後の医薬品に対する調査や試験。
目的: 市販後に、製品の効果や副作用のデータを収集・分析する。
主な内容: 販売後の調査や試験を行う基準。
覚え方: SはStudy(調査と試験)。販売後も試験を続けて情報を収集。
4. GVP(Good Vigilance Practice)
日本語名称: 製造販売後の安全基準
対象: 市販後の薬剤の安全性監視。
目的: 市販後の医薬品を継続的に監視し、副作用のリスクを管理する。
主な内容: 販売後に問題がないか監視する基準。
覚え方: VはVigilance(監視)。安全性を見守る監視活動。
違いを一言でまとめると
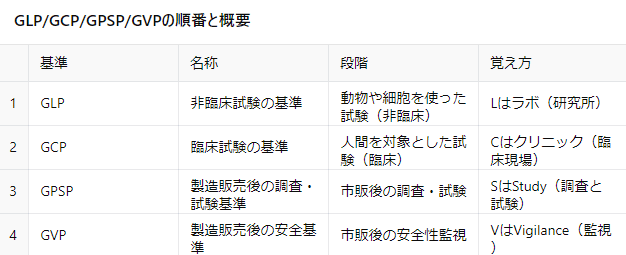
GLP: 動物などを使った試験基準(非臨床段階)
GCP: 人間を対象とした臨床試験基準
GPSP: 市販後の調査と試験基準
GVP: 市販後の安全性監視基準
これらは医薬品の開発から販売後に至るまで、すべての段階で医薬品の安全性と有効性を確保するための重要な基準です。それぞれの役割を覚えることで、試験問題にも対応しやすくなります!
