
【イオン交換膜法】水酸化ナトリウム製造装置つくってみた
目的
2020/4/2
Dr.STONEに影響されて化学実験的なことがしたくなる
基礎化学薬品として、製造の際に発生する塩素、水素からこれも基礎化学薬品である塩酸を製造できることから水酸化ナトリウム(以下NaOH)を作ろうと思った
方法
NaOHの製造方法は主に2つあり、どちらも試してみた
水酸化カルシウムと炭酸ナトリウムの反応
この世界が消えたあとの 科学文明のつくりかた内で石鹸を作るのに使ったNaOHはこの方法で作られた
水酸化カルシウム、炭酸ナトリウム、どちらもAmazonで購入可能、モル比1:1で水溶液を混ぜるだけなので簡単
反応させた水溶液はNaOHと炭酸カルシウムが2:1で存在する
炭酸カルシウムは水に溶けにくいので多くが析出し、濾過すればNaOH水溶液の完成
炭酸カルシウムを完全に除く精製は難しい
塩化ナトリウム水溶液の電気分解
NaOHは低濃度であれば水溶液を直接購入することができる
このような試薬は工業的、大量に効率的に純粋なものが製造されていて、工場等ではこの方法で製造されている
装置を作ること、有毒ガスの発生等があるため大変
こちらを本題とする
製造過程の問題
塩化ナトリウム水溶液の電気分解、つまり塩水に電気を流してNaOHを作る
ここで問題が2つある
まず1つが陰極から水素、陽極から塩素が発生し、この塩素ガスは混ぜるな危険を混ぜたときに出るガスと同じもので、有毒なので気軽にはできないこと
もう1つはこの塩素ガスは水に溶けやすく、NaOHと反応して次亜塩素酸ナトリウムになってしまう
解決方法
まずは塩素とNaOHが反応してしまう問題について、Dr.STONEでは素焼きの容器で陰極と陽極に隔たりを作り塩素とNaOHが反応しないように対策していた
Dr.STONEの科学監修の方による再現実験↓
この動画内で解説されているように、イオン交換膜法といい、水溶液は混ざらず、イオンだけが通過できる壁があれば、塩素や塩素水溶液と混ざらず、純粋なNaOH水溶液が手に入る
このイオン交換膜法はイオン交換膜によるイオンの濾過と考えられるが、このときに”ろ紙”の役割をするイオン交換膜はDr.STONEと上の動画では素焼きの容器、工業的にはイオン交換樹脂が使われている
しかし、イオンの濾過ができる機能があるものならなんでも良い
今回はセロファンで陰極と陽極の水溶液を隔てることで塩素とNaOHが反応せずに電気分解できるようにした
2つ目の問題である塩素ガスの処理については、シリコンチューブで換気扇まで運び、大気中に放出する
塩素ガスによる大気汚染について、大気汚染防止法の工場及び事業所に対しての施設ごとの排出基準を当てはめるとかなり少ないため問題ないと考え、装置の使用は実験時に必要最低限とする
カルキ抜き、チオ硫酸ナトリウムにトラップすることで無毒化することも考えられますが塩素ガスを完全に反応させるのは難しいので上の方法で行う
装置制作1
セロファンを透明の箱2つで挟んで密閉し接着、気体排出用のチューブ用の穴をそれぞれ上部に1つずつ、炭素棒電極用の穴を横面の下の方にそれぞれ1つずつ開ける

この設計には問題が多く、箱同士の接合が難しく、漏れがなかったとしてもセロファンが破れたときの交換が難しい、その都度接合やり直し、電極の交換も都度接合し直しが必要、など機能やメンテナンス性に問題があるので作り直す
装置制作2
電気分解により電極が消耗し、洗浄が必要なことを考慮しペットボトル2本をセロファン隔てて繋げ、交換できるようにした
この接合部にはガシャポンのカプセルを用いた
使用時間を考えると電極の交換が必要になるまでは使用しないので前作の方式を受け継いだ
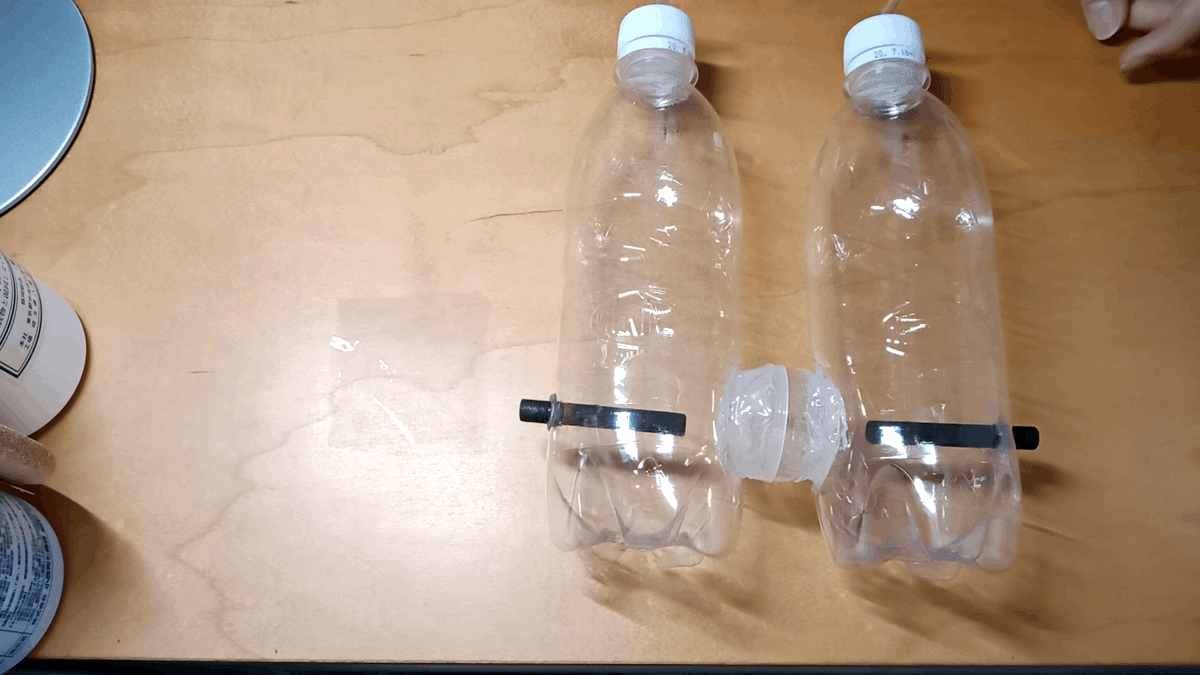
キャップにコネクタを接着して、ここにシリコンチューブを繋げて塩素、水素を排出する

電気を流すと塩素が発生する陰極側は、塩素水溶液の塩素が徐々に濃くなり、色も濃くなる

濃縮
ここで得られたNaOHは電極の消耗の影響でゴミが混じっているので濾過する
試薬として販売されているNaOHは粒状の固体で、再結晶すると固体になるが、濃度が低いとほとんど得られない
加熱して水を飛ばせば飛ばすほど濃度が上がるが、この煮詰める作業は注意が必要で高温かつ長時間空気に晒すと二酸化炭素と反応し炭酸ナトリウムになってしまう

また、ガラスの容器を使用するとガラスと反応してケイ酸ナトリウムが固着する

なので、保存はガラス容器は避けたいが、PETボトルなど飲用容器は誤飲の可能性があるので使用してはならない
注意
水酸化ナトリウム、5%を超える水酸化ナトリウム製剤は劇物に指定されています
この記事は薬品の製造を推奨するものではありません
いいなと思ったら応援しよう!

