vol.2 ラッカーゼの自動酸化反応

前回では,漆はウルシオールという物質からなり,ラッカーゼ酵素によって結晶化することについて簡単に書いた.今回は,ラッカーゼがウルシオールを酸化させる過程について説明を加えようと思う.
今一度,ウルシオールの構造式を見てみよう.
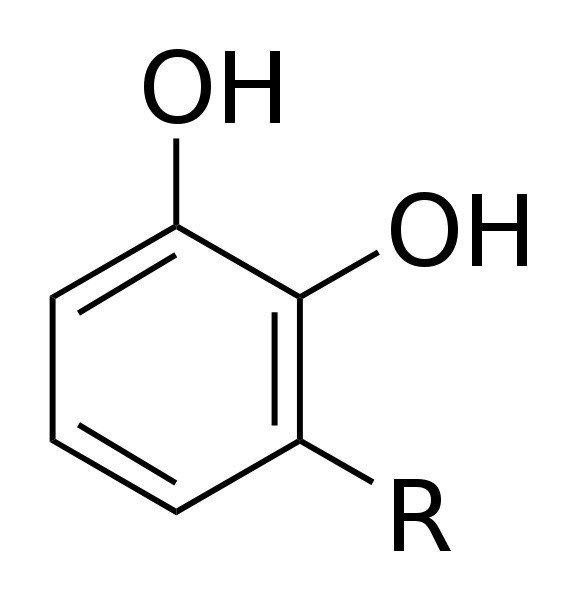
ラッカーゼは常温で多湿な環境でウルシオールの水素を奪い,ウルシオールを酸化させる.このとき,ラッカーゼ自身も空気中の酸素を取り込んですぐに還元(元の状態に戻る)する.するとラッカーゼは再び活性化されるので,また他のウルシオールを酸化させる.
ラッカーゼはこのようなサイクルでウルシオール同士を自動的に結合させる(自動酸化反応).しかし,塗装の表面ではウルシオールの酸化が進むが,奥になるとすぐに酸化できない.このとき温度と湿度が適切でなければ空気中の酸素が塗装の奥まで届かず,ラッカーゼは水素を奪ったまま不活性な状態になる.
一方で,ウルシオールは水素を奪われてしまうため,非常に不安定な状態になる.このとき,水素と結合している酸素はベンゼン環と二重結合する.
ここで基礎的な化学の説明になる.ものすごく雑に説明すると,原子は原子番号だけ電子を持っている.電子は原子の周辺をくるくる回っている.電子は1つしか軌道が持てない(と仮定する).原子に近い電子ほど,他との原子と結合しにくい.原子と原子が結合するとき,互いに電子を共有し合う.
例えば,水素で結合できる電子は1つ,酸素では2つとなる.一方で,原子番号6番の炭素は6つの電子を持っているが,炭素原子は2つの電子を原子周辺で強く引き付けているため,4つまでしか電子を共有できない(価電子).
二重結合とは,この価電子を2つ共有している状態になる.普通は1つだけだが,酸素のように何らかの理由で2つ共有することがある.
話を戻すと,ウルシオールから水素が酸化すると,酸素の電子の共有が切れてしまう.そうするとウルシオールは非常に不安定になるが,他と結合するためのエネルギーがない.そこで酸素と隣接する炭素は,二重結合の形を崩し,酸素と二重結合を行う.
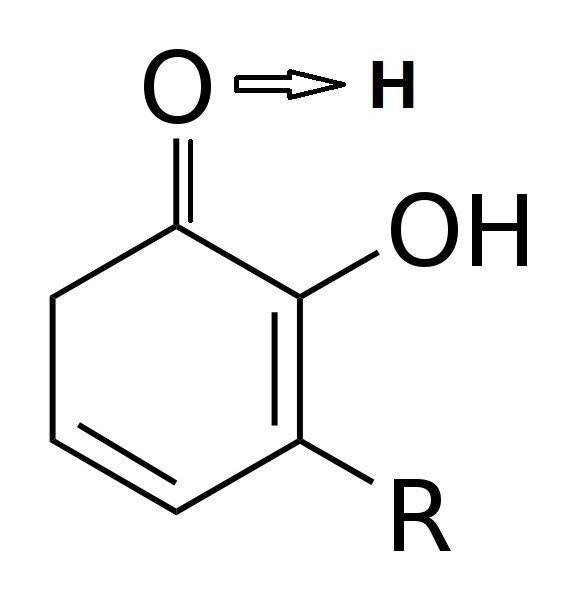
水素が酸化し,酸素が炭素と二重結合を行うことで,ベンゼン環はその形を崩してしまう.炭素は酸素のほうと結合したいと考えている.酸素と隣接した炭素をA,もともとAとくっついていた炭素をBとすると,Bは突然Aに別れを切り出されるのである.Bはとても不安定になる.
そこでたまたま時を同じくして不安定になっているウルシオールが隣にいる.その模式図は下のようになる.
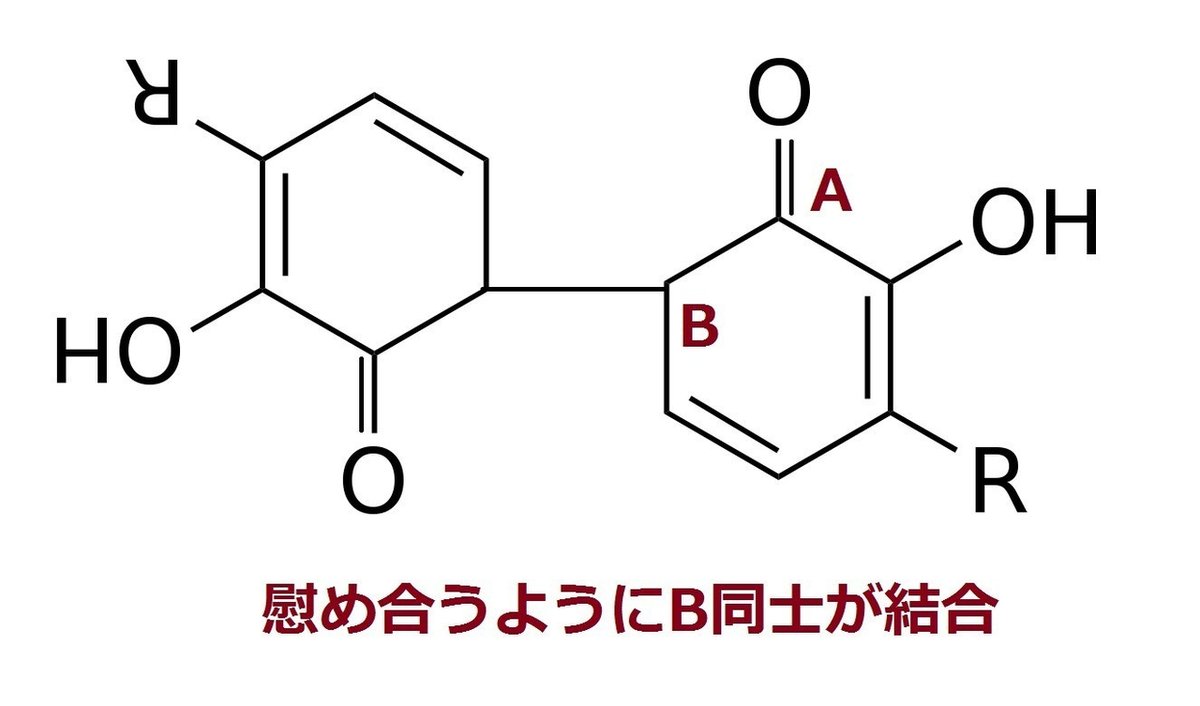
Bはとても不安定なので,電子を共有できる分子を空気中あるいは漆の中から探すのだが,不安定で哀れな分子はそう簡単には見つからない.しかし,ラッカーゼが猛烈な速さでウルシオールの水素を奪い,ウルシオールの酸素の二重結合を促す.このような不幸なBがたくさん存在する.すると,お互い不安定になった炭素同士ということでBとBで結合してしまうのである.
ウルシオールの自動酸化反応による炭素の痴情もつれはラッカーゼによって引き起こされている.これが微小なレベルで高速に行われている.そしてラッカーゼは水素を放出して空気中の酸素と結合させ,水分子を作り出し,水分子を作り出したら作り出したで自身は還元してしまうのである.
傍から見ると地獄そのものだが,このような反応が連鎖的に行われることで漆は硬化する.ラッカーゼは言い逃れできないが,不安定なウルシオール同士は自身で安定化を果たすため裁判のような物騒なことは起きない.
なぜなら,ソロモン王を判事とする裁判で既に争い,被告ラッカーゼは無罪となり,不善な水素を好きなだけ取り込んで還元することが許されたからである.
いいなと思ったら応援しよう!

