
ディープラーニングによるマウスボディ全体の単一セル解像度でのナノキャリアイメージング(論文の翻訳)
記事
公開日:2025年1月14日
Jie Luo、Muge Molbay、Ying Chen、Izabela Horvath、Karoline Kadletz、Benjamin Kick、Shan Zhao、Rami Al-Maskari、Inderjeet Singh、Mayar Ali、Harsharan Singh Bhatia、David-Paul Minde、Moritz Negwer、Luciano Hoeher、Gian Marco Calandra、Bernhard Groschup、Jinpeng Su、Ceren Kimna、Zhouyi Rong、Nikolas Galensowske、Mihail Ivilinov Todorov、Denise Jeridi、Tzu-Lun Ohn、Stefan Roth、...Ali Erturk 著者を表示する
ネイチャーバイオテクノロジー(2025)この記事を引用する
【要旨】
標的薬物送達のための効率的で正確なナノキャリア開発は、生物全体にまたがる細胞レベルの生物分布を分析する方法の欠如によって妨げられています。ここでは、
シングルセル精密ナノキャリア識別(SCP-Nano)
を紹介します。
これは、単一のセル解像度でマウス全体にわたるナノキャリアのターゲティングを包括的に定量化するための統合された実験および深層学習パイプラインです。SCP-Nanoは、従来の全身イメージング技術の検出限界をはるかに下回る0.0005 mg kg−1という低用量で、さまざまな注射経路後の脂質ナノ粒子(LNP)の組織分布パターンを明らかにします。私たちは、SARS-CoV-2スパイクmRNAを運ぶ筋肉内注射LNPが心臓組織に到達し、プロテオームの変化を引き起こし、免疫活性化と血管損傷を示唆していることを示しています。SCP-Nanoは、リポソーム、ポリプレックス、DNA折り紙、アデノ関連ウイルス(AAV)など、さまざまなタイプのナノキャリアに一般化され、AAV2変異体が体全体に脂肪細胞を伝達することを明らかにします。SCP-Nanoは、高感度でマウスの体全体にナノキャリア分布の包括的な3次元マッピングを可能にし、正確で安全なナノキャリアベースの治療薬の開発を加速する必要があります。
【メイン】
現代の生物医学は、人体の病気を引き起こす変化を逆転させる可能性のある、さまざまな高分子薬(例えば、さまざまなRNA種、ゲノム編集ツール、タンパク質薬)を提供しています1,2。しかし、それらの臨床翻訳における主要なハードルは、オフターゲット効果を最小限に抑えながら、これらの大きくて帯電した分子を標的細胞集団に特に送達することにあります。
脂質ナノ粒子(LNP)3、リポソーム4、アポリプレックス5などのナノキャリア、およびアデノ関連ウイルス(AAV)6などのウイルスベクターは、最も有望な送達ソリューションの1つです。
それらは薬物分子を保護し、生物学的障壁を克服するのを助け、臓器や細胞タイプの標的を媒介することができます³。米国食品医薬品局/欧州医薬品庁(FDA/EMA)が承認した30以上の製品と多数の臨床試験が進行中のこれらのナノキャリアは、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)ワクチンの成功に例示されているように、大きな治療の可能性を持っています。DNA折り紙などの新興モダリティは、生産、変更、特にプログラム性7,8,9,10,11,12の容易さを提供します。安定性とターゲティングを強化するために、ナノキャリアはしばしばポリエチレングリコール(PEG)などのポリマーでコーティングされ、抗体などのターゲティング分で機能化されます。しかし、生体内環境にさらされると、ナノキャリアは必然的に生物分布と細胞相互作用に影響を与える可能性のあるタンパク質コロナ13を獲得し、ナノキャリアの設計とターゲット組織の予測を複雑にします。
すべてのナノキャリア戦略における重要な課題は、有害およびオフターゲットの影響を最小限に抑えながら、ターゲット組織と細胞の特異性と効率を最大化することです。陽電子放射断層撮影(PET)、コンピュータ断層撮影(CT)、磁気共鳴画像法(MRI)、生体内光学イメージングなど、マウス全体のナノキャリア生物分布を分析するための既存の方法は、ナノキャリアによって標的にされた数百万個の細胞を3次元(3D)で識別する解像度を欠いており、予防用および治療用ワクチンなどのアプリケーションで使用される低用量で作業する感度がしばしば不足しています。同様に、低強度のオフターゲットサイトを検出および分析する能力は制限されています14,15,16。逆に、伝統的な組織学的アプローチは、細胞下分解能と高感度を提供しますが、事前に選択された薄い2次元(2D)組織切片に依存しているため、動物全体の分析には適していません17,18。
これらの制限に対処するために、
シングルセル精密ナノキャリア識別(SCP-Nano)
を開発しました。これは、マウス全体の蛍光標識ナノキャリアの生物分布をマッピングおよび定量化するためのパイプラインであり、単細胞分解能と高感度です(図1a)。SCP-Nanoは、高度なディープラーニングパイプラインを使用して、ナノキャリアイメージングに最適化されたDISCO組織クリアリングおよびライトシート顕微鏡法によって生成された大規模なイメージングデータを分析します。このアプローチは、マウスの体全体にまたがる臓器、組織、および単一細胞レベルでのナノメディスンの正確な定量化を可能にします。
私たちは、LNPベースのmRNA送達の研究、0.0005 mg kg-1(ワクチンで一般的に使用されている、ナノ粒子の従来のイメージング研究で通常使用されるものよりも100~1,000倍低い)の低用量で生物分布を定量化し、アプリケーションルート依存性組織栄養症を明らかにするためのSCP-Nanoの有用性を実証します。特に、SARS-CoV-2スパイクmRNA送達後、心臓組織における低強度のオフターゲットLNP蓄積が検出され、その後のプロテオミクス分析により、免疫および血管タンパク質の発現の変化が明らかになりました。これは、報告された臨床観察の一部を説明する可能性があります
19,20,21,22。最後に、SCP-ナノをリポソーム、ポリプレックス、DNA折り紙、および2つのアデノ関連ウイルス(AAV)変異体に適用することにより、SCP-ナノの一般化可能性を実証し、AAV2変異体Retro-AAVの主要な標的として脂肪組織を特定します。当社の人工知能(AI)ベースの定量化パイプラインは、数百万のターゲティングイベントに対する精度とスケーラビリティの点で以前に発表されたアプローチを大幅に上回り、当社の統合された空間プロテオミクス分析は、組織ターゲティングの分子基盤と影響に関する洞察を提供します。SCP-Nanoは、正確で安全なナノキャリアベースの治療薬の開発を加速する必要があります。
図。1:低線量でナノキャリアをイメージングするための最適化されたDISCOクリアリング。

a、SCP-ナノのスキーム—単細胞分解能と高感度でマウス全体に蛍光標識されたナノキャリアの生物分布をマッピングおよび定量化するためのパイプライン。 b、c、0.5 mg kg−1(b)および0.0005 mg kg−1(c)のルシフェラーゼmRNAを運ぶLNPの静脈内注射後6時間の生物発光イメージング(腹部)。 d–f、0.0005 mg kg−1 Alexa Fluor 647-標識EGFP mRNAを運ぶLNPを静脈内注射し、洗練されたDISCOクリアリング方法でクリアしたマウスの全身ライトシートイメージング。このアプローチは、肝臓(e)と脾臓(f)を含むマウスの体全体にmRNA送達を細胞分解能で視覚化することを可能にします。 g–m、0.0005 mg kg−1の鼻腔内送達後のマウス全体のLNPの視覚化:最大強度投影(g)と単一の光学スライスビュー(h–l);肺の代表的な個々の光学スライス(m)。
【結果】
【高解像度、全身生体分布イメージング】
一般的な全身イメージング技術である従来の生物発光イメージングは、臓器レベルで高コントラストを備えた高注射用量(0.5 mg kg−1)でLNPベースのmRNA送達後のルシフェラーゼ発現を同定しました(図1b)。しかし、シグナルコントラストは、例えばmRNAワクチン(0.0005 mg kg−1)など、通常使用される低用量で劇的に低下します(図1cおよび補足図。1)。
より高い感度と解像度でLNP分布を視覚化するために、Alexa蛍光染料(Alexa 647またはAlexa 750)でタグ付けされたEGFP mRNAを運ぶ臨床的に承認されたMC3イオン化可能な脂質23に基づいてLNPを生成しました。
最初に、DISCOのマウス全体のクリアリング技術を最適化し、単一細胞レベルで臨床LNP線量の敏感な3Dイメージングを可能にしました。ウレアとアジ化ナトリウムを除去し、ジクロロメタン(DCM)のインキュベーション時間を短縮することは、マウスの体全体にAlexa Fluorタグ付きmRNAの蛍光信号を維持するために重要であることがわかりました24,25,26,27(補足図2と方法)。この洗練されたDISCO方法を使用して、約1~2 µm(横方向)および約6 µm(軸方向)の解像度でマウスを画像化し、特に肝臓と脾臓で、0.0005 mg kg−1(図1d–fおよび補足図3)の低用量でも、LNPの広範な細胞標的を明らかにし、体全体で単一細胞分解能を達成しました(補足図4a–d)。mRNAへの染料結合は、2つの異なる蛍光タグと結合したLNPが同じ領域を等しく標的にしたため、LNPの生物分布に影響を与えず(補足図4e)、Alexa Fluor 647による脂質成分の標識も同様の結果をもたらしました(補足図4f)。
次に、多くの臨床試験28で調査中の経路である鼻腔内または筋肉内投与されたLNPの生物分布を比較し、体全体、特に肺、肝臓、脾臓に広範な細胞標的性が再び明らかになりました(図1d–m、補足図3および補足ビデオ1)。詳しく調べると、これらの臓器全体に数千の標的細胞が強調されました(図1mおよび補足図3b、c)。
クリアリング中の潜在的な信号損失を評価するために、組織学を使用して方法をさらに検証しました。マウス全体の灌流と固定の後、リンパ節と肝臓の組織学的スライスを生成し、LNP発現EGFPタンパク質の分布を画像化しました。その後、最適化されたDISCOプロトコルを使用して同じスライスをクリアし、再度画像化しました。シグナルコントラストとEGFPタンパク質陽性構造の数の両方が、クリアリングの前後によく保存されました(補足図5a)。さらに、私たちのクリアリング技術は、組織クリアリングと全身イメージングの後に共焦点顕微鏡を使用して見られるように、細胞の内外両方のナノ粒子を保存します(補足図5b)。
私たちの方法の一般化可能性を示すために、それぞれCOOH修飾Atto 647または一本鎖DNA(ssDNA)-Alexa Fluor 647を送達するリポソーム(臨床的に承認されたドキシル製剤に基づく)とポリプレックス(分岐ポリエチレンイミン(PEIに基づく)に基づく)の細胞レベルの分布も評価しました(補足図。6)。
【LNP標的のAIベースの細胞レベルの定量化】
最適化された組織クリアリングは、LNP標的細胞の可視化を可能にしますが、さまざまな条件下での全身生物分布を比較するには、偏りのない信頼性の高い定量化が必要です29。フィルターベースのImarisソフトウェアやディープラーニングソリューションDeepMACT30などの既存の方法は、最適ではない結果(F1スコア<0.50)を提供していることがわかりました。したがって、マウス全体のさまざまな組織で数千万の標的細胞を確実に検出および定量化するための堅牢なディープラーニングパイプラインを開発しました。
私たちのアプローチには、利用可能な計算リソースによって課せられた典型的な記憶制約内で、ディープラーニング分析のための離散ユニットに全身イメージングデータを分割することが含まれます(図2aおよび補足図。7)。バーチャルリアリティ(VR)ベースのアノテーション方法を使用してトレーニングデータセットを作成しました。これは、以前はスライスベースのアプローチ31よりも優れていることが証明されていました。このデータセットには、LNPの筋肉内および静脈内注射後、さまざまな組織(頭、心臓、肺、腎臓、肝臓、リンパ節、脾臓)からランダムに選択された31の3Dパッチ(200×200×200~300×300×300×300のボクセル)が含まれていました。データを手動でトレーニング/検証およびテストセットに分割して、関連機関全体でセグメンテーションモデルのパフォーマンスを追跡します。パフォーマンスは、インスタンスF1スコア(またはサイコロ係数)30を使用して評価されました。
図。2:SCP-Nano—すべての標的細胞をセグメント化して分析するためのディープラーニングベースのパイプライン。

a、SCP-ナノパイプラインのフローチャート。 b、SCP-ナノディープラーニングセグメンテーションモデルのカスタマイズされた3D U-Netアーキテクチャ。 c、SCP-ナノセグメンテーションモデルのF1(インスタンスサイコロ)スコアと他のモデルとの比較。 d、肝臓画像を使用したイマリスとSCP-ナノ予測精度の比較。 e、ナノ粒子予測パイプライン全体のイラスト。ライトシート顕微鏡で全身データセットを取得した後、VRメガネを使用して臓器の注釈を行い、その後、SCP-ナノ分析アルゴリズムを適用して全身のLNP分布を定量化しました。例の画像は肺からのものです。地上の真実データと比較して、私たちのアルゴリズムは、肺内のすべての異なるサイズの送達イベントを正確に検出します。 f、肝臓でのLNP分布の生データと、SCP-Nanoによって得られたインスタンス分離された多色セグメンテーション。各色は、モデルによって予測された個別の配信イベントを表します。 g、連続セグメント化されたスライスビューは、シングルセルセグメンテーションを示します。
確立されたパラメータ選択、トレーニングプロトコル、および5倍のクロスバリデーを使用して、いくつかのディープラーニングモデル(VNet32、U-Net++33、Attention U-Net34、UNETR35、SwinUNETR36、nnFormer36、および3D U=Net37)をトレーニングしました。私たちの最高パフォーマンスモデルは、漏れのある整流線形単位(ReLU)活性化機能を備えた6つのエンコード層と5つのデコード層を備えた3D U-Netアーキテクチャを採用しました(図2b)。SCP-Nanoは、独立したテストデータセットで0.7329のインスタンス平均F1スコアを達成し、臓器特異的スコアは0.6857から0.7967の範囲です(図2c、d)。セグメンテーション性能は、注入ルートの影響を受けませんでした(補足図8および9)。
cc3d library36を使用して、セグメント化された各ターゲットセル/クラスターインスタンスを特定し、背景に対するサイズと強度のコントラストを計算しました。これにより、臓器レベルの統計を計算し、関心のある臓器またはボリューム内のナノキャリア密度を視覚化することができました。洗練されたDISCOイメージングとともに、このディープラーニングモデルは、細胞レベルでマウスの身体器官全体にLNPターゲティングと生物分布を定量化するためのSCP-ナノパイプラインを形成しました(図2e、fおよび補足図。10)。特に、SCP-Nanoは、アルゴリズムが単一値のしきい値に依存しず、粒子形状や近隣に対する明るさ値などの要因に基づいて予測を行い、異なる強度の信号を忠実に識別するため、信号密度の高い領域でも個々の細胞を容易に識別できます(補足図。10)。
【SCP-Nanoは、さまざまなルートを介してLNPのトロピズムを明らかにします】
次に、SCP-Nanoを使用して、さまざまな投与経路がLNPの生物分布にどのように影響するかを調査しました。蛍光タグ付きEGFP mRNAを持つLNPは、0.0005 mg kg−1の用量で筋肉内、皮内、経口、静脈内、鼻腔内送達され、注射後6時間後に分析が行われました(n = 1グループあたり3匹のマウス)。定性的比較を容易にするために、マウス全体の送達密度マップを生成し、個々の臓器間および個々の臓器内の送達効率において実質的な異質性を観察しました(図3a)。特に、SCP-Nanoの分解は、肝臓や脾臓などの臓器内の局所的なホットスポットを明らかにしました(図3bの白い矢印)。従来の方法では識別するのが困難です。
図。3:SCP-Nanoは、異なるアプリケーションルートに基づいて、LNP生物分布の違いを明らかにします。

a、異なる経路を使用して適用されたLNP送達mRNAの分布の密度ヒートマップ(各ケースで0.0005 mg kg−1)。 b、生投影画像(左)と選択された臓器の密度ヒートマップ。矢印は臓器内送達ホットスポットを示しています。 c、SCP-ナノディープラーニングアルゴリズム(n = 1グループあたり3匹のマウス、平均± s.d.)を使用したさまざまなアプリケーションルートの主要臓器間のmRNA送達イベントの臓器レベルの定量化。 d、筋肉内注射マウスのリンパ節におけるmRNA送達イベントの定量化。 i.m.、筋肉内; i.v.、静脈内; LN、リンパ節。
SCP-Nanoは、投与経路に基づいて臓器内の明確な分布パターンに関する定量的データを生成しました(図3c)。鼻腔内投与は、主に肺内で、最高のmRNA用量保持につながりました。対照的に、予想通り、他のほとんどのルートは主に肝臓と脾臓を標的にしていました(図3a-c)。
管理ルートの違いは、さまざまな目的に推奨されます。鼻送達は主に呼吸器組織、特に肺を対象としています。静脈内および皮膚送達は主に肝臓と脾臓を標的としますが、筋肉内送達後に相対的な肝臓の非標的と脾臓標的の増加が見つかりました。この経路は、免疫器官を標的にするときに肝臓を避けるのに有益である可能性があることを示唆しています(図3a、c)。
mRNAワクチンの送達にLNPが広く使用されていることを考えると、筋肉内(後肢)注射後にmRNAを異なるリンパ節に輸送する能力を調べました(図3d、補足図11および補足表1)。LNP送達mRNAは、分析されたすべてのリンパ節で検出されましたが、注射部位からの距離とmRNAレベルとの間に明確な相関関係はありませんでした。特に、直接排水リンパ節と、さらに大きな範囲で、首近くの頸部リンパ節は、他のリンパ節よりも大幅に高用量のmRNAを受けました。この観察は、リンパ節の免疫応答を促進し、それによってワクチンの有効性を高めるLNPの可能性を強調しています。
LNPデータで訓練された深層学習モデルは、再訓練なしでリポソームとポリプレックスの分布をセグメント化および定量化することができました(補足図12a、b)。
全体として、これらの発見は、臓器間および臓器内のナノキャリア生物分布の複雑さを強調し、分布パターンを完全に理解するための細胞レベルの分析の必要性を強調しています。
【SCP-Nanoは潜在的なオフターゲティング効果を明らかにする】
LNP標的細胞を可視化した後、LNP送達mRNAを積極的に発現する細胞を特定することを目指しました。以前の研究では、すべてのLNP標的細胞がRNA貨物を翻訳するわけではないことが示されました38。LNP標的細胞とカプセル化されたmRNAを発現する細胞の両方を同時に同定できるようにするために、最適化されたDISCOクリアリングプロトコルで、Alexaタグ付きEGFP mRNA(LNPターゲティングイメージング用)とEGFPタンパク質に対するナノボディ(mRNA翻訳の可視化用)を使用しました。
低用量(0.0005 mg kg−1;図4a–d)と高用量(0.5 mg kg−1;補足図12c–f)の両方を使用して、EGFP mRNAを運ぶLNPを筋肉内注射してから72時間後にマウスの体全体にEGFP発現細胞を可視化するためにSCP-Nanoを適用しました。EGFP発現は両方の用量で検出可能でしたが、Alexa-mRNA信号の大部分は72時間でRNA分解により失われました。EGFP発現を定量化するために、注釈付きEGFPデータセット(方法)でトレーニングすることにより、SCP-Nanoアルゴリズムを改良し、すべての臓器で平均0.81のF1スコアを達成しました(図4e)。
図。4: SCP-Nanoは、LNPによって送達されたmRNAとLNPオフターゲティングからのタンパク質発現を明らかにします。

a.0.0005 mg kg−1 EGFP mRNA-LNPの筋肉内注射後72時間のmRNAおよびEGFPタンパク質発現の全身投影図。 b–d、脾臓(b)、肝臓(c)および心臓(d)の詳細ビュー。 e、タンパク質発現を検出するためのSCP-ナノセグメンテーションモデル(EGFPデータで微調整)の定量的評価(FN、偽陰性、FP、偽陽性、TP、真陽性、手動注釈と比較)。 f.注射後72時間(f)に筋肉内投与されたLNP送達mRNA由来のSARS-CoV-2スパイクS1タンパク質の全身分布。心臓でスパイクタンパク質が検出されました(f')。 g、ポドカリキシン抗体(赤)、αSMA抗体(緑)を使用した動脈、スパイクナノボディ(黄色)を使用したスパイクS1タンパク質を使用して毛細血管内皮細胞に染色された心臓組織セクションの共焦点画像。 h、異なるグループの質量分析に基づくプロテオミクスデータのPCA:スパイクLNP、EGFP LNP、無気体LNPおよびPおよびPBS。 i、2つの対照群(無用LNP/PBS)と複合スパイクLNPおよびEGFP LNP群(n = 9、平均± s.d.;一方通行AVA)の間で異なる反応物データベースの同位経路。 j、k、PBSと比較して、無気管LNPでアップレギュレートされたタンパク質の同じ分析(j)およびノーカーゴLNP(k)(n = 9、平均±s.d.;一方向ANOVA)と比較したスパイクmRNAで。 l、3つの異なるグループの典型的なタンパク質マーカーを使用した血管の健康分析(補足表3)。NS P > 0.05、**P < 0.01 (n = 9; 一方向 ANOVA)。 i.m.、筋肉内; PC、主成分; NS、有意ではない。
パイプラインの感度により、潜在的なオフターゲット組織で低強度の信号を検出できます。ここでは、例えば、マウスの心臓でまばらだが明確なLNP標的とEGFP mRNA発現を観察しました(図4dおよび補足ビデオ2)。MC3ベースのLNPがマウス、非ヒト霊長類、ヒト23,38,39,40,41のRNA治療と薬物開発に使用され、別のLNP製剤42,43,44,45,46を使用したワクチン接種後の心臓合併症の報告があることを考えると、LNP駆動の心臓におけるmRNA発現の潜在的な影響をさらに調査しました。
この目的のために、SARS-CoV-2スパイクmRNAを含むMC3ベースのLNPをマウスに筋肉内注射(2.4 µg、~0.1 mg kg−1)し、72時間後に灌流を行い、DISCOクリアリングとスパイクタンパク質47に対するナノボディで染色しました。0.0005 mg kg−1と比較して、このより高い用量は、ヒトからマウスへの線量変換50の体表面積正規化法(アロメトリックスケーリング)に基づいて、マウス48,49での信頼できるワクチン免疫原性と有効性研究に推奨される範囲内にあるため、選択されました。SCP-ナノ分析は、筋肉内注射後にLNP送達されたmRNAの心臓へのオフターゲティングが確認され、スパイクタンパク質シグナルの主要な供給源として、注射部位から心臓へのスパイクタンパク質の輸送を除外しました(図4fおよび補足ビデオ3)。
免疫細胞マーカーCD45とLNP送達mRNAから発現したSARS-CoV-2スパイクタンパク質を染色することにより、全身レベルでLNPによって標的にされた細胞型を分析しました。LNP-mRNA由来のスパイクタンパク質は、全身の免疫細胞と非免疫細胞の両方で観察されました(補足図。13)。
心臓組織内のスパイクmRNA-LNPによって標的とされる特定の細胞を識別するために、これらの領域で免疫組織学を行いました(SCP-ナノ識別領域は、さらなる分子探査のためにマウスの体全体から分離されました。詳細については、方法のセクションを参照してください)。スパイクタンパク質は、心臓の心筋細胞(トロポニンT;補足図14a)、免疫細胞(CD45;補足図14a)または動脈(アルファ平滑筋アクチン(αSMA);図4gおよび補足図14b)と共局在していないことがわかりました。代わりに、主に心臓毛細血管の内皮細胞内でスパイクタンパク質を発見しました(ポドカリキシン;図4gおよび補足図14b)。
オフターゲット組織におけるmRNA発現によって誘発される可能性のある分子変化を調査するために、SCP-ナノ同一の心臓領域51で質量分析法ベースのプロテオミクスを実施しました。サンプルは、グループごとに3匹のマウスから右、中、左の心臓領域から採取され、PBS(対照)、無貨物LNP、EGFP mRNAを含むLNP、スパイクmRNAを注入した動物を含むLNPからそれぞれ8つ以上のサンプルが採取されました。4,161個のタンパク質を特定し、2,828個がダウンストリーム分析(方法)に使用されました。主成分分析(PCA)は、mRNA発現のあるグループとないグループ(無貨物LNP/PBS対スパイクLNP/EGFP LNP)の明確な分離を示しました(図4h)。Reactomeデータベース(方法)を使用した経路分析により、とりわけ、mRNA発現群(複合無機器LNP + PBS群に対して)における細胞代謝およびシグナル伝達および免疫系に関連する変化が明らかになりました(図4i、補足図14cおよび補足データ1)。
次に、LNPのみによって誘発されたプロテオミクスの変化を調べました(無貨物LNP対PBS)。375個の差分発現タンパク質(DEP)を特定しました(PBSと比較して、無貨物LNPで240個、ダウンレギュレーションされ、135個)(図4jおよび補足データ2)。これらの変化は、Rpl11、Rpl15、Eif4b、Rps6、Rps2、Eif2b3などのマーカーが差別的に調節されたリボソーム活性、翻訳、RNA代謝(反応染色体データベース分析、方法)を含む代謝プロセスに関連していました。
次に、スパイクmRNA発現によって特に誘発されるプロテオミクスの変化を分析し、非貨物LNPサンプルと比較して、LNPスパイクmRNAに578のアップレギュレートされたタンパク質と201のダウンレギュレートされたタンパク質を発見しました(図4kおよび補足データ3)。私たちは、無貨物LNPサンプル(図4k)で見られたものを超えて、代謝に関連するタンパク質の発現、RNAおよびタンパク質の発現に顕著な変化を観察しました。また、個々のDEPレベルで免疫応答信号の増加も観察しました(図4k)。特に、血管の形成と維持に関連するタンパク質の変化を発見しました(個々の差分発現マーカー:Cd34とコラーゲンファミリーのいくつかのメンバー;図4lおよび補足表2の血管機能スコア)。
EGFP mRNA発現はまた、主に代謝および細胞反応に関連する無貨物LNPと比較して、心臓の顕著なプロテオーム変化(581アップレギュレーションタンパク質と424ダウンレギュレートタンパク質)を引き起こしました(補足図14dおよび補足データ4)。これは、スパイクmRNAだけでなく、任意のmRNAの送達と発現も、LNPを介した標的薬物送達について慎重に評価する必要があることを示唆しています。心臓へのオフターゲットと関連するプロテオミクスの変化がMC3ベースのLNPに特異的であるか、または現在の世代のLNPのより一般的な現象を表すかを評価するために、電離性脂質SM-102(Moderna SARS-CoV-2ワクチンで使用されている)とLung SORT LNPs38,52,53を使用してLNPの生物分布も評価しました。MC3-LNPと同様に、心臓には少量だが明確な数の両方のLNPが見つかりました(補足図15a)。LNP(無貨物LNP、EGFP mRNAおよびSARS-CoV-2スパイクタンパク質mRNAを含むLNP)とPBSコントロールのそれぞれについて、8つ以上のサンプルを再度分離し、質量分析法を使用してプロテオームを分析しました(補足図15b–d)。PCAプロットでは、LNPサンプルは再びPBSコントロールから分離され、空のLNPはコントロールに最も近い(補足図15b)。MC3ベースのLNPの観察と同様に、血管系に関連するタンパク質は、血管構造の維持に関与するいくつかの遺伝子を含む最も調節不全の1つであり、強く下ろされた(補足図15dの個々のタンパク質)。
観察されたLNP蓄積と心臓組織のプロテオームの変化は、LNPベースのmRNAワクチンが報告された心臓合併症に寄与する可能性のある潜在的なメカニズムを示唆しています42,43,44,45,46。それにもかかわらず、ここで使用されている正確なLNP製剤と潜在的にスパイクmRNAは、承認されたmRNAワクチンのものと異なる可能性があるため、さらなる調査が必要です。したがって、私たちが特定した潜在的な原因メカニズムは、将来の作業でさらに探求する必要があります。
異なる製剤間の心臓標的の潜在的な共通のメカニズムを調査するために、次に各LNPタイプ(MC3、肺SORT、SM-102およびALC-0315)のタンパク質コロナを調査しました。特定の細胞型を標的とするためにLNP表面に結合するタンパク質の重要性は、LNP製剤54,55,56,57,58のSORTシリーズで示されました。質量分析プロテオミクスを使用して、エンドーテル内細胞に付着し、それによって心臓細胞へのLNP標的化を促進することができるビトロネクチンなどのタンパク質の存在を観察しました(補足図15e)59,60。タンパク質のフィルタリング(1)すべてのLNPコロナで強く濃縮された;(2)LNPのレベルは、心臓のLNP+細胞の数と統計的に有意で正の相関を示した(R> 0.5);そして(3)心臓で発現した既知の結合パートナー(StringDBまたはUniProtからの手動キュレーション)、心臓62で強く発現するエラスチン61の既知の結合体であるフィコリン-1(Fcn1)も、心臓中のLNP蓄積の追加の潜在的なメディエレーターとして特定しました(補足図15e)。
【異なる細胞タイプを標的とするDNA折り紙の可視化】
SCP-ナノの幅広い適用性を実証するために、次に、将来の臨床応用のために現在開発されているモダリティであるDNA折り紙ナノ粒子を調査しました。DNA折り紙2,4,12,13のプログラム可能な自己組み立てにより、多様な用途のためのナノ粒子の設計が可能になります3,13,14,15。DNA折り紙は、生体適合性、形状とサイズの正確な制御、環境手がかりへの応答性、および定義された場所で構造を機能化する能力を提供します63,64,65。この汎用性は、ワクチン16、抗ウイルス薬17、18、刺激反応治療薬19、20の革新的な概念につながりました。
基本構造として、長さ80nm、直径8nmのDNAナノロッドを生成しました(図5aおよび補足図。16)。この非共役DNA折り紙は、最小限の免疫応答を誘発し(補足図17)、標的送達に適した循環時間を示しました(補足図17g)。動的光散乱(DLS)と蛍光相関分光法(FCS)の分析により、折り紙は血清にインキュベートしたときにタンパク質コロナで覆われた安定した単分散ナノ粒子を形成することが示されました(補足図。18)。ナノロッドをCX3CR1抗体と標的免疫細胞に結合させ(図5b)、これらの構造を50.725 mg kg−1の用量で静脈内注射しました。折り紙構造は通常、血液中の半減期が数分であるため、マウスは注射後20分後に安楽死、除去、画像化されました17。LNPと同様に、SCP-Nanoはマウスの体全体にさまざまなDNA折り紙構造の単細胞分解能イメージングを可能にしました(図5c-fおよび補足ビデオ4)。
図。5: SCP-Nanoは、DNA折り紙の標的送達を明らかにします。

a–f、非標的およびCX3CR1抗体免疫細胞標的(左図)折り紙の細胞レベルの細胞分解能分布(c、d)および肝臓の詳細なビュー(e、f;単細胞分解能図)50.725 mg kg−1 DNA折り紙の静脈内注射後20分。 g、免疫細胞および非標的折り紙(赤)の組織内分布、および個々の肝臓スライスの共焦点画像における標的細胞マーカーCX3CR1(左、黄色)および一般免疫細胞マーカーCD68(右、黄色)との共染色。 h、非標的およびCX3CR1標的オリガとCX3CR1標的オリガとの同局在化の定量化(n = 3、平均± s.d.)。 i、DNA折り紙検出の予測精度異なる臓器におけるSCP-ナノアルゴリズムによる。j、マウスの体全体にCX3CR1免疫細胞標的折り紙分布の密度マップ。k、異なる臓器におけるCX3CR1免疫細胞標的折り紙の生物分布のSCP-Nanoベースの定量化。
マウス全体のイメージングの後、組織学を使用して抗体共役DNA折り紙の特異的標的を検証しました。CD68(リソソーム/後期エンドソームマーカーマーキングクッファー細胞)またはCX3CR1(単核食細胞マーカー)抗体(図5g、h)で肝組織を共染色しました。非共役DNA折り紙は主にCD68と共局在し、受動的な肝臓クリアランスを示唆していますが、反CX3CR1 DNA折り紙はCX3CR1+免疫細胞を標的にすることに成功しました(図5g、h)。
次に、DNA折り紙データセットでSCP-Nanoディープラーニングパイプラインのパフォーマンスを評価しました。13の3Dパッチ(頭、心臓、肺、肝臓、脾臓、腎臓)のテストデータセットを手動で注釈付けし、LNPで訓練されたアルゴリズムを評価するために使用しました。SCP-Nanoは0.8583の平均F1スコアを達成しました(図5i)、広範な再訓練なしで他のナノキャリアを検出および定量化する適応性を示しました。背景上の各セグメント化されたインスタンスの強度コントラストを合計することで、折り紙の生物分布を定量化しました。この分析により、肝臓が非共役DNA折り紙の主要な標的器官であることが確認されました(図5j、k)。
抗体共役DNA折り紙による細胞特異的標的の可視化と確認の成功は、精密ナノメディシンにおけるSCP-ナノの価値を強調しています。この能力は、将来のDNA折り紙ベースの治療の有効性と安全性を最適化するために重要です。
【AAV分布の可視化と定量化】
AAVは遺伝子治療ナノキャリア66として有望です。しかし、それらの有効性と安全性を最適化するには、それらの標的の正確な細胞レベルの理解が必要です。SCP-Nanoを適用して、2つのAAV変異体の標的プロファイルを調査しました。(1)ニューロン67の逆行輸送用に設計されたRetro-AAV(AAV2変異体)、および(2)中枢神経系伝達のために血液脳関門を通過するように設計されたPHP.eB-AAV(AAV9変異体68,69。EGFPコードAAVを注射(レトロAAV:筋肉内;PHP.eB-AAV:静脈内)69,70、71、72、マウスは2週間後にSCP-Nanoによる全身分析のために灌流されました。
以前のレポート69と一致して、PHP.eB-AAV-EGFPは主に脳と脊髄を標的にし(図6a-d、補足図19および補足ビデオ5)、標的細胞の多様なサイズによって証明されるように、さまざまなニューロン集団を伝達します(図6c)。特に、鼠径部と腰椎のリンパ節で強いシグナルも観察されましたが、これは以前に報告されなかった発見です(図6e)。
図。6: SCP-Nanoは、2種類のAVVの標的特異性を定量化します。
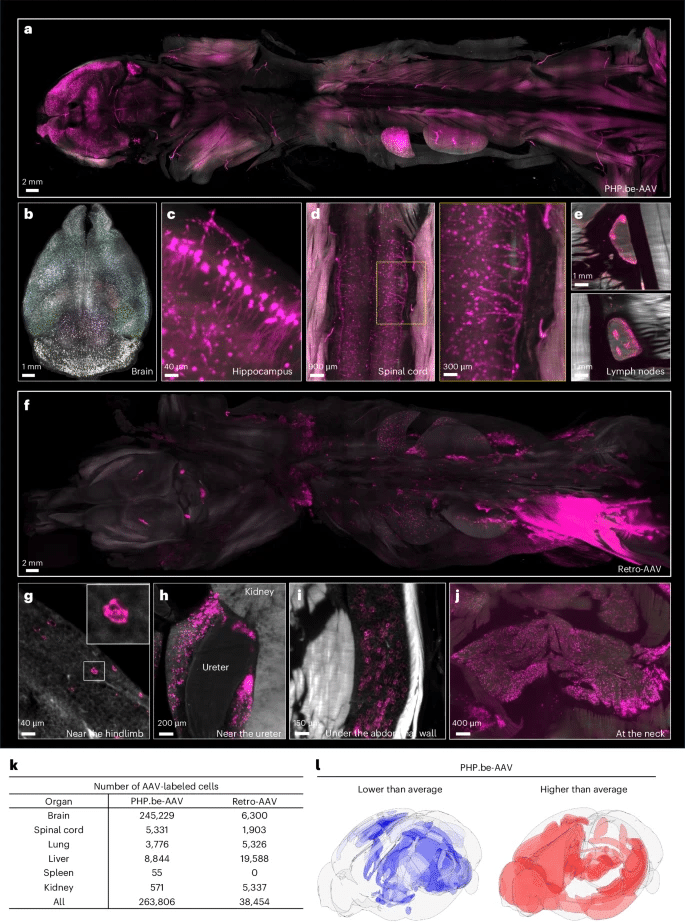
a–e、注射後2週間でPHPeB-AAVによる遺伝子送達後に発現したEGFPの生物分布。脳(b、PHPeBによってラベル付けされた細胞体の密度マップ)、海馬(c)、脊髄(d)、鼠径部および腰椎リンパ節(e)などのさまざまな領域でのPHPeB分布を示す全身ビュー(a)およびサブリージョン。 f–j、注射後2週間後のレトロAAVによる遺伝子送達後のEGFPの分布:後肢(g)および下肢(g)、尿道近く、腹壁下(i)、首(j)を含む脂肪組織を含む全身ビュー(f)およびサブリージョン。 k、PHPeB-AAVおよびレトロAAV由来EGFPによってラベル付けされた細胞数の細胞数のSCP-Nanoの高精度。 l、PHP.eB-AAVベースの遺伝子送達における脳内差異。青は平均よりも低いことを示し、赤は平均よりも高いEFP+細胞密度を示します。カラースケールは、脳全体の平均に対するlog2変換された細胞密度を表し、BrainRenderのアレン脳アトラス参照アトラスにDELiVR31を使用してプロットされます。カラーコーディングは、アレン脳アトラスCCF3領域ごとです。
Retro-AAVは、予想通り、さまざまな組織で軸索様延長のラベル付けでニューロンターゲティング(補足図20)を示しました67,73。しかし、私たちはまた、体全体の脂肪組織の顕著なレトロ-AAV-EGFP標的を特定しました(図6f–jおよび補足ビデオ6)。
脂肪組織のレトロAAV標的メカニズムに関するさらなる洞察を提供するために、最初にウイルスの標的細胞タイプを特定しました。正規の脂質液滴マーカーであるペリリピン-1のレトロAAV注射マウスの褐色脂肪から組織学的スライスを染色すると、レトロAAVシグナルの大部分が脂肪細胞内に含まれていることが示されました(補足図21a)。さらに、Retro-AAVがマウス脂肪細胞のin vitro培養で脂肪細胞を標的とする能力を確認しました(補足図21b、c)。
脂肪細胞の細胞受容体を識別するために、AAVR、膜関連ヘパラン硫酸プロテオグリカン(HSPG)、αVβ5インテグリン、線維芽細胞成長因子受容体1(FGFR1)74,75、76、77、78を含む、レトロAAVの親AAVサブタイプであるAAV2の以前に報告された受容体と補受容器を、ポリクローナル抗体(補足図21d)でin vitroで分化した脂肪細胞を事前にインキュベートすることによって阻害しました(補足図21d)。AAVRの阻害は、in vitroでのウイルス感染の85.7%の減少を引き起こし、脂肪細胞におけるRetro-AAVの一次細胞侵入受容体の候補である可能性が高い。他のタンパク質の阻害は、ウイルスの取り込みの大幅な低下を引き起こしたが、それでも注目すべき減少であり、以前に示唆されたように、それらが感染プロセスにも役割を果たすことを示唆している73,79。
定量分析を容易にするために、小さなデータセット(16パッチ)に注釈を付け、パイプラインを再訓練し、0.8019の平均インスタンスF1スコアを達成しました(補足表3)。SCP-Nano分析により、PHP.eB-AAVによる脳細胞の標的化がRetro-AAVと比較して約40倍高いことが明らかになりました(図6k)。さらに、PHP.eB-AAV(図6l)によるさまざまな脳領域31のターゲットに顕著な異質性を発見しました。
これらの結果は、SCP-Nanoがマウスの体全体にAAVの細胞ターゲットを明らかにする能力を強調しています。このアプローチは、ターゲット外効果を最小限に抑えながら、AAV設計を最適化し、目的のセルへの配信を最大化するために重要です。
【議論】
SCP-Nanoは、高度なディープラーニングパイプラインを使用して、マウス全体の身体イメージングデータの単一セルレベルでのナノキャリアターゲティングを定量化します。数千万の標的細胞を検出するには、人口密度の高い地域であっても、形状、サイズ、明るさなどの複数のパラメータに基づいて細胞をセグメント化する高度なアルゴリズムが必要です。高品質の3Dデータでこれらのアルゴリズムを訓練することにより、地上の真実比較から導き出されたF1スコアによって検証された、非常に正確な細胞識別を実現します。これにより、SCP-Nanoは、非常に低い線量範囲(~0.0005 mg kg−1)で生物分布分析を実行し、約1~2-µmの横方向と6~µmの軸解像度で全身イメージングで低強度のオフターゲット部位を確実に検出できます。
代替の高解像度生物分布評価は、臓器/組織解離に続いて選択されたセクション15、17、18の顕微鏡検査に依存し、サンプリングバイアスと薬物標的の完全な全身空間情報の欠如につながります。SCP-Nanoの全身分析は、これらの制限を克服し、臓器内送達の異質性と細胞型トロピズムの情報を含む、ナノキャリア分布の包括的で偏りのないビューを提供します(図3および補足図。14)。ここでは、SCP-Nanoが質量分析法ベースのプロテオミクスや免疫蛍光などの分子法と組み合わせることができ、空間トランスクリプトミクスやプロテオミクスイメージングなどの他の方法とも互換性があることを期待しています。
私たちは、SCP-Nanoを、特にLNP、リポソーム、ポリプレックス、AAV、DNA折り紙など、臨床的に関連する新興の幅広い薬物送達モダリティにうまく適用し、AIベースの定量化パイプラインが以前に発表された方法とモデルアーキテクチャを大幅に上回っていることを示しました(図2c)。
新しいナノキャリアのためのディープラーニング定量化モデルの再トレーニングには、控えめな新しいデータ注釈しか必要としません。広範な採用を促進するために、すべてのアルゴリズムと再トレーニングプロトコルを一般に公開しました。
SCP-Nanoは、イメージングと空間プロテオミクス分析を組み合わせることで、マイナーなオフターゲティングを明らかにし、それらの分子結果を評価する能力は、臨床翻訳に直接的な意味を持っています。
LNPスパイクmRNA送達後の心臓組織における免疫および血管タンパク質の発現の変化の発見は、mRNAワクチン21,44,45,46,80,81を受けた個人のサブセットにおける心筋炎および心膜炎の報告と一致しています。しかし、同様の影響がヒト被験者に発生するかどうかを決定し、マウスで観察されたこれらの分子変化が報告された臨床症状と因果関係があるかどうかを確立するには、さらなる研究が必要です。
また、承認された適正製造基準(GMP)施設で生産されたLNP-mRNAワクチンとは異なる実験室で生産されたLNPおよびmRNAスパイク製剤を使用しました(補足図22および補足データ3および5)。いずれにせよ、これらの結果は、動物体全体に及ぶ細胞レベルの感受性を持つLNPベースの治療薬の生物分布とオフターゲット効果を調査する必要性を強調しています。このアプローチは、ターゲットの精度を高め、ターゲット外の活動とその影響を明らかにすることにより、毒性リスク評価をサポートします。特に、SCP-Nanoは、最低用量でもオフターゲットを特定し(図4d)、リスクの階層化を支援し、必要に応じて代替ワクチン製剤または治療法の選択を知らせました。
SCP-Nanoは、特に遺伝子治療のために、AAVベースの治療を最適化する上で重要な要素であるAAVの細胞ターゲットを視覚化する上で並外れた感度を示しました。特に、筋肉内注射後の脂肪組織の全身レトロAAV標的を特定しました。この研究では、脂肪組織がレトロAAVを介した遺伝子伝達の重要な標的であることを明らかにし、肥満に関連する健康合併症を治療するための代替手段を提供します。
SCP-Nanoは相当な利点を提供しますが、さらなる制限を認識することが重要です。クリアリング、イメージング、ディープラーニング分析は複雑になる可能性がありますが、詳細なチュートリアルを提供し、コードとプロトコルをオープンソースにすることでこれを軽減しました(方法と「コードの可用性」)。
