
レプリコンワクチンの株変更、前例から考える承認の可能性
レプリコンワクチンに関して、「JN.1株ワクチンはまだ承認されていないので、秋からレプリコンワクチン接種というのは嘘だ」と発信している方の動画を見ました。確かにJN.1株ではまだ承認されていないので、私も決定のように書いていたことを反省しました。けれども、前例から考えれば、「嘘」とは違うと思います。
コロナワクチンの株変更
起源株で承認されたコロナワクチンは、株が変わる場合、非臨床データ(マウスのデータ)で一変承認(承認事項一部変更承認)の申請ができることになっています。
例えば、2023年6月16日に開催された「第47回厚生科学審議会予防接種・ワクチン分科会」で、2023年秋から行うコロナワクチン接種に、オミクロン株XBB系統に対応した新しいワクチンを使う方針が了承されました。けれどもこの時点では、XBB.1系統を含有するワクチンはまだ開発中で、承認申請されてもいない段階だったのです(下記参照)。
そして、2023年9月1日にファイザー社、9月12日にモデルナ社のワクチンが一部変更承認されましたが、自治体のHPでは8月22日の更新で、「接種を開始します」「XBB1.5対応ワクチン」と書いていました(下記参照)。
厚労省のサイトでは、2023年7月31日付で「新変異株対応のコロナワクチンの評価方針について」という資料が公開されていました。
2 新変異株に対するワクチンの薬事審査における評価方針について
(国際的な評価の考え方)
・令和5年5月8日に開催されたICMRAのCOVID-19変異株ワークショップにおいては、現在承認されているワクチンについてはプラットフォームとしての対応が適応可能であり、そのような場合は、株変更に際して、確認的な品質及び非臨床データのみの資料提出でよいとの見解がまとめられている。
・また、米国、欧州においても同じオミクロン株XBB.1.5系統の1価ワクチンでの薬事申請・供給が見込まれているが、品質及び非臨床のデータのみの確認がなされる見込みである。
すでに承認されているワクチンの株変更については、品質と非臨床データのみの提出でよいことになっていると書かれています(下記参照)。
つまり起源株で承認されていれば、株変更は短期間で審査される一部変更承認でよいということです。
ですから昨年は、XBB株に変更したコロナワクチンに関して、すべて「承認」前提で準備が進められていました。
ちなみに、「秋からレプリコンは嘘」の動画で塩野義製薬のワクチンに関するリリースを取り上げていましたが、それが今秋には供給されないことと、レプリコンが同じとはいえないと思います。
なぜならば昨年、第一三共のリリースにも同じようなことが書かれていましたが、株変更の一部変更承認で供給されたからです。
新型コロナウイルス感染症(COVID-19)に対する起源株1価mRNAワクチン「ダイチロナ®筋注」の追加免疫における国内製造販売承認取得のお知らせ(2023年8月2日)

2023年8月2日付のリリースには、「承認された起源株のワクチンついては供給を予定しない」と書いてありますが、2023年11月28日付でオミクロン株で一部変更承認されたというリリースが出ています。
新型コロナウイルス感染症(COVID-19)に対するオミクロン株XBB.1.5対応1価mRNAワクチン「ダイチロナ®筋注」の日本での追加免疫における一部変更承認取得のお知らせ(2023年11月28日)
そして実際に、2023年度中に接種されました。
資料1-1-2-5 予防接種法に基づく医療機関からの副反応疑い報告状況について(ダイチロナ筋注・集計対象期間における報告症例一覧)
第一三共は、今秋から接種される予定のJN.1株ワクチンも、今年5月の審議会に資料を提出しています。
塩野義製薬のワクチンは、今年5月に開催されたこの審議会に資料を提出していませんでした。ですから、おそらく今秋の接種には使われないのでしょう。けれども、Meiji Seika ファルマ社はファイザー社などと並んで資料を提出しているのです。
上記の中で、ファイザー社、モデルナ社のJN.1株はすでに一部変更承認されています。
モデルナ、厚生労働省よりオミクロン株(JN.1)対応の「スパイクバックス®筋注」の一部変更承認を取得(2024年8月23日)
下記の記事(2024年8月19日付)には、厚生労働省は8月30日に薬事審議会・医薬品第二部会を開くとのことで、審議予定品目が書かれています。その中に、「ヌバキソビッド筋注1mL」(組換えコロナウイルスワクチン、武田薬品)も含まれています。
武田薬品については、「承認取得を前提に、2人用バイアル製剤をJN.1対応ワクチンとして今秋供給する計画だと明らかにしている」と書かれています。
新型コロナウイルス(SARS-CoV-2)の組換えスパイク蛋白質(rS)抗原を含有するワクチン。今回、SARS-CoV-2のオミクロン株JN.1系統対応ワクチンを追加するとともに、2回接種分に相当する薬液(1mL)が充填された2人用バイアル製剤を承認する旨を報告する。武田薬品は承認取得を前提に、2人用バイアル製剤をJN.1対応ワクチンとして今秋供給する計画だと明らかにしている。
このように、「承認」が前提で準備が進められているのです。
Meiji Seika ファルマ社は一変申請したのか?
この流れを踏まえれば、起源株で承認されたMeiji Seika ファルマ社のレプリコン(自己増殖型)ワクチン「コスタイベ筋注用」も、一部変更承認申請すれば承認はほぼ確定なのではないかと思われます(下記参照)。
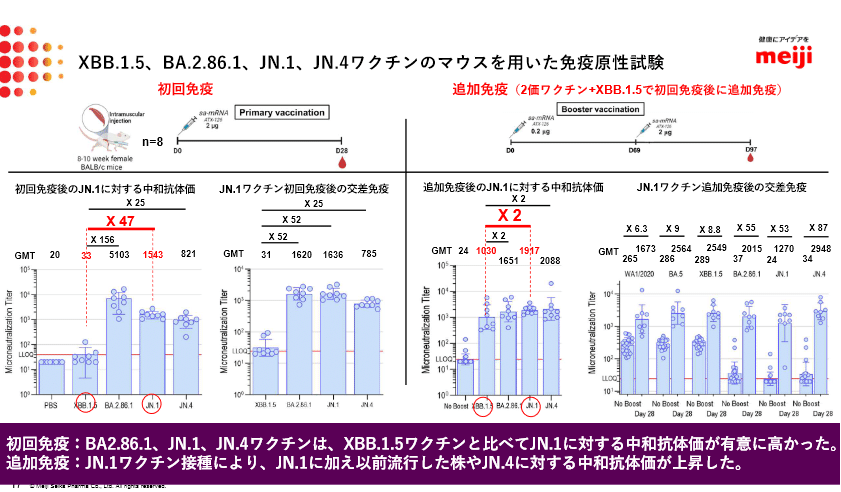
前述の記事で取り上げたミクスOnline の記事(2024年3月21日付)に、一変申請について書かれているので一部引用します。
Meiji Seika ファルマは、変異株の流行状況を見ながら株を複数選定し、製造準備も進めている。この準備もあって、今後WHOから24年秋冬の推奨ワクチン(株選定)が公表された場合、コスタイベの“2024推奨株ワクチン”を「株選定から2カ月程度で一変申請できる」(同社広報部)という。24年秋冬接種用のコスタイベは400万人分を国内製造・供給する計画で、10月出荷に向け対応中だとしている。
「株選定から2ヶ月程度で一変申請できる」と書かれています。さらに、今年3月の時点で「24年秋冬接種用のコスタイベは400万人分を国内製造・供給する計画で、10月出荷に向け対応中だとしている」と言っているので、「承認」される前提で進められていると考えられます。
Meiji Seika ファルマ社のサイトには、JN.1株は「一部変更申請中」だと書かれています。

申請しているなら、前例から考えて、すでに「承認」前提で準備が進められていると考える方が自然ではないでしょうか。
もちろん、まだ確定ではありませんし、何かの事情で承認されない可能性もあります。むしろ、そうなってほしいものです。
私も決定したかのような表現には気をつけなければと思いましたが、「嘘」とか「騙されている」という表現は適していないのではないでしょうか。
