第3世代経口セファロスポリンの「だいたいウンコ(DU)薬」という呼称は的を得ていないかも。わかりやすいけど。
第3世代経口セファロスポリンの問題点としてよくあげられるのは
1. Bioavailability(バイオアベイラビリティ)が低い
2. Clostridium difficile infection (CDI)のリスクが高い
3. 広域スペクトラムため、耐性菌発生リスクがある
などが挙げられています。「だいたいウンコ」は1番目のbioavailabilityの低さから抗菌薬の適正使用の観点において批判的に皮肉ってつけられた呼称です。しかし、ふと別に結果が出てれば問題ないんじゃないか?と思ったのです。つまり忍容性に問題ない用量で感染症が治療出来るのであればbioavailabilityの低さはあまり関係ないのではと。しかしそこで2番目の問題点が思い浮かびました。「吸収率が悪いということはそれだけ消化管に残る量も多いだろう。ということは腸内細菌叢への影響が吸収率の良い他の抗菌薬より大きいのでは? それがClostridium difficile infection (CDI)のリスクを高めているのでは?」という仮説がよぎりました。第3世代経口セファロスポリンは使用すべきでないという考えに疑問が出てきたので調べてみることにしました。
自分の現場感覚でよく処方される第3世代経口セファロスポリンはセフカペンピボキシルですね。小児ですとセフジトレンピボキシルでしょうか。一昔前はセフジニルでしたが最近はだいぶ減った印象です。データとしてはどうでしょうか。H28のNDBデータより編集した抗菌薬処方数トップ10を表1に示しました。

やはり最も処方数量の多い第3世代経口セファロスポリンはフロモックスでしたね。そしてメイアクトも3位に入っています。4位と6位は後発品です。数量ベースとしてのトップ10内に第3世代経口セファロスポリンが4つ(成分的には2つだが)ランクインしています。問題点が指摘されているのに多いですね。
まず問題点1のbioavailabilityを調べました。FDAの添付文書からセフジトレンピボキシルとセフジニルのbioavailabilityはそれぞれ約14%、21%とわかりました1),2)。かなり低いですね8割が残るとは確かに「だいたいウンコ」ですね。次に臨床試験の結果を調べました。
1. Five-day cefdinir treatment for streptococcal pharyngitis.3)
2. Study of use of cefdinir versus cephalexin for treatment of skin infections in pediatric patients. 4)
3. Comparison of cefdinir and cefaclor in treatment of community-acquired pneumonia. 5)
1の研究は溶血性連鎖球菌による咽頭炎に対するpenicillin Vとcefdinirの効果の比較です。投与量はcefdinirが300㎎を1日2回、penicillin Vが250㎎を1日4回をそれぞれ5日間。penicillin Vのbioavailabilityは60~75% 6)です。結果を表2に示しました。
表2

A:TOC was performed 5 to 10 days after completion of therapy
*TOC: test-of-cure
除菌成功率および症状寛解率もほぼ同等の結果でした。安全性の面ではどうでしょうか。発生頻度の多かった副作用を表3に示しました。
表3

副作用全体の重症度、発生頻度は同程度、下痢に関しては若干cefdinirが多い結果でした。
2の研究は生後6か月から1年の小児の皮膚感染症に対するcephalexinとcefdinirの効果の比較です。投与量はcephalexinが10㎎/kgを1日4回、cefdinirが7㎎/kgを1日2回をそれぞれ10日間。Cephalexinのbioavailabilityは>90%6)です。除菌成功率を表4に示しました。
表4

除菌成功率はほぼ同等です。
症状寛解率はどうでしょうか。表5に症状寛解率を示しました。
表5
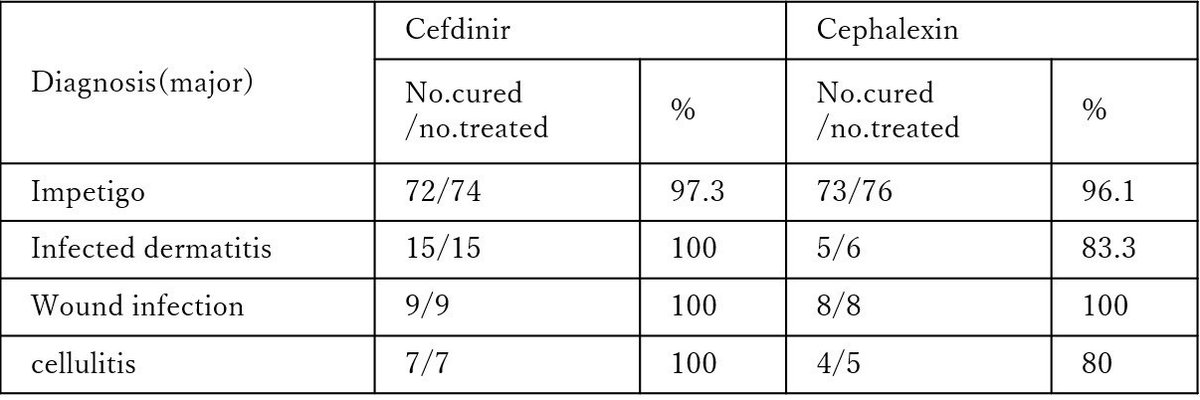
症状寛解率も同程度でした。安全性の面ではどうでしょうか。発生頻度の多かった副作用を表6に示しました。
表6

効果も副作用も大きな差はないようです。
3の研究は13歳以上の肺炎と診断された患者に対してcefdinirとcefaclorの効果の比較です。投与量はcefdinirが300㎎を1日2回、cefaclorが500㎎1日3回をそれぞれ10日間。Cefaclorのbioavailabilityは>50%以上6)です。症状寛解率と除菌成功率を表7に示します。
表7

a: n/N (clinical), number of successes/number of patients; n/N (microbiological),number of pathogens eradicated/number of pathogens isolated.
症状寛解率、除菌成功率共に大きな差はないようです。副作用はどうでしょうか。表8に示します
表8

3つの研究から見る限り第3世代のcefdinirと第1・第2世代セファロスポリンの感染症治療効果に大きな差はないようです。副作用も有意差があるものの使用すべきでないというような極端な差はないようです。
ここで気になるのが問題点2のClostridium difficile infection (CDI)です。3つ目の研究ではcefdinirとcefaclorの比較では下痢の副作用はcefdinirの方が有意差もついて2倍多いという結果でしたが、他の2つの研究では差はみられませんでした。「吸収率が悪い→消化管に残る量も多い→腸内細菌叢への影響が吸収率の良い他の抗菌薬より大きい」仮説と一致しない結果がみられました。そこで世代別セファロスポリンとCDIの関連を調査した研究を調べてみました。以下にご紹介します。
Community-associated Clostridium difficile infection and antibiotics: a meta-analysis.7)
CDIと抗菌薬の関連を調査したメタ解析です。抗菌薬のクラス別CDIリスクの結果が示されています。
図1

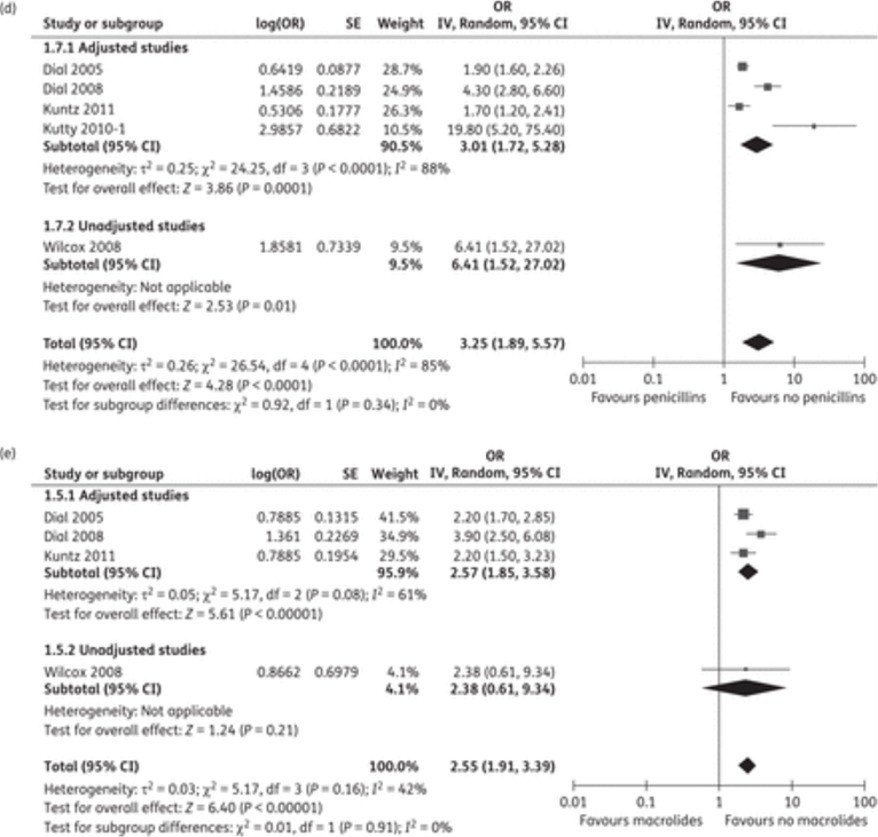

clindamycinによるリスクが最も高く、次いでfluoroquinolones、cephalosporins、penicillinsの順となっています。しかしこの研究の異質性はどのクラスの抗菌薬の調査においても高く、ごちゃ混ぜバイアスの可能性はあります。もう1つのご紹介します。
Role of cephalosporins in the era of Clostridium difficile infection.8)
この研究は世代別セファロスポリンの使用量とCDIの関連をしています。
図2


この図とグラフは欧州のCDIの発生数と第2、第3世代セファロスポリンの使用状況を示しています。
市中では使用量が減り、病院内での使用量が増えています。地図内の数字が1000人あたりの1日使用量です。使用量とCDI発生数との間に関連がみられません。フィンランドとフランスは市中での使用量は同じ(2.3)であるにもかかわらず発生数が倍以上違います。スウェーデンの市中での使用量は欧州中で下位に位置していますが、CDI発生数は上位に位置しています。この結果から世代によるセファロスポリンとCDIとの明確な関連性は確認できませんでした。
最後に、問題点3の耐性菌の発生との関連を調べてみました。グラム陰性菌までカバーする第3世代経口セファロスポリンはESBL(Extended-spectrum beta-lactamase)産生菌発生のリスク因子として指摘されているようです9)。この論文で引用されているESBL産生菌発生とセファロスポリンの関連を調査した研究をご紹介します。
International prospective study of Klebsiella pneumoniae bacteremia: implications of extended-spectrum beta-lactamase production in nosocomial Infections.10)
研究は前向き観察研究です。1996年1月1日から1997年12月31日までのKlebsiella pneumoniae菌血症の455例、440人の患者のうち、院内で得られた253例が解析対象。結果を表9に示しました。
表9

Cefotaximeを含めると第1世代より第3世代の方がとは確実には言えないよう気もしますが、例数を考慮すると可能性はあるかもしれません。
結局1から3の問題点のどれもクリアに第3世代経口セファロスポリンの使用を否定するデータはありませんでした。しかし可能性があることもわかりました。これらの研究から言えることは潜在的なリスクも考慮し、個々の薬物クラスの排除に焦点を当てるのではなく、不要な抗生物質の使用を減らし、抗生物質の持続時間を長くし、複数の抗生物質クラスの使用を避け、できるだけ早く広域治療のde-escalationを促進するという基本を守ることが最も重要ということだと思いました。
1) Spectracef® (cefditoren pivoxil) Tablets 200 mg and 400 mg. (FDA)
2) OMNICEF® (cefdinir) Capsules.(FDA)
3) Tack KJ, Henry DC, Gooch WM, Brink DN, Keyserling CH. Five-day cefdinir treatment for streptococcal pharyngitis. Antimicrob Agents Chemother. 1998 May;42(5):1073-5.
4) Tack KJ1, Keyserling CH, McCarty J, Hedrick JA. Study of use of cefdinir versus cephalexin for treatment of skin infections in pediatric patients. Antimicrob Agents Chemother. 1997 Apr;41(4):739-42.
5) Drehobl M1, Bianchi P, Keyserling CH, Tack KJ, Griffin TJ. Comparison of cefdinir and cefaclor in treatment of community-acquired pneumonia. Antimicrob Agents Chemother. 1997 Jul;41(7):1579-83.
6)MacGregor RR, Graziani AL. Oral administration of antibiotics: a rational alternative to the parenteral route. Clin Infect Dis. 1997 Mar;24(3):457-67.
7) Deshpande A, Pasupuleti V, Thota P, Pant C, Rolston DD, Sferra TJ, Hernandez AV, Donskey CJ. Community-associated Clostridium difficile infection and antibiotics: a meta-analysis. J Antimicrob Chemother. 2013 Sep;68(9):1951-61. doi: 10.1093/jac/dkt129. Epub 2013 Apr 25.
8) Wilcox MH, Chalmers JD, Nord CE, Freeman J, Bouza E. Role of cephalosporins in the era of Clostridium difficile infection. J Antimicrob Chemother. 2017 Jan;72(1):1-18. Epub 2016 Sep 22.
9) Paterson DL1, Bonomo RA. Extended-spectrum beta-lactamases: a clinical update. Clin Microbiol Rev. 2005 Oct;18(4):657-86.
10) Paterson DL1, Ko WC, Von Gottberg A, Mohapatra S, Casellas JM, Goossens H, Mulazimoglu L, Trenholme G, Klugman KP, Bonomo RA, Rice LB, Wagener MM, McCormack JG, Yu VL. International prospective study of Klebsiella pneumoniae bacteremia: implications of extended-spectrum beta-lactamase production in nosocomial Infections. Ann Intern Med. 2004 Jan 6;140(1):26-32.
