
科学者と自称専門家は、主流の物語に同調し、更新型COVID-19ワクチン追加接種の血清学データの解釈について、危険な、誤った公衆衛生上のメッセージを伝え続けている。
Dr. Geert Vanden Bossche 2023年12月30日投稿(substack and VOICES FOR SCIENCE AND SOLIDARITY)
Scientists and self-proclaimed experts have been aligning their interpretation of serological data from updated COVID-19 vaccine boosters with the mainstream narrative, thereby conveying a dangerously misleading public health message.
の翻訳です。正確な翻訳を期していますが、正確さを保証するものではありません。当翻訳の利用に当たっては原文の参照をお願いします。
訳者による補足、翻訳にあたっての語句/略語説明など
・多価非中和抗体:Polymeric non-neutralizing antibody、これまでのDr. Vanden Bosscheの論考の多反応性非中和抗体(Polyreactive/ polymeric non-neutralizing antibody)に同じ。
・プライミング:免疫記憶(抗原記憶)の初期条件づけ
・ブースト:プライミングされた免疫記憶(抗原記憶)を刺激し、記憶された免疫応答(抗体産生)を増強させること。
・ワクチン・ブレークスルー感染:ワクチンによってプライミングされた後のブレークスルー感染。ワクチン既接種が前提であるが、接種前にCOVID-19に罹患していた場合など、ワクチン既接種でも必ずしもワクチンによってプライミングされたとは限らない。
・Deep mutational scanning法:解析対象となる遺伝子配列の変異体ライブラリを作成し、その機能活性をハイスループットに測定することで、各変異の効果を網羅的に調査する手法 (出典)
・ELISA (Enzyme-Linked Immuno Sorbent Assay): 酵素結合免疫吸着測定法
・更新型ワクチン:変異株対応型ワクチン、変異株に対応した抗原を作るmRNAに更新したmRNAワクチン。
・スパイク:スパイクタンパク質
・不十分な:suboptimal、最適とはいえない、最適以下の、最適というには少し足りない、という意味を、「不十分な」と訳した。免疫圧力が最適(optimal)であれば、ウイルスは免疫反応で捕捉され、逃避できないであろう。
本稿で、単に、ワクチンと述べられている場合は、不活化ワクチンなどを含むCOVID-19ワクチン全般を指す。日本では、ほとんどがmRNAワクチンがしめるが、諸外国では多種類の、不活化ワクチンも含めたワクチンが使用されている。
緒言:
ビッグバンに備えるにあたり、やむにやまれない気持ちでこの論文をシェアする。特に読んでほしいのは、第一に、全ての科学者、公衆衛生当局、医師、そして、いわゆる「専門家」—— 今も、無邪気にも無知にも、COVID-19ワクチンの追加接種がウイルス中和抗体を呼び戻し、それによって、COVID-19疾患防御の延長が保証されたと信じている者たちである。
彼らの知的怠惰には本当に唖然とする。彼らが徹底的な調査研究を行っていたなら、Sars-CoV-2に対する集団ワクチン接種が、より感染性の高い免疫逃避変異株を生み出し、最終的には、高度にCOVID-19ワクチン接種された集団で、重症のワクチン・ブレークスルー感染を引き起こしうる、極めて感染性の高い変異株の蔓延につながることが予想できたであろうに。(一方で、非接種者は被害を免れることも)。
ここに至っては、私はもはや、科学界や医学界のエリートが私の詳細な免疫学的分析の結論を読もうが読むまいが気にしてはいない。今重要なことは、この実験の背後にある科学的事実と真実を、明確に文書化し、単純な無知であったとしても、故意の無視であったとしても、言い訳の余地を残さないことである。彼らの行動は、科学の統合性に対する侮辱であっただけでなく、接種を受けた人々に残酷な大打撃を与えた。歴史は間違いなく、彼らの知的無知と道徳的無関心を何世代にもわたって記憶するだろう。
1. 概要
強調しておかなければならないことは、mRNAワクチン既接種者の追加接種後、または感染後の血清で観察される、「中和」活性と主張されているものは、更新型ワクチンが、免疫インプリンティングを大きく上書きしたのではないということだ。それどころか、これまでに生じた立体的免疫再集中によってプライミングされた、より保存されたスパイクタンパク質(スパイク)関連エピトープを標的とした、低親和性の抗スパイク抗体が呼戻されているのだ。真の変異スパイク特異的ウイルス中和抗体と異なり、これら感染抑制性変異スパイク非特異的抗体は、祝福どころか災いである!
私は、大学や研究機関で、批判的思考の欠如が進む一方であることに当惑している。オンライン講義「パンデミックとエピデミックの免疫生物学」、著書「回避不能な免疫逃避パンデミック」[邦訳書]で述べたように、これらの科学者達が崇めている「亡霊」は、Sars-CoV-2粒子と、濃度を増した、これまでに立体的免疫再集中によってプライミングされた変異スパイク交差反応性抗体との間の多価性の相互作用である。この抗体は、更新型ワクチンの追加接種や、新たなSars-CoV-2変異株によるワクチン・ブレークスルー感染によって呼戻され、その濃度を増加させた。非常に濃度が高い場合には、この抗体は感染を抑制することができる。この感染抑制(もしくは「ウイルス中和」)効果は、この変異スパイク交差反応性抗体の濃度が非常に高い場合に限られることから、私はこの現象を「偽中和」と呼んでいる。
大規模な免疫再集中は、当初は、オミクロンによるワクチン・ブレークスルー感染、または、COVID-19 mRNAワクチンの2回の接種によって引き起こされた。免疫再集中は、それまでの抗スパイク中和抗体が高濃度に存在して、抗原性を大きく変化させた変異株と相互作用することで生じる。言い換えれば、大規模な免疫再集中は、高濃度の抗スパイク抗体が、低親和性でスパイクタンパク質の中和ドメインと相互作用する場合に生じる。
免疫再集中によって変異スパイク交差反応性免疫反応はますますその交差性を広げ、その結果として生じる、新たなSars-CoV-2変異株によるワクチン・ブレークスルー感染と相まって、ますます感染性の高いSars-CoV-2変異株の自然選択へとつながる。この過程によって、抗体依存性ワクチン・ブレークスルー感染が立体的免疫再集中を引き起こすという自己増殖サイクルが生まれる。こうして立体的免疫再集中現象が継続的に生じると、最終的には抗体非依存性ワクチン・ブレークスルー感染が引き起こされるようになり、その結果、高度にCOVID-19ワクチンを接種された集団は、集団として、ウイルス感染性に対する免疫選択圧力を増強させ、最終的には、ウイルス病原性に対する免疫選択圧力を強めることになる。
オミクロン、または、新たに生じたスパイク変異株による抗体依存性ワクチン・ブレークスルー感染は、それぞれ、これまでにワクチンによってプライミングされた変異スパイク特異的中和抗体、または、立体的免疫再集中によってプライミングされた変異スパイク交差反応性抗体の抗体価を急激に上げ(ブースト)、高度にCOVID-19ワクチンを接種された集団で、集団的に立体的免疫再集中が起こるようになった。それまでの立体的免疫再集中でプライミングされた変異スパイク交差反応性抗体は、高力価となって、一時的に中和活性を示した後、速やかに、長期間の感染緩和効果をもたらすようになった。その結果、新たな、より感染性の高い免疫逃避変異株の自然選択と拡大を促進し、新たな立体的免疫再集中を引き起こすワクチン・ブレークスルー感染が起こるようになった。こうして、オミクロンの出現は、立体的免疫再集中の自己増殖サイクル開始のきっかけとなった。新たに出現したSars-CoV-2変異株によるワクチン・ブレークスルー感染は、当初は、多価非中和抗体によって促進された。この(多価非中和)抗体依存性ワクチン・ブレークスルー感染は、ウイルスの病原性を抑制しつつ、より感染性の高いスパイク変異株の免疫選択を広範囲に引き起こした。
立体的免疫再集中によって、集団レベルの免疫選択圧力の源は、スパイク特異的感染緩和抗体から、スパイク非特異的感染緩和細胞傷害性T細胞へと徐々に移行している。立体的免疫再集中によってプライミングされる抗体の変異スパイクタンパク質への親和性が次第に低くなり、最終的には、抗体依存性ワクチン・ブレークスルー感染で生じる、より大きなウイルス凝集体を安定化させるようになるためである。このような大きな抗体-ウイルス複合体は直ちに抗原提示細胞に取り込まれ、MHC [1]クラスI非拘束性細胞傷害性T細胞リンパ球を活性化する。
細胞傷害性T細胞リンパ球を介する感染緩和(感染防止ではない!)によって、集団的におよぼされるスパイク非特異的免疫圧力は、スパイク非特異的な感染促進性変異(他のウイルスタンパク質に生じた複製を促進する変異を含む)を取り入れた、より感染性の高い免疫逃避変異株(すなわち、JN.1)の自然選択と優勢な拡大を促進した。スパイク非特異的なMHCクラスI非拘束性細胞傷害性T細胞リンパ球は、スパイクタンパク質のS2サブユニット内のユニバーサルペプチド(https://pubmed.ncbi.nlm.nih.gov/19439480/) による抗原提示細胞の強力な活性化の結果生じる。したがって、このようなT細胞が刺激されて動員されるということは、これまでにプライミングされたスパイク特異的記憶ヘルパーT細胞を呼戻す、スパイク特異的Tヘルパーペプチドが抑制されると考えることが妥当であろう。
スパイク特異的ヘルパーT細胞の呼び戻しが欠如する、あるいは不十分であれば、これまでに立体的免疫再集中でプライミングされた変異スパイク交差反応性抗体のブーストを弱めるだろう。この、それまでの立体的免疫再集中によってプライミングされた低親和性抗体の濃度低下は、多量体化したウイルス凝集体の安定化を促進すると同時に、新たな変異株によるワクチン・ブレークスルー感染や更新型COVID-19ワクチンによる追加接種後の、個々の単一ウイルス粒子と抗体との相互作用を減少させる。その結果、この抗体の、スパイクタンパク質のN末端ドメイン内の高度に保存された感染促進ドメインの認識が弱くなり、多価非中和抗体の産生が大きく減少する。
したがって、JN.1の優勢化は、現在進行中の、抗体非依存性ワクチン・ブレークスルー感染にともなう、集団的な多価非中和抗体の抗体価の減少の指標となる。ワクチン・ブレークスルー感染の(多価非中和)抗体依存性から(多価非中和)抗体非依存性への移行は、高度にCOVID-19ワクチンを接種された集団が、スパイクタンパク質のN末端ドメイン内の感染促進部位に、集団的に免疫圧力を及ぼす結果となる。それによって、樹状細胞表面に固定された、極めて感染性の高いウイルスに、病原性抑制性多価非中和抗体が結合することを妨げる能力を持つ、新たな変異株の選択が促進される。この進化によって、高度にCOVID-19ワクチンを接種された集団で、極めて重篤なワクチン・ブレークスルー感染を起こしうるウイルス変異株の優勢な拡大への途が開かれつつある。JN.1は現在の世界的なウイルス状況の主流を占め、ウイルスが移動性樹状細胞に吸着した時の、多価非中和抗体による病原性抑制に対する不十分な免疫圧力が徐々に増している。そのため、この抗体の結合を妨げる変異をJN.1の子孫が獲得するための免疫選択圧力は急激に強まっている。
私たちの科学機関の土台は腐っている。彼らの、複雑な問題に対する還元主義的アプローチは、学術的名声には利益をもたらすが、彼らのパンデミックに対する無策と無知に象徴されるように、社会に還元されるものは、無責任なものでしかない。
COVID-19集団ワクチン接種プログラムが個々人の健康だけではなく、COVID-19ワクチンを接種された集団全体に、どのような脅威をもたらすかが、次第に明らかになるにつれ、生物学の複雑さを理解することなく、単純に、洗練された科学技術を賞賛し、崇拝する科学者と、いわゆる「専門家」達は、思ってもいないことであろうが、無能だが、極めて影響力のある世界的公衆衛生機関を誤った方向に導いたという重大な責任を負うことになる。
批判的思考の持ち主たちは、繰り返し、彼らに警告を発してきたが、科学界と医学界の権威たちは、データの解釈を主流の物語に沿うように合わせ続けてきた。人工的な集団ワクチン接種プログラムが、自然感染に優る結果をもたらすことを証明するために何百万ドルという税金が投資されている。この巨大な財政支出が何の利益も生み出さなかったことが間もなく明らかになるだろうが、その時に社会がどのように反応するかを考えずにはいられない。
2. イントロダクション
『更新型Covid-19ワクチンは最新の変異株にも有効』というタイム誌に掲載された記事を読んだ(The Updated COVID-19 Shot Works on the Newest Variants | TIME)。
この記事は次の論文を引用している:『XBB.1.5対応型一価mRNAワクチンの追加接種はSARS-CoV-2変異株に対する強固な中和抗体を誘導する』(XBB.1.5 monovalent mRNA vaccine booster elicits robust neutralizing antibodies against emerging SARS-CoV-2)。
私は、この論文が科学的原則に対する冒涜と見なされる可能性を感じずにはいられない。科学者達が、「驚くべき(surprising)」とか「目を見張るような(striking)」と、明確な説明もなく述べられた観察結果を、更新型COVID-19ワクチンを、人々の防御を強化するものとして広く使用するための公的な推奨を強く支持する基盤として提示するのではないかという懸念を感じるのだ! これは、科学的言説に期待される厳密性と透明性に対する挑戦である。
この科学者たちによれば、更新型COVID-19ワクチンは「人々に、より強力な防御をもたらす」魔法の弾である!この分野で評判の高い学術研究機関の、名高い専門家やオピニオンリーダーまでもが、今や、mRNAワクチンを、私たちの祖先が星を崇めたかのように崇拝し始めている。COVID-19ワクチン接種の継続を、一見、正当化するように見えるデータであれば何であれ、盲目的に称賛するのだ。(しかし、彼らは、更新型mRNAワクチンやワクチン・ブレークスルー感染が、どのようにして免疫インプリンティングに打ち勝ち、抗原性の遠い、数多くの新規Sars-CoV-2変異株に対して「強固な中和抗体」を誘導するのかについての妥当な論拠は示せていない。更新型ワクチンはそれらを特異的な標的として設計されてすらいないのだ!)
彼らの単純な結論がすぐに私の注目を引き、さらに重要なことに、私が深い懸念を抱いたのも無理はない。
更新型COVID-19ワクチンによって引き起こされる免疫反応が、「抗原原罪」を無視して、流行中の感染性変異株を直ちに中和するなどということがあるのだろうか?
更新型ワクチンや、ワクチン・ブレークスルー感染を起こした変異株とは抗原性が大きく異なる変異スパイクタンパク質で覆われた現在流行中の変異株を、これらの抗体がどのようにして中和するというのだろうか。Deep mutational scanning法によれば、スパイク関連中和ドメインに大規模な免疫逃避変異があることが示されているのに、どのようにすれば、COVID-19ワクチン接種者が持つ抗体が、流行する免疫逃避変異株を中和し続け、COVID-19疾患から防御し続けることを説明できるのだろうか。
彼らが完全にポイントを見誤っており、彼らが観察しているものが、特定の研究条件下にでのみ観察されうる、ある種、人工的なウイルス中和効果を反映しているに過ぎないとしたら、どうだろうか。つまり、非常に抗体濃度が高い場合(すなわち、追加接種直後、あるいはワクチン・ブレークスルー感染直後に採取された血清サンプル)にだけ観察される事象であり、抗体価が減少すると直ちに比較的安定な感染緩和効果に移行するものであるとしたら?
そのような不完全な殺菌効果が、流行中の変異株の感染性に対する不十分な免疫圧力となり、免疫逃避の深刻な懸念を産まないと言うのだろうか?
数多くの流行する変異株に対して、このような中和効果が示されている。そうであるなら、感染抑制から感染緩和への移行が大規模な免疫逃避を引き起こし、より感染性の高い変異株の出現を早めることにつながらないのか?
このような抗体が低濃度で不十分な抗感染効果を持続させること、および/または、1価のスパイク抗原がELISAで認識されていないことは、更新型mRNA追加接種によって誘導される「強固な」中和反応に関する彼らの楽観的見通しを台無しにしないのだろうか?人々をより強く保護するために、更新型COVID-19ワクチン接種を多くの人に適用するという公衆衛生上の推奨に対する彼らの支持は、これによって、ゆらがないのだろうか?
3. 更新型ワクチンが抗原原罪を克服し、流行している、抗原的に遠い変異株に対して変異スパイク交差反応性中和抗体を誘導するという著者たちの主張を説明できるのは、mRNAワクチンによって引き起こされた立体的免疫再集中だけである。
この論文[2]の図2は、野生型(D614G)1価mRNAワクチンを複数回接種した後、BA.5対応型2価mRNAワクチンを1回接種し、その後、XBB.1.5による追加刺激(XBB.1.5対応型1価ワクチン、または、XBB.1.5によるワクチン・ブレークスルー感染)を受けた者の免疫学的呼び戻しを示している。D614GやBA.5抗原に対する中和抗体価は、XBB.1.5に対するものよりも著しく高い値であった。その一方で、XBB.1.5(および、他の新規スパイク変異株)に対するブースト効果(すなわち、中和抗体価の上昇率)はD614GやBA.5に対するブースト効果に比べて有意に高かった。
著者らは、以前のSars-CoV-2系統(すなわち、祖先系統およびBA.5変異株)に対する中和抗体の強い「バックブースト」は、これまでの、祖先型のD614G抗原を含む野生型1価ワクチンやBA.5対応型2価ワクチン接種による、強力な免疫インプリンティングの結果であると示唆している。彼らは、その実験結果から、BA.5対応型2価ワクチンとXBB.1.5対応型1価ワクチンの間の免疫インプリンティングの「重症度」を比較し(上述の文献2の図2:B-Dを参照)、追加接種を更新型1価ワクチンに限定し、最初に免疫反応をプライミングした抗原(すなわち、D614G)を除くことによって、免疫インプリンティングの重症度を緩和することができることを証明した、と結論している。
私はこの結論に合意しない。第一に、XBB.1.5対応型1価ワクチンとD614G、または、BA.5対応型1価ワクチンそれぞれのブースト効果を比較したデータがない。私の意見では、BA.5対応型1価ワクチンに祖先型のスパイクタンパク質が含まれていないとしても、得られる結果は同じであろう。
したがって、BA.5対応型2価ワクチンは野生型スパイク体が含まれたために免疫インプリンティングの問題を悪化させたこと、既に野生型スパイクタンパク質でプライミングされた者に更新型1価ワクチンの追加接種を行えば、より良い抗体刺激がもたらされることを実験データから示した、という著者らの結論に私は納得できない。
著者らは、XBB.1.5の抗原性が、BA.5と比較して、祖先型Sars-CoV-2系統からより遠くなっているにも関わらず、これまでに野生型1価ワクチンでプライミングされ、追加刺激された者の免疫インプリンティングの重症度を緩和できる理由を説明していない。抗原原罪の概念を考えれば、XBB.1.5抗原に対応した更新型追加接種、または、XBB.1.5変異株によるワクチン・ブレークスルー感染によって、XBB.1.5や、多くの抗原性の遠い変異株に対する中和抗体価が、これまでのワクチンによってプライミングされた抗体が呼戻される以上に、より効率良く増加するのは何故か理解できるものがいるのだろうか。著者らは、XBB.1.5対応型1価ワクチンの追加接種による異なる変異株に対する免疫インプリンティングの緩和とされるものについては、一言、「目を見張るような」と言及したのみである...。
このような矛盾があるため、初回接種(2回接種)が特定のスパイク変異株を標的としたmRNAワクチンであったことによって、その後に同じ抗原を用いたワクチンで追加接種を行った場合に観察されたブースト効果の減弱を説明できるのか、という疑問が生じる。さらに、初回接種と同じ抗原でのプライミングとブーストによってもたらされる中和抗体よりも、量としては少ないにも関わらず、新たに出現したスパイク変異株抗原によるブースト効果(中和抗体の上昇率)がより顕著であった理由を、mRNAワクチンによる初回接種によって説明できるのか、ということも検討する必要がある。
この一見矛盾した結果は、立体的免疫再集中の概念によってのみ説明することができる。立体的免疫再集中は、スパイク特異的非中和抗体が高濃度かつ、低親和性で抗原性の異なる変異スパイクタンパク質と相互作用する場合に生じる(稿末の図1、および、著書1.2.1章、1,2,2章を参照)。例えば、抗原的に遠いSars-CoV-2変異株にワクチン・ブレークスルー感染した結果、または、ワクチンが、その標的抗原(mRNAワクチンの場合はスパイク関連の免疫優勢エピトープ)に対する、低親和性の非中和抗体の抗体価を直接的に上昇させた結果として、立体的免疫再集中が生じる。
言い換えれば、野生型スパイクタンパク質を標的としたmRNAワクチンに続いて、BA.5対応型2価ワクチンの追加接種をした者が、XBB.1.5対応型ワクチンの追加接種をしたり、XBB.1.5変異株によるワクチン・ブレークスルー感染をした場合に、複数の新たに出現した変異株に対する中和抗体が強く刺激されたという現象は、より保存されたスパイク関連ドメインに免疫が再集中した結果であると考えるよりほかない。
BA.5対応2価mRNAワクチンによる追加接種の後に生じた免疫再集中は、それまでに誘導されていた祖先型(D614G)免疫優勢エピトープに対する低親和性抗体と、mRNAが取り込まれた宿主細胞の表面に発現したBA.5のスパイクタンパク質の免疫優勢エピトープに対する低親和性抗体が高濃度となり、mRNAが取り込まれた宿主細胞から放出された遊離スパイクタンパク質上の免疫優勢エピトープと相互作用した結果であると考えられる。祖先型(D614G)およびBA.5のスパイクタンパク質の免疫優勢エピトープに低親和性抗体が結合して覆ってしまうため、これらのエピトープの認識が阻害され、より保存されたスパイク関連の亜優勢ドメインが免疫学的に認識されるようになる(著書の第1章参照)。
以上に述べた免疫メカニズムにより、mRNAワクチンが立体的免疫再集中を引き起こし、広範に交差「中和」性の低親和性IgM抗体をプライミングすることが説明される。したがって、私は、このような立体的免疫再集中によってプライミングされた抗体が非常に高い濃度で呼戻されたことが、著者らによって、XBB.1.5対応1価mRNAワクチン接種、および、XBB.1.5によるワクチン・ブレークスルー感染後に見られた「特筆すべき」ブースト効果とされたものの正体であると考えている。以下8項、9項に述べるが、立体的免疫再集中によって誘導された抗体は低親和性で、特異性に欠けるため、その中和活性は短期間しか持続しない。したがって、更新型ワクチンの追加接種が持続的なCOVID-19に対する防御をもたらすことはなく、そのかわりに、ウイルスの免疫逃避を促進する。
要約:
引用した論文の著者らは更新型1価mRNAワクチン追加接種の効果を、この追加接種によって—— 少なくとも部分的に—— 免疫インプリンティングによる抗原性の制約を克服できる証拠であると誤って解釈した。しかし、この論文で示された「中和」抗体反応は、むしろ、これまでに生じた立体的免疫再集中によって誘導された変異スパイク交差反応性抗体が、XBB.1.5対応型mRNAワクチン(または、XBB.1.5変異株によるワクチン・ブレークスルー感染)によってブーストされたことを示唆する。今後、抗原的により遠い新規変異株に対応させた、どのような更新型mRNAワクチンも、そのような変異株によるワクチン・ブレークスルー感染も、これまでの立体的免疫再集中によってプライミングされた変異スパイク交差反応性抗体(つまり、複数の新規変異株に反応する)を高濃度で増加させることになるだろう。
BA.5対応型2価ワクチンとXBB.1.5対応型ワクチンのブースト効果の差は、XBB.1.5対応型ワクチンが免疫インプリンティング(または、いわゆる抗原原罪)を起こしにくくなったためではありえず、XBB.1.5の方が、それまでに立体的免疫再集中でプライミングされた、より保存されたスパイク関連ドメインに対する抗体 [3]を呼戻す力が強かったためである。この、より保存されたスパイク関連抗原部位を含むCOVID-19ワクチンの追加接種はどれも、これまでの立体的免疫再集中でプライミングされた抗体を同じ程度呼戻すことだろう。
したがって、二つの異なるmRNAワクチンによるブースト効果に差があることを説明するのは、「新版」の抗原原罪 [4]などではなく、免疫再集中なのである。すなわち、最初のワクチンでプライミングされた、スパイク関連免疫優勢エピトープを標的とした抗体から、立体的免疫再集中でプライミングされたスパイク関連亜免疫優勢エピトープを標的とした抗体に免疫反応の焦点が移ったのだ。一部の科学者は、ようやく、mRNAワクチンやワクチン・ブレークスルー感染が、新たに出現するSars-CoV-2変異株に対する液性免疫反応に及ぼす影響の解明を始めているが、それを免疫再集中と明言しているものはない(https://pubmed.ncbi.nlm.nih.gov/38035879/; https://www.science.org/doi/10.1126/sciimmunol.adk5845) 。
著者らは、更新型1価ワクチンによる追加接種は、抗原原罪を大幅に克服し、更新型の変異スパイクタンパク質(すなわち、新たに出現した変異株のスパイクタンパク質)を標的とした、ワクチンでプライミングされた中和抗体を効果的に呼戻す、と、誤って結論づけた。そのため、彼らは更新型ワクチンでの追加接種の継続によって、新たに出現しつつある、JN.1のような、ウイルス固有感染性を増した変異株に対しても持続的な防御が可能である、と誤って考えている。
4. 更新型ワクチンの追加接種後、または、新たに出現したSars-CoV-2変異株によるワクチン・ブレークスルー感染後の血清サンプルの測定結果が示した、多様な、抗原的に遠いSars-CoV-2変異株に対するウイルス中和効果が強く示唆することは、この「中和」効果は長続きしないことと、変異スパイク特異的ではない、ということである。
交差「中和」IgM抗体は多価であるため、多量体となった粒子(例えばウイルス粒子)上の複数のスパイク抗原に相互作用し、同時に複数の結合イベントを起こすことができる。このような相互作用の結合力のことをアビディティ[5]、と言う。
例えば、新たに出現した変異スパイクを持つ変異株に再曝露したりして、変異スパイク交差反応性抗体の濃度が増すと、そのような複数の結合イベントが同時発生する機会も増加する。それによって、この抗体のウイルスに対する全体的なアビディティも強まる。抗体と抗原の濃度のバランスが、安定な免疫複合体の形成に最適な場合に、アビディティは最大となる。
変異スパイク交差反応性IgMのような低親和性抗体はウイルス粒子と多価で相互作用することができる。そのため、このような抗体は異なるサイズのウイルス粒子の塊を安定化させることができ、幅広い希釈レンジで安定なウイルス-抗体複合体を形成する。稿末の図4に示すように、低親和性抗体の結合動態は高親和性抗体の結合動態とは大きく異なる。
スパイク関連免疫優勢ドメインに低親和性で結合する抗体が高濃度になると、複数の結合イベントが同時に起る可能性が増し、優勢度の劣るエピトープにもその結合が起こる可能性が増す。このような複数の結合イベントの増加は、低親和性抗スパイク抗体のSars-CoV-2粒子塊に対する全体的アビディティを強める。低親和性抗体とウイルスの濃度のバランスが理想的であれば、安定したウイルス-抗体複合体が形成され、このような抗体のウイルスに対するアビディティは最大化する。
例えば、更新型ワクチンの追加接種後や、新たに出現したSars-CoV-2変異株にワクチン・ブレークスルー感染後のように、低親和性抗体が過剰に高濃度に存在するばあいには、ウイルス上の標的結合部位との相互作用が促進され、あらゆる標的結合部位が最大限に抗体で占められる。引用した論文の著者らが「ウイルス中和」効果と報告し(、ウイルス変異株に対する、ワクチンによる持続的防御と称する研究を発表している他の多くの科学者たちによっても確認!され)た事象は、こうしてウイルス粒子が飽和されることによって説明される。
しかし、この中和メカニズムは、特異的免疫優勢標的エピトープ(いわゆる「中和」ドメイン)に高親和性に結合する、高親和性抗体のウイルス中和メカニズムとは根本的に異なる。著者らは、更新型ワクチンの追加接種(または新たなワクチン・ブレークスルー感染)で増加した抗体の、この感染抑制活性を、「中和」活性と誤って呼んだ。しかし、実のところ、彼らが観察したこの効果は、偽中和効果、と呼ぶべきものなのだ。
低親和性で標的エピトープと相互作用する抗体[6]は、その濃度が十分に高く、ウイルス粒子上の全ての結合部位を満たすことができる場合のみ、「偽」ウイルス中和活性を得ることができる。そのため、この中和活性は急激に不十分なレベルに低下し、ウイルスの感染性を中和するのではなく、せいぜい緩和するようになる(以下の8項、9項参照)。このことから、ウイルスの偽中和と本物の中和を区別することが極めて重要であることがわかる。偽中和抗体は、新たに出現しつつある、より高い感染性を持つよう進化した、したがって、新たなワクチン・ブレークスルー感染を起こす変異株に、長期間、不十分な免疫圧力をかけることになる。
主要な抗体が、ウイルスの中和エピトープと特異的に相互作用するものではない場合には、ID50の値(50%阻害希釈率)は、Sars-CoV-2からの堅固な防御の信頼性のある指標とはならない。低親和性の変異スパイク非特異的抗体の場合、「中和」力に関するID50値は、抗体価が減少した時に急速に生じる不十分な感染抑制抗体活性について、何の情報ももたらさないからである。したがって、変異スパイク交差反応性抗体が免疫逃避を引き起こす能力についても、当然、何の情報も得られない。したがって、立体的免疫再集中によってプライミングされた抗体をブースト[7]した直後に測定された急性抗体応答が、新たに出現するSars-CoV-2変異体に対する強固な防御効果をもたらすとすることは、完全な誤りである。変異スパイク交差反応性抗体が感染抑制効果を示すことができるのは、抗体価が非常に高い場合だけであるため、この偽中和効果は短期間で終わる。したがって、この効果が、血清サンプルの追跡調査で見出されることはない。
5. JN.1などの変異株の顕著な増加は、これらの変異株の固有の中和性(中和されやすさ)が減弱しているためではない。
これらの新興の亜系統がそれまでの系統を圧倒して拡大しつつあるのは、これらの亜系統が本質的に、血清の中和効果に対する耐性を増したからであるという著者らの解釈は誤っている。新たに出現した亜系統は、これまでにプライミングされた中和抗体に対して耐性となったために、これまでの系統を圧倒しているのであり、したがって、更新型ワクチンの追加接種や新たなワクチン・ブレークスルー感染によって、立体的免疫再集中を引き起こす。これらの新たな亜系統の自然選択と拡大を駆動しているものは、立体的免疫再集中によって誘導された変異スパイク交差反応性抗体によって、前系統におよぼされてきた不十分な免疫圧力である。
まとめると、これらの新たに出現した変異株の増加は、変異株固有の中和性が減少した(つまり、増加した抗体の固有中和活性に対して耐性となった)ためではない。そうではなく、変異スパイク交差反応性抗体が及ぼす免疫選択圧力が主要な決定要因なのである。この免疫選択圧力は、この抗体の濃度の低下と、変異スパイクに対する特異性の低下の組合せから生じる。
6. 最新の血清学的検査は、免疫再集中を明らかにし、ウイルス中和活性の誤った解釈を避けるための鍵である。
より感染性の高い免疫逃避変異株に対するワクチン・ブレークスルー感染や、更新型mRNAワクチンを繰り返し追加接種することは、液性免疫反応が、より一層保存された、「自己模倣」ドメインへ再集中することを促進し、そのような保存された、免疫原性のより低いスパイク関連エピトープを認識するIgM抗体を生み出す。
このような変異スパイク交差反応性IgM抗体は、最終的には成熟してアイソタイプスイッチし、機能的に1価のIgG4抗体となり、親和性を増し、これらの新たな、より保存された標的エピトープに特異的に結合する。免疫原性が著しく低い抗原ドメインは、免疫学的に休止した「自己類似」エピトープを含む可能性が高い。したがって、ワクチン・ブレークスルー感染の繰り返しや、更新型mRNAワクチンの追加接種の繰り返しで、COVID-19ワクチン接種者が免疫病態やがんに罹患しやすくなると考えるのは合理的である(https://www.voiceforscienceandsolidarity.org/scientific-blog/immunological-correlates-of-vaccine-breakthrough-infections-caused-by-sars-cov-2-variants-in-highly-c-xx-vaccinated-populations)[和訳]。
抗スパイクIgG4抗体の相対的増加は、免疫再集中が起こったことを示す。この抗スパイクIgG4抗体の増加は、抗体による感染緩和が細胞傷害性T細胞リンパ球による感染緩和へ移行すると無効化される(以下、11-13項参照)。オミクロンの出現後に極めて集中的にCOVID-19ワクチン接種を行った集団で認められている、早発がんや、免疫病態の増加が、次第にターボがんや、潜在する慢性状態の再活性化による死亡の増加に移行しつつあることの理由を、この進化が明らかにするかもしれない(https://www.voiceforscienceandsolidarity.org/scientific-blog/immunological-correlates-of-vaccine-breakthrough-infections-caused-by-sars-cov-2-variants-in-highly-c-xx-vaccinated-populations)[和訳]。これまでに述べたように、また以下の12-14項に再度述べるように、この過剰死亡率は、COVID-19疾患の重症度を悪化させる新しい変異株の出現による、さらに高い死亡率への移行に先行している可能性が高い。
最新の血清学的検査は、抗スパイク特異的IgG4抗体と、抗スパイク特異的IgG1抗体の比率を測定し、本来の中和活性と偽中和活性を区別するのに役立つだろう。アビディティの変化は、典型的には、多価抗体(IgM抗体など)と多価抗原(ウイルス表面に発現したスパイクタンパク質の繰り返しパターンなど)の間で起こる。著者らは感染抑制抗体のアイソタイプを決定し、1価のスパイク由来標的抗原との相互作用を測定するべきだったのだ。真の交差中和抗体は、通常、IgGクラスであり、極めて特異的に抗原/エピトープに結合する。反対に、「アンサンブル効果」で全体的に中和する抗体は、通常はIgGクラスではなく、IgMクラスであり、多価抗原を認識する。
1価のスパイクタンパク質には結合部位が一つしかないため、1価のスパイクタンパク質を用いたELISAでは効率的にIgM抗体を捉える/架橋することはできない。対照的に、多価抗原、または、抗原複合体はIgM抗体の複数の腕に、より多く結合部位を供給する可能性がある[8]。1価スパイクタンパク質を標的抗原に用いたELISAは、偽中和抗体に対する感度が低いため、この抗体の高い感染抑制活性がELISAの高値に反映されることはないだろう。真の中和抗体であれば、このような相関性の欠如は通常起こらない。しかし、今回の研究では、ELISAも、免疫グロブリンのサブクラスの解析も行われていない。このような解析を行っていれば、著者らが言及した抗体は、変異スパイク非特異的であり、したがって、真の中和抗体ではないことが明らかになったであろう。
したがって、私はウイルスの中和の新たな定義を提案したい。「ウイルスの中和とは、高度に抗原特異的な抗体がウイルス粒子と結合することによって、感染性のウイルス粒子の数が減少する結果、ウイルスの感染力が減弱することであり、通常は他の要素を必要としない。
この定義をSars-CoV-2に当てはめれば、中和とは、変異スパイク特異的抗体の結合によって、感染性ウイルス粒子の数が減り、その結果ウイルスの感染力が失われること、となる。この定義では、Sars-CoV-2系統に結合する変異スパイク非特異的抗体(すなわち、変異スパイク交差反応性抗体)によってもたらされる、いかなる感染力の減弱も除外されている。
7. 既にワクチン、または立体的免疫再集中によってプライミングされた抗体が非常に高い濃度で存在すれば、立体的免疫再集中と偽中和が起こるが、抗体濃度がわずかに低下すると、立体的免疫再集中と感染増強が起こる。
私は著書で、COVID-19mRNAワクチン(2回接種後)と、オミクロンによる大規模なワクチン・ブレークスルー感染が、立体的免疫再集中を促進したことを述べた(図1参照)。立体的免疫再集中は免疫反応を、より保存された、スパイク関連亜優勢エピトープに向かわせる。これは、2回目のmRNAワクチン接種が、ワクチンによって誘導された非中和性の低親和性抗スパイク抗抗体をブーストしたためであり、より感染性の高い新たな変異株によるワクチン・ブレークスルー感染が、以前は中和力があった、ワクチンで誘導された高親和性抗体をブーストしたためである。
免疫再集中と偽中和は、抗体が、分散された単一ウイルス粒子と相互作用する場合にのみ可能であるため、この二つの事象は低親和性抗体がウイルスの全ての結合部位を飽和できるほど高濃度に達した場合にのみ起こりうると結論できる。とはいえ、この過剰な高濃度からわずかに逸脱するだけで、低親和性抗体は速やかに多価結合に移行する。この結合であらゆる優勢、亜優勢の抗原性ドメインが占有され、その濃度が特異的な標的エピトープの飽和レベルを下回ると、より強力でより安定した相互作用が可能となる。
多価結合する親和性抗体が、高濃度で単一ウイルス粒子のスパイク関連抗原性ドメイン(免疫優勢抗原部位と免疫亜優勢抗原部位を含む)に結合すると、免疫反応は、全てのSars-CoV-2変異株で保存された、免疫学的に休止した/不活性(immunoquiescent/ immunosilent)のスパイク関連エピトープに標的を再集中する(例えば、スパイクタンパク質のN末端ドメイン内の感染増強性部位など;https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8142859/pdf/main.pdf; https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7128678/pdf/main.pdf)。
スパイクタンパク質のN末端ドメイン内の保存された抗原部位が反復配列としてウイルス表面に提示されると、この保存された抗原部位に対して、Tヘルプ非依存的な、多価の、非中和IgM抗体(多価非中和抗体)が誘導されると考えることは妥当である。N末端ドメイン内の高度に保存された感染増強性部位に結合する非中和抗体は、抗体依存性感染増強を引き起こすと報告されており(https://pubmed.ncbi.nlm.nih.gov/34384810/; https://www.sciencedirect.com/science/article/pii/S0092867421006620)、そのため、ウイルスが細胞性自然免疫系を回避できるようになり、ワクチン・ブレークスルー感染が促進される。
高親和性IgG抗体も高濃度であれば、抗原的に遠い変異株と相互作用して、個々のウイルス粒子を安定化させる強力な多価性の相互作用に関与する可能性がある、と仮説を立てることは妥当である。この結果、感染が促進される可能性がある。この現象がオミクロンによって引き起こされたワクチン・ブレークスルー感染の第1波の中心にあった可能性が高い。
最後に、偽中和と、抗体の再集中が起こる条件は、高濃度の低親和性抗体が存在していることである。その抗体は、抗原的にあまりに遠すぎるスパイク関連標的エピトープを(再)指向していてはいけない。遠すぎるエピトープに(再)指向された抗体の、標的エピトープに対する親和性は、個々のウイルス粒子と相互作用できる閾値以下となるだろう(図5参照)。したがって、これまでのワクチン・ブレークスルー感染によって、既に数回の立体的免疫再集中を経験している者が、さらに追加接種やワクチン・ブレークスルー感染をしたとしても、もはや、免疫再集中や偽中和力を引き起こす急性抗体反応は起こらないだろうと予測できる。
8. 一時的な偽中和や感染促進は、速やかに、より安定な、したがって、より持続的な感染緩和効果に移行する。
立体的免疫再集中を引き起こすワクチン・ブレークスルー感染は、より免疫優勢でないスパイク関連ドメインに対する多価IgM抗体のプライミングにつながる。この抗スパイク抗体は標的のスパイク関連エピトープへの結合親和性が低いため、粒子表面単位あたりの結合力は、単一のウイルス粒子を安定化するには不十分なレベルまで低下する(図2参照)。この抗体の濃度や親和性が減少すると、多量体化したウイルス粒子がより安定となるため、安定なウイルス粒子(塊)のサイズ分布が急速に、大きく変化する。図3に示すような、単一/単体ウイルス粒子が優勢に存在する状況から、ウイルス-抗体複合多量体が優勢に存在する状況への明らかな変化である。血清中に、感染不能なウイルス-抗体複合多量体の割合が増加すると、その影響が、感染促進活性をもつ単量体のウイルス-抗体複合体を凌駕するようになる。その結果、分析された血清の感染阻害活性(「偽」中和活性)は、感染緩和活性に変化する。
新たに生成された抗体の、新たな、より保存された標的エピトープへの固有親和性が低下するほど、安定なウイルス多量体の濃度は高くなり、この抗体の濃度が低下すると、より急速に、このウイルス多量体が優勢となる。つまり、新たに生成された抗スパイク抗体の固有親和性が低下すればするほど、偽中和効果は、より速やかに感染緩和効果に移行する(図4参照)。
以上すべてが、引用した文献で観察された、ブーストされた抗体の、新規ウイルス変異株に対する偽中和効果は、一時的で、速やかに持続的な感染緩和効果に移行する可能性が高いことを示唆する。さらに、新たに出現した、より感染性の高い変異株が、これまでの立体的免疫再集中によってプライミングされた変異スパイク交差反応性抗体による一時的な安定化の恩恵を受け、感染性をさらに高めるには、ウイルスに再暴露するまでの平均ラグタイムが短くなるように、十分高い感染伝播力を持つ必要があることも示唆している。このようにして、ウイルスは、残存する抗体価が、ウイルス粒子集団全体の主要な部分を、単一の感染促進性ウイルス粒子(これが、多価非中和抗体を産生させる)として十分に安定化させ、十分な数のワクチン・ブレークスルー感染を確保できる時点で、接種集団の十分に大きな部分に感染することができ、十分に高率でウイルス免疫逃避を起こすことができる。
ワクチン・ブレークスルー感染を繰り返すごとに、より大きなウイルス凝集体の寄与が大きくなるため、新たに出現する変異株にはより高いレベルの感染性が要求される。より大きなウイルス凝集体の寄与が大きくなるにしたがい、さらに親和性を弱める広範な変異スパイク交差反応性抗体によって、ウイルス感染性に対しておよぼされる免疫選択圧力が高まっていく。同じ濃度であった場合、高親和性の抗スパイク抗体よりも、より親和性が低い抗スパイク抗体の方が、抗原的に遠いSars-CoV-2変異株に対して、より強く、より持続する感染緩和効果を発揮すると考えることは、実のところ、全く合理的なのである(図4参照)。したがって、新たに出現する変異株へのワクチン・ブレークスルー感染の繰り返しや、更新型ワクチン接種の追加は、より感染性の高い、さらに免疫逃避を強めた変異株の自然選択を促進するだけであることは明らかである。
この論文の著者らは、不十分な免疫圧力を生み出す感染緩和抗体価の影響を無視しているため、これまでに立体的免疫再集中でプライミングされた、より保存されたスパイク関連抗原に対する抗体をブーストすることが、感染性を上げ続ける新規変異株の自然選択を促進するという影響も、必然的に無視している。
要約:
著者らは、更新型1価ワクチンの追加接種が以前にプライミングされた免疫記憶を弱めることはないが、ウイルスの感染性を大きく弱める、ということを理解していない。これは、ブーストされて呼戻された以前の立体的免疫再集中で誘導された抗体の抗体価は、速やかにウイルスの感染性を阻害できないレベルに低下するためである。この抗体は、ウイルスの感染性を緩和することによって、ブースト直後に高濃度であった時には中和できた、まさにその変異株に対して不十分な免疫圧力をかけることになる。言い換えれば、この抗体の中和活性は「急性」抗体反応のみの特徴であり、その後にウイルス感染性に対して不十分な免疫圧力を及ぼすという、重要な能力が隠れている。
その結果、著者らは、追加接種直後の血清サンプル中には中和活性が認められるにも関わらず、より頻繁に更新型ワクチンの追加接種を行うほど、ウイルスはより素早くこの追加接種が呼戻す抗体から逃避するということに気づいていないようだ。
9. 更新型ワクチンの追加接種と新たに出現したSars-CoV-2変異株は立体的免疫再集中を促進する。立体的免疫再集中と免疫インプリンティング[9]が組合さって、より感染性の高い免疫逃避変異株が大規模に選択されるようになる。こうして、抗体依存性ワクチン・ブレークスルー感染によって立体的免疫再集中が起こるという、一連の自己増殖サイクルが加速する。
高濃度の再集中された変異スパイク交差反応性抗体は感染を防ぐのではなく、緩和する方向でウイルス粒子(塊)を安定化させる傾向があるため、免疫逃避が促進され、新たな立体的免疫再集中を引き起こすワクチン・ブレークスルー感染に火を点け、幅広い変異株が同時流行する原因となる(いわゆる「大規模な」免疫逃避)。
ワクチン・ブレークスルー感染の継続は、免疫反応を一層保存され、したがって、一層免疫劣勢なスパイク関連エピトープに再集中させるため、ブーストされた抗体はスパイク関連標的抗原に対する特異的親和性[10]を失うが、その代わりに、ウイルス粒子上のスパイクタンパク質の多価配列に対する、より高いアビディティ[11]を手に入れた。
したがって、新たに出現したSars-CoV-2変異株をCOVIDSC-2変異株をC-19ワクチン接種者が中和できるという「魔法」の効果は、それまでにプライミングされた再集中した抗体に特異性が欠け、かつ、それがブーストされたことで高濃度となった結果に過ぎないのだ。エピトープ特異性が減少したことにより、この抗体はウイルス粒子の多量体に多価性で相互作用できるようになった。複数の相互作用の総合によって、この抗体と、ウイルス粒子上に提示されるスパイクタンパク質の多価配列とのアビディティが強められる(図3参照)。これは、1価の相互作用では、それぞれの粒子に対して一つの結合部位しかなく、全体の結合力としては弱くなることと対照的である。
単一のウイルス粒子は低親和性の変異スパイク非特異的抗体が高濃度の時のみ安定化されるため、追加直後接種[12]直後、またはワクチン・ブレークスルー感染直後に、この抗体が高濃度で呼戻されたことによる偽中和効果は速やかに減弱する。ある抗体濃度における、これらの抗体のアビディティは、標的とする変異スパイク特異的エピトープに対する抗体の親和性が低下するにつれて低下するため、ウイルスの感染力を50%低下させる感染阻害希釈レベル(いわゆる中和ID50)も、標的とする変異スパイク特異的エピトープに対する抗体の親和性が低下するにつれて低下する(https://www.biorxiv.org/content/10.1101/2023.11.26.568730v2.full.pdf: 図2B-D)。
mRNAワクチン既接種者が、抗原的に遠い変異株に繰り返しワクチン・ブレークスルー感染したり、更新型ワクチンの追加接種を繰り返すと、これまでに立体的免疫再集中でプライミングされた抗体が呼戻される。これらの抗体の標的は、スパイクタンパク質の、ますます免疫学的に優勢ではない、より変異しにくい領域に変わっていく。その結果、COVID-19ワクチン既接種者が、抗原的により遠いスパイク変異株に、さらにワクチン・ブレークスルー感染したり、変異株に対応した追加接種をうけると、さらなる立体的免疫再集中が起こる。このことは、立体的免疫再集中を引き起こすワクチン・ブレークスルー感染や更新型ワクチンの追加接種(例えば、XBB.1.5のスパイクタンパク質に対応した)を繰り返すと、スパイク関連免疫原性エピトープに対する抗体の親和性が徐々に低くなる理由を説明する。さらに、この現象は、引用した文献(図2)に示されているように、この抗体が示す偽中和のスペクトルの拡大(すなわち、解析に用いられた全ての新規変異株:XBB.1.5.そのものだけでなく、EG.5.1.、HV.1、HK.3、JD.1.1、および抗体価の上昇程度は低いがJN.1)も説明する。
低親和性抗体の特異的なスパイク関連標的エピトープに対する親和性が、ある閾値を下回ると、抗体の濃度に関係なく、感染阻害効果(「偽」中和効果)を発揮する能力が低くなりすぎる可能性がある。これが、複数回の立体的免疫再集中を通じて生成された広範な変異スパイク交差反応性抗体が、ウイルス中和能力を著しく失う理由である(https://www.biorxiv.org/content/10.1101/2023.11.26.568730v2.full.pdf 図2B-D;https://www.biorxiv.org/content/10.1101/2023.12.08.570782v1.full.pdf 図1H-I)。
水相に安定なウイルス粒子多量体の形成を促進するのに最適な濃度であれば、これらの抗体-ウイルス複合体と感受性宿主細胞との接触が、希釈の増加範囲にわたって阻害され、その結果、これらの複合体に含まれるウイルス粒子の感染性が阻害される。ウイルス粒子多量体の安定化が促進されると、Tヘルプ非依存的な多価非中和抗体産生を引き起こすウイルス粒子を含む、個々のウイルス粒子の寄与が減少する(図3参照)。こうして、感染能を持つウイルス粒子が減少し、更新型ワクチン追加接種後または新規感染後の、以前の立体的免疫再集中で誘導された抗体の感染緩和効果が延長する(図4参照)。感染緩和効果の長期化は、ウイルスの感染性に対する集団レベルの免疫圧力を強めると同時に、Tヘルプ非依存性の多価非中和抗体の産生を減少させ、最終的にはワクチン・ブレークスルー感染の病原性抑制効果が弱まる(以下12項を参照)。
要約:
ウイルス感染力の阻害は、特定のスパイク関連エピトープに対する本質的中和性が持続しているからではなく、ウイルス粒子上に林立するスパイクタンパク質に対する、すでに立体的免疫再集中でプライミングされた、変異スパイク交差反応性抗体のアビディティによる。これまでの立体的免疫再集中でプライミングされた抗体が高濃度で存在することによる、偽中和に続く感染緩和効果は、変異スパイクタンパク質の間で共有される免疫原性エピトープに免疫選択圧力をおよぼすことになる。ウイルス感染性の源はスパイクタンパク質にあるため、長期にわたる感染の緩和は、ウイルス感染性に対する免疫選択圧を強めることにつながる。
抗原的により遠いスパイクタンパク質による、ワクチン・ブレークスルー感染、または、mRNAワクチン接種を繰り返すと、さらに保存された、抗原的により遠いスパイク関連ドメインに対して免疫再集中が起こる。しかしながら、免疫再集中が向かうスパイク関連ドメインが完全に保存されていない限り、新たに産生される抗体は一定レベルの変異スパイク特異性を保持する。これが、XBB.1.5対応型ワクチンの追加接種でもたらされた偽中和効果が、より抗原性の遠い変異株[例えば、HV.1、HK.3 JD.1.1、JN.1]よりも、XBB.1.5および EG.5.1で強かった理由を説明する(引用した論文の図2参照)。偽中和活性に対するブースト効果が、より離れた複数の変異株間で同等であったという事実は、新たに標的となったスパイク関連エピトープがより保存されていることを裏付けている。このことはまた、偽中和が、なぜ速やかに、大規模な、すなわち選択性の低いウイルス免疫逃避に移行するのかを説明する。このことは、新たな変異株は、同時流行している全ての変異株の子孫の中から、スパイクタンパク質全体にわたる感染増強性変異に基づいて選択されることを示唆している。前駆変異株集団よりも有利な増殖性を得た新たな変異株は、それらに置き換わり、新たなワクチン・ブレークスルー感染と、それに引き続く立体的免疫再集中を起こし、大規模な免疫逃避をさらに加速させる(図5参照)。
以上のことから、引用した研究は主に2つの理由で誤解を招くものであると断言できる。第一に、著者らは、更新型ワクチンの追加接種後、あるいは抗原的に離れた変異体への再曝露後の急性抗体反応(すなわち、追加接種あるいはウイルス再曝露後2週間以内に測定されたID50力価)のみを調べている。第二に、ブーストされた立体的免疫再集中でプライミングされた抗体の力価は、当初はスパイク特異的エピトープに十分な親和性で結合し、ウイルス上のあらゆる結合部位に結合することができるが、より最新の変異株対応型mRNAワクチンによる追加免疫や、より最近のSars-CoV-2変異株によるワクチン・ブレークスルー感染の後では、このようなことはなくなり、血清中の中和抗体価が劇的に低下する可能性がある。
10. 更新型COVID-19ワクチンの追加接種、または、新たに出現した抗原的に遠い変異株によるワクチン・ブレークスルー感染による立体的免疫再集中の繰り返しは、選択される免疫逃避変異株の幅を広げたと同時に、感染性を増強させた。より感染性の高いSars-CoV-2変異株の多様な進化は、新たな、より感染性の高い変異株が次々に拡大し、それまでの流行株を凌駕するまでの期間を短縮する。
COVID-19ワクチン接種者がワクチン・ブレークスルー感染を起こすと立体的免疫再集中が引き起こされる可能性がある。ワクチン・ブレークスルー感染に引き続いて、新たな、抗原的により遠い変異株に曝露すると、新たな、それまでの立体的免疫再集中でプライミングされた抗体がブーストされて急増する。新たな、それまでの立体的免疫再集中でプライミングされた抗体が増加すると、ウイルスの感染性に対して不十分な免疫圧力がかかり、より感染性の高い変異株の自然選択と拡大が促進される。初期オミクロン子孫株への曝露は(多価非中和抗体による感染増強によって)ワクチン・ブレークスルー感染を引き起こし、それまでにワクチンでプライミングされていたスパイク特異的抗体をブーストしたが、現在流行しているオミクロン子孫は、これまでの立体的免疫再集中でプライミングされた変異スパイク交差反応性抗体をブーストしている(図5参照)。
流行中の変異株と、最初に免疫系をプライミングした元々のSars-CoV-2系統(またはワクチンのスパイク抗原)との抗原的距離が遠いほど、高度にCOVID-19ワクチンを接種された集団では、新たな立体的免疫再集中を引き起こす可能性のあるワクチン・ブレークスルー感染の頻度が高くなり、以前の立体的免疫再集中でプライミングされた抗体の、新たに出現した、より感染性の高いSars-CoV-2変異株に対する感染中和効果は低くなる。一方で、より抗原的に遠い変異株は、その感染緩和効果の範囲を広げ、持続時間を延長する。その結果、ウイルス感染性に対する集団的な免疫選択圧力が高まることは既に述べた。ウイルスの感染性に対する免疫選択圧力の増大は、新たな、より感染性の高い変異株の出現を促し、急速に先行株を凌駕する。その結果、前回の立体的免疫再集中でプライミングされた交差反応性抗体の濃度がまだ高い間に次のワクチン・ブレークスルー感染が発生する確率が高くなる。これによって、ブースト効果は強固で大規模なものとなり、偽中和効果も大規模なものとなり——そして、再び——流行する変異株の感染性に対する免疫選択圧力が長期化する。こうして、より感染性の高い変異株によるワクチン・ブレークスルー感染の繰り返しや、更新型ワクチンの追加接種は、より感染性の高い新たなSars-CoV-2変異株の自然選択と拡大を継続させ、加速する(図5参照)。
オミクロンによって引き起こされたワクチン・ブレークスルー感染による立体的免疫再集中の第1波の後、新しく出現する変異株の感染性が高まるにつれて、新たなワクチン・ブレークスルー感染の頻度も上昇し、徐々に新たな免疫再集中の発生率が高くなった。その結果、大規模な免疫逃避が起こり、より感染性の高いSars-CoV-2変異株が次々と出現した。より感染性の高いSars-CoV-2変異株は、その固有感染性を徐々に増し、急速に流行を拡大させた。
要約:
変異株対応型ワクチンによる追加接種の繰り返し、および/または、新たに出現したSars-CoV-2 変異株によるワクチン・ブレークスルー感染の繰り返しは、さらに感染性の高いSars-CoV-2変異株の免疫選択と拡大を駆動する。
流行中の感染性変異株への再曝露によって立体的免疫再集中でプライミングされた変異スパイク交差反応性抗体がブーストされると、この抗体は、当初短期間は感染中和効果を発揮するが、その後速やかに感染緩和効果に移行する。しかし、感染の緩和は必然的にウイルスの感染性に対する不十分な免疫圧力となる。ウイルスの感染性に対する、変異スパイク交差反応性抗体による、集団レベルの不十分な免疫圧力は、より多様化しつつある、スパイク特異性の低いオミクロン子孫株の間で、より感染性の高い変異株の自然選択を促進した。これによって、感染性の高い変異株の同時流行が促進され、高度にCOVID-19ワクチンを接種された集団では、(次第に症状は軽くなりながら)立体的免疫再集中を引き起こす可能性のあるワクチン・ブレークスルー感染の連鎖が早められている。
11. MHCクラスI非拘束性細胞傷害性T細胞がウイルス感染性に及ぼすスパイク非特異的免疫選択圧力が、おそらく、JN.1が優勢に増殖している理由であろう。
(https://www.voiceforscienceandsolidarity.org/scientific-blog/the-fulminant-spread-of-jn-1-is-a-highly-worrisome-prognostic-indicator)[和訳]
特定のスパイク関連標的エピトープに対する親和性が、抗体と抗原の濃度の最適なバランスを維持し、安定的に親水化された[13]免疫複合体の形成を確保するのに必要な閾値以下に低下すると、抗体のアビディティは、もはや、より大きなウイルス粒子塊の安定化には不十分となり、抗原提示細胞による取り込みが促進されるようになる。その結果、MHCクラスI非拘束性細胞傷害性T細胞を刺激することになる。細胞傷害性T細胞の活性化が亢進すると、ウイルス増殖が中断されるようになり、ウイルスの感染性の緩和が持続するようになる。細胞傷害性T細胞の大規模な活性化は、ウイルスの感染性に対する免疫選択圧力を強化する。
これらの活性化された細胞傷害性T細胞は、免疫記憶を持たず、その感染緩和作用がMHCクラスIハプロタイプに依存していることを支持する証拠もないことから、スパイクタンパク質のS2サブユニット内のユニバーサルエピトープ(https://pubmed.ncbi.nlm.nih.gov/19439480/) の提示が促進されたことによって活性化されたと考えられる。このようなことは、特に、ウイルス凝集体の形で高濃度でウイルス粒子が抗原提示細胞に取り込まれた場合に起こる。MHCクラスI非拘束性細胞傷害性T細胞の活性上昇は、高度にCOVID-19ワクチンを接種された集団では、ウイルスの感染性に対するスパイク非特異的免疫選択圧力につながるため、この仮説は、信頼性が高い。その結果、スパイクタンパク質に限定されないスパイク非特異的感染増強変異を組み込んだ新たな変異株が出現し、優勢に拡大することが可能となる。したがって、他のウイルスタンパク質に感染を増強する変異を組み込んだJN.1変異株が、急速かつ世界的に広がりつつあることは驚くべきことではない(https://www.forbes.com/sites/williamhaseltine/2023/10/26/jn1-the-odd-man-out-among-omicron- sublineages/?sh=74aa039b3e47&s=03) 。細胞傷害性T細胞によるウイルス感染細胞の排除の増加に対応して、Sars-CoV-2は、このようなスパイクタンパク質非特異的な感染増強変異を追加して組み込み、その複製能力を高めたのだ。
要約:
それまでに立体的免疫再集中でプライミングされた 抗体の力価が低下すると、偽中和効果は急速に消失し、より安定した感染緩和効果へと移行し、徐々に低下する。この減少の速度は、スパイク関連標的エピトープに対して誘導された抗体の親和性に依存する。
高度にCOVID-19ワクチンを接種された集団では、更新型ワクチンの追加接種や新たに出現して流行する変異株に対するワクチン・ブレークスルー感染の繰り返しによって、一連の免疫再集中現象が起こり、ウイルス感染性に対する不十分な免疫圧力が長期にわたって発生する。不十分な感染阻害免疫反応が広範囲に生じると、ウイルス感染性に対する集団的な免疫選択圧力となるため、ウイルスの進化状況の特徴は、同時流行する変異株の分岐進化から、強化された固有感染性に基づいて、その直前の前駆体から多様なSars-CoV-2変異株へ直ちに置き換わる状況に急速に変化している。新たに獲得された免疫反応の標的は、変異スパイク交差反応性エピトープから、高度に保存されたスパイク関連エピトープへと移行しているため、相対的に感染性の低い前変異株に急速に取って代わる新規変異株が、あまり一般的には観察されない感染増強変異を、スパイクタンパク質だけでなく、他のウイルスタンパク質にも組み込んだとしても驚くべきことではない。このことがJN.1変異株の優勢化の原動力になっていることは間違いない。JN.1が組み込んだ変異は、もはや一部のスパイクタンパク質変異株に特異的なものではなく、ウイルス侵入とウイルス増殖を促進するものである(例えば、前者はスパイクタンパク質の変異であり、後者は他のウイルスタンパク質の変異である)。これらの変異が増殖/適応度において有利であるため、JN.1変異株は現在、同時流行している他の変異株を急速に駆逐しつつある(https://www.everydayhealth.com/coronavirus/covid-19-variant-jn1-variant-drives-new-wave-of-illness/; https://www.cdc.gov/nwss/rv/COVID19-nationaltrend.html; https://www.cidrap.umn.edu/covid-19/us-covid-activity-jumps-jn1-expands-brisk-flu-and-rsv-levels-continue; https://www.cdc.gov/respiratory-viruses/whats-new/SARS-CoV-2-variant-JN.1.html) 。
12. MHCクラスI非拘束性細胞傷害性T細胞の大規模な活性化は、親和性が低下しつつある、それまでに立体的免疫再集中によってプライミングされた抗体による、大規模な、ウイルス粒子塊の安定化を促進する。高度にCOVID-19ワクチンを接種された集団は、抗体による感染緩和から、細胞傷害性T細胞による感染緩和へと集団的に移行することによって、ついには、ウイルスの病原性に対して免疫選択圧力をかけるようになる。
(図6および図7参照)
現在のところ、流行中の、非常に感染性の高いウイルスによる増殖性感染は著しく妨げられている。これは、非常に感染性の高いウイルスが作り出している免疫学的環境によって、上気道ではウイルス粒子が常在性の樹状細胞に吸着しやすくなると同時に、低親和性抗体が、抗原提示細胞による大きなウイルス粒子の取り込みを促進しているためである。ウイルス粒子を細胞内に取り込むのではなく、細胞表面に吸着させた樹状細胞は、成熟することができないまま、組織関連リンパ節ではなく、肺に移動する。多価非中和抗体が樹状細胞に吸着したウイルス粒子に結合していると、ウイルス感受性の肺胞細胞へのトランス感染が阻止される(図6)。一方、ウイルス凝集体が抗原提示細胞に取り込まれると、MHCクラスI非拘束性細胞傷害性T細胞が活性化され、ウイルス感染細胞を速やかに排除し、増殖性ウイルス感染を阻止する。
細胞傷害性T細胞の活性亢進は感染を緩和するだけでなく、それまでの立体的免疫再集中でプライミングされた変異スパイク非特異的抗体のTヘルプ依存性のブーストを弱め、その結果、多価非中和抗体の産生が減少する。この状況は非常に憂慮すべきものである。なぜなら、多価非中和抗体は、中和抗体活性が著しく低下した場合にウイルス侵入を促進する役割だけでなく、上気道常在樹状細胞に吸着した非常に感染性の高いウイルス粒子が、遠隔臓器の感受性細胞にトランス感染して、トランス融合と増殖性感染を起こすことを防ぐ役割も担っているためである。細胞傷害性T細胞の活性が集団的に上昇するにしたがい、スパイクタンパク質のN末端ドメイン内の保存された特定の感染増強部位に、大きな免疫選択圧力がかかると考えられる。この部位は、多価非中和抗体と結合してトランス感染を阻害し、その結果、ワクチン・ブレークスルー感染時のウイルスの病原性を阻害している。
特定の抗原部位に限定された不十分な免疫圧力は急速に強まり、ウイルスはこの特定部位に対する免疫圧力に対抗するために大幅な変異を余儀なくされ、それによって多価非中和抗体の病原性抑制効果が消失すると考えるのが妥当である。しかし、このような変化によって、多価非中和抗体の感染増強活性が損なわれることがあってはならない。この活性は、新たな変異株が、多価非中和抗体の病原性抑制効果を克服するために必要とする、大幅な変異に伴う適応コストを補うために不可欠であると考えられるからである。
13. 新たに出現する感染性の高い変異株は、ワクチン・ブレークスルー感染するのに多価非中和抗体を必要としないため、非高度にCOVID-19ワクチンを接種された集団は、スパイクタンパク質のN末端ドメインS-内の感染増強部位に免疫選択圧力をかけるようになり、ウイルスの病原性にブレーキをかけることができなくなる。
免疫再集中によって、抗体反応が、より保存されたスパイク関連エピトープに向けられるほど、新たに産生された抗体と、これらのエピトープとの親和性は低くなり、これらの抗体は抗原提示細胞に取り込まれやすくなるような形で、凝集した子孫ウイルスを安定化させるようになる。抗原提示細胞によるウイルス凝集体の取り込みが促進されると、非常に感染性の高いSars-CoV-2変異株に再曝露した時のMHCクラスI非拘束性細胞傷害性T細胞の活性化が促進される。
免疫再集中が変異スパイク非特異的液性免疫エフェクターからスパイク非特異的細胞性免疫エフェクターに移るにつれて、感染緩和効果が強まり、ウイルス感染性に対する免疫圧力は、流行中のあらゆる変異株に対して増大する。細胞傷害性T細胞の活性化が促進されると、JN.1に代表されるような、ますます多くの、スパイクタンパク質に限定されない感染増強変異を組み込んだ新しい免疫逃避変異株の優勢化が促進される。
新たに循環する変異型の固有感染性が高まるにつれて、感染を増強する多価非中和抗体がウイルスと相互作用する必要性がなくなる。その結果、ますます感染性を強める変異株による抗体依存性ワクチン・ブレークスルー感染は、抗体非依存性ワクチン・ブレークスルー感染の自己増殖サイクルへと急速に進化する。非常に感染性の高い免疫逃避株は、ワクチン・ブレークスルー感染をおこすのに、多価非中和抗体の力を借りて感染性を増す必要がないため、多価非中和抗体の濃度が集団的に低下している状態で感染すると、高度にCOVID-19ワクチンを接種した集団は、多価非中和抗体の病原性抑制効果に抵抗するウイルスの能力に対して、不十分な免疫圧力をかけることになる。
言い換えると、感染性をますます上げるスパイク変異株によるワクチン・ブレークスルー感染からの立体的免疫再集中、という連鎖の加速によって、高度にCOVID-19ワクチンを接種された集団は、最終的に、ウイルスが多価非中和抗体の病原性抑制効果から逃れる能力に対して免疫選択圧力をかけることになり、その結果、多価非中和抗体による重症COVID-19疾患予防効果は失われ、非常に重篤な抗体非依存性ワクチン・ブレークスルー感染が起こるようになるだろう。
14. 高度にCOVID-19ワクチンを接種された社会は不意打ちをくらうだろう。
病原性抑制に対する集団レベルの免疫圧力が、ある閾値を超えると、流行するどのSars-CoV-2子孫株であっても、スパイクタンパク質中のO型糖鎖予測部位に変異を取り入れ、樹状細胞に吸着したウイルス粒子のスパイクタンパク質のN末端ドメイン内の保存された感染増強部位と、病原性抑制性多価非中和抗体との結合を妨げることができるようになる。ウイルスの(O型-)糖鎖プロファイルの重要な変化が、ウイルスのトランス感染性と全身への播種をどのように可能にするかについては以前に説明した(https://www.voiceforscienceandsolidarity.org/scientific-blog/predictions-gvb-on-evolution-c-19-pandemic) [和訳]。
病原性を増強する変異によって生じる潜在的な適応コストは、同じ多価非中和抗体の感染増強活性によって補われるであろう。このシナリオが最も有力である理由は、この抗体の、遊離ウイルス粒子の感染増強部位への結合は影響を受けず、また、多価非中和抗体の濃度が病原性抑制には不十分であっても、固有感染性が低下した変異株は、どのような変異を組み入れているかに関わらず、多価非中和抗体によってその感染力を十分に増強できるからである。
結果として、この新しく出現する変異株は、COVID-19ワクチンを接種した集団全体に渡って、多価非中和抗体の病原性抑制効果を無効にしながら、速やかに優勢となるだろう。このような新しい変異株は病原性を無制限に発揮し、高度にCOVID-19ワクチンを接種された集団で、重篤なCOVID-19疾患と死亡率の突然かつ劇的な増加を引き起こす可能性がある。
残念なことだが、高度にCOVID-19ワクチンを接種した国々での、最近の、COVID-19に関連した入院や死亡の急増を、私たちの保健専門家や公衆衛生当局は警戒していない。JN.1が、現在流行している他の変異株(HV.1など)と比べて重症化を引き起こしたり、公衆衛生上のリスクを高めることを示唆する証拠はないが、その急速な広がりは非常に懸念される。JN.1の加速度的な増加は、おそらく、スパイク特異的Tヘルパー活性の低下を示しており、多価非中和抗体のブーストが減少していることの表れだからである。したがって、JN.1の出現は、高度にワクチンを接種された集団が、スパイクタンパク質のN末端ドメイン内の保存された(すなわち、変異スパイク非特異的な)感染増強部位に選択的免疫圧力をかけ始めたことを示す可能性が高い。
前述したように、JN.1の高いウイルス感染性がCOVID-19ワクチン接種者の免疫系に与える影響は、最終的には、ウイルスの病原性の「謎の」(科学的専門家や公衆衛生当局がまだ理解していない!)封鎖を解き放ち、COVID-19ワクチン接種者がこれまで享受していた防御を崩壊させる可能性がある。
かつて社会は、(私以外の多くの人の意見によれば)、オミクロンが、スパイクタンパク質の受容体結合ドメインに対する抗体の感染抑制効果をバイパスする一方で、病原性を抑制する抗体の産生を誘導した時、「うれしい」驚きを隠さなかった。しかし今回、新しい変異株(著書では「ヒビクロン(HI-VI-CRON)」と呼んでいる)が、スパイクタンパク質のN末端ドメインに対する抗体のトランス感染抑制効果をバイパスし、ウイルスの病原性を解放した時には、社会は「不愉快な」不意打ちを食らうだろう。
12-14項の要約:
再集中された、高濃度の変異スパイク交差反応性抗体は、ウイルス感染を防止はしないが、緩和するような形でウイルス粒子複合体を安定化させる傾向があるため、免疫逃避を促進し、新たな立体的免疫再集中を引き起こすワクチン・ブレークスルー感染を煽り、同時流行する変異株の多様性を拡大させる(いわゆる「大規模」免疫逃避)。
立体的免疫再集中によって、液性免疫反応が、次第に、より保存されたスパイク関連エピトープへと導かれるにつれ、新たに産生された抗体のアビディティは低下し、その結果、追加接種や新たなワクチン・ブレークスルー感染後の感染中和効果は、機能的な幅を広げる一方で、減弱するだろう。これにより、より感染性の高い免疫逃避変異株の自然選択が促進され、急速に、流行するSars-CoV-2ウイルス集団の大部分を占めるようになる。
免疫再集中がスパイク非特異的液性免疫反応からスパイク非特異的細胞性免疫反応(すなわち、MHCクラスI非拘束性細胞傷害性T細胞)に移行した後は、変異がスパイクタンパク質か他のウイルスタンパク質かに関係なく、増殖性感染性を強める新たな変異を獲得した変異株が、他のすべての同時流行中の変異株よりも競争上の優位性を獲得することになる。
この現象は、JN.1変異株の急速な蔓延を説明する。JN.1が、スパイクタンパク質に関連しない複数の変異を組み込んで、その増殖力を向上させたことは、ウイルス感染性に対するスパイク非特異的免疫選択圧力の高まりを反映している。このことは、免疫再集中が進むと、最終的には安定化したウイルス-抗体凝集体の抗原提示細胞への取り込みが促進され、それによってMHC クラス I非拘束性T細胞が活性化されるという私の説を裏づける。これらの細胞傷害性T細胞は、抗原提示細胞がウイルス凝集体を大量に取り込んだ後に提示する、高濃度のユニバーサル(すなわち、スパイク非特異的MHCクラスI)ペプチドによって引き起こされると考えられる。したがって、ウイルスの増殖性感染性に対して集団的に及ぼされる免疫選択圧力は、ここ数週間で急速に拡大した変異株であるJN.1が示す変異の変化と合致するだろう。
さらに重要なことは、JN.1の著しい増加は、MHCクラスI非拘束性T細胞の活性亢進を反映するだけでなく、間接的に、スパイク特異的Tヘルプ記憶細胞の呼び戻しの低下を示唆していることである。この現象は、T細胞への抗原提示が強化されている間に抗原提示細胞が過剰に活性化されたため、PD-1/PD-L1を介した負の共刺激が引き起こされたが、ユニバーサルペプチドによるT細胞の活性化には影響がなかったためと考えられる(https://www.nature.com/articles/s41467-020-18570-x; https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6199356/)。
十分なブースト効果がない場合、高度にCOVID-19ワクチンを接種された集団の病原性抑制性多価非中和抗体は、ウイルスの病原性を抑制するのに必要な、至適閾値以下に集団的に低下する。
現在の細胞傷害性T細胞感性の亢進は、COVID-19ワクチン接種者のCOVID-19疾患とウイルス伝播性を緩和しているだけでなく、非常に感染性の強いJN.1変異株によるウイルスのトランス感染への防御を低下させる原因ともなっている。その結果、公衆衛生当局や「専門家」と称される人々を含め、高度にCOVID-19ワクチンを接種した国々は、不意を突かれるだろう。
15. 図

図1:立体的免疫再集中は、より保存された免疫亜優勢エピトープ(①)に向かう低親和性の広範性中和抗体を誘導する。これによって、大規模な免疫逃避が促され、より中和されにくい変異株(②)につながり、新たなワクチン・ブレークスルー感染をおこすようになる。それによって、それまでの立体的免疫再集中でプライミングされた抗体がブーストされ亜優勢エピトープに結合し(③)、2回目の立体的免疫再集中が引き起こされる。2回目の立体的免疫再集中は高度に保存された免疫劣勢ドメインに向かい、幅広い交差反応性を示す変異スパイク交差反応性抗体をプライミングする(④)。これらの抗体は低親和性なため、高度にCOVID-19ワクチンを接種された集団では、急速に、ウイルス感染性に対する大規模な免疫選択圧力が発生するようになる。こうして、ついには、多価非中和抗体非依存性のワクチン・ブレークスルー感染をおこすことができる、非常に感染性の高いSars-CoV-2変異株の出現につながる。

図2:低親和性抗体はウイルス複合体/凝集体を安定化する。

図3:オミクロンによるワクチン・ブレークスルー感染は(一時的な)感染防御効果をもたらし、より感染性の高いオミクロン子孫株によるワクチン・ブレークスルー感染は、トランス感染からの防御をもたらした。

図4:アビディティは、2価、または多価抗体の複数の抗原結合部位と、対応する多価抗原との間の相互作用の、全体としての強さと安定性の指標である。低親和性抗体は、より幅広い変異株と相互作用して、より幅広い希釈範囲にわたってウィルス粒子塊を安定化することができる。そのため、低親和性抗体は(感染緩和活性が長期化することによって)、高親和性抗体に比較して、ウイルスの感染性に対して、より幅広く、より強い免疫選択圧力をかけることができる。しかし、その濃度が過剰に高い場合には、高親和性抗体は、低親和性抗体に比べて、はるかに強い偽中和力を示す。

図5:mRNAワクチン既接種者の更新型ワクチンの追加接種や、または、新たなSars-CoV-2変異株に対するワクチン・ブレークスルー感染は、それぞれ、それまでにワクチン、または、立体的免疫再集中でプライミングされた抗体をブーストし、多価非中和抗体依存性ワクチン・ブレークスルー感染と立体的免疫再集中の自己増殖サイクルを開始、または、継続させる。

図6:
A:増殖性感染はインターフェロン産生のような自然免疫系の炎症反応を引き起こす。インターフェロンは樹状細胞表面のレクチンの発現を増加させる。レクチンはSars-CoV-2が接着する受容体である。
B:上気道でウイルスは樹状細胞表面のレクチンに吸着される。ウイルスを吸着したことで、活性化した組織常在樹状細胞自身が増殖性感染するわけではないが、下気道へ移動して、(ACE2低発現の)上皮細胞へのトランス感染を促進することで、ウイルスの遠隔播種を促進する(https://www.nature.com/articles/s41586-021-03925-1)。
C:スパイクタンパク質による細胞膜の融合と合胞体の形成。合胞体の形成は、重篤なCOVID-19疾患の特徴である。
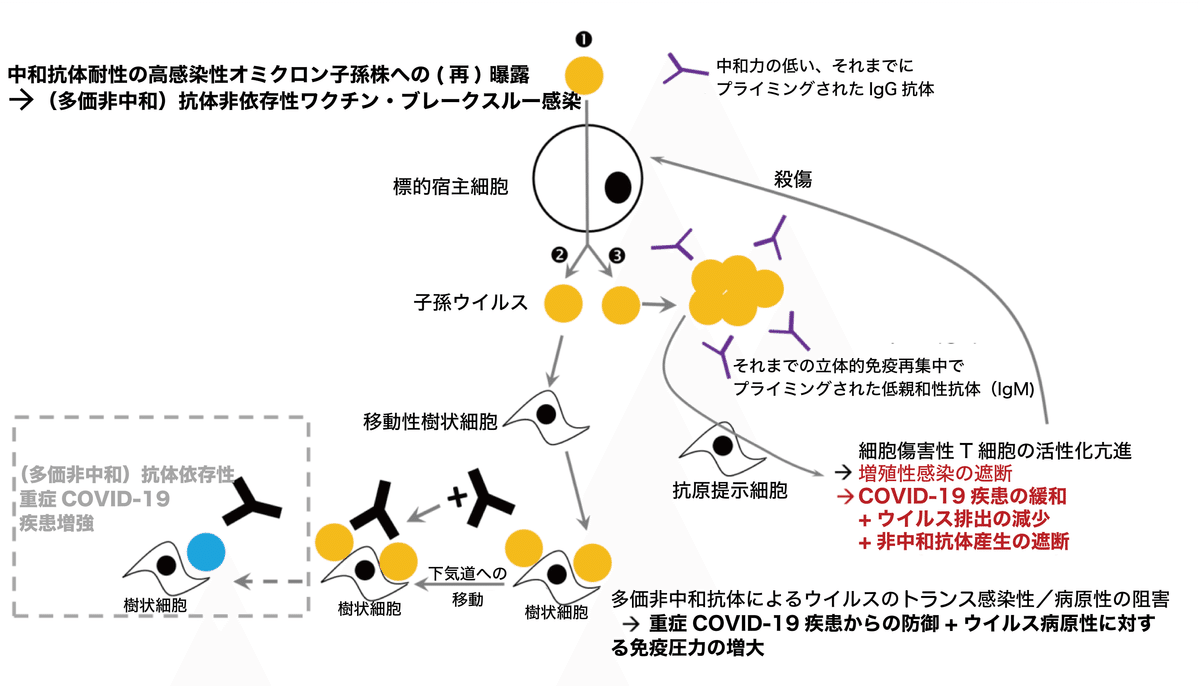
図7:新たに出現した、非常に感染性の高いオミクロン子孫株は、標的宿主細胞に感染するのに、多価非中和抗体を必要としない(❶)。非常に感染性の高いオミクロン子孫株は複製(増殖)して、組織常在樹状細胞へ吸着が促進されるような免疫環境を作り出す。吸着した子孫ウイルスに多価非中和抗体が大量に結合した状態で、樹状細胞は肺や他の遠隔臓器に移動する(❷)。この、樹状細胞に吸着したウイルスと、病原性抑制性の多価非中和抗体との結合の促進と、抗体産生の減少が相まって、高度にCOVID-19ワクチンを接種された集団では、ウイルス病原性に対する免疫選択圧力が上昇していく。それまでの立体的免疫再集中でプライミングされた抗体は、非常に感染性の高い、抗原的に遠い変異株に対して低親和性のため、大きな抗体-ウイルス複合体が形成され、巡回する抗原提示細胞に取込まれる(❸)。抗原提示細胞による大きな抗体-ウイルス複合体の取込みが亢進すると、細胞傷害性T細胞の強力な活性化が起こる。それによって、ウイルスに感染した宿主細胞が排除されるが、ヘルパーT細胞の働きが妨げられ、それまでの立体的免疫再集中でプライミングされた抗体のブーストが弱まる。本文に述べたように、それまでにプライミングされた抗スパイク抗体のブーストの減弱と、移動性樹状細胞との結合の強化によって、新たに出現した免疫逃避変異株による次のワクチン・ブレークスルー感染の際に、ウイルスの病原性に対する大規模な免疫選択圧力が引き起こされる。非常に感染性の高いJN.1の蔓延によって、高度にCOVID-19ワクチンを接種された集団は、多価非中和抗体依存性重症COVID-19疾患増強による、非常に重いワクチン・ブレークスルー感染を引き起こし得る、新たな変異株が選択される閾値を超えて、ウイルス病原性に対する免疫選択圧力を上げている可能性が高い。
脚注
[1] MHC: Major Histocompatibility Complex、主要組織適合性遺伝子複合体
[2] https://www.biorxiv.org/content/10.1101/2023.11.26.568730v2.full.pdf
[3] mRNAワクチン接種は立体的免疫再集中を引き起こす(著書の第1章参照)。したがって、立体的免疫再集中によって新たにプライミングされた、より保存された抗原に対する交差「中和」抗体のブーストは、野生型(D614G)1価ワクチンの接種者が、更新されたBA.5対応型2価ワクチンの追加接種を最初に受けた時に、既に、起こっていたと考えられる。
[4] 抗原原罪とは、新たに変異した抗原は、最初のプライミングに用いられた抗原に対する記憶エフェクター細胞を必然的に呼戻してしまう、という免疫現象を指す。
[5] アビディティとは、2価、または多価抗体と、対応する多価抗原上の複数の結合部位間の相互作用の総合的な強度と安定性の指標である。
[6] この抗体は、高親和性の抗スパイクIgG抗体(例えば、オミクロンにワクチン・ブレークスルー感染した場合)、低親和性の抗スパイクIgM抗体(例えば、新たに出現した、より感染性の高いSars-CoV-2変異株にワクチン・ブレークスルー感染した場合)のどちらもありうる。
[7]引用した研究では、ブーストは、野生型mRNAワクチン接種済みの者にBA.5対応型ワクチンを追加接種するか、野生型mRNAワクチン接種済でBA.5対応型ワクチンを追加接種した後に、XBB.1.5対応型ワクチンを接種するか、XBB.1.5に曝露することで成された。
[8] IgM抗体は5つの抗体サブユニット(単量体)が互いに結合した5量体である。それぞれの単量体は二つの抗原結合部位を持つ。IgM抗体の特徴は抗原を架橋(クロスリンク)することができることであるが、それは、この多価性による。
[9] 以前にmRNAワクチン接種を受けた人がワクチン・ブレークスルー感染した後、または、更新型ワクチンの追加接種を受けた後に認められる、偽中和活性と不十分な抗感染活性は、mRNAワクチン接種(2回接種)の後に起った立体的免疫再集中によって、以前にプライミングされた、より保存された免疫亜優勢スパイク関連ドメインに対する新しい抗体の免疫インプリンティングによる。
[10] 親和性とは単一の抗原決定基と、抗体上の単一の抗原結合部位との間の結合力を指す。
[11] アビディティとは、2価あるいは多価抗体上の複数の結合部位と、対応する多価、あるいは多量体抗原(すなわち、複数のエピトープを持つ抗原)との相互作用の全体的な強さと安定性を指す。
[12] 2回目のmRNAワクチン接種後に生成される広範性交差「中和」抗体の力価が、急速に中和以下の濃度に低下することは、これまでに多くの文献で報告されている。
[13] すなわち、水相で安定化された。
いいなと思ったら応援しよう!

