
研究テーマ 第三部:コーティング(1)
どうも、
だいぶ間が空いてしまって申し訳ございません。研究テーマの記事も第三部に突入しました。「ジョジョの奇妙な冒険」だったら、承太郎たちがエジプトへ向かっているところですね。
それでは早速始めましょう
前回に話した内容としては、人工肺の中に形成する血栓を止める唯一の術である抗凝固薬は、出血リスクが高くあまり好ましくない、でしたね。
今回は、そういった問題をテーマとして僕がどのような研究に取り組んだのかを話していきます。
1.コーティング
まずはコーティングの話から始めさせていただきます。
「コーティング」という言葉を耳にすると、何を思い浮かべますでしょうか?色々ありますが、例えばフライパンのテフロン加工。または溶かしたチョコレートで表面を覆ったビスケット菓子。コーティングは表面処理の一種であり、表面を滑らかにしたり、フライパンを焦げにくくしたり、食品の味付けに使ったり、用途は様々です。
血栓の要因となる血小板や凝固因子の活性化を防ぐためにも、コーティング技術は研究されてきました。そもそもこれらの因子などの活性化は表面に付着することが根源であるため、人工肺の表面をくっつきにくいように加工すれば済む話なんです。実はフライパンに用いるテフロンコーティングからそこまで遠い話ではありません。
1.1. コーティングの歴史
人工肺の歴史は浅いものではありますが、その短い時間において色々なコーテイングが開発され、そして人工肺に応用されてきました。
ヘパリンコーティング
例えば前回でも紹介したヘパリン。凝固因子の内の一つでもあるトロンビンを抑制する働きがある抗凝固薬です。ヘパリンを血液に直接投与しすぎると出血のリスクが高まります。代わりにヘパリンを人工肺の表面に繋げておいたらどうか、と考えた学者さんたちがいました。理にかなっていますよね。血栓の形成を抑制したい場所は人工肺の中だけのことですので、そこだけにヘパリンを集中しておけば良いのでは?そうすれば、ヘパリン投与量も減らすこともでき、よって出血リスクも減らせるのでは?
ヘパリンコーティングは、一番歴史の長い人工肺のコーティングです。よってほかのコーティング材料より最も多く学術記事のテーマとして扱われてきました。これほど多くの研究データがあるにも関わらず、エクモに直接関するデータは比較的限られています。ヘパリンコーティングに関する文献の大半は、Cardiopulmonary Bypass(人工心肺装置)に応用されたときの研究結果が多いです。人工心肺装置は心臓手術のときに使われる措置であるため、使用期間はせいぜい数時間にしか及びません。それに比べてエクモは数日間、数週間にも及ぶこともあります。ヘパリンのコーティングの効果において、はっきりと解析されていることといえば、薬品としてのヘパリンほどの効果が残念ながら見られないことです。[1]
PEG
あとコーティングの代表格の一つといってもいいPEG、ポリエチレングライコールです。コンタクトレンズ、シャンプー、薬品、様々な医療用品に用いられ続けてきた材料です。PEGの特徴としての一つは、その高い親水性です。あとでもっと詳しく説明しますが、親水性は水に溶けやすさを示す性質です。水に溶けやすいPEGをコーティングにした場合、覆われた表面は血とも相性が良いです。免疫反応もあまり引き起こさないので、薬品のカプセルのコーティングなどに用いられてきました。PEGも人工肺の表面コーティングとして応用されてきました。MedtronicのTriliumが多分一番有名です。
だが、PEGには欠点がいくつかあります。まず、長期間使用には不向きなこと。薬の投与などの短期間の使用には良いかも知れませんが、長期間血液に晒されていると化学反応によってコーティングが剥がれだすことが分かってきました。[2] また、PEGはかなり多くの用品に用いられているためか、PEGに対して人間の体が抗体を作ることも最近の研究で判明されてきました。[3、4]PEGの抗体持ちのエクモ患者さんが、PEGコーティングが適用された人工肺に繋げられたら、免疫反応を引き起こすリスクなどが懸念されています。
結局のところ、その浅い歴史を通して数々のコーティングが開発されてきましたが、著しい効果を持つコーティングは未だに出てきておりません。これらのほかにも何種類かコーティングはありますが、全体的に見ても短期実験のデータが殆どです。より長く使える人工肺を作るには、新しくコーティングを長期実験を重ね開発する道しかありません。
1.2.次世代のコーティング
僕が以前在籍していた研究室の長であるKeith Cook博士は、よりふさわしいコーティング材料となるものを探りまくりました。そこで見つけあてたのは、そのようなコーテイング材料の開発をしているShaoyi Jiang博士。当時はシアトルのワシントン大学、現在はコーネル大学で教授をしています。彼の研究室はタンパク質の付着を抑制するコーティング技術の開発に取り組んでいました。その材料とは、英語でzwitterionicという性質を持った素材です。すみません、専門用語をぶっこんできて。もちろん説明します。
zwitterionicを日本語に訳すと「双性イオン」。イオン(ion)とは、原子が電子を失うまたは得ることによって成るプラス・マイナスのチャージを帯びている原子のことです。双性イオンとはつまり、プラスとマイナスの両方のチャージを兼ね揃えているイオンのことです。この双性イオンの身近な例をあげるとすれば、アミノ酸です。アミノ酸が身近かどうかは人それぞれかもしれませんが、名前に聞き覚えのある人はたくさんいるはずです。タンパク質の材料となるもので、全部で20種類あります。アンモニア(NH3+)のプラスそしてカルボン酸(COO-)のマイナスの電荷を両方併せ持っているその構造が全てのアミノ酸に共通しています。
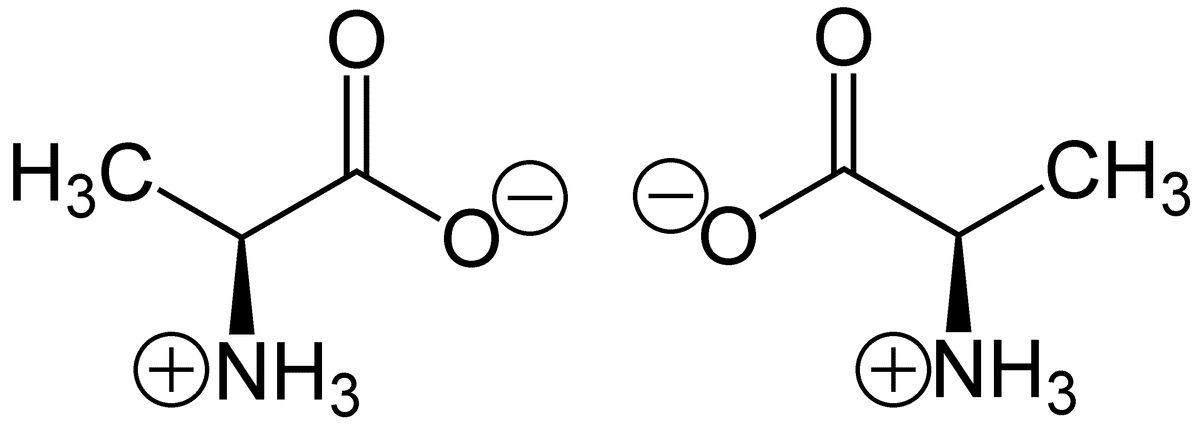
https://upload.wikimedia.org/wikipedia/commons/4/4a/Zwitterion-Alanine.png
僕が実験に用いた双性イオンコーティングは、polycarboxybetaineというものです。”poly"は複数という意味を持ち、carboxybetaineという単体がたくさん並びpolycarboxybetaineとなります。下の図にも描かれているよう、かっこの右側にあるのが単体となるcarboxybetaine methacrylate。アミノ酸と同様、アンモニアとカルボン酸によってプラスとマイナスのチャージを両方帯びています。この単体が枝のようにたくさん生えている木を想像すれば、polycarboxybetaineの出来上がりです。

プラスとマイナスが両方あることによって、何が起こるのか?これを説明するにはコーティングが使用される環境を込みで説明すればわかりやすい(はず)です。このコーティングの環境はもちろん血液ですね。血液の約50-60%は水で出来ています。赤血球などの細胞、などが残りの40%ほどを占めています。少しややこしい環境ですが、
水のほうに注目しましょう。
水を原子レベルで見てみると、水素(H)が2つ、酸素(O)が1つです。いわゆるH2Oですね。水素と酸素が隣同士にいることによって、弱い電場が起こります。水素がややプラス、酸素がややマイナス、とイメージしてください。水の分子が引き起こす電場に引き寄せられる物質は水に溶けやすく、親水性の高いものと見なされます。
この理論でいくと、双性イオンはめちゃくちゃ親水性が高いです。水分子と双性イオンはすごく引き付けられ、引き離そうとしても中々できません。この性質をうまく活用することによって、血栓が出来にくい環境となります。表面上に双性イオンで加工しましょう。分子レベルで見ると、水はこの双性イオンの電荷に引き寄せられます。血液内に巡回してる血小板や凝固因子も表面に引き付けられますが、この電場に打ち勝たなければ付着できません。付着しなければ血栓も出来ません。
実際にこのcarboxybetaineがどれほど血小板や凝固因子の付着を防げるか調べてみたところ、これまで開発されてきたコーティング以上の効果が見られてきました[5ー7]。よってかなり期待が高まっているコーティング材料の内の一つです。
人工肺の表面を隈なく双性イオンの材料で覆えば、血栓を防ぎそして長期使用の安全性も高めることにつながる。そのような仮定を基に人工肺にこのコーティングを応用する研究をしてきました。ただ、そんなうまく研究がいかないのが現実です。人工肺にこのようなコーティング技術を応用するのは、実はすごく難しいことなのです。
まず、コーティングのベースとなる表面の材料に関する課題がありました。以前にも話した筒のことです。筒の材料となるのは一種のプラスチックであり、ポリメチルペンテンとかポリプロピレンが主流です。このようなプラスチック素材は、双性イオンとは違って親水性が低いです。水と油が混ざらないのと同様、親水性の高いものと親水性の低いものをくっつけ合うのは、結構難しいことなのです。従って、このコーティングをどうのように表面上にキープするのかが第一の難関です。
2つ目の問題は、人工肺の表面の規模の大きさ、そしてその複雑さ。コーティングの基礎研究で使われる表面サンプルは、数平方センチほどの小さくて真っ平らなものです。そこから色々な用途に応用されていき、そこでスケールアップをどうするかなど検討していきます。人工肺においては、これが特に難しいです。人工肺の総表面積は前にも話したとおり1-2平方メートルです。平方cmに換算すると10000-20000平方cmです。桁が4個ぐらい違い、つまり1万倍ほど拡大しなければなりません。その上、人工肺の複雑な表面にどう対応するかも考えてなくてはいけません。
1.3.次回予告
こういった難関を乗り越えるにはどうするのか?これを説明するだけで記事が何本か書けることでしょう。今回もちょっと長くなったので、次回予告にしておきましょう。焦らして焦らして本当に申し訳ございません。
Ukita R, Wu K, Lin X, Carleton NM, Naito N, Lai A, Do-Nguyen CC, Demarest CT, Jiang S, Cook KE. Zwitterionic poly-carboxybetaine coating reduces artificial lung thrombosis in sheep and rabbits. Acta Biomater. 2019 Jul 1;92:71-81. doi: 10.1016/j.actbio.2019.05.019.
この論文の要点としては、様々な動物実験を通して人工肺の表面に最も相応しいコーティング方法を定めたことです。人工肺の親水性の低くて且つ莫大な表面積をカバーできるコーティングとは果たして何だったのか?
それはずばり、ドーパ(DOPA)コーティングです。次回はこのドーパに注目しましょう。
今回もありがとうございました。
参考文献
[1]R. Biran, D. Pond, Adv. Drug Deliv. Rev. 2017, 112, 12–23.
[2]Ulbricht, J, Jordan R, and Luxenhofer, R. On the biodegradability of polyethylene glycol, polypeptoids and poly(2-oxazoline)s. Biomaterials, 2014, 35(17), 4848-4861.
[3]Garay, R.P., and Labaune, J.P. Immunogenicity of Polyethylene Glycol (PEG). The Open Conference Proceedings Journal, 2011, 2, 104-107.
[4]Chen, B.-M. Cheng, T.-L., and Roffler, S. R. Polyethylene Glycol Immunogenicity: Theoretical, Clinical, and Practical Aspects of Anti-Polyethylene Glycol Antibodies. ACS Nano 2021, 15, 9, 14022–1404
[5]J. Ladd, Z. Zhang, S. Chen, J. C. Hower, S. Jiang, Biomacromolecules 2008, 9, 1357–1361.
[6]C. R. Emmenegger, E. Brynda, T. Riedel, Z. Sedlakova, M. Houska, A. B. Alles, Langmuir 2009, 25, 6328–6333.
[7]M.-C. Sin, S.-H. Chen, Y. Chang, Polym. J. 2014, 46, 436–443.
