
【大学化学への梯】アルカリ型燃料電池の電解液はどうして水酸化”カリウム”なの?
こんにちは やまたくです
今日は高校化学で登場する燃料電池の一つ「アルカリ型燃料電池」についてのお話です。
昨今の水素社会実現に向けた社会情勢の関係から燃料電池は注目を集めています。
そんな中でもアルカリ型燃料電池は、アポロ宇宙船に搭載されたなどの華々しい利用実績は多くあるものの、安全性や耐久性の観点から他の燃料電池に劣ってしまい最近のトレンドとは少し言い難いタイプの燃料電池となっています。
ではなぜ、あえてアルカリ型燃料電池の話をするかというと、自分が高校生2年生の化学の授業でアルカリ型燃料電池について学習したとき、あることに疑問を感じ、実際にそれをテーマに研究をしたという経験があるからです。
その疑問は今日の記事の表題にもあるとおり、「どうしてアルカリ型燃料電池の電解液は水酸化”カリウム”なの?」ということです。
高校の教科書に出てくる強塩基といえば、中和滴定の実験などにも出てくる「水酸化”ナトリウム”」です。
それにもかかわらず、なぜかアルカリ型燃料電池の説明の時は、なんの前触れもなく水酸化カリウムを電解液に使います!!と習います。
素直な高校生は、ここで「水酸化カリウムか!覚えておかなきゃ!!」となると思いますが、何を思ったか私は「なんで?」と感じてしまい、その日以降学校の先生に相談しながら、放課後や夏休みは実際にアルカリ型燃料電池を組み立て、さまざまな電解液を用意して電流や電圧を測定していました。
今日はその研究の中で、高校生の自分が、当時何を考え、どんな結果が得られたのか、そして、少しだけ大学化学と結びついた高校化学の楽しさを記事にできればと思い執筆しています。
ただ、高校生の頃のポンコツな仮説も混ざっているので、温かい目で見ていただければ幸いです。
疑問の発端
高校生当時、
アルカリ型燃料電池に強塩基を使うのは、単純に電離度が高い方が溶液中のイオン濃度が高い分、電気が流れやすいからだろうと納得していました。
一方で、強塩基として水酸化カリウムを使うことに疑問を感じたのは、
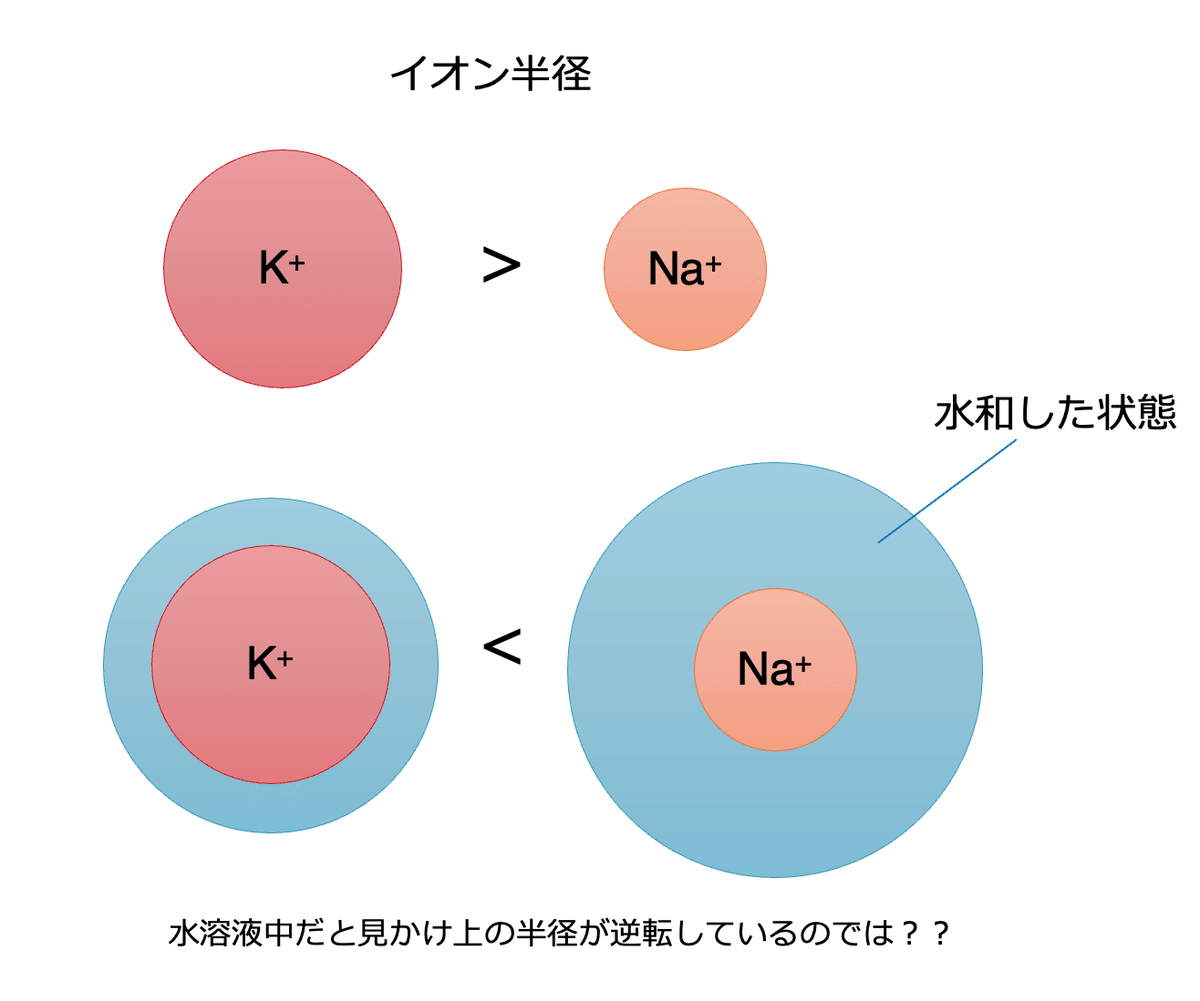
同じ1族の元素であるカリウムとナトリウムのイオンを比較した場合、そのイオン半径は、第3周期のナトリウムイオンよりも第4周期のカリウムイオンの方が大きくなるはずだから、水溶液中ではカリウムイオンの方が動きにくくないか?(電気抵抗が大きくなるのでは?) と考えたためです。

実験の結果
実験としてはものすごく単純で色々な電解液で燃料電池の電圧と電流を調べるということをしていました。
(燃料電池の作り方は、ここでは割愛します。もしこの記事が人気になって、作り方を知りたいという人が出てきたら、その時に記事にしようと思いますのでコメントしていただければ幸いです。基本的にはかなり簡単なので高校に科学部があるくらいの学校ならなんとかなると思います。)
その時の実験結果が、下の写真の通りです。(色々ツッコミどころのあるグラフですが、高校生が作ったものなのでご容赦ください。)

電圧に関しては
水酸化カリウム = 水酸化ナトリウム >炭酸ナトリウム > 酢酸ナトリウム
という序列になっています。
一方で、電流に関しては
水酸化カリウム > 水酸化ナトリウム >炭酸ナトリウム > 酢酸ナトリウム
となっていました。
この結果は、水酸化カリウム水溶液の方が水酸化ナトリウム水溶液よりも電気抵抗が小さいということを意味しています。
原因解明
この結果を受けて、高校生だった自分は、直感と違う結果が出てきたことになぜかワクワクしていた気がします。
イオン半径だけを考えればナトリウムイオンの方がカリウムイオンより小さいのだから、電気抵抗が小さくなるはずだと考えていたのにもかかわらず、実験結果はその逆になっています。
何か見落としていることがあるはずだと思い、高校の化学の教科書を隅から隅まで読んでみました。
しかし、その答えは化学の教科書からは見つけられませんでした。
そんなある日、高校の物理の授業で電磁気を扱っている時、クーロンの法則の式を目にして、「あれ?これってイオンでも同じことが言えるんじゃね?」と感じました。

クーロンの式を見るまで、イオンの大きさばかりに気を取られていましたが、
よくよく考えると、カリウムイオンやナトリウムイオンは水溶液中に存在している以上、そのイオンの周りには水分子がまとわりつく (水和する)ことをすっかり忘れていたのです。
クーロンの式を見たときに、カリウムイオンの方がナトリウムイオンよりもイオン半径が大きい分、水分子を寄せ付ける力が弱くなるはずだと感じました。(なんでそんなことを感じたのかはよくわかりません。)
そうすると、下図のように、水和した時のそれぞれのイオンの半径の序列は、カリウムイオンとナトリウムイオンで逆転するのでは?という仮説が容易にたてられ、
すべての実験結果が説明がつくと思い、喜んだことを今でも覚えています。
その日の物理の授業後は、高校の化学便覧に載っているカリウムイオンとナトリウムイオンのイオン半径から、水分子がどれだけまとわりつくことができるか大雑把に計算し、カリウムイオンの水和した状態の方がナトリウムイオンの水和した状態より小さくなるという結論を導き出すのに必死になっていました。
結果的に、私はこの研究成果を引っ提げて韓国のKAISTと呼ばれる大学の附属高校で開催されたサイエンスフェアや、タイの王立高校で開催されたサイエンスフェアに日本代表として参加することになりました。
KAISTの附属高校で行われたサイエンスフェアでは英語ポスターでの発表
タイの王立高校で行われたサイエンスフェアでは研究成果を英語で4ページの論文形式にまとめ提出し、英語口頭発表を行いました。
今思うと、これらの経験が、博士課程に進学しようと思った原点になったものかもしれません。(これらのサイエンスフェアでの話はまた別の機会にしようと思います。)
補足の説明
今回の結果は、大学生になると習う人も出てくる
「ストークス半径」の存在に、高校生の頃の実験事実から気がつくことができたという話になります。
ストークス半径とは、「ある反応がおこるときにそれに伴って反応に関与すると考えられる仮想的な半径」と説明されます。
これだと意味不明なので少し噛み砕いて説明してみようと思います。(厳密性は失われますがご容赦くださ合い)
アルカリ型燃料電池の電解液中において、カリウムイオンは電流が生じると移動します。しかし、この時には単純にカリウムイオンだけが移動しているのではなく、周りの溶媒である水分子もある程度引き連れて移動することになります。
その時の仮想的なイオンの半径をストークス半径と言います。
さて次に、水溶液中でイオンが引き連れることのできる水分子の数を考えてみましょう。
その数はクーロンの法則からもわかるように、同じ電荷であれば、半径が小さいイオンほど、多くの水分子を引き連れることができます。
ここでは細かい計算は省略しますが、一般的な水溶液を考えた場合、
リチウムは5つの水分子を
ナトリウムは4つの水分子を
カリウムは3つの水分子を
引き連れることができるとされています。この引き連れることのできる水分子の数を「水和数」と呼びます。
そうすると、イオン半径の序列と、水和した時の半径の序列は下図のように逆転します。その結果、イオン伝導度 (数字が大きいほどイオンが水溶液中で移動しやすいことを意味する) はリチウムイオンやナトリウムイオンに比べてカリウムイオンは大きくなるということになります。
以上のことから、水溶液中ではリチウムイオンやナトリウムイオンよりも「カリウムイオンの方がイオン伝導しやすい」 = 「電気抵抗が小さくなる」 ため、水酸化カリウムがアルカリ型燃料電池の電解液に利用されることになります。

終わりに
今日は自分の経験から、アルカリ型燃料電池の電解液に水酸化カリウム水溶液を使う理由を説明してきました。
意外と高校化学の教科書には理由がきちんと書かれておらず、暗記せざるを得ない部分がたくさんあります。
しかし、その背景には大学で習う化学の知識を使うと暗記しなくても論理的に考えることができるものがたくさんあります。
ぜひ高校生の皆さんは教科書を鵜呑みにせず、なぜ?と思ったら調べてみるようにしていただけると嬉しいです。そうすると、高校化学がより楽しくなるだけではなく、大学で学習する化学が待ち遠しくなると思います。
いいなと思ったら応援しよう!

