
有機化学演習-基本から大学院入試まで-6章解説
例題6・1
この命名問題で新しく出てきたポイントはありません。2 章または 3 章で復習してください。
例題6・2
例題 6・1 と同様です。
例題6・3
(a)Sn2 反応では遷移状態が 5 配位(教科書 p70)ということからもわかるように、化合物にアタックしてくる求核試薬と脱離基が反応の同じ段階で近い位置にあります。よって求核試薬は立体障害が少ない化合物に対して Sn2 反応を起こしやすいです。つまり第一級>第二級>第三級の順ですね。そして脱離基の脱離能ですが脱離基による電荷の安定化の程度が大きくなればなるほど遷移状態のエネルギーが低くなり反応がより早くなります。負電荷を安定化する基は塩基として弱いです。よってハロゲンやトシラートのような弱い塩基は優れた脱離基ですがOH⁻のような強い塩基は脱離基として劣っています。
Br より I のほうが大きな原子ですから負電荷を分散して安定化できます。よって I のほうが Br よりも脱離能が優れていることが理解できます。
(b)1-クロロヘキサンとクロロシクロヘキサンについては脱離基 Cl のついた炭素が第何級かで判断できるでしょう。ここでハロゲン化アリールとハロゲン化アルケニルの Sn2 反応に対する反応性を学ばなければいけません。この 2 つは Sn2 反応に対して不活性です。というのも攻撃してくる求核試薬が背面置換を行うためには C=C 結合の平面内で接近しなければいけません。この立体的要因により Sn2 反応に不活性であると考えられています。


ハロゲン化アルケニルの 3D 図をの載せました。2 枚目の方向から求核試薬はアタックしなければいけません。立体的にかなり難しいのが分かります。繰り返しですがSn2 は背面置換ですからもしハロゲン化アルケニルやハロゲン化アリールで反応が起こるなら二重結合の平面内(立体的に混んでいる)ほうから求核試薬がアタックします。上の図を見ればメチル基でも相当難しそうです。よってハロゲン化アリールとハロゲン化アルケニルは Sn2 反応に対して不活性です。
(c)解説にあるようにいずれも第一級ハロゲン化アルキルですが立体障害が異なります。立体障害が少ない順に Sn2 反応に対しての活性が高いです。
例題6・4
(a) Sn2 反応が 5 配位の遷移状態を経由するのに対しこちらの Sn1 反応は脱離基が脱離したカルボカチオンが反応の遷移状態となります。その後求核試薬がカルボカチオンにアタックするという反応機構です。よって反応に対する活性は中間体のカルボカチオンの安定性を比較すればわかります。カルボカチオンの安定性は第三級>第二級>第一級の順ですね。メチル基がつけばつくほどカチオンに対して電子を供与してくれますから安定となります。メチル基が電子供与基というのは 4 章でやりました。
(b)解説にある通りクロロベンゼンはフェニル基が電荷を分散するため反応活性が高いです。
(c)溶媒の極性が高ければ X を脱離基として C-X 結合の分極がさらに強くなります。分極が強くなるということはカルボカチオンになりやすくなります。ということは Sn1 反応の遷移状態であるカルボカチオンに至るまでの活性化エネルギーが小さいですから Sn1 反応が起きやすくなります。
例題6・5
よく出てくる反応ですから反応機構ごと覚えましょう。解説にすべて書いてあります。
例題6・6
Sn2 反応であることが分かれば反応速度が 1-ブロモプロパンと CN⁻ の濃度が重要になることが分かるはずです。
例題6・7
(a)置換反応が起こっていますから Sn1 もしくは Sn2 です。ハロゲン化アルキルが第三級ですからすぐに Sn1 だとわかると思います。
(b)置換ではなく脱離反応が起こっていますから E1 反応か E2 反応のどちらかです。答えは E2 反応で反応機構は解説にある通りです。E2反応については教科書 p72 を参照しましょう。Sn2反応と同様に中間体がない 1 段階で反応が起こります塩基が脱離基の隣の炭素からプロトンを引き抜くと C-H 結合が切れはじめ、C=C結合ができ始めます。そして脱離基が C-X の電子とともに脱離していく反応です。かさだかい(立体障害のある)強塩基は E2 反応というのを覚えておきましょう。
(c)第一級ハロゲン化アルキルの置換反応です。この時点で Sn2 だとわかるようにしておきましょう。
(d)強塩基存在下では E2 反応です。ナトリウムエトキシドは強塩基です。
(e)脱離反応なので E1 か E2 です。強塩基が存在しないので E1 です。ここで複数の反応が同時に起こることもあるということを覚えておいてください。本問ではSn1 反応と E1 反応が同時に起こっています。E1 だけが起こるわけではありません。また求核性というワードが出てきていますが塩基性との違いを明確にしましょう。塩基性というのはプロトンとの反応のしやすさで求核性というのは炭素に対しての反応性のことです。
例題6・8
(a)解説の通りです。OH⁻が優れた求核試薬というのは覚えておいてください。他にもナトリウムエトキシドは強塩基というようなものも出てくるたびに覚えましょう。Sn2 反応は脱離基の背面からの攻撃なので立体化学が変わりますね。
(b)臭化物イオンは求核性に優れるが塩基性が低いというのが非常に重要となります。臭化物イオンは負電荷を分散できるので塩基性が低くなります。塩基性とはプロトンとの反応のしやすさ、求核性とは炭素との反応のしやすさです。塩基性が低いということは脱離ではなく置換反応が優先です。あとは解説の通りです。
例題6・9
例題6・8 と全く同じ問題です。
例題6・10
E2 反応は通常アンチぺリプラナー形の配座から起こります。アンチぺリプラナーの形を以下に示します。
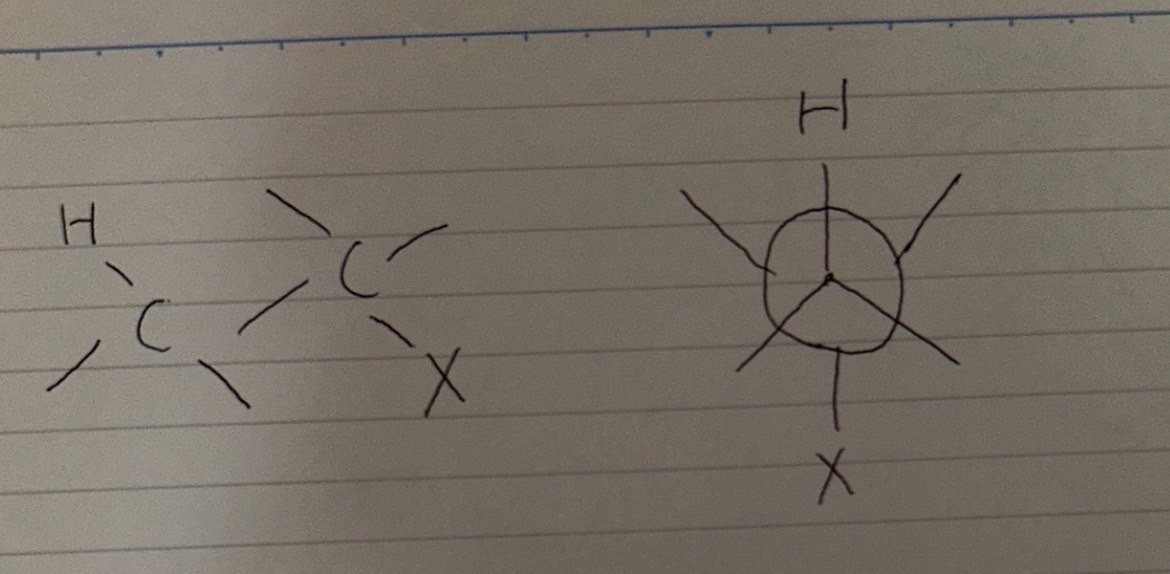
アンチぺリプラナー形では炭素上の置換基(図では H と X) が重なり合うことなくエネルギー的に安定となっています。アンチぺリプラナー形が特別なのはそれだけではありません。そもそも E2 反応では出発物におけるもともとの C-H 結合と C-X 結合の sp³ σ 軌道が重なり合って生成物であるアルケンの p π 軌道になる必要があるため、遷移状態においても部分的な重なりが必要です。これは E2 反応がすべての軌道がもともと同じ平面内にあるアンチぺリプラナー形の配座の場合に最も起こりやすいということです。
このことを踏まえるとこの問題が解けると思います。
例題 6・11
(a) 置換反応が起こっているので Sn1 か Sn2 で反応が起こるとわかります。実際には第三級カルボカチオンですから立体障害の観点的に Sn2 ではなく Sn1 で反応が起こるとわかります。 NaCN は弱塩基です。解説にあるように Sn1 の反応中間体のカルボカチオンは塩基性条件で存在できませんからこの反応は起こりません。
(b)解説の通り OH は脱離基として弱く、 Br⁻ は塩基として劣っています。よって反応は起こりません。脱離基の脱離能ですが脱離基による電荷の安定化の程度が大きくなればなるほど遷移状態のエネルギーが低くなり反応がより早くなります。負電荷を安定化する基は塩基として弱いです。よってハロゲンやトシラートのような弱い塩基は優れた脱離基ですがOH⁻のような強い塩基は脱離基として劣っています。
(c) Sn1 と E1 が競合しています。基本的には塩基があると脱離反応が起こりますが Br⁻ は塩基性が弱く求核性が強いです。復習ですが塩基性とはプロトンとの反応のしやすさ、求核性とは炭素との反応のしやすさです。
例題 6・12
Grignard 試薬以外は既出の反応なので省略します。ハロゲン化アルキルはエーテルや THF 中で金属マグネシウムと反応してハロゲン化アルキルマグネシウムを生成します。ハロゲンは Cl, Br, I のどれでもいいですが Cl は Br や I よりも反応性が劣ります。F はほとんどマグネシウムと反応しません。
形式的には Grignard 試薬は炭化水素酸 CH₃-H のマグネシウム塩 CH₃⁻⁺MgX でカルボアニオンです。
また Grignard 試薬は水と反応して分解されます。
6・1
省略
6・2
(a)第一級ハロゲン化アルキルと NaSH を反応させます。SH の部分は塩基性は弱く求核性が高いですから Sn2 反応が起こります。
(b)第一級ハロゲン化アルキルと二当量の HN(CH₂CH₃)₂ を反応させています。こちらも同じく N がローンペアを持ち求核性が高くなっています。よって Sn2 反応が起こって解答の通りになります。二当量あった HN(CH₂CH₃)₂ のうち一つは Sn2 反応に使われ、もう一当量は脱離した I とくっつきます。
(c) 第二級ハロゲン化アルキルと NaN₃ の反応です。 N₃ の部分は非常に求核性が高くなっています。第二級ハロゲン化アルキルですから Sn1 ではなく Sn2 反応が起こるのが自然でしょう。

(d)アンモニアは強塩基です。第三級ハロゲン化アルキルは普通 Sn1 もしくは E1 機構で進行するが強塩基存在下では E2 機構で反応が進行します。
(e) (d) で述べたように第三級ハロゲン化アルキルは普通 Sn1 もしくは E1 機構で進行するが強塩基存在下では E2 機構で反応が進行します。この問題の場合は水が強塩基ではありませんから Sn1 もしくは E1 で進行します。塩基として弱くローンペアを持ち求核性の高い水ですから Sn1 で反応が進行します。
(f)第三級ハロゲン化アルキルを水中で NaOH と反応させています。矢印の下にある化学種は溶媒です。水中で第三級ハロゲン化アルキルがですからカルボカチオンが生成します。その後 NaOH と反応して E1 脱離が起こります。
(g) (b) と同様の N 原子のローンペアによる Sn2 反応が起こります。
(h) I と CN が Sn2 反応により置換しています。立体化学の反転に注意しましょう。結合がわざわざくさび線や破線で書いてあるときは立体化学を考えろという出題者のメッセージを読み取れるようにしてください。
(i)分子内で Sn2 反応が起こります。脱離能の高い Br⁻ が脱離基で ローンペアを持ち求核性の高い OH⁻が求核試薬です。
(j) Sn2 反応が起こります。脱離能の高い Br⁻ が脱離基で ローンペアを持ち求核性の高い NH₂ が求核試薬です。
(k) KI の I が脱離基で S が求核試薬の Sn2 反応が起こっています。
6・3
(a) HBr の H によるヒドロキシ基のプロトン化が起こってから Sn2 反応が進行します。例題 6・11 (b) のように HBr ではなく NaBr だったらこの反応は進行しません。

(b) Cl⁻は求核性が低く (a) のように反応は起こりません。求核性は次の 3 つの傾向でまとめられます。
①同一原子では中性状態よりもアニオンのほうが求核性が大きい
②周期表の同一周期では右に行くほど求核性が低い
③同一族では講習気になるほど求核性が強い
(c)第二級アルコールに HBr を反応させています。(a) と同様にアルコールがプロトン化された後 Sn2 反応が起こります。
(d)第三級アルコールですから強塩基がない限り Sn1 か E1 が起こります。第三級なためカルボカチオンが生成しそこに Cl⁻がアタックする Sn1 で反応が進行します。
(e) (d) とハロゲンが変わっただけで同様です。
(f)こちらもまずアルコールがプロトン化されます。オキソ二ウムイオンが脱離してカルボカチオンが生成しますが HSO₄⁻ の求核性が低く置換反応は起こりません。強塩基がない限り Sn1 か E1 が起こる第三級アルコールで置換が起こらないということは E1 脱離が進行します。
(g) カルボカチオン転移がポイントになります。反応自体は Sn1 反応で進行します。
(h)こちらも転移を含む Sn1 反応です。
6・4
(a)暗記です。第三級アルコールから臭化物を合成する際には臭化水素、第一級アルコールと第二級アルコールから臭化物を合成する際には PBr₃ を使います。
(b)第三級アルコールから塩化物を合成する際には塩化水素、第一級アルコールと第二級アルコールから塩化物を合成する際には SOCl₂ を使います。
(c) E2 反応は強塩基で暗記しましょう。
(d)シアン化物を合成したいときは NaCN です。
(e) Grignard 試薬のトリッキーな使い方です。たまに院試本番でも出てくるので暗記しましょう。
(f)こちらも暗記しましょう。
6・5
(a)例題2・4 でもやったラジカル連鎖反応です。反応機構などはそちらにすべて書いてありますからそちらを参照してください。
(b) 4章で既出です。わからない人はよく復習してください。
6・6
第三級ハロゲン化アルキルは強塩基がなければ Sn1 か E1 で反応が進行します。この問題では 2 つの第三級ハロゲン化アルキルをエタノール中で加熱すると同一のカルボカチオンが生じます。よって同一の生成物が得られています。
6・7
Sn2 反応が起こると立体化学が反転します。長時間の Sn2 反応が起こった結果 R 体と S 体の割合がそれぞれ 50 % のラセミ体が生成します。
6・8
(1) Grignard試薬です。
(2) Grignard試薬の水との反応を思い出せばわかると思います。H ではなく D になっているので注意しましょう。
(3)~(5) 章末問題6・2 の (k) と同じです。出発物の左側にくさび線と破線がありますから光学活性の (3) の部分に該当するとわかります。(4) は残りのE2
反応が起こった部分です。(5) は強塩基による加水分解です。
6・9
(a), (6) 第一級ハロゲン化アルキルと強い求核試薬とのSn2 反応です。
(a), (7), (8) かさ高い塩基は E2 反応ですね。一方で Sn2 反応もおこります。
(a), (9) 第三級ハロゲン化アルキルとメタノールを反応させます。カルボカチオンが生成してからメタノールと反応する Sn1 反応が起こります。
(b)解説の通りです。
(c)解説の通りです。
6・10
わざわざ構造式にくさび線と破線が書いてあるということは作問者からの立体構造を考えろというメッセージです。立体的に混雑していないほうが反応は起こりやすくなります。
6・11
(a) 第二級ハロゲン化アルキルに強塩基、 (b) は第二級ハロゲン化アルキルかさ高い強塩基ですからどちらも E2 反応が起こります。アンチぺリプラナー形の配座だと E2 反応が進行しやすいのでした。詳しくは例題 6・10 を参照してください。
