
有機化学演習-基本から大学院入試まで-4章解説
例題 4・1
(a)二置換ベンゼンの命名ですが p40 1) にあるように置換基はアルファベット順に並べましょう。また p41 2) に慣用名を持つ一置換ベンゼンに第二の置換基がついたとみなせる化合物の場合はその慣用名の前に置換基名をつけて命名するとあります。この問題ではクロロベンゼンにブロモ基がついていると考えることもできますしブロモベンゼンにクロロ基がついていると考えることもできます。このような場合はアルファベット順に並べましょう。
(b)ニトロベンゼンにヒドロキシ基がついているのか、フェノールにニトロ基がついているのかの判断ですが母体が慣用名になっていると書くのも声に出して読むのも楽です。よってフェノールにニトロ基がついていると考えましょう。
(c)C₆H₅CN は慣用名でベンゾニトリルと呼ばれています。エチルベンゼンには慣用名がありませんからベンゾニトリルにエチル基がついていると考えましょう。
(d)三置換ベンゼンの命名問題です。この場合はブロモベンゼン、クロロベンゼンなど、どの一置換ベンゼンにも慣用名はありませんから置換基をアルファベット順に並べていきましょう。
(e)アミノ基がついたベンゼンはアニリンと呼ばれています。後はブロモ基とクロロ基をアルファベット順に並べましょう。
(f)解説にあるカルボキシ基とアミノ基の命名法における優先順位が高い、というのは覚えておいてください。よって母体は安息香酸となります。
(g) IUPAC 命名法において酸の優先順位が高いようです。よってベンゼンスルホン酸を母体として命名しましょう。
(h)ベンズアルデヒドに 3 つクロロ基がついていると考えて命名しましょう。
(i) 4 つの置換基がついています。唯一慣用名があるのはメチル基のついたトルエンです。トルエンから右回りに行けば置換基番号が小さくなります。置換基番号とアルファベット順は関係なかったことを思い出してください。
(j)カルボキシ基が 2 個ついているのでどうすればいいのか悩む方もいるかもしれませんが実はベンゼン環にカルボキシ基がついているものにはフタル酸という慣用名があります。CH₃O- はメトキシ基ですから解説の通りになります。
例題 4・2
ベンゼンをニトロ化するときには硝酸だけではなく硫酸も必要です。これを混酸と言います。その理由が解説にあるように硝酸をにトロニウムにするのにプロトン供与体の硫酸が必要だからです。原理はすべて書いてあるので反応機構の巻き矢印だけ示します。

またエネルギー図を見るとベンゼン環への求電子反応は旧エルゴン的で活性化エネルギーが高いことが分かります。実際にこの反応はかなり遅い反応です。しかし最終的に置換反応が起こることによって芳香環の安定性が保持され反応は発エルゴン的になります。
例題 4・3
芳香族求電子置換反応は p42 a にもあるように強力な求電子試薬 E⁺ がベンゼンに付加してカルボカチオン中間体を生成します。そのカルボカチオン中間体からプロトンが塩基に引き抜かれて脱離してこの芳香族求電子置換反応は完結します。では例えば Br₂ で臭素化したいと思ったときに Br₂ だけでは求電子試薬となりません。他に触媒が必要です。ニトロ化の時もそうでしたが基本的には芳香族求電子置換反応には触媒が必要となります。一問ずつ見ていきましょう。
(a)臭素化の場合は Br₂ と FeBr₃ が必要になります。まずこの二つが結合を作って正に分極した Br⁺ が出来上がります。次にベンゼンの二重結合(電子豊富)が正に分極した臭素を攻撃し新しく炭素臭素結合を形成しカルボカチオン中間体が生成します。次に塩基がカルボカチオン中間体から水素を奪って反応が完結します。

(b)フリーデルクラフツ反応と呼ばれる反応です。芳香族化合物を塩化アルミニウム存在下で塩化アルキルと反応させます。塩化アルミニウムと塩化アルキルから求電子試薬のカルボカチオンが生成し、そのカルボカチオン(電子不足)が芳香環の二重結合(電子豊富)に攻撃され新しいカルボカチオン中間体が生成します。その後プロトンが延期によって引き抜かれ反応が完結します。

このフリーデルクラフツ反応にはいくつかの制約があるので以下に示します。
①ハロゲン化アルキルしか使えない。ハロゲン化アリールやハロゲン化ビニルは反応しない。
②強い電子吸引基がベンゼン環についていると反応しない。
③一置換で反応を止められない。
④アルキルカルボカチオンの骨格転移が起きる。(ヒドリド移動、カルボカチオン転移)
(c)こちらは反応機構は同じですがフリーデルクラフツアシル化反応と言われるものです。上記②の制約はありますが他にはありません。生成物のアシルベンゼンが常にアシル化されていない出発物より反応性が劣るので一置換で反応が止まります。またアシルカチオンは炭素の空軌道と隣の酸素の非共有電子対の軌道との相互作用により安定化されているためにカルボカチオン転移が起きません。
例題 4・4
解説参照。頻出問題ですし期末テストなどで目にしたことがあるはずです。反応中間体の構造式をすべて書けるようになりましょう。書いて覚えてください。クロロベンゼンなどのハロゲンに置換された芳香環ががオルト体、パラ体を作るのも同じ反応機構を書けば理解できます。
例題 4・5
前問同様に頻出問題ですから書いて覚えましょう。またこの問題と同様に考えられるのがベンズアルデヒドです。ニトロ基もそうですが電気陰性度の大きな酸素に電子を持っていかれますから正電荷が反発しあって不安定になります。
例題 4・6
例題 4・4 と例題 4・5 が関係していきます。これらの問題のように反応中間体を書いていくと、どの置換基がついていると次につく置換基がどこの位置につくかが予測できます。
もう一つ考えなければいけない要素が活性化と不活性化です。求電子置換反応の反応機構を考えると芳香環が電子豊富であればあるほど反応に対する活性が高いです。よって非共有電子対を持つような電子供与基だと求電子置換反応を活性化させ、電子吸引基は求電子置換反応に対する活性を弱めます。それを表した表を以下に示します。

この置換基の性質といくつかの規則に従いこの問題を解いていきます。
規則①: 2 つの置換基の配向性が互いに強め合うならそれに従う。
規則②:2 つの置換基の配向性が互いに相反していたらより強力な活性化基の影響が強い。
規則③:メタ二置換化合物は立体障害が強いのでその間で置換が起こらない。
具体的に問題を解きながら見ていきます。
(a)フリーデルクラフツアシル化反応です。オルトパラ配向性活性化基のメチル基が芳香環に 2 個ついています。ということは 1 の位置についたメチル基は 2, 4, 6 の位置にアシル基を導入するように働きます。そして 3 の位置についたメチル基は 2,4, 6 の位置にアシル基を導入するように働きます。ここまでだと規則①より 2 の位置にアシル基が導入されそうですが規則③にあるように立体障害のせいで 2 には置換基が導入されません。よって 4,6 にアシル基が導入されますがどちらでも同じですから答えの通りになります。
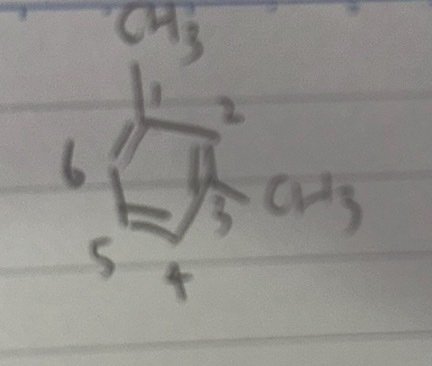
(b)スルホン化です。クロロ基はオルトパラ配向性ですから 4, 6 の位置にスルホ基を導入しようとします。一方のニトロ基はメタ配向性ですからこちらも 4, 6 の位置にスルホ基を導入しようとします。6 の位置は立体的に込み合っていますから 4 にスルホ基が導入されます。


上の図を見ると 6 の位置は立体的にかなり込み合っていることが分かります。
スルホン化の反応機構は以下の通り

(c)ニトロ基もカルボキシ基もメタ配向性です。規則①より解答は納得できるはずです。
(d)メチル基もヒドロキシ基もどちらもオルトパラ配向性ですがどちらが優先するのでしょうか。下の図を見るとヒドロキシ基のほうが共鳴構造が多いです。よってヒドロキシ基の配向性が優先します。

(e) (d) と同じです。NHCOCH₃ もヒドロキシ基と同様にローンペアを持つオルトパラ配向性の活性化基です。よってメチル基よりも配向性に与える影響が大きくなります。
(f)ハロゲンは不活性化基ですがオルトパラ配向性を持つ珍しい置換基です。なぜこのようになっているかというとハロゲンはベンゼン環上の電子を引き付けてベンゼンの求電子置換反応を妨げる誘起効果と共鳴構造による安定化でベンゼンの求電子置換反応を促進させる効果を持つためです。そして共鳴効果のほうが誘起効果より強いためメチル基のオルトパラ配向性よりもハロゲンのオルトパラ配向性に従っています。
例題 4・7
解説参照。逆から考えていきましょう。
例題 4・8
例題 4・3 (b) 規則④で解説しました。より安定なカルボカチオンが生成するカルボカチオン転移が起こります。(ヒドリド移動が起こる可能性もあります。)
例題 4・9
液体アンモニアというワードを見ただけでバーチ還元を疑えるようにしておきましょう。ナトリウムではなくLiの場合もあります。反応機構については解説を参照してください。アニオンラジカル→ラジカル→カルボアニオンの順番に生成します。
4・1
省略
4・2
省略
4・3
例題4・4 と同じです。共鳴構造を書けるようにしておきましょう。
4・4
こちらも前問と同様に共鳴構造を書けるようにしましょう。
4・5
(a)酸無水物のフリーデルクラフツアシル化反応です。酸ハロゲン化物RCOX だとすぐにフリーデルクラフツだとわかるでしょうが、酸無水物だと一見分かりにくいですね。ただ反応機構自体は全く一緒です。酸無水物も酸ハロゲン化物もカチオンとなる炭素についているのは電気陰性度の大きな原子ですし四塩化アルミニウムがルイス酸として機能します。

(b)アルケンにプロトンが付加してカチオンが生成します。その後は通常通り芳香族求電子置換反応が進行します。

(c)例題 4・8 でやったようにカルボカチオン転移に注意が必要です。
(d)芳香族の塩素化です。メチル基が 2 つついています。メチル基はオルトパラ配向性でしたがオルト位は立体障害があり置換が難しそうです。反応が起こらないわけではありませんが問題で主生成物を問われていますからパラ置換体を書きましょう。
(e)こちらも位置選択の問題です。芳香環自体を置換基として考えます。芳香環は電子供与性のオルトパラ配向性ですね。
(f)この問題は右のベンゼン環で置換が起こると思った人も多いでしょう。しかし解説にあるようにより活性化された芳香環で置換が起こります。ブロモ基がオルトパラ配向性の不活性化基、ベンゼン環がオルトパラ配向性の活性化基であることを考えると左のベンゼン環がより反応に対して活性化されています。よって解答の通りになります。
(g)フリーデルクラフツアシル化反応です。そしてすでについているメチル基とイソプロピル基のどちらもオルトパラ配向性の活性化基です。この場合は立体障害を考えましょう。当然イソプロピル基のほうがメチル基よりも立体障害が大きいです。立体障害が大きい基の近くには近づきにくいですからメチル基のオルト位にアシル基が導入されます。
(h)ヒドロキシ基はオルトパラ配向性の活性化基です。そこに過剰の臭素を加えていますから 2 つのオルト位と 1 つのパラ位に臭素が導入されます。
(i)ニトロ基もカルボキシ基もメタ配向性の不活性化基です。例題 4・5 を参照してほしいのですがニトロ基もカルボキシ基も例題 4 ・5 にある理由でメタ配向性の不活性化基となります。ニトロ基のNのほうがカルボキシ基の炭素原子よりも電気陰性度が強くより電子を引き付けます。そうなると正電荷の反発が強くなり不安定になりますからニトロ基のほうがより芳香環を芳香族求電子置換反応に対して不活性化させます。よってニトロ基のメタ位に置換基が導入されます。
(j)こちらも(f) と同様により芳香族求電子置換反応に活性なベンゼン上で反応が起こります。芳香族求電子置換はベンゼンの電子(マイナス)が求電子試薬(プラス)を捕まえるのでした。つまりベンゼン環上に電子が多いほうが活性です。左のベンゼン環についているのは炭素原子、右のベンゼン環についているのは非共有電子対を持つ酸素ですから右のベンゼン環のほうが活性ですね。
(k)解説にあるように活性化基と不活性化基があった場合活性化基の配向性に従います。
(l)分子内でフリーデルクラフツ反応が起こっています。

4・6
例題4・6 (b) 参照
4・7
(a)アルキル側鎖は KMnO₄ によりカルボキシ基へと酸化されます。 反応の結果としてはアルキルベンゼンの安息香酸への変換 Ar-R→ Ar-COOH です。反応機構は芳香環の隣の位置で炭素水素結合が反応し中間体のベンジル型ラジカルを生成すると考えられています。よってベンジル位に水素を持たないtert-ブチルベンゼンは KMnO₄ による酸化に対して不活性です。
(b) (a) 参照。
(c)芳香環の接触水素化です。芳香環の水素化には数百気圧の水素で通常の白金触媒または炭素上のロジウムなどのような強力な触媒が必要です。H₂/Pd が出てきたら芳香環の接触水素化で間違いないでしょう。反応の結果は芳香環が還元されます。
(d)バーチ還元です。例題 4・9 でもやりました。環のどこに二重結合を書くかですが教科書解答の通りに書かなければ不正解です。その理由はバーチ還元の反応機構が分かっていれば理解できます。例題 4・9 でもやったようにアニオンラジカル、ラジカル、アニオンの順に生成していきます。アニオンラジカルが発生するときの構造を考えてほしいのですが電子供与基のCH₃O-がアニオン部分に立っていると電子密度が大きくなり非常に不安定です。よって解答のようになります。
(e)こちらもバーチ還元ですが今度の置換基は電子吸引基です。よってこの置換基がアニオン部分に立っているほうが安定となりますね。よって教科書の解答の通りになります。
(f)芳香環は関係ありません。アルケンへの求電子付加反応です。二重結合の右と左どちらに書いてもいいわけではありません。左側に塩素がつくとかんがえて反応機構を書くとベンゼン環の二重結合を利用してより多くの共鳴構造を書くことができます。共鳴中間体が多いと安定ですから塩素を二重結合の左につけましょう。
(g)NBS のベンジル位臭素化です。まずベンジル位の臭素が引き抜かれて中間体のベンジル型ラジカルが生成します。その後に臭素ラジカルが発生しラジカル連鎖反応が進行します。
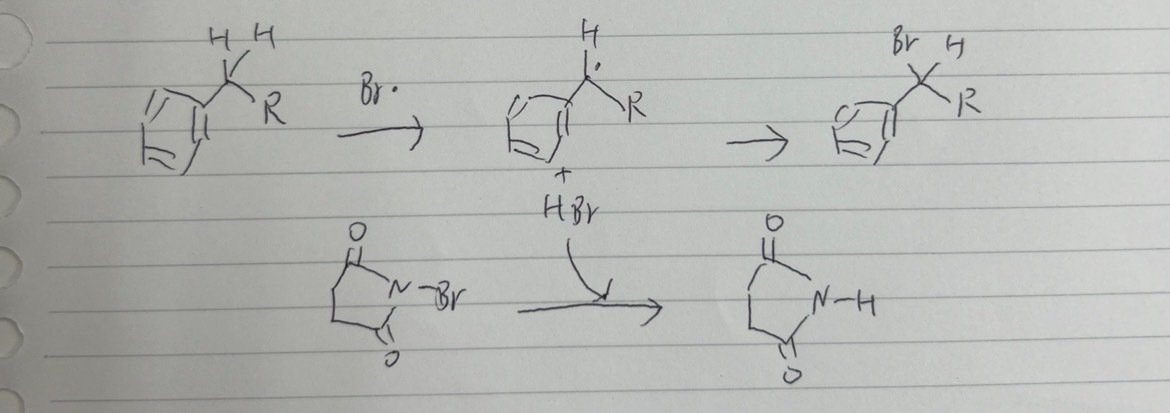
4・8
逆合成の問題です。まず化合物名を見て構造を書けるようにしておかなければいけません。それから各置換基の配向性も暗記していないと解けません。逆にこの 2 つさえ覚えていれば分かる問題だと思います。例題 4・6 で各置換基の配向性をまとめていますからそちらを参照してください。
4・9
解説参照。
4・10
解説参照。反応が可逆ということは最も熱力学的に安定な構造へと変化していくことは大丈夫だと思います。
4・11
(a)解説参照。
(b), (c)解説参照。ほとんどのことは解説に書いてありますがベンザインが院試に頻出なので解説します。ブロモベンゼンに液体アンモニア中でカリウムアミドを反応させると次のようにアニリンが得られます。

しかし臭素がついていないところにもアミドが導入されているのです。この謎を解くのがベンザインです。この謎は反応がベンザインを経由したと考えると理解することができます。塩基が芳香環上の水素に攻撃し、そのC-H 結合が追い出されて芳香環の二重結合上に倒れます。そして臭素が追い出されるという反応機構です。ここで塩基が OH 以外にも NaNH₂, KNH₂ と種類があります。これらの塩基を見たらベンザインだと思えるようにしておいてください。
4・12
ある化合物が芳香族性を示すかどうかを判断するにはヒュッケル則 ( 4n+2 則)を知らなければいけません。これは分子が平面の単環状共役系で全部で 4n+2 個のπ電子を持つとき化合物は芳香族となる。というものです。逆にこれを満たさないものは芳香族ではありません。さまざまなシチュエーションでの電子の数え方を載せました。参考にしてください。〇がついてたらヒュッケル則を満たすため芳香族、×がついていたら芳香族ではありません。またイミダゾールの右上の窒素ですがこの非共有電子対は平面上にはありません。平面上に存在し環状 p 共役を形成するのは 1 つです。

(a)それぞれがヒュッケル則を満たすか満たさないかで芳香族かそうでないかが決まります。
(b)(a) 同様です。
(c)解説参照。京目中間体が多ければ多いほどその反応で反応が進行します。
(d)解説参照。
(e)解説参照。
