有機化学演習-基本から大学院入試まで-3章解説
例題 3・1
(a) p 23 にあるように炭素数 4 以上の直鎖アルケンでは二重結合に近い末端から炭素鎖に番号を振り、最初の二重結合炭素の番号を、その二重結合の位置番号として名称の前に置きます。
ブテンの右端、左端のどちらから数えても二重結合の位置は 2 番目です。よってその 2 という番号を二重結合の位置番号としてブテンという化合物の名称の前に置きます。ここまでで 2-ブテンとなります。
そしてメチル基がついていますからそれも名前に含まなければいけません。ブテンは対称性を持ちますからどちらが 2 でどちらが 3 か決めていませんでした。そこはどちらでも構わないのでどうせなら置換基の番号も小さくなるように名前を付けます。つまりメチル基のついた二重結合炭素を 2 とするのです。よって答えの通り 2-メチル-2-ブテンとなります。
(b)まず母体となる炭素鎖を決定します。しかし 2 章のようにただ一番長い炭素鎖を選べばいいというわけではありません。二重結合を含む最も長い炭素鎖を母体とします。
その次に二重結合の位置番号付けです。この二重結合の番号もなるべく小さくなるように付けていきます。母体が末端に二重結合を持ちますから末端から番号を付け始めれば二重結合の位置番号を1, 4 とすることができますね。
この二重結合の位置番号を化合物の前に置きます。倍数接頭辞も忘れずにつけると1,4-ヘキサジエン となります。
最後に置換基について考慮します。母体の位置番号 2 の炭素にエチル基が、位置番号 5 の炭素にメチル基がついています。よって答えの通り 2-エチル-5-メチル-1,4-ヘキサジエンとなります。
(c)母体が二重結合を有するシクロペンタンです。二重結合の位置番号がまず優先です。シクロペンテンは対称性をもつのでどちらから番号をつけても大丈夫です。よって置換基の位置番号が小さくなるように炭素番号を決めましょう。二重結合の左から数えると置換基番号は2,3です。右から数えると1,5 となるので後者のほうで番号付けを行います。
(d)
母体はシクロヘキサジエンです。二重結合番号に関しては右から数えても左から数えても番号は1,3 です。よって置換基の番号付けが小さくなるようにしましょう。左から数えるといいですね。よって答えの通り2,5-ジメチル1,3-シクロヘキサジエンとなります。
(e)母体の鎖はすぐにわかります。重要なのは番号付けです。置換基よりも多重結合の番号が小さくなるのが優先です。よって左から炭素に番号をつけていきます。すると解説の通り 4-メチル-2ペンチンです。
(f)母体の右端と左端どちらから数えても二重結合の番号は1,5 です。よって置換基であるエチル基の位置番号が小さくなるように左端から番号付けしましょう。答えは3-エチル-1,5-ヘキサジインとなります。
(g) p23 にもありますが二重結合と三重結合が共存する場合はアルケンインとして命名します。二重結合と三重結合に関係なく多重結合の位置番号の組み合わせが小さくなるように主鎖に番号を振る。どちらの末端から数えても同じ位置番号の組み合わせになる場合には二重結合に小さい番号を振ります。
問題となっている化合物の右端から数えると多重結合の番号が1,3 で左端から数えると2,4 です。よって前者の数え方が正解です。答えはアルケンインとして命名しますから 3-ペンテン-1-イン です。
(h)アルケンインの末端から数えても同じ位置番号の組み合わせになる場合には二重結合に小さい番号を振ります。
(i)二重結合を置換基として考えなければいけないときにどう対処するかの問題です。
(j)二重結合を含む置換基の名前を憶えておきましょう。
例題 3・2
例題 3・1 でやった通常の命名に加えて E,Z の要素も加わった問題です。 E は二重結合の置換基が二重結合に関して反対側にあるもの、 Z がその逆です。
(a)カンインゴールドプレローグ則 ( p24 参照 )より最も順位の高いクロロ基とエチル基が二重結合に関して同じ側にあります、よってこの化合物は Z 体です。次に母体の二重結合の位置番号を決定します。母体の左から数えるより右から数えたほうが二重結合の位置番号が小さくなりますね。よって母体の右端から炭素番号をつけていきます。すると答えは解説のようになります。
(b)二重結合を含む置換基のカンインゴールドプレローグ則を正しく理解しているでしょうか。そのことをこの問題で問われています。解説に詳しく書いてあるのでそちらを参照してください。ここでは省略します。順位付けが決まったら E か Z です。明らかに化合物の二重結合に関して置換基が反対側にあります。よって解答の通りになります。
(c)二重結合が 2 つあるため E か Z の判断を 2 回する必要があります。カンインゴールドプレローグ則より判断してください。後の命名は基本通りです。E とZ の部分の表記は解説の通りです。
(d)解説参照。 E,Z は二重結合に関するシストランス異性体でのものなので環構造には用いられない概念です。
例題 3・3
反応機構は解説参照。アルケンの二重結合は単結合に比べ電子密度が高くなっています。また二重結合の π 結合の電子は二重結合の平面の上下に存在するため分子外の試薬に対して接近可能であり、求核試薬と言えます。。HCl についてですが強い酸ですから強力なプロトン供与体であり求電子試薬と言えます。つまりこの反応は求核試薬であるアルケンと求電子試薬である HCl が反応していることが分かります。プラスとマイナスがくっつく、有機化学の大原則です。
次にカルボカチオンはそれ自体が正電荷を持つ求電子試薬です。さらに Cl⁻ は負電荷をもつ求核試薬ですからここでもプラスとマイナスがくっつくことが分かります。
注:カルボカチオンの安定性についてですが誘起効果で説明されます。正に荷電した炭素にアルキル基がついていればいるほどアルキル基から中心炭素へ電子が流れ込みカルボカチオンは安定となります。よってカルボカチオンは第三級>第二級>第一級の順に安定です。この問題では第二級から第三級へのカルボカチオン転移が起こっています。
例題 3・4
(a) 例題3・3 と同様です。この反応はマルコフニコフ則に従うことが分かります。その理由はカルボカチオンの安定性です。二重結合がプロトンと反応すると第一級カルボカチオンか第二級カルボカチオンが反応中間体として考えられます。後者のほうが安定なので後者の反応中間体を経由して反応が進行します。その結果この反応はマルコフニコフ則に従うことになります。

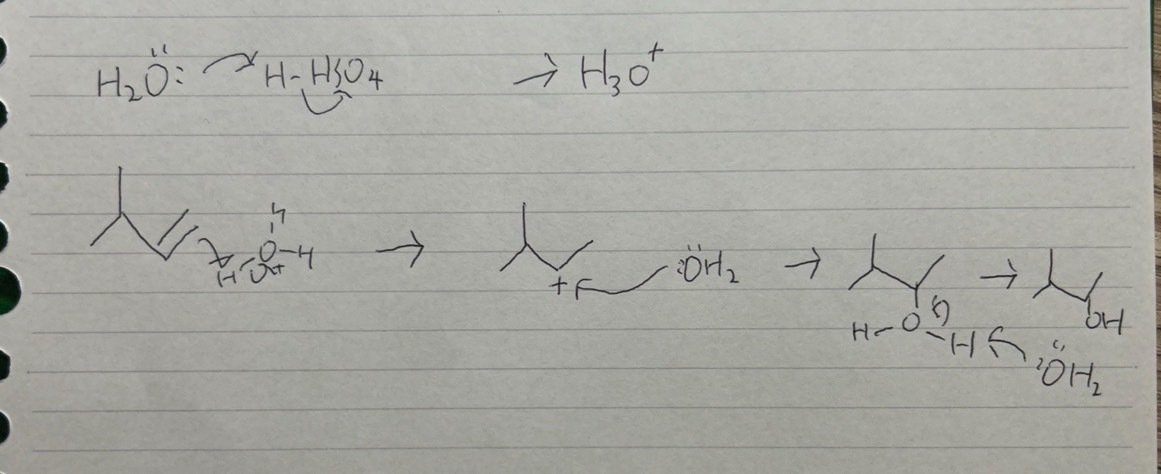
(b)硫酸の役割は水のプロトン化です。まず水が硫酸によりプロトン化されてオキソ二ウムイオンになります。アルケンの二重結合は求核的でした。その二重結合が求電子試薬のオキソ二ウムイオンのプロトンと反応します。ここで先ほどと同様により安定なカルボカチオンが選択的に生成します。そこに水がアタックした後プロトンが脱離し解答のようになります。
(c)この反応は先ほどまでと違いカルボカチオン中間体を経由しません。反応機構を図に示します。立体的に混雑していない方向から BH₃ がアルケンの二重結合に対してアタックすることが分かります。

全体の反応結果としてはシンの立体化学で逆マルコフニコフ的にヒドロキシ基が二重結合に付加することとなります。
(d)オゾン分解です。四置換二重結合をもった(二重結合に水素がついていない)アルケンをオゾン分解すると二つのケトンが生成し産地間二重結合を持ったアルケンをオゾン分解するとケトンとアルデヒドが生じます。反応中間体のオゾニドの名前は問われることがあります。覚えておきましょう。

(e) m-クロロ過安息香酸は mCPBA と言われます。これは COOOH の構造をもつ過酸の一種です。アルケンと過酸の反応機構は以下の通りです。生成するC-O-C の環構造はエポキシドと呼ばれます。この名前も院試に頻出です。反応はシンの立体化学で進行します。

(f) 1,4 付加の問題です。炭素の番号 1 と 4 の部分に水素と塩素が付加しています。はじめは電子に富んだアルケンの二重結合とプロトンが反応します。例題 3・3 と同様です。
(A) では左端に水素がついています。ここを 1 位としましょう。一方で(B) のほうは 4 位に水素がついています。両者の共鳴構造を書いて比較するとカチオンの安定性が違いますね。よって (A) が (B) に優先して生成します。ここで 1,2 付加ではなくて 1,4 付加が進行する理由ですが速度的には 1,2 付加が優先しますが十分に反応時間があれば熱力学的に安定な 1,4 付加が進行します。
(g) 典型的な Diels-Alder 反応です。 12 章のペリ環状反応で詳しく解説します。
例題 3・5
四塩化炭素が不活性溶媒で反応に関与しないことは覚えておいてください。そして二重結合にハロゲンを反応させた場合の反応機構は解説の通りです。アンチの立体化学で反応が進行することと、反応中間体はハロ二ウムイオンと呼ばれることを覚えておきましょう。この問題ではブロ二ウムイオン中間体です。
一方メタノールは求核性を持ちますから臭化物イオンに優先してブロ二ウムイオン中間体と反応します。求核剤の原子が周期表の右のほうへ行くと求核性が小さくなることは 1章の章末問題 1・10 でやりました。
例題 3・6
(a)例題 3・5 と同様にハロ二ウムイオン中間体を経由してアンチの立体化学で塩化物イオンが三重結合に付加します。それと同じことがもう一度起こって 2,2,3,3-テトラクロロブタンが生成します。
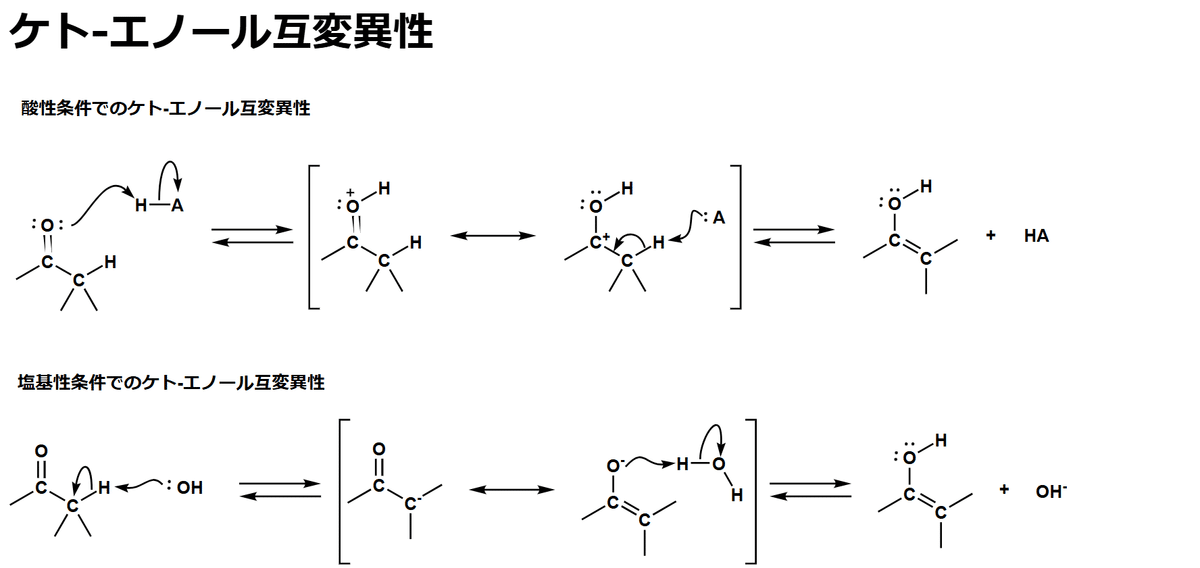
(b) 例題 3・4 の (b) と同じ反応が起こります。もう一度自分で手を動かして反応機構を書いてみましょう。マルコフニコフ則に従い二重結合に水が深しエノールが生成します。エノール体はケト体と平衡状態にありケト体のほうが安定です。よってエノールからケト体へと変異します。
酸性条件と塩基性条件で反応機構が違います。この後の章でも出てくるので今のうちに書けるようにしておいてください。
(c)末端アルキンはかなりの酸性です。よってナトリウムアミドのような強い塩基と反応させると末端の水素が引き抜かれてアセチリドアニオンが生成します。その後はそのアセチリドアニオンがハロゲン化アルキルと後にでてくる SN₂ 反応で反応が進行しアルキル化が起こります。
末端アルキンが酸性な理由ですがアルキンからプロトンのとれた炭素は負電荷を生じます。またその炭素は sp 混成です。 s 軌道は正電荷を持つ原子核の近くに存在しており電荷的な観点から安定です。sp 混成ということは末端アルキンの末端炭素は 50 % の s 性を持ちますからプロトンのとれた形のアセチリドアニオンはエネルギー的にも安定です。これが末端アルキンが酸性な理由です。
(d)パラジウム触媒などを用いるとアルキンがアルカンへと還元されてしまいますがこの Lindlar 触媒を用いるとアルケンで還元反応をストップできます。またこの還元はシス型の生成物を与えます。これとは別にトランス型の生成物を与える還元試薬があるので注意しましょう。
3・1
(a)母体はすぐにわかると思います。二重結合番号が置換基の番号に優先するように生成します。母体の左側から数えると二重結合番号が 2 で右から数えると 4 ですから炭素の番号付けは左側から行います。
(b) (a) とほぼ同様の問題です。異なる置換基がついているときは置換基をアルファベット順にならべます。
(c)母体の二重結合の番号を決めたいですが母体は対称性を持ちます。よって教科書二重結合部分の上と下どちらから数えても大丈夫です。しかし置換基がついているので置換基の番号がなるべく小さくなるように付けなければいけません。 Cl を 1 として時計回りに番号をつけていきます。反時計回りに回したほうが Br の番号が小さくなると思う方もいらっしゃるかもしれませんがそれは違います。二重結合の番号を 1 としたら 1,2 の部分に、二重結合の部分を 3 としたら 3,4 の部分に二重結合がなければいけません。
(d)右端から数えると二重結合番号が小さくなりますから母体の右端から二重結合番号を数えていきます。二重結合の番号を小さくすることは置換基の番号を小さくするのに優先します。そして置換基をアルファベット順に並べて次に母体の名前を書きます。
(e) (d) と同様です。
(f)母体が対称性をもっていることから二重結合番号はどちらから数えても一緒です。よって置換基の番号が小さくなるように番号付けしましょう。ここでメチル基とイソプロピル基のどちらから数えても番号が一緒ですね。こういう時は置換基のアルファベット順に番号付けを行います。
(g)二重結合を含む置換基の名称は既出です。
(h)アルケンインの命名は例題でもやっています。どちらの末端にも多重結合がありますがこういう時は二重結合を優先します。
(i)末端の多重結合から番号をつけていくと番号付けが小さくなりますね。
(j)一見難しそうですが (f) とほぼ同じです。炭素数が増えて二重結合が三重結合になっただけです。一番置換基の番号付けが小さくなるように番号を振っていきます。教科書図の下の三重結合の左側から反時計回りです。(c) と同様に三重結合の番号を 1 としたら 1,2 の部分に、三重結合の部分を 3 としたら 3,4 の部分に三重結合がなければいけません。数え方はくれぐれも注意してください。
(k)三重結合を含む置換基の名前も書けるように覚えておきましょう。
3・2
命名は難しいと思う人が多いでしょう。しかしこちらは簡単だと思いますので省略します。
3・3
詳しく書かれているので解説を参照してください。ちゃんと読めば理解できるはずです。わからなければ連絡していただいて結構です。
3・4
(a)アルケンへの塩化水素の求電子付加反応です。マルコフニコフ則に従って反応が進行します。例題 3・4 (a) で反応機構を解説しています。
(b)例題 3・4 (b) 参照。
(c)例題 3・5 の溶媒が四塩化炭素の時の反応と同じ反応機構で進行します。この時の反応中間体がブロ二ウムイオンと呼ばれることは覚えておきましょう。例題 3・5 を参照してください。
(d)ヒドロホウ素化反応です。この反応は逆マルコフニコフ則に水が付加したアルコールが生成します。その理由は例題 3・4 (c) を参照してください。
(e)オゾン分解です。反応中間体の名前はオゾニドでしたね。例題 3・4 (d) を参照です。
(f)オキシ水銀化と言われる反応です。中間体のマーキュリ二ウムイオンという名前を覚えておいてください。

水銀イオンの求電子付加がマーキュリ二ウムイオンを与えます。これが水と反応しプロトンが取れて有機水銀生成物となり水素化ホウ素ナトリウムが水銀を取り除きます。反応の結果はマルコフニコフ則に従います。
3・5
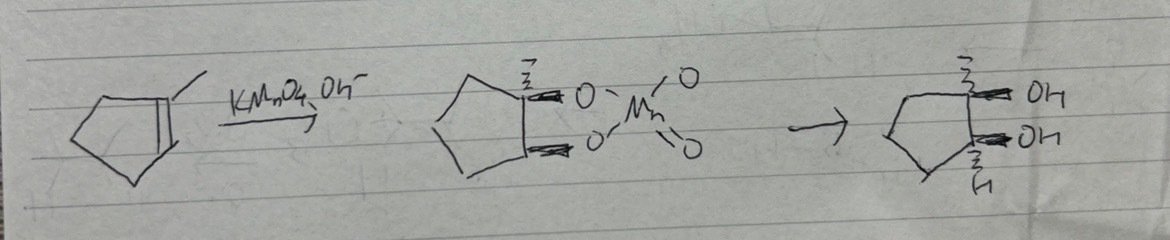
(a)アルカリ性というのがこの問題のポイントです。中性だとアルケンが開裂してケトンが生成します。アルカリ性で過マンガン酸カリウムをアルケンに反応させるとヒドロキシ基が付きます。エステル中間体の構造からシンだとわかります。
(b)白金触媒存在下でアルケンに水素を反応させるとアルケンが還元されます。アルケンが白金に担持された水素に近づくと還元されます。反応はシンです。
(c)ヒドロホウ素化です。例題 3・4 (c) を参照してください。これもシン付加です。あくまでも水素とヒドロキシ基がシン付加しています。
(d)例題 3・4 (e) を参照してください。こちらもシン付加でした。
(e)例題 3・5 を参照してください。ブロ二ウムイオン中間体が生成した後に立体的に混雑していない面から求核試薬がアタックします。よってアンチ付加です。
3・6
(a)例題 3・4 (f) を参照してください。
(b)例題 3・4 (f) と同じです。直鎖構造から環構造になっただけです。

(c),(d) diels-alder 反応です。 12 章で解説するのでここでは割愛します。
1,3-ブタジエンの表記の仕方が (d) になっていてもdiels-alder 反応だと気づけるようになってください。
3・7
(c) 以外は既出の反応です。アルケンがアルキンになっただけです。(c) も3・10 でやるのでそちらを参照してください。
3・8
(a)ケトエノール互変異性でエノールからケト体へと変異します。他は各自(d)はアンチ付加などポイントを押さえてください。すでに解説済みです。
3・9
逆合成の問題です。反応段階は 1 段階ですからそこまで難しくありません。ある反応の概要(例えばヒドロホウ素化はアルケンに逆マルコフニコフ型でヒドロキシがつく。)を覚えておけば分かると思います。
(a) を見ればヒドロキシ基がアルケンにマルコフニコフ型で付加していることが分かります。オキシ水銀化や酸性での水との反応など複数の答えがあるとわかります。
英単語の暗記に似ています。英語を見たら日本語に、日本語を見ても英単語にできるようにする感じで反応の概略と反応図もどちらかを見たらどちらかが出てくるまで暗記してください。
3・10
解説にすべて書いてあります。
この記事が気に入ったらサポートをしてみませんか?
