
経口小分子Lipoprotein(a)(Lp(a))阻害薬Muvalaplin
臨床的意義の確立まではまだまだ、忍容性が高いことは確かめられた
Nicholls, Stephen J., Wei Ni, Grace M. Rhodes, Steven E. Nissen, Ann Marie Navar, Laura F. Michael, Axel HauptとJohn H. Krege. 「Oral Muvalaplin for Lowering of Lipoprotein(a): A Randomized Clinical Trial」. JAMA, 2024年11月18日. https://doi.org/10.1001/jama.2024.24017.
重要なポイント
質問
経口小分子Lipoprotein(a)(Lp(a))阻害薬であるMuvalaplinは、心血管イベントのリスクが高い高Lp(a)濃度患者のLp(a)レベルを低下させることができるか?
結果
第2相試験において、175 nmol/L以上のLp(a)濃度を有する心血管疾患、糖尿病、または家族性高コレステロール血症の患者が、プラセボまたはMuvalaplin(10 mg/日、60 mg/日、240 mg/日のいずれか)を12週間投与されるようランダム化された。
Muvalaplinは、Lp(a)粒子アッセイで最大85.8%、アポリポプロテイン(a)アッセイで最大70.0%のプラセボ調整後のLp(a)減少を示した。安全性や忍容性に関する懸念は認められなかった。
意義
Muvalaplinは忍容性が高く、心血管イベントのリスクが高い患者のLp(a)レベルを大幅に低下させた。心血管イベントへの影響についてはさらなる調査が必要である。
概要
重要性
MuvalaplinはLp(a)形成を阻害する。14日間の第1相試験では、忍容性が高く、最大65%のLp(a)低下が示された。高心血管リスク患者への長期投与による影響は未解明である。
目的
MuvalaplinがLp(a)レベルに与える影響を評価し、安全性と忍容性を検証すること。
デザイン・設定・参加者
第2相試験(プラセボ対照、ランダム化、二重盲検試験)。2022年12月10日から2023年11月22日まで、アジア、ヨーロッパ、オーストラリア、ブラジル、アメリカの43施設で実施。動脈硬化性心血管疾患、糖尿病、または家族性高コレステロール血症を有する175 nmol/L以上のLp(a)濃度を持つ233名が対象。
介入
参加者はMuvalaplin(10 mg/日(n=34)、60 mg/日(n=64)、240 mg/日(n=68))またはプラセボ(n=67)を12週間経口投与された。
主な評価項目
主要評価項目は、12週目におけるLp(a)モル濃度のベースラインからのプラセボ調整後変化率。Lp(a)粒子アッセイおよび従来のアポリポプロテイン(a)-ベースアッセイで測定。副次評価項目にはアポリポプロテインBおよび高感度C反応性タンパク質の変化率が含まれる。
結果
参加者の中央値年齢:66歳、女性:33%、アジア系:27%、黒人:4%、白人:66%。
Muvalaplinは以下のLp(a)減少を達成:
Lp(a)粒子アッセイ:10 mg/日で47.6%、60 mg/日で81.7%、240 mg/日で85.8%の減少。
アポリポプロテイン(a)アッセイ:10 mg/日で40.4%、60 mg/日で70.0%、240 mg/日で68.9%の減少。
用量依存的にアポリポプロテインBも減少(最大16.1%)。
高感度C反応性タンパク質に変化なし。
いずれの用量でも安全性や忍容性に問題なし。
結論と意義
MuvalaplinはLp(a)粒子アッセイおよびアポリポプロテイン(a)-ベースアッセイでLp(a)を低下させ、忍容性が高かった。心血管イベントへの影響を明らかにするためにはさらなる調査が必要である。
試験登録
ClinicalTrials.gov Identifier: NCT05563246
https://www.medscape.com/viewarticle/new-pill-successfully-lowers-lp-levels-2024a1000l13
箇条書き要約:
Muvalaplinの特徴
Muvalaplinは新規の経口薬であり、Lipoprotein(a)(Lp(a))を安全かつ効果的に低下させる。
Lp(a)粒子の2つの部分を結合させる結合を破壊することで効果を発揮。
現在臨床試験中の他の治療法は注射薬のみであり、経口薬はmuvalaplinが唯一。
Lp(a)について
遺伝的に決定され、生活習慣や食事では影響されない。
高値(125 nmol/L以上)は血栓、炎症を促進し、心筋梗塞、脳卒中、大動脈弁狭窄症、末梢動脈疾患のリスクを大幅に増加。
黒人や南アジア系に多く、全体の約20%に影響。
KRAKEN試験の概要
対象:高Lp(a)値(>175 nmol/L)の233名の成人。
方法:3つの用量(10, 60, 240 mg)のmuvalaplinまたはプラセボを12週間投与。
測定:従来の血液検査と新しい検査法を使用。
試験結果
従来の検査で最大70%、新検査法で最大85.5%のLp(a)低下を確認。
従来の検査で82%、新検査法で97%の参加者が125 nmol/L以下に到達。
60 mgと240 mg群での効果は10 mg群より顕著。
安全性と耐容性が良好。
研究者のコメント
Muvalaplinは「以前は治療不可能とされていた疾患に対する有望なアプローチ」。
より大規模で多様な患者群を対象とした長期試験が必要。
Lp(a)低下が心血管イベント(心筋梗塞や脳卒中)の減少につながるかは未確認。
発表と出版
結果はAHA Scientific Sessions 2024で発表、JAMAに同時掲載。
序文:
Lp(a)のリスクと特性
Lp(a)の高値は動脈硬化性心血管疾患および石灰化大動脈弁狭窄症のリスク増加に関連。
Lp(a)濃度は遺伝的に決定され、幼少期に達した濃度が生涯ほぼ安定する。
動脈硬化の病因は、Lp(a)の動脈硬化促進作用、炎症促進作用、潜在的な血栓促進作用による。
未解明の課題
Lp(a)が修正可能なリスク因子か、どの程度の低下が有効か、誰が恩恵を受けるかは未解明。
心血管リスクを低下させるには、85~250 nmol/Lの大幅なLp(a)低下が必要と推測される。
現在の治療法
現時点でLp(a)を低下させるための承認薬はない。
アフェレーシスはLp(a)を低下させるが、侵襲的、時間的・経済的負担が大きい。
新規治療法の開発
核酸ベース治療(アポリポプロテイン(a)転写阻害)では、80%以上のLp(a)低下が確認。
小干渉RNAベース治療では90%以上の低下を示す。
Muvalaplinの特徴
Lp(a)粒子のアッセンブリを阻害する初の薬剤。
経口薬としてアポリポプロテイン(a)とアポリポプロテインBの非共有結合を阻害し、Lp(a)形成を防ぐ。
第1相試験では、14日間の投与で最大65%のLp(a)低下と良好な忍容性を確認。
検査法の課題
商業用Lp(a)測定法(アポリポプロテイン(a)-ベース)は、一般集団では正確だが、MuvalaplinのようなLp(a)阻害薬存在下では濃度を過大評価する可能性がある。
これは、アポリポプロテイン(a)を含む粒子、遊離状態のアポリポプロテイン(a)、薬剤に結合したアポリポプロテイン(a)を測定するため。
KRAKEN試験の概要
高Lp(a)濃度および心血管イベントリスクが高い成人を対象に、Muvalaplinの12週間投与効果と忍容性を評価。
従来のアポリポプロテイン(a)-ベース測定法と、新しいLp(a)粒子検出法を併用。
method
研究デザイン
第2相ランダム化二重盲検プラセボ対照試験。
試験はオーストラリア、ブラジル、中国、ドイツ、ハンガリー、日本、オランダ、アメリカの43施設で実施。
Eli Lilly and Companyが主催し、学術著者の協力でデザインされた。
独立した倫理委員会の承認を受け、参加者は書面で同意を提供。
対象者
対象は40歳以上で心血管イベントのリスクが高く、Lp(a)濃度が175 nmol/L以上の成人。
心血管リスクは冠動脈疾患、虚血性脳卒中、末梢動脈疾患、2型糖尿病、または家族性高コレステロール血症の既往歴で定義。
除外基準はコントロール不良の糖尿病や高血圧、推算糸球体濾過率30 mL/min/1.73 m²未満、BMIが18.5未満または40以上、最近3か月以内の心血管イベントや手術など。
治療プロトコル
参加者は1:2:2:2の比率で、Muvalaplin(10 mg/日、60 mg/日、240 mg/日)またはプラセボを12週間投与されるようランダム化。
0日目、1週、2週、4週、8週、12週に空腹時訪問を実施し、投与終了4週後に追跡訪問を行った。
Lp(a)、アポリポプロテインB、高感度CRP、プラスミノーゲン活性などを測定。
主要評価項目
ベースラインから12週目までのLp(a)濃度の変化率。
商業用アポリポプロテイン(a)-ベースアッセイと、新しいLp(a)粒子検出アッセイを使用。
副次評価項目
12週目までにLp(a)濃度が125 nmol/L未満に達した割合。
アポリポプロテインBや高感度CRP濃度の変化率。
プラスミノーゲン活性や酸化リン脂質濃度の変化。
統計解析
混合モデル反復測定法を用いて、Lp(a)の変化率を解析。
バイナリ評価項目はロジスティック回帰モデルで解析。
Rソフトウェアを用い、全ての有意水準はP<.05で評価。
サンプルサイズ
233名を予定、10%の脱落率を考慮。
Muvalaplinのプラセボに対する60%のLp(a)減少を検出するため、99%以上の検出力を確保。
安全性評価
副作用、バイタルサイン、安全性検査値を収集し、治療群別に要約。
独立した委員会が主要心血管イベントと死亡を盲検化して評価。
結果:
患者の特性
試験期間中(2022年12月10日~2023年11月22日)、233名が無作為化され、Muvalaplin(10 mg/日:34名、60 mg/日:64名、240 mg/日:68名)またはプラセボ(67名)を投与された。
試験を完了したのはMuvalaplin群で計158名、プラセボ群で67名。
参加者の中央値年齢は66歳、33%が女性、27%がアジア系、4%が黒人、66%が白人。
冠動脈疾患の既往歴が73.0%、糖尿病が33.5%、家族性高コレステロール血症が10.7%。
スタチン(91.0%)、抗血栓薬(86.3%)、β遮断薬(52.8%)が主な併用薬。
ベースラインの生化学的パラメータ
Lp(a)濃度(中央値):粒子アッセイで216.8 nmol/L、アポリポプロテイン(a)アッセイで246.5 nmol/L。
LDL-C:73.5 mg/dL、アポリポプロテインB:76.0 mg/dL、高感度CRP:0.9 mg/L。
ベースライン時点での脂質パラメータやCRPに群間差は認められなかった。
主要評価項目(Lp(a)濃度の変化)
粒子アッセイでのLp(a)濃度変化率:
プラセボ:0.5%、10 mg/日:−47.4%、60 mg/日:−81.6%、240 mg/日:−85.7%。
アポリポプロテイン(a)アッセイでのLp(a)濃度変化率:
プラセボ:−3.2%、10 mg/日:−42.3%、60 mg/日:−70.9%、240 mg/日:−69.9%。
プラセボ調整後のLp(a)低下率:粒子アッセイで最大85.8%、アポリポプロテイン(a)アッセイで最大70.0%。
副次評価項目(Lp(a)濃度125 nmol/L未満達成率)
粒子アッセイ:10 mg/日:64.2%、60 mg/日:95.9%、240 mg/日:96.7%、プラセボ:6.0%。
アポリポプロテイン(a)アッセイ:10 mg/日:38.9%、60 mg/日:81.9%、240 mg/日:77.4%、プラセボ:3.6%。
アポリポプロテインB:用量依存的に低下(最大−16.1%)。
高感度CRPに統計的有意な変化なし。
探索的評価項目
酸化リン脂質アポリポプロテインBのプラセボ調整後変化率(12週目):最大−67.2%。
酸化リン脂質アポリポプロテイン(a)のプラセボ調整後変化率(12週目):最大−73.0%。
LDL-Cのプラセボ調整後変化率(12週目):最大−21.3%。
安全性と忍容性
治療関連有害事象の発生率は各群で類似。
重篤な有害事象は6%以下で、各群に散発的に発生。
主な有害事象:下痢、悪心、インフルエンザ、腰痛、筋肉痛、子宮筋腫、貧血。
肝機能障害の発生率は各群で類似。
1名が肝機能異常(既往歴あり)を示したが、解決。
プラスミノーゲン濃度に有意な変化なし。
プラセボ群で1名が末梢動脈血管形成術を実施。
研究の主な結果
MuvalaplinはLp(a)形成を阻害する経口薬で、12週間の治療によりLp(a)を大幅に低下させた。
240 mg/日では、粒子アッセイで85.8%、アポリポプロテイン(a)アッセイで68.9%のプラセボ調整後の低下を達成。
粒子アッセイで96.7%、アポリポプロテイン(a)アッセイで77.4%の患者がLp(a)濃度125 nmol/L未満を達成。
LDL-Cは最大21.3%、アポリポプロテインBは最大16.1%減少した。
忍容性が良好であり、用量依存的な有害事象や懸念される生化学的異常は認められなかった。
作用機序と関連知見
Muvalaplinはアポリポプロテイン(a)とアポリポプロテインBの非共有結合を阻害し、Lp(a)粒子の形成を防ぐ。
自然に低Lp(a)濃度を示すアポリポプロテイン(a)変異を模倣した作用。
前臨床研究では非ヒト霊長類でLp(a)を低下させ、第1相試験では用量依存的なLp(a)低下を確認。
酸化リン脂質濃度も用量依存的に低下し、動脈硬化や石灰化大動脈弁狭窄症の炎症促進効果を減少させる可能性を示唆。
測定法の特徴
従来のアポリポプロテイン(a)-ベースアッセイでは、Muvalaplinに結合したアポリポプロテイン(a)も検出し、Lp(a)低下を過小評価する可能性がある。
新しい粒子アッセイはアポリポプロテインBを含む粒子のみを検出し、Lp(a)低下を正確に評価可能。
プラスミノーゲン活性への影響
Lp(a)はプラスミノーゲン活性を競合的に阻害し、血栓促進作用を持つ可能性がある。
Muvalaplinはプラスミノーゲン活性に影響を与えないことが確認された。
制限事項
12週間の短期試験であり、長期の有効性と安全性は未評価。
粒子アッセイは臨床で利用できず、広範な評価が進んでいない。
Muvalaplinに結合したアポリポプロテイン(a)の生物学的影響は不明。
治験薬中止後や他のLp(a)修正薬併用後のデータは主要解析から除外された。
Lp(a)低下が心血管リスクをどの程度減少させるか、またそのための適切な低下幅は不明。
1. Lp(a)の構造と生理的役割
構造
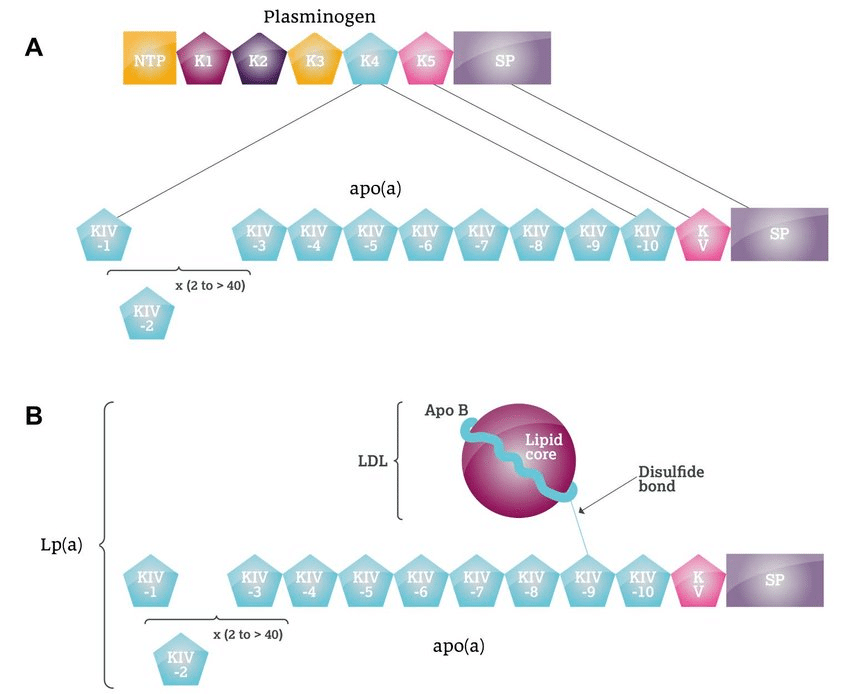
Lp(a)は、低密度リポプロテイン(LDL)に似た構造を持ち、アポリポプロテインB-100(ApoB-100)を含むLDL様粒子に、アポリポプロテイン(a)(Apo(a))が共有結合で付加したもの。
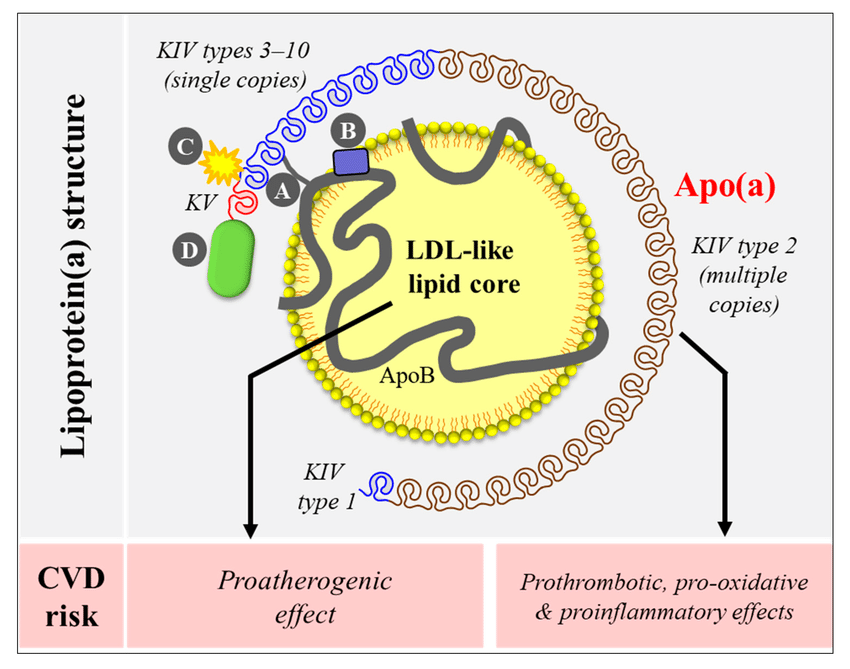
Apo(a)はプラスミノーゲンと構造的類似性があり、クリングルIVドメインと呼ばれる反復構造を持つ。
生理的役割(未解明な部分が多い)
血管修復:血管内皮の損傷時に修復を助ける可能性があるが、確実な証拠は乏しい。
止血作用の調整:Apo(a)のプラスミノーゲン様構造が線溶系に影響を与える可能性がある。
進化的背景:Lp(a)は主にヒトやいくつかの霊長類に存在するため、感染防御や創傷治癒における進化的意義があると推測される。
2. Lp(a)の病的意義
Lp(a)は、動脈硬化性疾患や血栓形成に関与し、心血管リスクを増加させる。
動脈硬化性疾患
プロアテロジェニック作用:Lp(a)はLDL様粒子として、血管壁に取り込まれやすく、マクロファージによる泡沫細胞形成を促進する。
プロインフラマトリー作用:Lp(a)に含まれる酸化リン脂質(OxPL)が炎症を誘発し、内皮機能障害を促進。
結果:冠動脈疾患、虚血性脳卒中、末梢動脈疾患のリスク増加。
血栓促進作用
Lp(a)はプラスミノーゲンと競合し、プラスミン形成を阻害することで線溶系を抑制。これが血栓形成を助長。
結果として、プロトロンボティック状態を引き起こす。
石灰化大動脈弁狭窄症
Lp(a)に含まれる酸化リン脂質が石灰化過程を促進し、大動脈弁の硬化・狭窄を引き起こす。
3. 臨床的意義
リスク評価
血中Lp(a)濃度は遺伝的に決定され、生活習慣や薬物治療ではほとんど変化しない。
血中濃度125 nmol/L以上が心血管リスク増加の基準とされる。
治療の現状と課題
現在、Lp(a)を標的とした承認薬はない。スタチンやPCSK9阻害薬はLp(a)にほとんど影響を与えない。
一部の治療(アフェレーシスなど)はLp(a)を低下させるが、侵襲的かつ高コストである。
新規治療薬として、核酸医薬(アンチセンスオリゴヌクレオチド、siRNA)やMuvalaplin(経口小分子薬)などが開発中。これらはLp(a)を50〜90%以上低下させる効果を示している。
