特発性肺線維症:循環中代謝特性
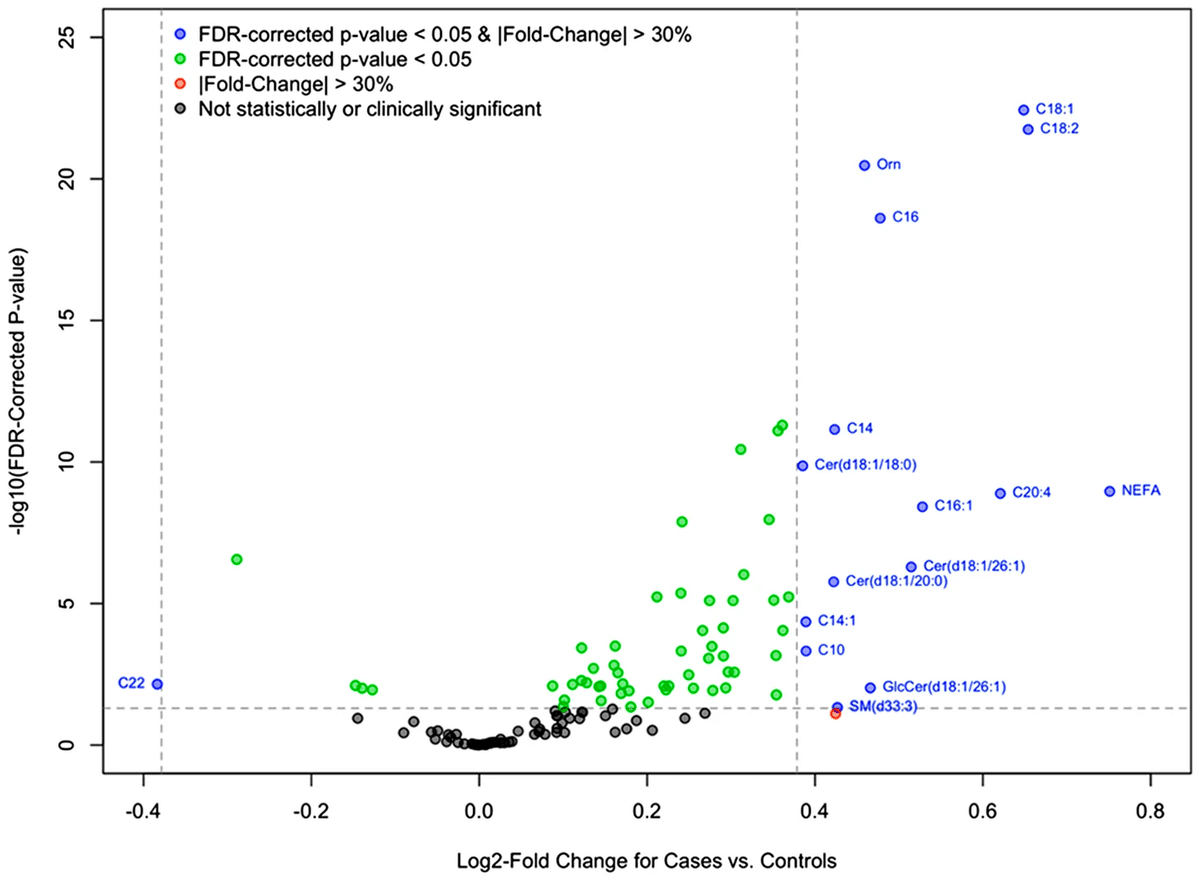
IPF患者における非エステル化脂肪酸(NEFA)の高いレベルとアシルカルニチンおよび特定のセラミドの高いレベルは、脂肪酸の利用可能性の増加を示唆.ミトコンドリアの脂肪酸酸化の抑制と関連しており、ミトコンドリアの酸化活動の限界が部分的に酸化された脂肪酸CoAおよびアシルカルニチンの蓄積につながる可能性がある.オルニチンの循環レベルが有意に高かった.
Summer, Ross, Jamie L Todd, Megan L Neely, L Jason Lobo, Andrew Namen, L Kristin Newby, Shirin Shafazand, ほか. 「Circulating metabolic profile in idiopathic pulmonary fibrosis: data f rom the IPF-PRO Registry」. Respiratory research 25, no. 1 (2024年1月25日): 58. https://doi.org/10.1186/s12931-023-02644-7 .
背景
循環代謝物は、細胞内プロセスや疾患の生物学を反映していますが、特発性肺線維症(IPF)患者におけるその特徴は十分に明らかにされていません。我々は、IPFの存在、IPFの重症度、またはIPF患者における臨床的に重要な結果のリスクと、循環する代謝物のレベルが相関するかどうかを評価しました。
方法
IPF-PROレジストリーに登録された300人のIPF患者と、既知の肺疾患のない100人の個人の登録時の血漿サンプルを、ターゲット代謝物質学および臨床分析モジュールのセットを使用して分析しました。線形回帰を用いて、IPF患者と対照群の代謝物および臨床分析物のレベルを比較し、IPF患者における代謝物のレベルと疾患の重症度の指標との関連を決定しました。調整および未調整の一変量コックス回帰モデルを使用して、IPF患者における循環代謝物と死亡リスクまたは疾患進行のリスクとの関連を評価しました。
結果
64種類の代謝物と5種類の臨床分析物のレベルが、IPF患者と対照群とで有意に異なっていました。最も差が大きかった分析物には、非エステル化脂肪酸、複数の長鎖アシルカルニチン、および特定のセラミドが含まれ、これらのレベルはIPF患者の方が対照群よりも高かった。分岐鎖アミノ酸のバリンとロイシン/イソロイシンのレベルは、疾患の重症度の指標と逆相関していました。臨床的に影響を与える因子を調整した後、アシルカルニチンC:16-OH/C:14-DCの高いレベルは全原因死亡率と関連しており、アシルカルニチンC16:1-OH/C14:1DCの低いレベルは全原因死亡率、呼吸器死、および呼吸器死または肺移植と関連していました。また、スフィンゴミエリンd43:2の高いレベルは呼吸器死または肺移植のリスクと関連していました。
結論
IPFは、非エステル化脂肪酸、長鎖アシルカルニチン、およびセラミドの増加したレベルによって特徴づけられる独特の循環代謝プロファイルを持っており、これは脂質の動員と代謝を促進するよりカタボリックな環境を示唆している可能性があります。我々は、疾患の重症度や疾患進行のリスクと高い相関を示す特定の代謝物を同定し、これらはバイオマーカーとしてさらに開発される可能性があります。
試験登録
ClinicalTrials.gov; No: NCT01915511; URL: www.clinicaltrials.gov.
序文要約 written with ChatGPT4
特発性肺線維症(IPF)は、進行性で致命的な肺疾患であり、過剰な細胞外マトリックスの沈着による肺機能の進行的な低下が特徴です。これは最終的に肺の構造の破壊と呼吸不全につながります。疾患の進行は、上皮細胞の損傷、線維芽細胞の活性化、および線維化促進成長因子の産生に関連しています。ニンテダニブとピルフェニドンという2つの抗線維化薬は、IPF患者の肺機能の低下を遅らせますが、病気の進行は患者によって異なり、個々の患者の病気の進行速度を予測することは困難です。
代謝物は細胞プロセスの最終産物であり、疾患生物学の潜在的な影響因子であるため、循環代謝物は疾患活動に関する新しい洞察を提供し、疾患進行のバイオマーカー候補を特定することができます。この考えは、肺線維症の病因がミトコンドリア機能不全、脂質異常、乳酸および乳酸脱水素酵素5の上昇、糖解作用、グルタチオン生合成、アデノシン三リン酸分解、オルニチンアミノトランスフェラーゼ経路の変化などの代謝異常と関連していることを示唆する研究によって支持されています。IPF患者の循環代謝物は広範囲には研究されていませんが、特定の代謝物と疾患の重症度、進行リスクとの関連が特定されています。この研究では、IPF患者と既知の肺疾患のない対照群の循環代謝物を定量化し、これらのグループ間で異なるレベルに存在する代謝物を特定します。次に、IPF患者の疾患重症度の指標と循環代謝物レベルとの関連を調査し、これらの患者の臨床的に関連する結果のリスクを予測するための有用性を評価します。これにより、IPFの病因理解と疾患進行の新しいバイオマーカーの特定が可能になるかもしれません。
discussion要約 written with ChatGPT4
この研究では、特発性肺線維症(IPF)患者の末梢血代謝物が、同じ年齢と性別分布の既知の肺疾患のない個人とは異なることが分かりました。また、特定の代謝物は、疾患の重症度や臨床的に重要な結果のリスクと高い相関があり、これは既知の臨床的影響因子を考慮しても同様でした。
IPF患者は、対照群と比較して、複数の長鎖アシルカルニチン、セラミド、および一種のスフィンゴミエリンなど、いくつかの脂質種の循環レベルが有意に高かった。これらの所見は、IPFのマウスモデルでの脂肪酸や脂質代謝の異常、IPF患者の肺における遊離脂肪酸や脂肪酸代謝関連遺伝子の異常、IPF患者の循環脂肪酸レベルの上昇と一致しています。IPF患者における非エステル化脂肪酸(NEFA)の高いレベルとアシルカルニチンおよび特定のセラミドの高いレベルは、脂肪酸の利用可能性の増加を示唆しています。これは、脂肪の分解に関連する可能性があります。また、NEFAの高いレベルはインスリン抵抗性のマーカーである可能性もありますが、IPF患者は対照群と比較して循環グルコースレベルが低く、糖尿病の割合も少なかったため、これはあまり可能性が高くないと考えられます。
慢性閉塞性肺疾患患者の研究では、個々のスフィンゴ脂質と肺気腫の重症度との間に逆相関が示され、特定のスフィンゴ脂質の測定は、人口統計学的および臨床的共変量に基づく予測を超えて重度の増悪の予測を改善しました。IPF患者の研究では、末梢血中の特定のシグナリング脂質のレベルと肺機能との間に負の相関が観察され、より速い進行を示す患者の血漿中に特定のトリグリセリドとホスファチジルコリンの高いレベルが見られました。セラミドC18:1/C16:0の高いレベルは、より重症の疾患と関連していました。このセラミドは、ミトコンドリアの脂肪酸酸化の抑制と関連しており、ミトコンドリアの酸化活動の限界が部分的に酸化された脂肪酸CoAおよびアシルカルニチンの蓄積につながる可能性があることを示唆しています。
また、IPF患者におけるアミノ酸の異常調節の証拠も見つかりました。特に、IPF患者は対照群と比較してオルニチンの循環レベルが有意に高かった。オルニチンは非タンパク質性アミノ酸であり、アルギナーゼの作用によって生成され、尿素回路の重要な中間体およびシトルリン、プロリン、および創傷治癒や細胞増殖に重要な様々なポリアミンの前駆体として機能します。また、特定のアミノ酸の高いレベルが病気の重症度が低いことと相関していました。これらのアミノ酸は、エネルギー代謝とタンパク質合成のための主要な基質であり、成長とエネルギー経路を調節する重要なシグナリング役割を果たしています。これらのアミノ酸の循環レベルが肺のmTOR活動と相関するかどうかは、さらなる調査に値する概念です。
この研究には、IPFおよび対照コホートが導出された登録簿の多施設性や、年齢、性別、喫煙歴の分布が類似した対照参加者との比較など、いくつかの強みがあります。しかし、アプローチにはいくつかの固有の制限があります。当社のコホートは、主に白人の患者で構成された米国ベースの人口であり、他のIPF患者の集団への一般化は不確実です。また、多くの代謝物を特徴づけたが、アプローチはターゲット指向であり、発見ベースではないため、重要な可能性のある代謝物が見逃された可能性があります。臨床分析物の分析には、サンプル量が不足しているため、研究のすべての参加者が含まれていませんでした。
