
低酸素と睡眠分断が、治療されたOSAにおける残存する過眠症に関与
nCPAP下の遺残眠気の検討
残存する低酸素負荷は客観的な覚醒度の障害と有意に関連、一方、覚醒指数>25/hは主観的な残存眠気と有意に関連
Tankéré, Pierre, Jacques Taillard, Thierry PetitJean, Pierre Le-Cam, François Ricordeau, Margaux Blanchard, Jade Vanbuis, ほか. 「Residual Sleepiness and Impaired Alertness in Treated Obstructive Sleep Apnoea: Role of Hypoxic Burden and Sleep Fragmentation」. Thorax, 2025年1月19日, thorax-2024-222462. https://doi.org/10.1136/thorax-2024-222462.
抄録 日本語訳
治療された閉塞性睡眠時無呼吸症候群(OSA)における残存する眠気の病態生理は、いまだ十分に解明されていない。動物モデルでは、間欠的な低酸素と睡眠分断による神経細胞の損傷が示唆されている。維持覚醒検査のために紹介された、持続陽圧呼吸療法(CPAP)治療を受けている122人のOSA患者のコホートにおいて、Epworth Sleepiness Scaleで評価した(主観的な)眠気と(客観的な)覚醒度の決定因子を検討した。
ロジスティックモデルにおいて、残存する低酸素負荷は客観的な覚醒度の障害と有意に関連しており(OR=1.005、95% CI 1.002~1.008、p=0.003)、一方、覚醒指数>25/hは主観的な残存眠気と有意に関連していた(OR=1.23、95% CI 1.05~1.43、p=0.02)。
このことは、低酸素と睡眠分断が、治療されたOSAにおける残存する過眠症の異なる側面に関与している可能性を示唆している。
序文
閉塞性睡眠時無呼吸症候群(OSA)患者の約60%が日中の過剰な眠気(EDS)を抱えている。
治療後も12%~65%のOSA患者がEDSを経験し、Epworth Sleepiness Scale(ESS)やMaintenance of Wakefulness Test(MWT)で測定される。
EDSと覚醒度の低下は、心血管リスクを含む社会的・個人的負担の原因となる。
治療後のOSA患者における残存EDSと覚醒度低下の決定因子は不明である。
動物モデルでは、OSAにおけるEDSのメカニズムとして、低酸素損傷と呼吸イベントに関連する睡眠分断が示唆されている。
ヒトでは、低酸素負荷(HB)が症状や心血管アウトカムに影響を与えるというエビデンスが増加している。
EDSと心血管アウトカム、HBと心血管アウトカムの相互作用は、HBとEDSの関係に疑問を投げかける。
本研究では、CPAP治療中のOSA患者における主観的な眠気と覚醒度低下に対するHBと睡眠分断の相対的な役割を調査した。
HBと覚醒指数がESSとMWTの結果の両方に影響を与えるという仮説を立てた。
方法:
2017年から2022年にリヨン大学病院の睡眠医学・呼吸器疾患センターでMWTのために紹介された連続患者のコホートの方法論は以前に発表されている。
本研究は、CPAP治療患者の眠気と覚醒度に関連する因子に焦点を当てた。
主観的な眠気はESSスコア≧11と定義され、客観的な覚醒度障害はMWTにおける唯一の米国睡眠医学会が認める平均睡眠潜時40分未満と定義された。
睡眠パラメータは、MWTの前夜に実施されたポリソムノグラフィーから抽出された。
HBは、同じポリソムノグラフィーから、無呼吸または低呼吸に関連するベースライン飽和度の曲線下面積として計算された。
ベースライン飽和度は、イベント前の100秒間の最大酸素飽和度であった。
また、OSAに関連する低酸素の特定の役割を解明するために、「SpO2<90%負荷」(睡眠時または呼吸器イベントに関係なく、90%未満で過ごした夜間時間の積分)を測定した。
質的変数は数とパーセンテージで記述され、量的変数は中央値と四分位範囲(IQR、すなわち25%と75%四分位数)で記述された。
客観的な覚醒度と主観的な眠気の二元状態に応じて分析された変数は、R 4.0.5ソフトウェアを用いて、期待されるすべてのセルカウント≧5のカテゴリカル変数にはPearsonのχ2検定(または期待されるセルカウント<5の場合はFisherの検定)、連続変数にはMann Whitney検定を用いて比較された。
2つのロジスティックモデルを用いて、MWTとESSの結果を説明する可能性のある変数を評価した:HB、覚醒指数>25/h、残存無呼吸低呼吸指数(AHI)、BMI>30kg/m2、Beckの抑うつ尺度(<20)。
変数の選択は、臨床的関連性、過去の文献、およびステップワイズ後方回帰に基づいて行われた。
Wald検定を用いて、予測変数が有意かどうかを判定した。
本研究は、病院の研究倫理委員会(N°23–4374)によって承認された。
結果
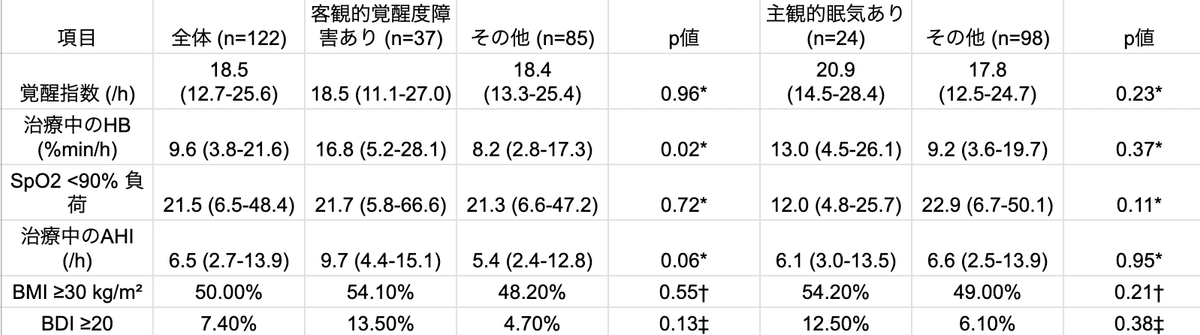
122人の患者が登録され、9%が女性、年齢中央値(Q1-Q3)は49(42-54)歳で、81%の患者は治療前AHIが39.0(30.6-57.0)/hの重症OSAであった。
全ての患者はMWT前のポリソムノグラフィー(PSG)評価でCPAP治療を受け、過去1ヶ月間の毎日のCPAP使用時間の中央値は5.6(4.5-6.7)時間であった。
ESSは7.7(3.3-9.0)であり、合意された平均睡眠潜時は40.0(36.9-40.0)分であった。
ESSとMWTの結果に基づいて、30.3%の患者は客観的な覚醒度障害、19.7%は主観的な眠気、12.3%は主観的および客観的な障害の両方、62.3%は残存障害なしであった。
平均HBは9.6(3.8-21.6)%min/hであり、覚醒度障害のある患者とない患者の間で有意に高かった(16.8(5.2-28.1)%min/h vs 8.2(2.8-17.3)%min/h、p=0.02)。
主観的な眠気のある患者とない患者の間には差は観察されなかった(13.0(4.5-26.1)vs 9.2(3.6-19.7)、p=0.37)。
AHI、SpO2<90%負荷、覚醒指数のいずれも、覚醒度障害のある患者とない患者、または主観的な眠気のある患者とない患者の間で有意な差はなかった(表1)。
AHIは、覚醒度障害のあるサブグループで高くなる傾向があった。
客観的な覚醒度障害に関するロジスティック回帰の唯一の有意な共変量は、HB(OR=1.005、95% CI 1.002~1.008、p=0.003)とBMI>30kg/m²(OR=1.27、95% CI 1.12~1.45、p=0.0007)であった。
主観的な眠気に関しては、有意な共変量は、覚醒指数>25/h(OR=1.23、95% CI 1.05~1.43、p=0.02)とBMI>30kg/m²(OR=1.14、95% CI 1.05~1.43、p=0.009)であった。
Hosmer and Lemeshow検定はどちらもp<0.0001であり、分散拡大係数はすべて<5であり、深刻な多重共線性がないことが保証された。
ロジスティック回帰に関する仮定(観測の独立性、反復測定の欠如、外れ値のスクリーニングと除去、多重共線性の欠如、過適合を避けるための十分なイベント数など)も検証された。
Discussion
本研究では、治療中のOSA患者において、(i) HBが残存する客観的な覚醒度障害と正の関連があり、(ii) 睡眠分断が残存する主観的な眠気と正の関連があることを示した。
OSAにおける(残存)EDSの病態生理は部分的にしか解明されていないが、低酸素と睡眠分断が関与している可能性がある。
マウスモデルでは、低酸素/再酸素化への慢性的な曝露は、ドーパミン作動性を含むカテコールアミン作動性覚醒促進ニューロンを損傷することが示されている。
睡眠分断は、いくつかの覚醒に関与する(ノルアドレナリン作動性、オレキシン作動性、ヒスタミン作動性、コリン作動性)ニューロンの活動に影響を与えることが記録されている。
本研究は、ヒトにおいて同様のメカニズムが存在する可能性を示す論拠を提供し、客観的な覚醒度障害はむしろ低酸素(おそらくMWTには動機付けの要素が含まれており、ドーパミン作動性経路を動員するため)、主観的な眠気はむしろ覚醒(および覚醒促進構造のより広範な関与)によって影響を受けることを示唆している。
興味深いことに、SpO2<90%負荷は覚醒度障害と有意な関連がなく、OSAに関連するHBの特定の影響を示唆している。
過去の研究では、HBは過剰に眠気のあるクラスターよりも、中程度の眠気のあるOSA表現型(主観的な眠気)で高いことが示唆されている。
眠気と低酸素の関係は、覚醒指数よりも以前にOSAで示唆されている。
本研究は、覚醒度の補完的な探索を追加する。治療中のOSA患者において、明らかに異なるメカニズムが関与する主観的な眠気と客観的な覚醒度の間の乖離に対して、信頼できる説明を提供する。
本研究の強みは、HBの影響がこれまで眠気と覚醒度障害の両方で同時に調査されていなかったことである。
さらに、MWTとESS測定の前夜に測定されたポリソムノグラフィーデータを調査することができた。
重要なことに、動物実験は慢性損傷モデルに基づいている。低酸素/覚醒ストレスの臨界閾値と持続時間は、まだ決定されていない。
初期のHBと睡眠分断の役割を解明するためには、さらなる研究が必要である。
本研究には、横断的デザインに固有のいくつかの限界がある。最も重要な変数を研究したが、さらなる交絡因子(初期HBを含む)の調整はできなかった。
結論として、残存HBは治療中のOSAにおける客観的な覚醒度の障害に役割を果たし、残存覚醒指数は残存する主観的な眠気に関与している。臨床的には、運転能力や安全な状態を評価する際には、OSA患者の残存低酸素に特に注意する必要がある。
**Maintenance of Wakefulness Test (MWT, 覚醒維持検査)**の実際の検査方法は以下のように実施されます。
1. 検査の目的
MWTは、日中の覚醒を維持する能力を評価するために行われる検査です。特に、過度の眠気(例: ナルコレプシー、閉塞性睡眠時無呼吸症候群、特発性過眠症)を評価するために使用されます。また、職務上の覚醒維持能力(例: 運転適性評価)を確認する目的でも利用されます。
2. 検査の手順
(1) 前日の準備
通常、検査前日は 通常の睡眠スケジュール を維持するよう指示される。
カフェインや覚醒作用のある薬 の摂取は制限されることが多い。
必要に応じて、睡眠ポリグラフ検査(PSG) を前夜に実施し、前夜の睡眠状況を確認することがある。
(2) 検査環境
静かで薄暗い部屋 で行う。
被験者は リクライニングチェアまたはベッドに腰掛ける。
室温は快適に保たれる。
外部の刺激(騒音、光、会話など)は最小限に抑える。
(3) 測定セッション
1日4回~5回(2時間ごと)にわたり、20~40分間の試行 を行う。
例: 09:00, 11:00, 13:00, 15:00(場合によっては17:00にも実施)
各セッションでは、被験者に できるだけ長く覚醒を維持するよう指示 される。
目を開けた状態 で、座ったまま何もせずに待機する。
寝落ちしてしまった場合 は、眠りにつくまでの時間(Sleep Onset Latency, SOL)を記録し、一定時間経過後に起こされる。
(4) 測定方法
脳波(EEG)、眼球運動(EOG)、筋電図(EMG)などを測定する。
睡眠段階に入った場合、その時点で試行は終了する。
覚醒を維持できた場合は、最大試行時間(通常40分) まで継続する。
3. 評価基準
(1) Sleep Onset Latency(SOL)の測定
各試行の入眠時間(SOL)を平均 し、覚醒維持能力を評価する。
(2) 一般的なカットオフ
平均SOLが40分(試行全てで覚醒を維持)→ 正常
平均SOLが8分未満 → 病的な過眠
8~40分の間 → 状態によって評価
特に、ナルコレプシーや特発性過眠症 の診断補助として重要視される。
4. MSLT(Multiple Sleep Latency Test)との違い
MWTとよく比較される検査に MSLT(反復睡眠潜時検査) がありますが、目的と方法が異なります。
項目MWT (Maintenance of Wakefulness Test)MSLT (Multiple Sleep Latency Test)目的覚醒を維持する能力を評価睡眠に入るまでの時間を評価方法できるだけ起き続けるよう指示できるだけ眠るよう指示測定回数4~5回(40分/回)4~5回(20分/回)主な用途日中の覚醒能力の評価、運転適性日中の過眠症の評価、ナルコレプシー診断
5. 臨床での適用
過眠症やナルコレプシーの評価
睡眠障害患者の治療評価(例: CPAP治療後の改善)
職務上の適性評価(パイロット、トラック運転手など)
過眠症状の重症度評価
まとめ MWTは、日中の覚醒維持能力を評価するための標準的な検査であり、4~5回の試行で入眠潜時を測定し、覚醒維持能力を判定します。MSLTとは異なり、「どれだけ起きていられるか」に焦点を当てた検査であり、主に過眠症評価や職業適性検査に利用されます。
4o
無呼吸の Arousal Index(覚醒指数, AI)とは?
Arousal Index(AI, 覚醒指数)は、睡眠中に生じる 短時間の覚醒(Arousal) の頻度を示す指標です。特に 閉塞性睡眠時無呼吸症候群(OSA) や 中枢性睡眠時無呼吸(CSA) などの評価に重要です。
1. Arousal Index の測定法
Arousal Index(AI)は 終夜睡眠ポリグラフ(Polysomnography, PSG) を用いて測定されます。
(1) 測定機器
脳波(EEG, Electroencephalography):覚醒の検出
眼電図(EOG, Electrooculography):眼球運動の確認
筋電図(EMG, Electromyography):筋緊張の評価
呼吸センサー(気流、胸腹運動):無呼吸・低呼吸の検出
動脈酸素飽和度(SpO₂):酸素低下の評価
(2) Arousal(覚醒)の定義
AASM(American Academy of Sleep Medicine)による基準
NREM睡眠(N1, N2, N3) において 3秒以上のEEG変化(α波, θ波増加) を認める場合
REM睡眠 では、EEG変化 + 筋緊張の一時的な上昇 を伴う場合
ただし、短時間(3秒未満)のEEG変化は覚醒としてカウントしない。
(3) Arousal Index(AI)の計算方法
AI は 1時間あたりの覚醒回数 で表され、以下の式で算出されます。
Arousal Index=総覚醒回数総睡眠時間(時間)Arousal \, Index = \frac{総覚醒回数}{総睡眠時間(時間)}ArousalIndex=総睡眠時間(時間)総覚醒回数
例えば:
総睡眠時間 6時間
覚醒回数 90回
AI = 90 ÷ 6 = 15回/時
2. Arousal Index の評価
Arousal Index の基準は、年齢や疾患によって異なりますが、一般的な基準は以下の通りです。
Arousal Index(回/時)評価< 5正常5 – 15軽度(Mild)15 – 30中等度(Moderate)> 30重度(Severe)
特に、閉塞性睡眠時無呼吸症候群(OSA) では AIが15回/時以上 であることが多く、30回/時を超える場合は重度OSA と診断されることが多い。
3. Arousal Index と 無呼吸・低呼吸指数(AHI)の関係
Arousal Index(AI)は、無呼吸(Apnea)や低呼吸(Hypopnea)による覚醒(Respiratory Arousal)だけでなく、以下の要因による覚醒も含まれます。
無呼吸・低呼吸による覚醒(呼吸関連覚醒, Respiratory Arousal)
OSA, CSA などの呼吸イベントによる覚醒
AHI(Apnea-Hypopnea Index) と関連が強い
周期性四肢運動障害(PLMD)による覚醒
Periodic Limb Movement Arousal Index(PLMAI) で評価
PLMDがある場合、AIが高くなる
覚醒性脳波異常
不眠症、ストレス、薬剤(カフェイン、抗うつ薬)などの影響
呼吸イベントとは関係なく、Arousal Indexが上昇
4. 臨床での意義
高AI(>15) は、睡眠の質の低下 を示唆する。
AIがAHIより高い場合:呼吸イベント以外の要因(PLMD, 精神的ストレス)が影響している可能性がある。
AIの改善は治療評価の指標(CPAP, マウスピース治療など)。
5. まとめ
Arousal Index(AI) は 1時間あたりの覚醒回数 で測定。
PSG(終夜睡眠ポリグラフ) で EEG, EOG, EMG, 呼吸パラメータ を用いて評価。
AI > 15回/時 は 睡眠障害の可能性 を示唆。
AIとAHIの比較 により、無呼吸以外の覚醒要因も評価可能。
AIは、睡眠の質を評価する重要な指標であり、特に OSA診断やCPAP治療の評価 に役立ちます。
nCPAP治療中の圧変動による擬似的 Arousal Index の測定方法
nCPAP(nasal Continuous Positive Airway Pressure)治療中、圧変動(Pressure Fluctuation)を指標として擬似的な Arousal Index(AI)を推定する方法 があります。これは、覚醒に伴う呼吸パターンの変化やCPAP圧の不安定性を検出 することで、従来の終夜PSGを行わずにAIを評価する方法です。
1. 圧変動を用いた擬似的 Arousal Index の測定方法
(1) 測定機器
nCPAP装置には、圧変動や呼吸イベントを記録できる内蔵データロガーやクラウド管理システムが搭載されていることが多く、これを用いて分析します。
nCPAPフロー・圧センサー
呼吸の安定性(正常な吸気・呼気パターン)
圧変動の頻度(一定時間内の変動回数)
呼吸努力センサー
胸腹運動の変化
動脈酸素飽和度(SpO₂)
低酸素イベント(覚醒に伴う変動)
代表的な解析ソフトウェア・デバイス
ResMed AirSense/AirCurve シリーズ
Philips DreamStation
Fisher & Paykel ICON+
CPAP解析ソフト(ResScan, OSCAR, SleepyHead)
(2) 擬似的 Arousal Index の計算方法
擬似的 AI は、CPAPデータから短時間の圧変動(Pressure Fluctuation Events, PFE)を解析 して推定されます。
① 圧変動イベント(Pressure Fluctuation Events, PFE)の検出
圧力変動(Pressure Flow Variability)
短時間(3秒以上)の急激な圧変動
呼吸パターンの急激な変化(例:不規則なフロー、吸気時間の短縮)
マイクロアロウザル(Micro-arousal)の特徴
nCPAP装置ではEEGを記録できないため、圧変動 + 呼吸努力の変化 + SpO₂の変動 を指標とする。
これを**"Pressure-Induced Micro-arousal"(PIM)** として解析。
② 擬似的 Arousal Index の算出
擬似的 AI は、1時間あたりのPFE回数として求められます。
$${Pseudo−Arousal Index =\frac{PFEの総回数}{総睡眠時間(時間)}}$$
例:
圧変動イベント(PFE)発生回数 60回
睡眠時間 6時間
擬似的 Arousal Index = 60 ÷ 6 = 10回/時

3. 擬似的 Arousal Index に影響する要因
(1) CPAP圧の設定
圧力が低すぎる
低呼吸が継続 → 覚醒反応を引き起こし、AIが上昇
圧力が高すぎる
不快感や中枢性無呼吸(Complex Sleep Apnea)を誘発 → AIが上昇
圧力の急変動
オートCPAP(APAP)の圧調整が過剰に働くと、覚醒を誘発する可能性がある
(2) CPAPリーク
マスクのフィットが不適切だと圧力が変動しやすくなり、擬似的 AI が上昇する。
(3) 非呼吸関連の要因
周期性四肢運動障害(PLMD) → 圧変動では検出しにくい
不眠症・ストレス → 擬似的 AI は増加しないが、EEGでは高い覚醒指数が検出される可能性あり
4. 実際の使用例(臨床応用)
(1) 自宅での睡眠評価
nCPAPのデータロガーを用い、AIの推移を長期間モニタリング
診察時にPSGなしでAIのトレンドを確認できる
(2) nCPAP治療の適正化
擬似的 AI > 10回/時 の場合、圧設定やマスク調整を検討
AHIは低いのにAIが高い場合 → PLMDや不眠症の可能性
(3) APAP(オートCPAP)の圧制御の最適化
圧力が変動しすぎていないかを確認し、適切な最小・最大圧の設定を行う。
