
未消化食品と腸内細菌叢は神経炎症性疾患の発症に協力する可能性がある: 臓器特異性の起源に関する提案と障壁の問題
未消化食品と腸内細菌叢は神経炎症性疾患の発症に協力する可能性がある: 臓器特異性の起源に関する提案と障壁の問題
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6893834/
パオロ・リッチョ、ロッコ・ロッサーノ
追加記事情報
アブストラクト
食は能動的な対象であり、抗炎症作用や炎症促進作用があることから、食習慣は慢性神経変性疾患に関連する低グレードの神経炎症を調節する可能性があります。食品は私たちとは異なる生命体であるが、私たち自身の性質でできている。したがって、未消化の状態では私たち(非自己)にとって異物であると同時に、完全に消化された状態では私たち(自己)と同じである。未消化の食物が内腔から流出しないようにするためには、腸管バリアが無傷であることが必要です。私たちは何をどれだけ食べるかによって、腸内細菌叢の組成を形成しています。欧米型食生活の結果、腸内細菌バランスが崩れると、腸の炎症が起こり、腸管バリアが漏れる。未消化の食物、微生物、内毒素、免疫担当細胞や分子の流出により、慢性的な全身性の炎症が引き起こされます。血液脳関門の開放は、ミクログリアやアストロサイトの引き金となり、神経炎を引き起こす可能性があります。自己免疫炎症プロセスの臓器特異性を決定するものは、攻撃される臓器のタンパク質に似た食物抗原に依存する可能性があることを我々は示唆している。これは、脳と神経炎症性疾患にも、他の臓器やがんを含む他の疾患にも当てはまると考えられる。炎症性疾患における微生物叢と未消化食物の協力関係を理解することは、臓器特異性を明らかにし、疾患の適切な実験モデルを設定することを可能にし、標的を絞った食事介入を開発することができる。





キーワード:食事、腸内細菌叢、炎症、腸管バリア、血液脳関門、アルツハイマー病、パーキンソン病、多発性硬化症、自閉症スペクトラム障害、筋萎縮性側索硬化症
慢性神経変性疾患は低グレードの慢性炎症と関連する
多発性硬化症(MS)、アルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)、自閉症スペクトラム障害(ASD)などの慢性神経変性疾患は、病因や発症メカニズムが異なるものの、共通して炎症性であることが指摘されています[1](図1)。
図1
慢性神経変性疾患には、共通して慢性炎症性基盤が存在する。
これらの疾患の根底にある炎症過程と闘うことで、疾患の進行や重症度を軽減できる可能性がある。炎症は、生来の非特異的な防御プロセスである [2,3] 。異物(非自己)の存在に反応して、あるいは物理的、化学的、生物学的要因による組織損傷の結果として、あるいは老廃物の排出や栄養の消化がうまくいかないなどの異常によって発生する。炎症の原因が持続する場合、炎症も持続しますが、通常は強度が低く、低悪性度慢性炎症と呼ばれます。慢性神経炎症性疾患については、ほとんどの場合、神経炎症状態は中枢神経系(CNS)に由来するものではなく、慢性全身性炎症(CSI)に由来すると考えられています[4,5,6]。最近の証拠によると、CSIは、腸の炎症が腸のバリアを通して広がり、全身的な炎症反応や免疫反応を引き起こすことによって生じる可能性があることが示唆されています。CSIが持続することで、炎症性分子が血液脳関門(BBB)を通過し、中枢神経系に侵入する可能性があります。脳内に侵入すると、ミクログリアやアストロサイトを活性化することで炎症プロセスを引き起こし、特定の慢性神経変性疾患への道を開く可能性があります[6]。現在のところ、何が原因で炎症が他の臓器ではなくCNSに向かうのかはわかっていません。
したがって、腸から中枢神経系への炎症状態の伝播には、腸管バリアと血液脳関門(BBB)という2つの生物学的バリアが破壊されることが必要である。両者とも、細胞間にタイトジャンクションが存在し、柵がないため、特定の輸送系を持たないものや親油性でないものは通過できない、という特徴がある。腸管由来の神経疾患を避けるためには、この2つのバリアが無傷であることが必要である。
ここでは、炎症性食習慣(低度の慢性炎症を引き起こす食品の長期摂取)が、腸管バリアの透過性を高める状態を持続させ、その結果、BBBの破壊や神経変性疾患の原因となる可能性を扱っている。BBBへの攻撃は、未消化の食物分子の一部の脳内タンパク質が腸から脱出し、腸内細菌叢と協力して慢性炎症と免疫反応を誘発する分子模倣に起因する可能性を示唆する。食は能動的な主体である
食べ物が人間の健康に何らかの影響を与えるかどうかを理解するためには、食べ物の摂取が単なるエネルギー(カロリー)の摂取ではなく、むしろ自分にとって和やかな世界とのエネルギーの共有を意味することを考慮する必要があります。食べ物という形で摂取したエネルギーは、受動的な役割ばかりではなく、宿主によって変容され、宿主を変容させるという能動性を持っています。食べ物が宿主にアレルギーや不耐性を引き起こし、毒性を持つことさえあることはよく知られている。例えば、神経毒性のアミノ酸であるODAP(オキサリルジアミノプロピオン酸、神経伝達物質グルタミン酸の構造類似体)を含むそら豆の粉は、潜在的な毒性を持つ例である。長期的には、ODAPは下肢の麻痺を特徴とする「ニューロパチーリズム」と呼ばれる神経変性疾患を引き起こします[7,8]。
基本的に、食べ物は2つの方法で私たちの健康状態に影響を与えることができます。(1)代謝に影響を与える、(2)腸内細菌叢の組成を調整する、です(図2)。
図2
食習慣は、代謝と腸内細菌叢の組成の両方に影響を与えます。
食生活が代謝と腸内細菌叢の両方に協調的に作用することで、慢性炎症が引き起こされたり、予防されたり、軽減されたりする可能性があります。後述するように、慢性炎症は、神経変性疾患を含む現代の様々な慢性疾患と相関しています。食物がヒトの代謝に及ぼす影響
周囲の環境を「感じ」、栄養面を含む環境変化に適応するために、ヒトの細胞は転写因子、核内受容体、酵素といった特定のセンサーを持っています [9,10]。転写因子と核内受容体は、特定のDNA配列に結合することで遺伝情報の転写を制御し、酵素は特定の代謝経路を制御し、サーチュインのように核内レベルでも活動することがあります [11] 。
食べ物はどのようにして代謝を制御するのだろうか?食物分子の中には、転写因子、核内受容体、酵素に結合し、それらの活性を調節するものがあります。代謝への影響は、異化作用と同化作用のどちらかである。異化作用は抗炎症作用があり、異化作用は炎症促進作用がある。実際、同化作用のある状態では、炎症誘発性分子の合成が起こる可能性がある。食物活性分子のうち、野菜や魚にそれぞれ含まれるポリフェノールや長鎖n-3 PUFA(オメガ3多価不飽和脂肪酸)は、抗炎症作用、異化経路のアップレギュレーション、異化作用と炎症の抑制作用があるのに対し、飽和脂肪酸やその他の動物食の食物因子は炎症誘発作用があります[9, 10].ヒトの腸内細菌叢
人間の腸内には、細菌、ウイルス、真菌など、非常に多くの異なる微生物が生息しています:腸内細菌叢(ちょうないさいきんそう)。その数は、少なくとも私たちの細胞の数に匹敵し[12]、あるいはそれ以上かもしれません[13]。近年、全ゲノムショットガンメタゲノミクスなどの培養に依存しない手法が導入されたおかげで、微生物叢の構成に関する非常に信頼性の高いデータを得ることができ、その偉大な生物多様性についてより深く知ることができるようになりました[14]。私たちは皆、指紋のように他の人とは異なる独自の微生物叢を持っています [15,16,17]。その多様性は、宿主の遺伝子型、性別、経膣・帝王切開出産、年齢、非食環境、ストレス要因、薬剤、病気、とりわけ食習慣などの要因から生じます。ヒトの腸内細菌叢は非常に多くの要因に依存しているため、その組成は日々絶えず変化しています。
現在、腸内細菌叢に多くの関心が集まっています。しかし、NIHのヒトマイクロバイオームプロジェクトの元コーディネーターであるリタ・プロクターが報告したように[18]、「これまでの研究のほとんどは、種名のカタログ化に重点を置きすぎていました。私たちは、ヒトマイクロバイオームを、あたかも身体の他の部分から切り離された、マッピングや操作が可能な比較的固定された性質であるかのように特徴づけてきたのです」と述べています。
健康な状態では、さまざまな微生物の集団が、自分自身や宿主と調和的かつ相互依存的な関係で暮らしています。この状態は「ユビオシス」と呼ばれ、腸の生態系はバランスがとれています。微生物の多様性が高く、消化とエネルギーの獲得、粘膜免疫、腸管バリアの完全性、病原体からの保護、ビタミンや短鎖脂肪酸(SCFA)などの有用代謝物の生産など、腸のほぼすべての機能に影響を与えるため、私たちにとって有益な微生物が顕著に多いことが特徴である。さらに、ユビオティック状態では、腸内細菌叢の組成は、脳を含む宿主のすべての器官の機能性に有益である。
一方、異なる微生物集団の相互関係が失われると、「ディスバイオシス」と呼ばれる状態に陥ります。この状態では、腸内細菌システム全体の生物多様性が極端に低下し、潜在的に病原性のある微生物が有益な微生物よりも優勢になります。ディスバイオシスの傾向は、腸内で優勢な細菌門であるファーミキューテス(F)/バクテロイデーテス(B)比の増加によって示されることが多い[19,20]。
ユビオティックな状態は抗炎症性であり、ディスバイオティックな状態は炎症性である。後述するように、ユビオシスもディスバイオシスも、私たちの生活習慣、特に食習慣に強く依存しています。ヒトの腸内細菌叢に及ぼす食物の影響
腸内細菌叢は、その維持のために私たちに依存しています。実際、私たちが選択した食事は、1つまたは別の微生物集団に餌を与え、その成長を促進することによって、腸内細菌叢の組成を決定します [21,22,23,24].
食物摂取が腸内細菌叢の組成を決定することを説明するために、簡単のために、私たちの食習慣を2種類の基本的な食事だけに絞り込むことができます:(1)低カロリーで繊維質の多いベジタリアン(VD)食、(2)高カロリーで主に肉食、飽和脂肪酸と精製炭水化物に富む「西洋」動物食(WD)、工業的に加工された食品としばしば関連しています[25]。VD]は、私たちが分解できない繊維の複雑な炭水化物を消化できる腸内細菌集団にのみ適しています。繊維は、プレボテラ属などのバクテロイデーテス門に属する細菌にとって、適切な燃料となります。その見返りとして、彼らはSCFA、特に酪酸などの有用な分子を産生します[26]。
[VD]菌は、腸の優生、高い生物多様性、腸管バリアの完全性、人間の健康と関連しています。食物繊維の少ない欧米食の場合は、もちろん異なります。欧米食は、繊維に含まれる複雑な炭水化物を消化するための機械を持たない微生物集団に好まれているのです。欧米食で過剰に摂取したエネルギーを収穫するのに適した[WD]菌の摂食は、多くの[VD]菌にとって有毒な胆汁酸の生成につながる。そのため、異なる微生物集団の相互関係が失われてしまうのです。その結果、微生物群の生物多様性が著しく低下し、長期的に持続すると、腸内炎症の前提となるディスバイオシス状態になります。dysbiosisと腸の炎症を避けるためには、ベジタリアン主体の食事が好ましいと言えます。健康な状態では、食べ物は完全に消化されていなくても腸内で腸内細菌叢と相互作用し、代謝への影響は完全に消化された分子を通してのみ、吸収後、つまり腸の外で起こることをこの時点で指摘しておく価値があります。炎症促進食と抗炎症食
図3に示すように、エネルギー密度の高い欧米食は、飽和動物性脂肪、赤身肉、フライドポテト、スナック菓子、マーガリン(トランス脂肪酸)、甘味飲料と単糖、塩、加工食品、手の込んだ調味料を多く含む典型的な炎症促進食である。欧米の食事は、座りっぱなしのライフスタイルと関連することが多く、繊維が少ないという特徴があります。アルコール摂取や喫煙も炎症促進作用があります。
図3
炎症が起こりやすい食事要因
加工食品は、いくつかの化学添加物:人工香料、着色料、保存料、乳化剤、抗生物質、さらに、腸内細菌叢やビタミンDレベルに悪影響を及ぼす重金属、農薬、除草剤を含むことがあるので、炎症促進作用がある。
図4は、ベジタリアンを中心とし、食物繊維を豊富に含む抗炎症食の活性因子を示したものである。この食事は、パンやカゼインが少ないことを意味し、野菜、果物、キノコ、豆類、魚、貝、甲殻類、全粒粉パスタ、ダークチョコレート、低脂肪ヨーグルト、スパイス、エクストラバージンオリーブオイル、コーヒー、紅茶の摂取が基本である。
図4
抗炎症作用のある食事因子。内因性因子とは、私たちの代謝に関与している因子です。魚油に含まれるオメガ3系不飽和長鎖脂肪酸(n-3 PUFAs)、ビタミンA、D、B12、PP、E、C、オリゴエレメントなどである。
カロリー制限されたベジタリアン食は、食物繊維やプロバイオティクス、管理された断食や断続的な断食、適度な運動と統合する必要があります。再発寛解型(RR)または原発性進行型(PP)のMS患者を対象としたパイロット試験で検証した抗炎症食は、MMP-9(マトリックスメタロプロテアーゼ-9、またはゼラチナーゼB)の活性型の減少によって証明されるように、炎症を抑えるのに有効だった [27] 。食べ物とは何か、なぜ消化されなければならないか
食べ物とは、私たちが食べるものであり、無機物ではなく、生命の質に関係するすべてのものを指します。砂や泥、紙やプラスチックではなく、安全で、本質的に私たちと似ていると私たちが認めるもの、つまり、私たちと同じように作られ、エネルギーを得るため、あるいは時間の経過とともに変化した成分を置き換えるために、「処理」、代謝、変換する方法を知っているものすべてを私たちは食べます。したがって、私たちの食べ物は、(多くの場合、不活性化された)生体物質のみで構成されています。
しかし、私たちがそれを摂取するとき、食品は私たちとは全く異なるもの(非自己)であり、そのままでは何一つ使うことができません。総じて、食物の高分子は私たちとは全く異なるものであるため、消化器系の外で発生した時点で、私たちはその排泄を用意しなければならない。
私たちのメニューに含まれる生体細胞や高分子構造(タンパク質、膜、多糖類)は私たちのものとは異なりますが、その基本構成要素(生体元素(C、N、O、H)、脂肪酸、単糖、アミノ酸などの単純分子)は私たちが利用するものと同じです(図5)。つまり、生物は、私たちにとって異物(非自己)であると同時に、私たちに適合した存在(自己)でもあるのです。
図5
生きている物質の基本的な構成要素です。私たちが知っている世界は、92種類の化学元素で構成されており、そのうち81種類は安定している。生物はこのうち26~30種類程度の元素しか使っていないが、その99%は炭素...という4つの「生体元素」だけで構成されている。
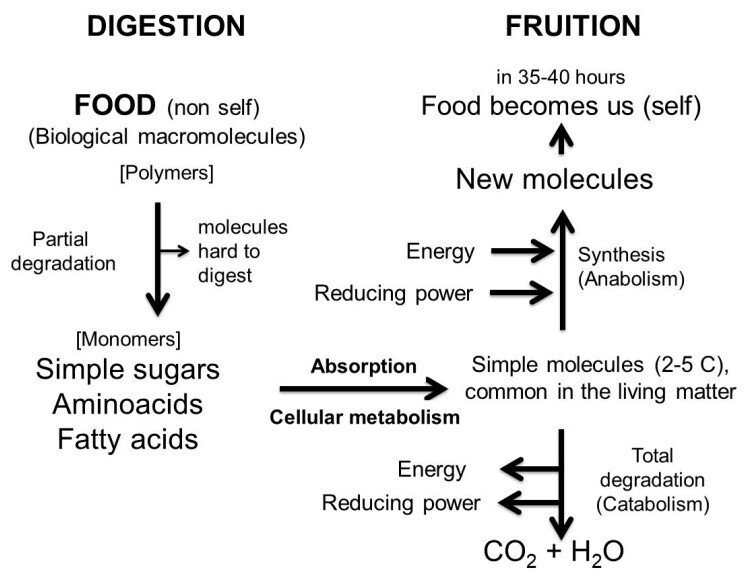
私たちとは起源が異なるため、食品から採取した組織や細胞、タンパク質はそのままでは使えません。胃腸管(反応容器)にある消化器官で単純な分子に分解され、吸収されなければならない。消化される前は非自己であり、消化が完了すると自己になるのです。完全に消化された分子だけが、私たちと同質であり、自己として認識され、吸収された後に私たちの代謝に入ることができるのです。結論として、消化の仕事は食べ物を私たちに似せることであり、吸収は単純な分子を私たちの代謝に利用できるようにするために必要である。わずか1日余り(35~40時間)で、食べ物は私たちの一部となるのです(図6)。
図6
最も単純な分子の消化から、すべての生物に共通する代謝過程とその結実までを模式的に表現している。私たちに腸のバリアがある理由
口から肛門までの消化管全体は、その内部にあるものに対して不浸透性である。ただし、生理的な例外として、摂取した食物の消化過程で得られる小さな食物分子は、疎水性であったり、内腔から宿主の内部環境へ特異的な輸送システムを持つ場合、そのような分子は含まれない。
腸管バリアの構造は複雑である。物理的バリア、生化学的バリア、免疫学的バリアを区別することができる。
8.1. 物理的腸管バリア
内腔から宿主の内部環境に至るまで、物理的な障壁は、1層(小腸)または2層(大腸)の粘液、1層の上皮細胞、血管内皮からなる。上皮細胞は、輸送システムを持たないすべての分子、そして明らかに内腔に存在するすべての微生物細胞に対して、本当の意味で乗り越えられない障壁を表しています。これは、腸上皮細胞同士が、先端部のオクルジンやクローディンなどの特定の膜タンパク質(タイトジャンクション、TJ)と、基底部のデスモソームやその他のタンパク質(アドヒアランスジャンクション、AJ)との相互結合によって密接に結びつき、その構造を保持することによって、物理的バリアを形成しているという事実によって可能になります。
腸管上皮バリアは静的な構造ではなく、動的な構造である [28]。そのタイトジャンクションは、外来および内部の刺激に反応して開閉することができるからである [29]。腸管バリアの完全性の重要な制御因子は、ゾヌリンとゾヌラ・オクルデンス・ファミリーの関連タンパク質である [30].小腸内の微生物が増加すると、ゾヌリンの活性化によってタイトジャンクションが開き、微生物を洗い流すための水のフラッシュと消化の加水分解反応に必要な水を確保することができる。
上皮細胞層には、いわゆる杯細胞も存在します。この細胞は、上皮細胞の先端面にある巨大なゲル状の層「粘液」を形成する糖タンパク質「ムチン2」を分泌し、微生物との直接的な相互作用を制限する機能を有しています。このタンパク質は、乳脂肪球膜(MFGM)にも含まれており、乳幼児期には消化器官の発達を助ける役割を担っています。とはいえ、大人になってから牛乳(とMFGMタンパク質)を摂取することの是非は疑問視されている[31]。
8.2. 生化学的および免疫学的な腸のバリアー
腸のバリアは、物理的に緊密な構造をしているだけでなく、生化学的な防御線と免疫学的な防御線の両方を含んでいます。これらの機能は、バリアが漏出した場合、不要な細胞や分子の通過を阻止したり、不活性化したりすることです。実際、バリアは動的な構造であるため、その完全性は時として破壊されることがある。すなわち、α-ディフェンシン、リゾチーム、REG3タンパク質などの抗菌ペプチドを放出するパネス細胞や、微生物や食事の抗原に最初に遭遇する免疫細胞の一つである多数のT細胞などである。
しかし、実際の免疫防御ライン(自然免疫と適応免疫の両方)は、粘液層と上皮バリアの後に、T細胞とB細胞、マクロファージ、樹状細胞の形で存在します。腸管関連リンパ組織(GALT)に存在する活性化B細胞は、潜在的に病原性のある微生物抗原に対してはIgAを分泌するが、相互に有益な細菌に対しては分泌しないため、粘液層の防御を強化する役割を果たす。
8.3. 腸のバリアが必要な理由
一般に、腸に生息する細菌の全身への拡散を避けるためには、腸管粘膜バリアと免疫バリアの完全性が必要だと考えられていますが、実際には、腸管バリアを持つ主な理由は、食事の高分子が消化されずに血流に乗ることを防ぐためです。前述したように、消化管には体の免疫システムの最大の構成要素があります。腸関門の境界に位置する免疫担当細胞は、非自己と自己を区別して、よそ者が通らないようにチェックするために存在する。非自己と自己の区別は、検査した分子がすでに知られている内因性分子と類似しているかどうかを推定することに基づいて行われることがある。検査した抗原のうち、自己または非自己との擬態の確率が、それぞれ、許容または免疫優性である領域である。しかし、微生物も食物も生き物である以上、事はそう単純ではない。
我々は以前、抗原とヒトや微生物のタンパク質コレクションとの間の類似性プロファイル(SP)、すなわち擬態の確率が同等であることを示した。しかし、実際に違いを生み出しているのは、非自己/自己のSP比である。この比率が高くなると、エピトープがT細胞を刺激する力が強くなる[32]。
結論として、腸管バリアは、主に完全に消化されない食物分子に対して不透過性でなければならない。そのために存在するのである。微生物の拡散も避けなければならないが、これはおそらく腸管バリアが形成された理由ではない。バリアが壊れることで、微生物の分子も細胞も、未消化の食物分子も、免疫担当の分子や細胞も、腸から脱出することができます。これらはすべて、全身性の炎症反応を引き起こす可能性があります。したがって、腸のバリアが壊れることは絶対に避けなければならない。食習慣が腸管バリアの完全性に与える影響
腸管透過性の制御について
粘液による保護と、タイトジャンクションと接着ジャンクションによる「補強」にもかかわらず、最前線にあり、したがってストレスを受けている上皮細胞は、5日以内に新しい細胞と入れ替わらなければならない [29] 。つまり、古い細胞が押し出され、新しい細胞が挿入される間に、タイトジャンクションを素早く開閉する必要があるのです。バリアは、異物の侵入を防ぐ壁でありながら、非常に動的である。それ自体を維持するために、素早く変化する。しかし、炎症が起きると、腸管バリアはリーキー(漏出)になります。
腸管バリアが漏れるという最初の証拠は、数十年前にMS患者において報告された[33,34]。Yacyshynetら[33]は、研究対象のMS患者の25%に腸管透過性の上昇があることを示し、ReicheltとJensen[34]は、MS患者にグリアジンとグルテンに対するIgA抗体とIgG抗体が存在することを確認しました。当時は、腸の機能や腸内細菌叢の役割はまだ考慮されていなかったため、グリアジンとグルテンに対する抗体の存在は、MSにおけるこれらのタンパク質に対する特異的な免疫反応に起因すると考えられていました。
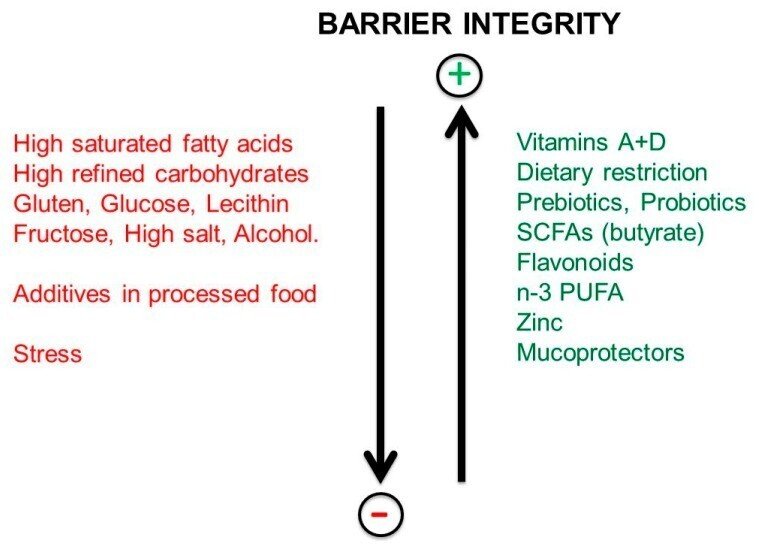
現在では、自己免疫疾患を回避するためには、腸管バリアが無傷でなければならないことがますます明らかになっています[35]。したがって、持続的なストレス状況を含め、腸のバリアの完全性を緩める可能性のある食物や薬物を回避または制限し、腸のバリアの完全性を強化する可能性のある食事因子を好むことが重要である[28]。
図7に示すように、以下の項目はタイトジャンクションの完全性を緩め、腸バリアの透過性を増加させる: 欧米型の食生活、飽和脂肪酸、グルテン、塩分、アルコール、加工食品に含まれる化学添加物。腸バリア破壊物質」は、直接的に、あるいは腸内細菌叢の組成を変化させることによって作用します。また、非ステロイド性抗炎症薬やストレスも、胃腸にダメージを与える可能性があります。ストレスは、コルチコトロピック放出因子(CRF)マスト細胞軸の活性化により、バリアの悪化を引き起こします。
図7
腸管バリアの完全性に及ぼす食事因子およびストレス因子の影響。
しかし、カロリー制限や絶食、プレバイオティクス、プロバイオティクス、酪酸(SCFA)、ビタミンDとA、フラボノイド、オメガ3 PUFA、亜鉛、粘膜保護剤(タンニン酸ゼラチン、チンダル化プロバイオティクス)などはバリアの保護効果があると言われています。腸のバリアーの透過性を高める要因
10.1. グルテン
現在では、グルテンが腸の粘膜バリアに直接作用することが知られている[36]。グルテンがゾヌリンというタンパク質を活性化し[30]、その結果、タイトジャンクションが緩んで腸のバリアがより透過しやすくなる。Reichelt と Jensen [34]が観察した抗体反応は、グリアジンタンパク質がそのまま、あるいは部分的に消化されただけでバリアを通過したためであることが、現在では明らかになっている。グルテンによる腸管バリアの透過性亢進は、非セリアック型グルテン過敏症の人に特に顕著である[36]。
グルテンの特徴は、小麦、ライ麦、大麦に含まれるグリアジンとグルテニンから水の存在下で形成されるため、パン、ピザ、ケーキ、パスタ、そしてビールなどの食品に含まれることである。また、加工食品に添加されることも多い[37]。グルテンは、消化されにくい性質を持っています。完全に消化されないグルテンの断片は、微生物分子[36]、すなわちアデノウイルスのタンパク質[38]と誤認されることがあります。このため、グルテンの断片は、ゾヌリンの放出とタイトジャンクションの開通を引き起こす。同様に、血液中に入ると、グルテンは、タイトジャンクションを備えたもう一つのバリア、血液脳関門(BBB)を開く。グルテンの断片は、腸壁を通過する際に、ウイルスタンパク質のような異物として認識される。このバリアが開くと、他の未消化の食物分子や微生物もバリアを通り抜けていきます。すべての侵入者は、免疫反応を引き起こします。グルテンやグリアジンに対する抗体は、一部の脳タンパク質と交差反応し、神経変性疾患を促進する可能性があります[39,40]。
10.2. アルコール
慢性的なアルコール摂取は、細菌の過剰繁殖と腸内環境の異常を促進します[41]。また、抗菌分子REG3のレベルを低下させることで腸管バリアの完全性を変化させ、腸粘膜への微生物の侵入を有利にします[42]。さらに、アルコールはNAD+をNADHに変換するため、脂肪酸、タンパク質、炭水化物の代謝を妨害し、炎症促進分子でもある。
10.3. 加工食品に含まれる化学物質が腸管バリアと腸内細菌叢に与える影響について
加工食品には、経時的な安定性や消費者への訴求力を高めるために、様々な化学物質が添加されていることがある。添加物には、保存料、人工香料、着色料、乳化剤、人工甘味料、抗生物質などがあります。これらはすべて、ヒトの腸内細菌叢にとって有害である[35,43,44,45,46]。例えば、食事性乳化剤は腸内細菌叢の多様性を低下させ、炎症を助長し、粘液層の厚さを減少させる。非栄養素系甘味料(ステビア、アスパルテーム、サッカリン)は、腸内細菌叢を静菌する作用がある。加工食品に含まれる可能性のある抗生物質の摂取は、微生物の多様性をも低下させますが、加えて抗生物質に対する耐性を引き起こす可能性があります。重要な問題は、加工食品に乳糖、砂糖、乳清タンパク質、グルテン、乳糖、カゼインなど、他の食品由来の成分を添加することである。これらの添加物は、特定の食品を過剰に摂取することになり、不耐性を引き起こす可能性がある。
10.4. 腸内バリアの透過性に及ぼす腸内異種細菌の影響
腸管バリアの完全性を損なう可能性があるのは、まず腸内環境の異常であり、多くの場合、ファーミキューテス/バクテロイデーテス比の増加や全体的な微生物多様性の減少と関連しています [19,20] 。ファーミキューテス類とバクテロイデーテス類は、腸内で最も代表的な細菌門である。持続的なディスバイオシスは、Th17/Treg比とリポポリサッカライドLPSの増加をもたらし、腸の炎症を誘発する。その結果、タイトジャンクションが緩み、バリアが開く。内腔にあるものが出てきて血流に入る。すなわち、未消化の食物の断片、微生物、インターロイキン6などの炎症性サイトカイン、グラム陰性菌の転座を示すマーカーであるLPSなどの内毒素である[47, 48]。その結果、全身性内毒素血症、慢性全身性炎症、慢性炎症性疾患が発症します。腸内環境の異常は、主に私たちの食習慣や生活習慣に依存するため、腸炎や腸管バリアの開放、現代の代謝性疾患や慢性疾患を引き起こすのは、私たち自身である。その中でも、炎症性疾患を基盤とする神経変性疾患の発症は、腸内細菌異常症と関連付けることが可能です。
以下の神経炎症性疾患では、特異的な腸内環境の異常が報告されている: アルツハイマー病 [49,50,51]; パーキンソン病 [52,53,54]; 自閉症スペクトラム障害 [20,55]; 多発性硬化症 [25,56] および筋萎縮性側索硬化症 (ALS) [57].微生物叢とバリア保護
11.1. ファスティング(断食
人間は、自発的な採集、狩猟、農耕など、定期的に食べ物がない時期があり、数日間の断食が必要なこともあった。断食や飢餓の経験が最も多かったと言えるでしょう。一方、現在の西洋のライフスタイルで最も頻繁に経験するのは、断食、少なくとも予定外の断食や強制的な断食がないことである。何千年も経った今、欧米では断食しない、あるいは食事を摂らないという体験が最も新しいのです。
しかし、人間の腸内細菌叢とその宿主の間では、断食に依存するのは微生物叢のほうである。腸内細菌叢は主に大腸に存在し、小腸で宿主に消化吸収されたものの残りだけを食べることを目的としています。宿主と微生物叢の間で、食物不足に最もさらされるのは微生物叢である。
実際、単純炭水化物、脂肪酸、タンパク質の取り込みは、通常、微生物の存在感が乏しいか高まらない小腸で行われるプロセスであるため、上記の食事栄養素は主に宿主によって代謝され、大腸微生物群にとっては不十分な場合があります。とりわけ、タンパク質に含まれる窒素の量が制限となる可能性がある。窒素の利用可能性は生物にとって基本的であり、原核生物にとってはなおさらであるため、これは二次的な重要性ではない[58]。したがって、宿主の残した窒素の量は、腸内細菌叢の構成に影響を与え、その窒素依存性に応じて、微生物集団の成長を促進または制限する可能性があります。これが、食事中の過剰なタンパク質が高い窒素利用率をもたらし、腸内微生物の生態系を劣化させる理由かもしれない[58]。
以上、宿主による食事栄養素の優先的な選択により、重要な要素である窒素が利用可能か否かの結果であるため、より腸内細菌叢に関わる断食の例である。同様のケースは、単糖類や脂質でも起こる。
断食の場合は、宿主にとって異なる。数日間の絶食、絶食模倣食(FMD)[59]、間欠絶食、短期絶食、カロリー制限、時間制限食[60]は、健康増進のために最近提案された異なる絶食または食物制限計画である。いずれも腸管バリアの完全性を向上させ、より高い微生物多様性を誘導し、腸の炎症に対抗する[61,62,63]。実験的自己免疫脳炎(EAE)のマウスでは、FMDがTreg/Th17比を増加させ、CNSの損傷を減少させました[64]。
断食のさらなる特性として、白色脂肪組織の褐色脂肪組織への転換(「ベイジング」効果)が挙げられる。さらに、FMD、短期間の絶食、カロリー制限は、マウスにおいて腸管幹細胞を活性化することが示されている[62,65]。
腸内細菌集団に関して、絶食は腸内細菌叢に影響を与えるが、微生物の多様性に対して常に同じ効果を示すわけではない。その影響は、宿主と絶食前の腸内細菌叢の構成に依存すると思われる。ヒキガエル、マウス、パイソン、スズキでは、絶食によってバクテロイデーテスの増加が見られ、コプロバチルスとルミノコッカスの存在量の減少が見られた[66]。バクテロイデーテス(Bacteroides fragilis、Bacteroides thetaiotaomicron)の絶食時の増加は、絶食時に粘液糖鎖を餌として利用する能力に起因すると考えられるが[67,68,69]、絶食動物は摂食動物よりも粘液の生産量が少ないかもしれない[70]。マウスでは、FMDは運動機能を促進し、ドーパミン作動性ニューロンの生存に関与する脳由来神経栄養因子(BDNF)レベルを増加させることにより、黒質におけるドーパミン作動性ニューロンの損失を低減することが判明した。また、FMDは神経炎を抑制しました。上記の効果は、腸内細菌叢の組成が変化し、酪酸などの腸内細菌叢の代謝産物が多く生成されたことに起因すると考えられています。
消化は非常に負荷の高い活動である。十分な蓄えがある場合、断食によるその停止はメリットしかもたらさず、消化ストレスからの回復を促進することができます。特に夕方から夜にかけては、食事を摂らないことが重要です。少なくとも12時間以上の断食が重要です。概日時計に対応していない食事は、人間の健康に悪影響を及ぼす可能性があります。一方、夕方から夜にかけての少なくとも12時間の定期的な絶食は、炎症に対抗し、ストレス抵抗力を高め、腸内細菌叢の集団をポジティブに調整すると考えられますが、何よりも腸を休めることができます[59]。
11.2. ヒトの腸内細菌叢に餌を与える
前述したように、宿主に十分な食事があるにもかかわらず、微生物群が絶食することはあり得る。同様に、宿主の栄養を犠牲にして微生物叢の栄養を優先させるために、特定の食事を提案することも可能である。この場合、微生物叢と宿主の間の最適な互恵関係を促進することが目的でなければならない。宿主は、自らの健康を促進するように腸内細菌叢を形成することが利益であるからだ。
ヒトの健康を増進するための重要な戦略の一つは、微生物叢が有益な代謝産物に変換できる栄養素を選択し、微生物叢が有害な代謝産物に変換する栄養素を避けることによって、特定の微生物を育成し、他の微生物を育成しないことかもしれない[71]。
微生物叢にとって良い食事を定義するにあたっては、基本原則、すなわち、微生物叢は宿主に利用されなかったものの残骸を食べるということを考慮しなければなりませんが、宿主に利用されないのは、それが利用できないか豊富すぎるからです。
食物繊維は、腸内細菌叢の主要な食物である。食物繊維は宿主に消化されないため、ほぼそのままの状態で大腸の微生物群に到着します。繊維の複雑な炭水化物の発酵により、酪酸を含む短鎖脂肪酸(SCFA)が生成され、これらは宿主の健康にとって非常に有用である[26]。低濃度では、酪酸は上皮のバリア機能を改善し、炎症性転写因子NF-kBを阻害することで腸の炎症に対抗する [72] 繊維の推奨摂取量は約25g/日、いかなる場合でも15g/日以上とすべきである。
微生物叢にとって重要な他の食事因子は、ファイトケミカルです。これらは生物学的利用率が非常に低い(1~5%)だけでなく、抗炎症作用を除けば、私たちの代謝には何の役割もなく、代謝によって異物とみなされる。野菜や果物に含まれるポリフェノールや、キャベツなどの野菜に含まれるグルコシノレートは、腸内細菌叢によって代謝され、それぞれエクオール(大豆のダイゼイン由来)やイソチオシアネートなどの有用分子を提供する可能性があります[71]。ポリフェノールとその誘導体の摂取は、ファーミキューテス/バクテロイデーテス比の低下と、有益なバクテリアの優先的な増殖に対応すると考えられる[73]。
ポリフェノールとグルコシノレートから大腸で得られるその他の重要な産物は、アリール炭化水素受容体(AHR)に対するリガンドである。AHRは、環境、食事、微生物、代謝のシグナルを免疫系に統合する転写因子である。その重要性は、神経疾患においてますます認識されつつある[74]。
一方、ベジタリアン食から、飽和脂肪、肉、卵の摂取を基本とし、食物繊維はわずかでポリフェノールも少ないエネルギー密度の高い西洋食にシフトすると、カルニチンやコリンといった微生物叢に基質を与える可能性がある。トリメチルアミン(TMA)は、腸でのそれらの代謝の有害な産物であり、肝臓でその酸化物TMAOに変換される。TMAOは心血管イベントと関連する可能性があり[75]、ヒトの脳脊髄液中にも存在し[76]、アルツハイマー病で上昇する[77]可能性がある。さらに、肉食の食事は、胆汁酸の生産を増加させる飽和脂肪酸とコレステロールを多量に供給します。その後、腸内細菌叢によって、他の、主に有益な腸内細菌にとって有毒なデオキシコール酸やリトコール酸に変換されることで、微生物の生物多様性の低下や腸内異変を引き起こすと考えられる。
最後に、微生物叢に食物を与え、ユビオティックな状態を確保するためには、生もの、明らかに特に野菜(セロリ、フェンネル、グリーンサラダ、キュウリ、タマネギなど)を食べるのが良いだろう。実は、家庭での調理や工業的な加工によって食品のマトリックスが破壊されないと、宿主酵素は内部の高分子にアクセスすることができません。また、食品を粉や粒の形ではなく、大きく砕いて摂取した場合にも、同様のことが起こる可能性があります。
11.3. ビタミン類
最近、ビタミンAは、腸の炎症やLPSレベルが高い場合でも、腸のバリアの完全性を改善することが示されました。ビタミンAはLPSの作用を打ち消し、タイトジャンクションタンパク質の発現を促進するようです[78]。
しかし、ビタミンAは十分ではありません。前回の総説[25]で報告したように、ビタミンAとビタミンDは相乗的な抗炎症作用を持つので、一緒に投与する必要がある。このことは、両者が脂溶性であり、同じ食品に一緒に含まれていることが多いことから、驚くべきことではありません。両者の核内受容体は、両ビタミンが結合している場合、協力し合う。ビタミンAとビタミンDの共有機能には、タイトジャンクションタンパク質の増強、IFN-γとIL-17の抑制、制御性T細胞(Treg)の誘導などがある [79] 。最後に、ビタミンAとビタミンDは、慢性炎症に対して有効であり、腸管バリアの安定性を支持する。これらの核内受容体は宿主によってのみ発現し、微生物叢には発現しないため、微生物叢への作用は直接的ではありません。ビタミンDの欠乏は、腸管バリアの破壊、腸内細菌の異常、腸の炎症につながる [80] 。
11.4. ムコプロテクター
粘膜保護剤は、上皮の上に保護膜を形成することで、腸のバリア機能を正常に戻すことができます。中でも、タンニン酸ゼラチンやキシログルカンは、腸粘膜を保護することが示唆されています。また、プロバイオティクス(主に乳酸菌やビフィズス菌)[81]やチンダル化プロバイオティクス[82]は、ムチンの産生や上皮のタイトジャンクション蛋白の発現を調節する可能性があります[83]。タンニン酸ゼラチンおよびチンダル化プロバイオティクスは、いずれも有益な効果をもたらすことを目的としており、急性胃腸炎の治療において非常に有効であることが示されている[83,84,85]。腸内細菌異常症から血液脳関門の破壊と脳炎へ
腸内細菌叢と未消化の食物分子がBBBを攻撃する際に協力する
一見すると、腸内細菌の異常が血液脳関門(BBB)の損傷につながるというのは不思議に思えるかもしれない。しかし、腸内細菌異常症が長引くと、腸と中枢神経系との間の正常なクロストーク [86,87,88] が、腸管内腔から血流に出てくる分子によって何らかの形で乱され、慢性全身性炎症が引き起こされます。いくつかの脳タンパク質に似た未消化の食物分子に対する抗体の形成は、BBBに炎症促進プロセスを宛がい、その破壊を引き起こすかもしれない。実際、腸管バリアをよりリーキーにすることができたものは、BBBにも同じ影響を与えることができる。
BBBが存在する場所は、脳毛細血管である。その内皮細胞は、腸関門と同じように、クローディン、オクルディン、ゾーンオクルデンスというタンパク質のタイトジャンクションによって互いに融合している。そのため、血液と脳の間の分子や細胞の通過は絶対的に制限される。通常の状態では、疎水性分子や特定の輸送システムを持つ分子(D-グルコース、必須アミノ酸など)だけがBBBを通過することができます。BBBと腸関門の大きな違いは、BBBがアストロサイトの仮足(膜の突起物)に囲まれていることである。
腸に由来する分子や細胞がBBBの近傍に存在することで、BBBの破壊を引き起こす可能性がある [89] 。グラム陰性菌のリポ多糖であるLPSやグラム陽性菌のリポテイコ酸であるLTAは、脳内皮細胞が発現するToll様受容体(TLR)、TLR2、TLR4と結合できる。TLRは、自己および非自己の抗原の認識に関与している[90]。TLRの活性化は、炎症性転写因子NFκBとMAPキナーゼ経路を通じて、炎症性と抗原特異的な免疫反応を開始させる。
しかし、これだけでは十分ではありません。炎症を起こした腸から逃げ出す他の要素、特にT細胞や、抗体や炎症性サイトカインなどの免疫系の他の構成要素は、BBBの完全性を損なう可能性があります。これらはBBBの完全性を損ない、自己免疫疾患の引き金となる可能性があります。T細胞は、活性化された場合にのみBBBを通過することができます。この点で、腸管関連リンパ組織(GALT)を持つ腸内細菌叢が重要な役割を果たすと考えられる。GALTで活性化されたT細胞は、自己反応性T細胞の脳への移行を可能にする [89] 。活性化したTヘルパー17とIL-17Aは、BBBを破壊することができる[91]。
上記のような外来分子や細胞によるBBBクロスオーバーは、ミクログリアの活性化をもたらす。ミクログリアは、アストロサイトに対して相反する作用を持つ2つのタンパク質-TGF-α(トランスフォーミング成長因子-α)とVEGF-B(血管内皮成長因子-B)の放出によって、アストロサイトの炎症性活性を調節している: VEGF-Bはアストロサイトの炎症性活性化を促進し、TGF-αはそれを抑制する。活性化したアストロサイトは、神経細胞や神経突起を破壊し、瘢痕形成を開始する。脳の様々な領域が病的プロセスに関与する可能性がある。TGF-αの産生を促進し、VEGF-Bの産生を減少させることで、炎症プロセスを逆転させ、自己修復を生じさせることができる。この点で、腸内細菌叢が産生する分子は有用である [92] 。実際、腸内細菌叢由来のSCFAs [93,94]とトリプトファン誘導体 [95]は、ミクログリアとアストロサイトの活性を調節する可能性がある。SCFAに加えて、TLRシグナルに影響を与え、神経炎症を抑制する可能性のある他の分子は、多価不飽和オメガ3脂肪酸であるドコエキサン酸(DHA)、いくつかのプロバイオティクス、フルクトオリゴ糖およびガラクトオリゴ糖(FOSおよびGOS)などのプレバイオティクスと考えられる[96]。したがって、抗炎症食[27]と栄養補助食品[97]が炎症性神経変性疾患を改善する可能性があるという仮説を立てることができる。腸内炎症から神経炎症に至る全過程を模式的に表したのが図8である。
図8
食生活の欧米化から神経炎症、神経変性疾患へ:模式図による説明結論
腸内細菌叢と未消化の食物分子が神経炎症性疾患の発症に関与していることが判明
我々は、炎症性食習慣が、神経炎症および神経変性疾患の引き金となる一連の事象を引き起こす可能性があることを明らかにした。疾患発症には、微生物叢と未消化の食物片の両方が関与しており、腸管バリアと血液脳関門の破壊が必要である。一連の流れとしては、以下のようなものが考えられる: (1) 炎症性の食事が長期間続くと、腸内細菌叢の組成が変化し、腸内異常が誘発される。 (2) 腸管免疫系が活性化して腸管炎症が上昇し、T細胞が活性化してTh 17/Treg 比とLPSレベルが上昇する。 (3) 腸管壁がリーキーになって内腔内容(微生物、消化されない食物分子、エンドトキシン、T細胞およびサイトカイン)が出てきて慢性全身性炎症を誘発する; (4) 脳内分子に似た未消化の食物片に対する免疫応答が、炎症性分子をBBBに宛がい、その破壊を引き起こす。 (5) 活性化した炎症性細胞や分子がBBBを通過することにより、ミクログリア細胞やアストロサイトが活性化し、異なる脳領域で炎症プロセスが発生する。
腸内細菌叢は、この一連の事象において重要な役割を担っており、特に注意が必要である。従って、長い間全く顧みられることがなかったが、近年、微生物叢に関する多くの論文が発表されている: 2013年から2017年までで12,900本、2017年だけでも4000本と充実している[98]。2018年に発表された腸内細菌叢に関する論文数は4735編で、前年と比較してなお増加していることから、微生物叢の役割が人間の健康の中心であると認識されつつあると述べることができる。しかし、腸内細菌叢だけを重要視していたら、それは間違いである。実のところ、腸内細菌叢はその維持のために食事に依存しており、何を食べるか、どれだけ食べるかは、腸内細菌叢の優生・異生を決定的にする[99]。腸の炎症を開始し、おそらく脳への炎症性自己免疫反応に対処するのは食物である。したがって、微生物叢と食物は、病気でも健康でも互いに関連していると言うことができる。
本論文では、未消化の食物片が炎症誘発物質として働く可能性を強調し、人間の健康にとって、腸とBBBという2つのバリアの完全性が重要であることを説明します。腸管バリアに漏れが生じると、未消化の食物片も細菌、エンドトキシン、免疫担当分子や細胞とともに管腔空間から脱出する。腸内で隔離されていたはずのこれらの物質が、循環するようになるのです。私たちは通常、細菌の拡散を気にしますが、腸管バリアを通過して血液中に入った未消化の食物の拡散も見逃してはいけません。
腸内では、完全に消化されていないペプチドが、我々(非自己)とは異なるものの、我々(自己)と同じようになる途中であったため、部分的に消化された後は、我々のペプチドと分子模倣する確率が高くなると考えられる。腸内環境の悪化や腸の炎症が進むと、T細胞が活性化されます。T細胞が活性化すると、B細胞のスイッチが入り、抗体を産生します。この食物抗原に対する抗体が自己抗原を認識し、自己免疫反応を誘発する可能性がある。例えば、献血者の小麦や牛乳のタンパク質に対する抗体が神経免疫活動に寄与している可能性が示唆されている[39]。
このように、未消化ペプチドとその抗体は、炎症や自己免疫活動を強化し、異なる臓器のいずれかに向けて対処する可能性があるが、微生物叢との協力が必要である。
疾患を設定する際の腸内細菌叢と抗原の協力の必要性は、Bererら(2011)[100]によって初めて示されました。彼らの研究では、ミエリン自己抗原であるミエリンオリゴデンドロサイト糖タンパク質(MOG)が実験的自己免疫性脱髄を誘発できることが示されたが、腸内細菌叢が存在する場合にのみ、無菌マウスではT細胞やB細胞を活性化できず、抗MOG自己抗体の生産も不十分であることが示された。彼らの論文を読み直すと、食と慢性神経炎症性疾患との関係という現在の文脈で役立つかもしれない新しい解釈を与えることができる。私たちが述べたことを考慮すると、Berer研究の自己抗原MOGの代わりに、部分的に消化された食物抗原が考慮されるかもしれません。我々のモデルによれば、MOGは食物分子であり、同じMOGか、ブチロフィリン(BTN)のような類似のものである可能性があります。BTNは乳脂肪球膜(MFGM)の主要タンパク質で、牛乳のBTNはMOGと非常に似ており(類似度64%)、MOGと同様にEAEを誘導し、MOG抗体と交差反応を起こす[31]。T細胞が活性化されると、食事性抗原の利用により、抗体産生B細胞が確実に動員・活性化され、抗体は食事性抗原と類似性を持つ構造を攻撃すると考えられる。
結論として、自己免疫性炎症プロセスの臓器特異性を決定するものは、攻撃される臓器のタンパク質に似た食物抗原に依存する可能性があることが示唆された。これは、脳や神経炎症性疾患にも、癌を含む他の臓器や他の疾患にも当てはまる。BBBを通過した微生物が脳内に留まり続ける可能性があるため、脳における微生物とその内毒素の役割を深く評価する必要がある。慢性的な神経炎症を持続させるだけでなく、さまざまな神経疾患において、多様な様式でシナプス結合や脳の形態を変化させる可能性がある [101] 。脳内微生物叢の存在と神経変性疾患におけるその役割を証明できるような新しい技術的ツールを待つしかないだろう [102,103] 。
炎症性疾患における微生物叢と未消化食物の協力関係を理解することで、臓器特異性や神経疾患に至るメカニズムが明らかになるとともに、適切な疾患実験モデルの設定や標的食介入を可能にすることができる。
謝辞
本研究は、バジリカータ大学(Ricerca Interesse Locale, 2015)の助成を受けた。
利益相反について
著者らは利益相反のないことを宣言している
記事情報
ニュートリエンツ(Nutrients) 2019 Nov; 11(11): 2714.
オンライン公開 2019/11/9. doi: 10.3390/nu11112714
pmcid: pmc6893834
PMID:31717475
パオロ・リッチョ、ロッコ・ロッサーノ*。
バジリカータ大学科学部、85100ポテンザ、イタリア; moc.liamg@oiccirxoloap
*Correspondence: ti.sabinu@onassor.occor
Received 2019 Oct 1; Accepted 2019 Nov 8.
Copyright © 2019 by the authors.
ライセンシー MDPI, Basel, Switzerland. この記事は、クリエイティブ・コモンズ表示(CC BY)ライセンス(http://creativecommons.org/licenses/by/4.0/)の条件下で配布されるオープンアクセス記事です。
Nutrientsの記事は、Multidisciplinary Digital Publishing Institute (MDPI)の提供でここに提供されます。
参考文献Spielman L.J., Gibson D.L., Klegeris A. Unhealthy gut, unhealthy brain: 神経変性疾患における腸内細菌叢の役割. Neurochem. Int. 2018;120:149-163. doi: 10.1016/j.neuint.2018.08.005. [PubMed] [CrossRef][Googleスカラー].
メジトフR. 炎症の起源と生理的役割。Nature. 2008;454:428-435. doi: 10.1038/nature07201. [PubMed][CrossRef][Googleスカラー]。
ベネットJ.M.、リーブスG.、ビルマンG.E.、スタンバーグJ.P. 炎症は、あらゆる種類の課題に効率的に対応するための自然の方法である: 慢性疾患の "流行 "を理解し、管理するための示唆を与えてくれる。Front. Med. 2018;5:316. doi: 10.3389/fmed.2018.00316. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Huang C., Irwin M.G., Wong G.T.C., Chang R.C.C. Evidence of impact of systemic inflammation on neuroinflammation from a non-bacterial endotoxin animal model. J. Neuroinflammation. 2018;15:147. doi: 10.1186/s12974-018-1163-z. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Rea K., Dinan T.G., Cryan J.F. the microbiome: ストレスと神経炎症の重要な制御因子。Neurobiol. Stress. 2016;4:23-33. doi: 10.1016/j.ynstr.2016.03.001. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Cunningham C. Microglia and neurodegeneration: 全身性炎症の役割。Glia. 2013;61:71-90. doi: 10.1002/glia.22350. [PubMed] [CrossRef] [Google Scholar].
Rao S.L.N., Adiga P.R., Sarma P.S. The isolation and characterization of β-N-oxalyl-L-α, β-diaminopropionic acid: Lathyrussativusの種子から神経毒を分離した。Biochemistry. 1964年;3:432-436。[PubMed] [CrossRef] [Google Scholar].
Spencer P.S., Allen C.N., Kisby G.E., Ludolph A.C., Ross S.M., Roy D.N. Lathyrism and western Pacific amyotrophic lateral sclerosis: 短・長潜時運動系障害の病因.Adv. Neurol. 1991;56:287-299. [PubMed][Google Scholar].
Riccio P., Rossano R., Liuzzi G.M. May diet and dietary supplements improve wellness of multiple sclerosis patients? 分子的アプローチ。Autoimmune Dis. 2011;2010:249842. doi: 10.4061/2010/249842. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Riccio P. The molecular basis of nutritional intervention in multiple sclerosis: A narrative review. Complement. Ther. Med. 2011年;19:228-237.doi: 10.1016/j.ctim.2011.06.006. [PubMed] [CrossRef] [Google Scholar].
Mendes K.L., Lelis D.F., Santos S.H.S. Nuclear sirtuins and inflammatory signaling pathways. Cytokine Growth Factor Rev. 2017;38:98-105. doi: 10.1016/j.cytogfr.2017.11.001. [PubMed] [CrossRef] [Google Scholar].
Sender R., Fuchs S., Milo R. Revised estimates for the number of human and bacteria cells in the body. PLoS Biol. 2016;14:e1002533. doi: 10.1371/journal.pbio.1002533. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Thursby E., Juge N. ヒト腸内細菌叢の紹介。Biochem. J. 2017;474:1823-1836. doi: 10.1042/BCJ20160510. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Poretsky R., Rodriguez-R L.M., Luo C., Tsementzi D., Konstantinidis K.T. 16S rRNA遺伝子アンプリコンシーケンスによる微生物群集の時間的動態の解明における強みと限界. PLoS ONE. 2014;9:e93827. doi: 10.1371/journal.pone.0093827. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Eckburg P.B., Bik E.M., Bernstein C.N., Purdom E., Dethlefsen L., Sargent M., Gill S.R., Nelson K.E., Relman D.A. Diversity of the human intestinal microbial flora. Science. 2005;308:1635-1638。[PMC free article] [PubMed] [CrossRef] [Google Scholar].
Schloissnig、Arumugam、Sunagawa、Mitreva、Tap J.、Zhu A.、Waller A.、Mende D.R. 、Kultima J.R., Martin J., et al. Genomic variation landscape of the human gut microbiome. Nature. 2013年;493:45-50. doi: 10.1038/nature11711. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Franzosa E.A., Huang K., Meadow J.F., Gevers D., Lemon K.P., Bohannan B.J., Huttenhower C. メタゲノムコードによる個人のマイクロバイオームの同定。Proc. Natl. Acad. Sci. USA. 2015;112:2930-2938. doi: 10.1073/pnas.1423854112. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
プロクターL. ヒトのマイクロバイオームの次は何?Nature. 2019;569:623-625. doi: 10.1038/d41586-019-01654-0. [PubMed] [CrossRef] [Google Scholar].
Sampson T.R., Debelius J.W., Thron T., Janssen S., Shastri G.G., Ilhan Z.E., Challis C., Schretter C.E., Rocha S., Gradinaru V., et al. パーキンソン病モデルにおける運動障害と神経炎症の制御は腸内細菌叢が担う。Cell. 2016;167:1469-1480. doi: 10.1016/j.cell.2016.11.018. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Strati F., Cavalieri D., Albanese D., De Felice C., Donati C., Hayek J., Jousson O., Leoncini S., Renzi D., Calabrò A., et al. Autism spectrum disordersにおける腸内細菌叢変化の新証拠. Microbiome. 2017;5:24. doi: 10.1186/s40168-017-0242-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Tilg H., Moschen A.R., Kaser A. Obesity and the microbiota. 胃腸病学(Gastroenterology)。2009;13:1476から1483まで。[PubMed] [CrossRef] [Google Scholar].
De Filippo C., Cavalieri D., Di Paola M., Ramazzotti M., Poullet J.B., Massart S., Collini S., Pieraccini G., Lionetti P. Impact of diet in shaping gut microbiota revealed by a comparative study from children from Europe and rural Africa. Proc. Natl. Acad. Sci. USA. 2010;107:14691-14696. [PMC無料記事] [PubMed] [CrossRef] [Google Scholar].
David L.A., Maurice C.F., Carmody R.N., Gootenberg D.B., Button J.E., Wolfe B.E., Ling A.V., Devlin A.S., Varma Y., Fischbach M.A., et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature. 2014;505:559-563. doi: 10.1038/nature12820. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Foster J.A., Rinaman L., Cryan J.F. Stress & the gut-brain axis: マイクロバイオームによる制御。Neurobiol. ストレス(Stress). 2017;7:124-136. [PMC無料記事】【PubMed】【Google Scholar】。
Riccio P., Rossano R. Diet, gutmicrobiota, and vitamins A+D, in multiple sclerosis. レビュー。ニューロセラピューティクス. 2018;15:75-91. doi: 10.1007/s13311-017-0581-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Koh A., De Vadder F., Kovatcheva-Datchary P., Bäckhed F. 食物繊維から宿主生理へ: 食物繊維から宿主生理へ:細菌の重要な代謝産物としての短鎖脂肪酸。Cell. 2016;165:1332-1345. doi: 10.1016/j.cell.2016.05.041. [PubMed] [CrossRef] [Google Scholar].
Riccio P., Rossano R., Larocca M., Trotta V., Mennella I., Vitaglione P., Ettorre M., Graverini A., De Santis A., Di Monte E., et al. 再発・寛解期および原発性進行性多発性硬化症の患者における抗炎症栄養介入について: パイロットスタディ。Exp. Biol. Med. 2016;241:620-635. doi: 10.1177/1535370215618462. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Vancamelbeke M., Vermeire S. 腸管バリアー: 健康と病気における基本的な役割。Expert Rev. Gastroenterol. Hepatol. 2017;11:821-834. doi: 10.1080/17474124.2017.1343143. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Bischoff S.C., Barbara G., Buurman W., Ockhuizen T., Schulzke J.D., Serino M., Tilg H., Watson A., Wells J.M. Intestinal permeability-a new target for disease prevention and therapy. BMC Gastroenterol. 2014;14:189. doi: 10.1186/s12876-014-0189-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Fasano A. ゾヌリンとその腸管バリア機能制御: 炎症、自己免疫、がんへの生物学的扉。Physiol. 2011;91:151-175。doi: 10.1152/physrev.00003.2008. [PubMed] [CrossRef] [Google Scholar].
Riccio P. バランスのとれた乳脂肪球膜のタンパク質。Trends Food Sci. Technol. 2004;15:458-461. doi: 10.1016/j.tifs.2003.12.005. [CrossRef] [Google Scholar].
自己抗原と非自己抗原の免疫優性T細胞エピトープにおける非自己プロテオームへの組成バイアスと模倣。FASEB J. 2000;14:431-438. doi: 10.1096/fasebj.14.3.431. [PubMed] [CrossRef] [Google Scholar].
Yacyshyn B., Meddings J., Sadowski D., Bowen-Yacyshyn M.B. 多発性硬化症患者は末梢血CD45RO+ B細胞および腸管透過性の上昇を認める。Dig. Dis. Sci. 1996;41:2493. doi: 10.1007/BF02100148. [PubMed] [CrossRef] [Google Scholar].
多発性硬化症におけるグリアジンとグルテンに対するIgA抗体。Acta Neurol. Scand. 2004;110:239-241. doi: 10.1111/j.1600-0404.2004.00303.x. [PubMed] [CrossRef] [Google Scholar].
Lerner A., Matthias T. 工業用食品添加物に関連した腸管タイトジャンクション透過性の変化は、自己免疫疾患の発生率の上昇を説明する。Autoimmun. Rev. 2015;14:479-489. doi: 10.1016/j.autrev.2015.01.009. [PubMed] [CrossRef] [Google Scholar].
Fasano A., Sapone A., Zevallos V., Schuppan D. Non celiac gluten sensitivity. ガストロエンテロロジー. 2015;148:1195-1204. doi: 10.1053/j.gastro.2014.12.049. [PubMed] [CrossRef] [Google Scholar].
Bressan P., Kramer P. Bread and other edible agents of mental disease. Front. Hum. Neurosci. 2016;10:130. doi: 10.3389/fnhum.2016.00130. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Kagnoff M.F., Paterson Y.J., Kumar P.J., Kasarda D.D., Carbone F.R., Unsworth D.J., Austin R.K. Evidence for the role of a human intestinal adenovirus in pathogenesis of coeliac disease. Gut. 1987年、28:995-1001。[PMC free article] [PubMed] [CrossRef] [Google Scholar].
Vojdani A., O'Bryan T., Green J.A., Mccandless J., Woeller K.N., Vojdani E., Nourian A.A., Cooper E.L. 自閉症児の食事タンパク質、グリアジンおよび小脳ペプチドに対する免疫応答。Nutr. Neurosci. 2004;7:151-161. doi: 10.1080/10284150400004155. [PubMed] [CrossRef] [Google Scholar].
Vojdani A., Kharrazian D., Mukherjee P.S. The prevalence of antibodies against wheat and milk proteins in blood donors and their contribution to neuroimmune activities. Nutrients. 2013;6:15-36. doi: 10.3390/nu6010015. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Bajaj J.S. アルコール、肝疾患、腸内細菌叢. Nat. Rev. Gastroenterol. Hepatol. 2019;16:235-246. doi: 10.1038/s41575-018-0099-1. [PubMed] [CrossRef] [Google Scholar].
Wang L., Fouts D.E., Starkel P., Hartmann P., Chen P., Llorente C., DePew J., Moncera K., Ho S.B., Brenner D.A., et al. Intestinal REG3 lectins protect against alcoholic steatohepatitis by reducingmucosa-associated microbiota and preventing bacteria translocation. Cell Host Microbe. 2016;19:227-239. doi: 10.1016/j.chom.2016.01.003. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
食用乳化剤は、マウスの腸内細菌叢に影響を与え、大腸炎とメタボリックシンドロームを促進することを明らかにした。Nature. 2015;519:92-96. doi: 10.1038/nature14232. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Roca-Saavedra P., Mendez-Vilabrille V., Miranda J.M., Nebot C., Cardelle-Cobas A., Franco C.M., Cepeda A. 食品添加物、汚染物質およびその他のマイナーコンポーネント: ヒトの腸内細菌叢に対する影響-レビュー。J. Physiol. Biochem. 2017;74:69-73. doi: 10.1007/s13105-017-0564-2. [PubMed] [CrossRef] [Google Scholar].
Shi Z. Gut microbiota: 西洋の食事と慢性疾患の重要な関連性。Nutrients. 2019;11:2287. doi: 10.3390/nu11102287. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Zinöcker M.K., Lindseth I.A. The Western diet-microbiome-host interaction and its role in metabolic disease. Nutrients. 2018;10:365. doi: 10.3390/nu10030365. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Linsalata M., Riezzo G., D'Attoma B., Clemente C., Orlando A., Russo F. Noninvasive biomarkers of gut barrier function identify two subtypes of patients suffering diarrhoea predominant-IBS: 症例対照研究。BMC Gastroenterol. 2018;18:167. doi: 10.1186/s12876-018-0888-6. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Hills R.D., Jr., Pontefract B.A., Mishcon H.R., Black C.A., Sutton S.C., Theberge C.R. 腸内細菌叢(Gut microbiome): 食事と疾患に対する深遠な影響。ニュートリエンツ(Nutrients). 2019;11:1613. doi: 10.3390/nu11071613. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Jiang C., Li G., Huang P., Liu Z., Zhao B. The gut microbiota and Alzheimer's Disease. J. Alzheimers Dis. 2017;58:1-15. doi: 10.3233/JAD-161141. [PubMed] [CrossRef] [Google Scholar].
Sochocka M., Donskow-Łysoniewska K., Diniz B.S., Kurpas D., Brzozowska E., Leszek J. The gut microbiome alterations and inflammation-driven pathogenesis of Alzheimer's disease - critical review. Mol. Neurobiol. 2019;56:1841-1851. doi: 10.1007/s12035-018-1188-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Pistollato F., Cano S.S., Elio I., Vergara M.M., Giampieri F., Battino M. Role of gut microbiota and nutrients in amyloid formation and pathogenesis of Alzheimer disease. Nutr. Rev. 2016;74:624-634. doi: 10.1093/nutrit/nuw023. [PubMed] [CrossRef] [Google Scholar]を参照。
Sun M.F., Shen Y.Q. Dysbiosis of gut microbiota and microbial metabolites in Parkinson's Disease. Ageing Res. Rev. 2018;45:53-61. doi: 10.1016/j.arr.2018.04.004. [PubMed] [CrossRef] [Google Scholar].
Parashar A., Udayabanu M. Gut microbiota: Implications in Parkinson's Disease. パーキンソニズムRelat. Disord. 2017;38:1-7. doi: 10.1016/j.parkreldis.2017.02.002. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Mulak A., Bonaz B. パーキンソン病における脳-腸-微生物叢軸. World J. Gastroenterol. 2015;21:10609-10620. doi: 10.3748/wjg.v21.i37.10609. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Qiao Y., Wu M., Feng Y., Zhou Z., Chen L., Chen F. Alterations of oral microbiota distinguish children with autism spectrum disorders from healthy controls. Sci. Rep. 2018;8:1597. doi: 10.1038/s41598-018-19982-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Riccio P., Rossano R. Nutrition facts in multiple sclerosis. ASN Neuro. 2015;7 doi: 10.1177/1759091414568185. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Rowin J., Xia Y., Jung B., Sun J. ヒト運動ニューロン疾患における腸の炎症とディスバイオシス. Physiol. Rep. 2017;5:e13443. doi: 10.14814/phy2.13443. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
哺乳類大腸における微生物による窒素制限。Nat. Microbiol. 2018;3:1441-1450. doi: 10.1038/s41564-018-0267-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Choi I.Y., Piccio L., Childress P., Bollman B., Ghosh A., Brandhorst S., Suarez J., Michalsen A., Cross A.H., Morgan T.E., et al. 断食を模した食事は再生を促進し、自己免疫および多発性硬化症の症状を軽減する。Cell Rep. 2016;15:2136-2146. doi: 10.1016/j.celrep.2016.05.009. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Paoli A., Tinsley G., Bianco A., Moro T. The influence of meal frequency and timing on health in humans: 絶食の役割。ニュートリエンツ(Nutrients). 2019;11:719. doi: 10.3390/nu11040719. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Cignarella F., Cantoni C., Ghezzi L., Salter A., Dorsett Y., Chen L., Phillips D., Weinstock G.M., Fontana L., Cross A.H., et al. Intermittent fasting confers protection in CNS autoimmunity by alterizing gut microbiota. Cell Metab. 2018;27:1222-1235. doi: 10.1016/j.cmet.2018.05.006. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Rangan P., Choi I., Wei M., Navarrete G., Guen E., Brandhorst S., Enyati N., Pasia G., Maesincee D., Ocon V., et al. ファスティング模倣食は微生物相を調節して腸の再生を促し、炎症性腸疾患の病態を軽減させます。Cell Rep. 2019;26:2704-2719. doi: 10.1016/j.celrep.2019.02.019. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Catterson、Khericha、Dyson、Vincent、Callard、Haveron、Rajasingam、Ahmad、Partridge L. 短期間の断続的な絶食は、腸の健康とTOR-Independent寿命延長を長期的にもたらす。Curr. Biol. 2018;28:1714-1724. doi: 10.1016/j.cub.2018.04.015. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Peruzzotti-Jametti L., Pluchino S. Targeting mitochondrial metabolism in neuroinflammation: 進行性多発性硬化症の治療法に向けて。Trends Mol. Med. 2018;24:838-855. doi: 10.1016/j.molmed.2018.07.007. [PubMed] [CrossRef] [Google Scholar].
Larrick J., Mendelsohn A.R. Roads to the fountain of youth? 若返り腸管幹細胞。Rejuvenation Res. 2019;22:342-347. doi: 10.1089/rej.2019.2251. [PubMed] [CrossRef] [Google Scholar].
Kohl K.D., Amaya J., Passement C.A., Dearing M.D., McCue M.D. 長期絶食に対する腸内細菌叢のユニークかつ共通の反応: 5種類の脊椎動物の宿主における比較研究。FEMS Microbiol. Ecol. 2014;90:883-894. doi: 10.1111/1574-6941.12442. [PubMed] [CrossRef] [Google Scholar].
Macfarlane G.T., Gibson G.R. Bacteroides fragilisによる糖タンパク質分解酵素の生成。FEMS Microbiol. Lett. 1991;77:289-293. doi: 10.1111/j.1574-6968.1991.tb04363.x. [PubMed] [CrossRef] [Google Scholar].
Sonnenburg J.L., Xu J., Leip D.D., Chen C.H., Westover B.P., Weatherford J., Buhler J.D., Gordon J.I. 腸に適応した細菌共生体による生体内での糖鎖採食(Glycan foraging in vivo). Science. 2005;307:1955-1959.doi:10.1126/science.1109051. [PubMed][CrossRef][Googleスカラー]。
Mucosal glycan foraging enhances fitness and transmission of a saccharolytic human gut bacterial symbiont. Cell Host Microbe. 2008;4:447-457. doi: 10.1016/j.chom.2008.09.007. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Thompson K.L., Applegate T.J. Feed withdrawal alters small-intestinal morphology and mucus of broilers. Poult. 2006;85:1535-1540. doi: 10.1093/ps/85.9.1535. [PubMed] [CrossRef] [Google Scholar].
Ercolini D., Fogliano V. ヒトの腸内細菌叢を養うための食品設計。J. Agric. Food Chem. 2018;66:3754-3758. doi: 10.1021/acs.jafc.8b00456. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Knudsen K.E.B., Lærke H.N., Hedemann M.S., Nielsen T.S., Ingerslev A.K., Nielsen D.S.G., Theil P.K., Purup S., Hald S., Schioldan A.G., et al. Diet-modulated butyrate production on intestinal barrier function and inflammation, Impact of diet modulated butyrate production. Nutrients. 2018;10:1499. doi: 10.3390/nu10101499. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
食餌性ポリフェノールとその代謝産物によるエネルギー代謝の調節における腸内マイクロエコロジーの役割。Food Nutr. Res. 2019;63 doi: 10.29219/fnr.v63.1518. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Rothhammer V., Quintana F.J. The aryl hydrocarbon receptor: 健康や病気における免疫反応を統合する環境センサー。Nat. Rev. Immunol. 2019;19:184-197. doi: 10.1038/s41577-019-0125-8. [PubMed] [CrossRef] [Google Scholar].
Haghikia A., Li X.S., Liman T.G., Bledau N., Schmidt D., Zimmermann F., Kränkel N., Widera C., Sonnenschein K., Haghikia A., et al. 腸内細菌叢依存性のトリメチルアミンN-オキシドにより脳卒中患者の心血管イベントのリスクを予測し、炎症性単球に関連性があるとした。Arterioscler. Thromb. Vasc. Biol. 2018;38:2225-2235. doi: 10.1161/ATVBAHA.118.311023. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Del Rio D., Zimetti F., Caffarra P., Tassotti M., Bernini F., Brighenti F., Zini A., Zanotti I. 腸内細菌代謝物トリメチルアミンN-オキシドはヒト脳脊髄液中に存在する。ニュートリエンツ(Nutrients). 2017;9:1053. doi: 10.3390/nu9101053. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Vogt N.M., Romano K.A., Darst B.F., Engelman C.D., Johnson S.C., Carlsson C.M., Asthana S., Blennow K., Zetterberg H., Bendlin B.B., et al. 腸内細菌由来の代謝物トリメチルアミンN酸化物はアルツハイマー病で高値を示す. Alzheimers Res. Ther. 2018;10:124. doi: 10.1186/s13195-018-0451-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
He C., Deng J., Hu X., Zhou S., Wu J., Xiao D., Darko K.O., Huang Y., Tao T., Peng M., et al. ビタミンAはLPSの腸管上皮バリア機能およびタイトジャンクション蛋白への作用を抑制する。Food Funct. 2019;10:1235-1242. doi: 10.1039/C8FO01123K. [PubMed] [CrossRef] [Google Scholar].
Cantorna M.T., Snyder L., Arora J. ビタミンAとビタミンDは、微生物の複雑さ、バリア機能、粘膜免疫反応を制御し、腸のホメオスタシスを確保する。Crit. Rev. Biochem. Mol. Biol. 2019;54:184-192. doi: 10.1080/10409238.2019.1611734. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Zhu W., Yan J., Zhi C., Zhou Q., Yuan X. 1,25(OH)2D3 欠乏による腸内細菌異常は、Cyp27b1ノックアウトマウスにおいて大腸粘液バリアを劣化させる。Gut Pathog. 2019;11:8. doi: 10.1186/s13099-019-0291-z. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Wang J., Ji H., Wang S., Liu H., Zhang W., Zhang D., Wang Y. プロバイオティクスLactobacillus plantarumは、上皮の強化と腸内細菌叢の調節により腸のバリア機能を促進する。Front. Microbiol. 2018;9:1953. doi: 10.3389/fmicb.2018.01953. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Piqué N., Berlanga M., Miñana-Galbis D. Health benefits of heat-killed (Tyndallized) probiotics: 概要 Int. J. Mol. Sci. 2019;20:2534. doi: 10.3390/ijms20102534. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Eutamene H., Beaufrand C., Harkat C., Theodorou V. The role of mucoprotectants in the management of gastrointestinal disorders. Expert Rev. Gastroenterol. Hepatol. 2018;12:83-90. doi: 10.1080/17474124.2018.1378573. [PubMed] [CrossRef] [Google Scholar].
Lopetuso L., Graziani C., Guarino A., Lamborghini A., Masi S., Stanghellini V. Gelatin tannate and tyndallized probiotics: 下痢の治療のための新しいアプローチ。Eur. Rev. Med. Pharmacol. Sci. 2017;21:873-883. [PubMed][Google Scholar].
Lopetuso L.R., Scaldaferri F., Bruno G., Petito V., Franceschi F., Gasbarrini A. 腸管バリア漏れの治療管理: 粘膜バリアプロテクターの新たな役割。Eur. Rev. Med. Pharmacol. Sci. 2015;19:1068-1076. [PubMed][Google Scholar].
Ochoa-Repáraz J., Mielcarz D.W., Begum-Haque S., Kasper L.H. Gut, bugs, and brain: 中枢神経系疾患の制御における常在菌の役割。Ann. Neurol. 2011;69:240-247. doi: 10.1002/ana.22344. [PubMed] [CrossRef] [Google Scholar].
Ochoa-Repáraz J., Kasper L.H. The microbiome and neurologic disease: 2方向からの相互作用の過去と未来。ニューロセラピューティクス. 2018;15:1-4. doi: 10.1007/s13311-018-0604-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Tang A.T., Choi J.P., Kotzin J.J., Yang Y., Hong C.C., Hobson N., Girard R., Zeineddine H.A., Lightle R., Moore T., et al. Endothelial TLR4 and the microbiome drive cerebral cavernous malformation. ネイチャー(Nature)。2017;545:305-310. doi: 10.1038/nature22075. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Wekerle H. 脳の自己免疫と腸内細菌叢:100兆のゲームチェンジャー。Trends Immunol. 2017;38:483-497. doi: 10.1016/j.it.2017.03.008. [PubMed] [CrossRef] [Google Scholar].
Vidya M.K., Kumar V.G., Sejian V., Bagath M., Krishnan G., Bhatta R. Toll-like receptors: 哺乳類における意義、リガンド、シグナル伝達経路、および機能。Int. Rev. Immunol. 2018;37:20-36. doi: 10.1080/08830185.2017.1380200. [PubMed] [CrossRef] [Google Scholar].
Huppert J., Closhen D., Croxford A., White R., Kulig P., Pietrowski E., Bechmann I., Becher B., Luhmann H.J., Waisman A., et al. Cellular mechanisms of IL-17-induced blood-brain barrier disruption,. FASEB J. 2010;24:1023-1034. doi: 10.1096/fj.09-141978. [PubMed] [CrossRef] [Google Scholar].
Wekerle H. 腸内分子が脳の炎症を制御する。Nature. 2018;557:642-643. doi: 10.1038/d41586-018-05113-0. [PubMed] [CrossRef] [Google Scholar].
酪酸は脱髄を抑制し、再髄化を促進する。J. Neuroinflammation. 2019;16:165. doi: 10.1186/s12974-019-1552-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Erny D., de Angelis A.L.H., Jaitin D., Wieghofer P., Staszewski O., David E., Keren-Shaul H., Mahlakoiv T., Jakobshagen K., Buch T., et al. Host microbiota constantly control maturation and function of microglia in CNS. Nat. Neurosci. 2015;18:965-977. doi: 10.1038/nn.4030. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Rothhammer V., Borucki D.M., Tjon E.C., Takenaka M.C., Chao C.C., Ardura-Fabregat A., de Lima K.A., Gutiérrez-Vázquez C., Hewson P., Staszewski O., et al. Microglial control of astrocytes in response to microbial metabolites. Nature. 2018;557:724-728. doi: 10.1038/s41586-018-0119-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
パーキンソン病における微生物-腸-脳軸とToll-Like Receptors.Int. J. Mol. Sci. 2018;19:1689. doi: 10.3390/ijms19061689. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Pantzaris M.C., Loukaides G.N., Ntzani E.E., Patrikios I.S. A novel oral nutraceutical formula of omega-3 and omega-6 fatty acids with vitamins (PLP10) in relapsing remitting multiple sclerosis: 無作為化、二重盲検、プラセボ対照の概念実証臨床試験。BMJ Open. 2013;3:e002170. doi: 10.1136/bmjopen-2012-002170. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Cani P.D. ヒト腸内細菌叢: 期待、脅威、そして約束。Gut. 2018;67:1716-1725. doi: 10.1136/gutjnl-2018-316723. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Foster K.R., Schluter J., Coyte K.Z., Rakoff-Nahoum S. The evolution of the host microbiome as an ecosystem on a leash. ネイチャー(Nature)。2017;548:43-51. doi: 10.1038/nature23292. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ベラーK.、ミュースM.、クトロロスM.、ラスビZ.A.、ボジキM.、ヨナーC.、ウェカーレH.、クリシュナモワースG. 共生微生物とミエリン自己抗原は協力して自己免疫性脱髄を誘発する。Nature. 2011;479:538-541. doi: 10.1038/nature10554. [PubMed] [CrossRef] [Google Scholar].
Cai R., Pan C., Ghasemigharagoz A., Todorov M.I., Förstera B., Zhao S., Bhatia H.S., Parra-Damas A., Mrowka L., Theodorou D., et al. 透明マウスの全周囲イメージングにより全身神経突起と頭蓋骨・髄膜結合が明らかになった。Nat. Neurosci. 2019;22:317-327. doi: 10.1038/s41593-018-0301-3. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Qi Y., Yu T., Xu J., Wan P., Ma Y., Zhu J., Li Y., Gong H., Luo Q., Zhu D. FDISCO: 臓器全体をイメージングするための先進的な溶媒ベースのクリアリング法。Sci. Adv. 2019;5 doi: 10.1126/sciadv.aau8355. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Mitra P.P., Rosa M.G., Karten H.J. Panoptic neuroanatomy: 全脳のデジタル顕微鏡検査と脳全体の回路マッピング。Brain Behav. 2013;81:203-205.doi:10.1159/000350241.Evol. [PubMed] [CrossRef] [Google Scholar].
