
ああ、腸が 神経変性疾患の微生物起源は本当か?
感染と免疫のロゴ
ジャーナルホーム
著者紹介
論文
ジャーナルについて
購読申し込み
ジャーナル
ログイン
戻る
抗菌薬と化学療法
応用・環境微生物学
臨床・ワクチン免疫学
臨床微生物学レビュー
エコサル・プラス
真核細胞
感染と免疫
細菌学ジャーナル
臨床微生物学ジャーナル
微生物学・生物学教育ジャーナル
ウイルス学ジャーナル
mバイオ
微生物学・分子生物学レビュー
微生物学リソース
微生物学スペクトラム
mSphere
mシステム
オープンアクセス
病原性と宿主応答
2023年9月26日
ああ、腸が 神経変性疾患の微生物起源は本当か?

著者 Alyssa Walker https://orcid.org/0000-0002-3508-7076, Daniel M. Czyz https://orcid.org/0000-0002-7491-5292 dczyz@ufl.eduAUTHORS INFO & AFFILIATIONS
DOI: https://doi.org/10.1128/iai.00437-22
特別シリーズ: 早期キャリア研究者からのミニインタビュー
PDF/EPUB
IAI
オンライン・ファースト
要旨
細菌感染症、抗生物質、タンパク質構造疾患
無症候性コロニー形成,抗菌薬耐性,タンパク質構造疾患
神経変性疾患のモデル生物
細菌が神経変性PCDに関与する可能性のある機序
結語
謝辞
参考文献
著者略歴
情報および貢献者
指標と引用
参考文献
図表とメディア
表
シェア
ABSTRACT
アルツハイマー病やパーキンソン病などの神経変性タンパク質構造疾患(PCDs)には、治療法や有効な治療法がない。しかし、PCDの発症における細菌の役割に関する現在の理解は、腸内細菌叢、口腔内細菌叢、膣内細菌叢といった特定のマイクロバイオームに関連する微生物群集の複雑さによって妨げられている。これらの特定の微生物叢の構成は、感染症、食事、生活習慣、抗生物質などの要因に影響される固有の指紋とみなされている。これらの因子はすべて、神経変性疾患の重症度にも影響する。微生物の寄与を明らかにする研究の大半は相関的なものであり、疾患の発症や進行に影響を及ぼす可能性のある個々の微生物の役割を解読するために、ミミズ、ハエ、マウスなどの様々なモデルが利用されている。最近、モデル生物とヒトの間で、グラム陰性腸内病原性細菌の存在とPCDの発症との間に正の相関関係があることが示された。これらの相関研究は、メカニズム的な説明を与えるものではないが、原因菌種を明らかにし、さらなる研究のための重要な基礎を提供するものである。PCDへの微生物の寄与に関連する懸念事項のひとつに、抗生物質耐性菌の増加や抗生物質管理の不備があり、これらは最終的に蛋白毒性菌、特に内在性耐性菌として知られるグラム陰性菌を選択することになる。本総説では、PCDに対する個々の微生物の寄与と、抗菌薬耐性の増加がもたらす潜在的影響について、既知のことを要約する。
細菌感染症、抗生物質、タンパク質コンフォメーション病
重金属やその他の有毒化学物質を中心とする抗菌薬の初期の広範な治療への応用は、19世紀初頭の細菌病理論に影響されたものであった(1)。興味深いことに、アルツハイマー病(AD)、パーキンソン病(PD)、ハンチントン病(HD)、筋萎縮性側索硬化症(ALS)などの神経変性タンパク質コンフォメーション病(PCDs)の最初の診断が下されたのも同じ時期であり(2-5)、重金属毒性に加えて、抗菌薬がこれらの疾患の病因に寄与した可能性を示唆している。PCDが最初に診断されたのは、人口の急激な増加や医療水準の向上により、診断が容易になった結果かもしれない。しかし、より顕著なのは、抗生物質の発見と実用化、特に抗生物質の「黄金時代」と呼ばれた20世紀後半以降、これらの疾患の発生率が急速に増加し始めたことである(6)。微生物がPCDsの病因に関与していることを示唆する証拠は増えてきているが、抗菌薬が防御微生物叢を駆逐することによっても、これらの疾病に関与しているのだろうか?もしそうであれば、抗菌薬は保護微生物を排除し、有害な細菌を増やすのだろうか?病原性細菌の抗菌薬耐性(AMR)の増加は、PCDの発症にどのような影響を及ぼすのだろうか?この総説では、現在の文献を要約することで、これらの興味深い疑問を解決しようと試みる。
細菌がPCD、より具体的にはパーキンソン病の病因に影響を及ぼしている可能性を最初に示唆したのはBraakである(7)。例えば、抗生物質が発見される以前は、スピロヘータ菌の一種であるトレポネーマ・パリダムによる性行為感染症である梅毒が、急速な認知機能低下を示す神経疾患である麻痺性痴呆の主な原因であり、精神病院への入所が大幅に増加していた(8, 9)。スピロヘータ感染症は後にADと関連づけられた(10, 11)。20世紀初頭に初めて成功した治療法のひとつは、ヒ素を主成分とする抗菌薬サルバルサンの発見と商品化であり、次いでペニシリンが発見され、効果的な治療法が提供された結果、T. pallidium感染に伴う神経学的合併症が解消された(12, 13)。神経変性疾患への微生物の寄与を示すさらなる証拠が、抗菌性サルファ剤であるダプソンを投与された日本のハンセン病患者で観察された。この薬剤を投与された患者は、認知症になる可能性が2倍以上低かった(14)。ダプソンの保護作用がオフターゲット効果によるものなのか、あるいは癩菌を標的とすることで間接的に病気の病原性に影響を与えたのかは不明である。別の研究では、マイコプラズマの存在がALSと関連している。Nicolsonらは、ALS患者の83%(30/36)に血液培養でマイコプラズマが検出されたのに対し、対照群ではわずか2.8%(2/70)であったことを明らかにした(15)。マイコプラズマ肺炎は急性パーキンソニズムとも関連している(16)。最近では、抗生物質が慢性感染症のPCD患者の疾患表現型を緩和することが示されている。例えば、AD患者の88%がヘリコバクター・ピロリ感染と診断されたのに対し、対照群では46.7%であり、臨床試験と集団ベースの研究の両方において、病原体の除菌は疾患の進行抑制と関連していた(17-19)。オメプラゾール、クラリスロマイシン、アモキシシリンからなる抗生物質カクテルによるピロリ菌除菌は、ADに関連する症状を改善し、認知機能および機能的スキルを向上させた(18)。さらに、ある集団ベースの研究では、ピロリ菌の除菌が認知症の進行を抑制することが明らかにされた(19)。ピロリ菌による腸内感染は、腸管透過性の亢進(20)やパーキンソン病の病原性(21、22)と関連している。腸管透過性の亢進は、腸内の内容物を体内の他の部位に拡散させる可能性がある。実際、ADを含むPCD患者の脳からは、細菌やその産物が検出されている(23-25)。B群連鎖球菌(GBS)などの他の細菌は、ヒトのマイクロバイオームの様々な部位に無症候性にコロニー形成する常在細菌叢の一部である(26)。GBSは腸管上皮細胞の細胞間結合を破壊することが知られており(27)、これが腸管透過性の変化をもたらし、細菌およびおそらく腸内細菌叢の他のメンバーの置換を引き起こすと考えられる。興味深いことに、若年者における溶連菌感染後の急性パーキンソニズムが観察されている(28-30)。高齢者、慢性感染症患者(34)、ADやALS患者(23、35)では、PCDの病原性に関与する細菌性内毒素であるリポ多糖(LPS)の循環レベルの上昇が検出されており(31)、腸管透過性と脳障害の関連は明らかである。LPSはまた、マウスモデルにおいてPDの病態に寄与することが示されている(36、37)。これらのエビデンスを総合すると、抗生物質が神経変性疾患に対してある程度の予防効果を発揮することが示唆されるが、それは感染症との関連においてであろう。
抗生物質はPCDの病原性を抑制する効果があるようだが、感染がない場合にはその効果は明らかではない。ある種の抗生物質、例えばテトラサイクリン系抗生物質は、in vitroでさまざまなタンパク質アミロイドと直接相互作用し、その凝集を阻害することが見いだされたため、有望な治療候補であった(38-41)。神経変性疾患の病因に抗生物質が蛋白毒性を持つことを支持する証拠が増えている。例えば、2つの全国的な事例研究において、抗生物質がPCDのリスクを高めることが判明した(43, 44)。SunらはスウェーデンのALS患者2,484人における抗生物質の使用状況を分析し、すべての抗生物質、特にβ-ラクタマーゼ感受性のペニシリンに関連したリスクの上昇を見出した(44)。これらの結果は、防御微生物叢の崩壊が疾患の病因に関与している可能性を示唆しているが、他の研究ではペニシリンによる防御効果が示されている(45)。ALSの病原性に対する抗生物質の影響におけるこのような相違は、おそらく2つの要因に起因していると考えられる。そのため、基礎的な感染症がない場合、ペニシリン投与はSunらによって観察されたように有害であるか、ALSの病原性に影響を及ぼさないかのどちらかであろう。ALSに対する抗生物質の有害な作用は、テトラサイクリン系の抗生物質であるミノサイクリンで治療された患者にもみられ、病気の進行を促進し、死亡率を増加させた(47)。テトラサイクリン系抗生物質は、原核生物のリボソームと可逆的に結合し、最終的に翻訳を阻害することによって細菌の増殖を阻害することが知られている(48)。しかし、最近のデータでは、テトラサイクリン系抗生物質は真核生物のリボソームとも相互作用することが示唆されており(49)、真核生物の翻訳速度に影響を与え、最終的に、タンパク質毒性に最も敏感な不安定化凝集しやすいタンパク質の発現を緩和する可能性がある。動物モデルにおけるミノサイクリンの神経保護効果は多くの研究で証明されているが、ヒトにおける有効性を支持する証拠はほとんどない(50, 51)。ミノサイクリンのヒトにおける有効性の欠如は、約170のADのトランスジェニックマウスモデルで最初にテストされた潜在的な治療薬の失敗率が100%であったことを考えると、驚くべきことではないかもしれない(52)。テトラサイクリンのin vitroとin vivoの動物モデル対ヒトにおける有効性のこのような不一致は、ヒトとネズミの腸内細菌叢の違いに起因している可能性があり、細菌種はわずか10%しか共有されていない(53)。感染症がない場合の抗生物質の有害な効果と一致するように、フィンランドの大規模な研究では、PDリスクに対する抗生物質の使用量の影響を分析している。約14,000人のPD患者を分析した結果、マクロライド系、リンコサミド系、テトラサイクリン系、スルホンアミド系、トリメトプリム系など、さまざまな抗菌薬に暴露された後に発症するリスクが高いことが明らかになった(43)。14,000人の女性を対象とした最近の研究で、Mehtaらは軽度の抗生物質使用から7年後に検出可能な認知機能低下を認めた(54)。さらに、スウェーデン人集団における初期および中期の抗生物質使用に関する最近の解析では、ADおよびPDとの有意な関連が明らかになった(55)。抗生物質の有害作用は、313,161人のコホートにおいて抗生物質の投与期間と認知症リスクの上昇を関連づけた別の研究によってさらに支持されている(56)。これらの知見を総合すると、抗生物質の保護作用は、おそらくPCDの病因に寄与するタンパク毒性細菌の根絶と関連しており、一般的な抗生物質の使用は、おそらく保護的マイクロバイオームを変化させることによって、後年PCDのリスクを増加させる可能性がある。
抗生物質は、宿主に神経保護を与える細菌を減少させることにより、神経変性疾患のリスクを高める可能性がある。例えば、臨床データから、プレボテラ属の細菌の存在量は、ALS(57)、PD(58-66)、マウスADモデル(67)など、さまざまなPCDの病原性や有病率と負の相関があることが明らかになっている。また、プレボテラ属の減少は、PD患者の運動症状に最大20年先行する便秘とも関連している(46, 68)。これらの結果は、腸内細菌叢の変化が病気の原因であり、結果ではないことを示唆している。Global Biodiversity Information Facilityによると、プレボテラ属には61種が存在するが(69)、ヒトの疾患と関連しているのは約20種のみである(70)。そのため、属レベルで結果を報告することは、細菌の貢献についての真の理解を妨げることになる。プレボテラ属細菌の神経保護的役割の根底にあるメカニズムは未知のままであるが、最近の研究で、特定の種(すなわち、disiensとcorporis)が線虫における有毒なポリグルタミン(polyQ)の凝集を減少させることが明らかになった(71, 72)。ブタとラットを用いた研究では、抗生物質の使用はプレボテラ属菌の相対的な存在量を減少させることが示されており(73, 74)、ヒトにおいても同様の効果が期待できることが示唆され、抗生物質と神経変性疾患との関連を裏付けるものと考えられる(43, 44)。アンピシリンはラットの微生物叢の組成を著しく変化させ、ADの2つの特徴である記憶障害とグルココルチコイドレベルの上昇を含む生理的・心理的変化と関連することが示された(75)。強力な抗酸化作用で知られる常在菌であるラクトバチルス・ファーメンタム(Lactobacillus fermentum)をプロバイオティクスで補充すると、前述の問題や腸内細菌異常症が改善された(76)。例えば、L. fermentumとL. plantarumを含むプロバイオティック・カクテルはショウジョウバエのADの発症と進行を遅らせた(77)。一方、ラクトバチルス属を含む別のプロバイオティック・カクテルはマウスのPD症状を緩和し(78)、ラットのAD症状を軽減した(79)。興味深いのは、動物モデルでADを効果的に治療した治療薬の100%がヒト臨床試験で失敗したのに対し、細菌を介したアプローチではそうではないということである。例えば、二重盲検無作為化試験では、発酵菌を含むラクトバチルス属を含むプロバイオティクス・カクテルが、12週間のサプリメント摂取後にAD患者の認知機能を改善することが示された(80)。これらの結果を総合すると、抗生物質が誘発する腸内細菌異常症のリスク、特に神経変性PCDのリスクが強調される。
われわれの最近の研究から、宿主のプロテオスタシスが細菌プロテオームの変化によって影響を受けることが明らかになった。我々は、タンパク質凝集体の存在量が増加した細菌が線虫の腸に定着すると、宿主のプロテオスタシスが破壊されることを示した(72)。Walkerらは、アミノグリコシド系の抗生物質であるゲンタマイシンが、誤翻訳やタンパク質のミスフォールディングを誘導することで細菌を殺すことが知られているが(81)、この抗生物質にさらされた細菌にコロニー形成された線虫では、細菌由来のタンパク質凝集体(BDPA)の存在量が増加するだけでなく、ポリQの凝集も促進されることを示した(72)。抗生物質は細菌を特異的に標的としていることから、これらの結果は、抗生物質が宿主プロテオームの安定性にも間接的に影響を及ぼす可能性を示唆している。事実、抗生物質は細菌の病原性と持続性に生理的な役割を果たす未同定のBDPAを誘導することがある(82)。これらの結果を総合すると、抗生物質は一般に受け入れられているほど宿主に対して不活性ではなく、ヒトのマイクロバイオームの構成に影響を与え、BDPAを増強することによって、PCDの発症に寄与する可能性があることが懸念される。
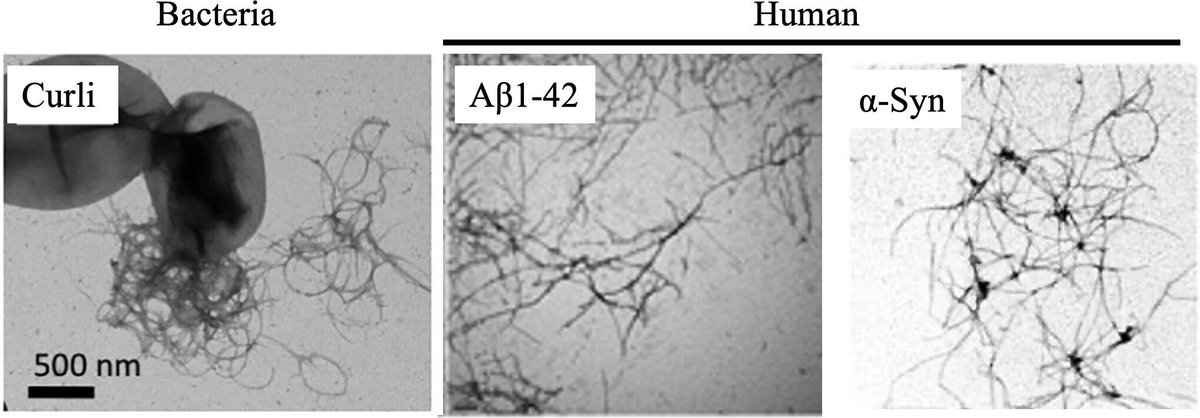
ヒトの腸内には、少なくともヒトの体内の細胞と同数の細菌が生息していると推定されているが、細菌の遺伝子数はヒトのそれを100倍以上もはるかに上回っている(83, 84)。従って、宿主のプロテオスタシスに影響を与え、最終的にPCDの病因に関与する細菌遺伝子が存在することは驚くべきことではない。主に腸内細菌科に属するグラム陰性細菌(85)は、機能性アミロイドであるキュリーを産生する。キュリーは凝集して細胞外マトリックスを形成し、ADやPDなどのPCDに関連する凝集体に酷似している(図1)。これらの細菌の機能性アミロイドは、細胞接着、バイオフィルム形成、抗生物質耐性に関与しており、最近の研究では、これらのタンパク質がPCDの病因にも関与している可能性が示唆されている(86-91)。
図1
図1 細菌とヒトのタンパク質凝集体。(左)細菌のcurli(許可を得て文献(86)から複製)。(中)ヒトAβ1-42(許可を得て文献(92)から複製)。(右)ヒトα-シヌクレイン(許可を得て文献(93)から複製)。
例えば、シュードモナスが産生するアミロイドであるFapCは、in vitroでのα-シヌクレインとアミロイドβ(Aβ)の凝集に影響を与え、ゼブラフィッシュにおけるAD発症を促進した(94, 95)。興味深いことに、嚢胞性線維症(CF)患者の約80%が18歳までに緑膿菌にコロニー形成されている(96)。CFは非神経変性性PCDであるにもかかわらず、最近の研究によると、CF患者は認知機能障害や脳組織の変化を示している(97,98)。CF患者の平均寿命は、30〜40歳であ り、PDやADなどのPCDの平均診断年齢より20〜 30歳短い(99,100)。したがって、この年齢差が、 CFと神経変性PCDとの間に明らかな相関がない理由 である可能性がある。しかし、CF患者が、血清アミ ロイドA蛋白(SAA)の凝集による二次性アミロイドーシスを 発症していることは、驚くべきことである(101)。興味深いことに、SAAのレベルは、CF患 者の肺における緑膿菌の存在と相関しており、 抗生物質によって減少することが示されている。これは、 細菌(この場合、緑膿菌)が宿主のプロテオスタシ スの崩壊に関与しているという仮説をさらに裏付けて いる(102)。
抗生物質が神経変性疾患と関連していることを示唆す る間接的な証拠としては、一般人口における抗生物質 の使用状況があげられる。驚くべきことに、45歳と65歳でアルツハイマー型認知症を発症する生涯リスクは、男性に比べて女性の方が2倍近く高い(105, 106)。これらの結果は、中年期の女性における抗生物質の使用が7年後の認知機能の低下と関連することを報告したMehtaらの所見を支持するものである(54)。さらに、女性は腸内のプレボテラ属菌の存在量が少なく、これらの細菌の神経保護特性が疑われることから、女性と男性のADリスクの違いに寄与している可能性がある(107-109)。動物におけるプレボテラ属菌の存在量と抗生物質の使用量との相関関係(73, 74)に基づくと、抗生物質の使用量の増加は、プレボテラ属菌の存在量の低下とADおよび認知症のリスクの増加と関連している可能性がある。抗生物質とADを関連付ける他の証拠は、AD有病率と抗生物質消費量の相関関係に基づいている。興味深いことに、2018年のサーベイランスデータによると、イタリアとギリシャの認知症有病率は全ヨーロッパ諸国の中で最も高かった(110)。2010年、これら2カ国は抗生物質の最大消費国のひとつでもあり(111)、2010年、イタリアは家畜における抗生物質の最大使用国でもあった(112)。これらのデータは、世界的な抗生物質消費量と認知症との間に驚くべき相関関係があることを明らかにし、ADや認知症を含むいくつかの神経変性疾患のリスク上昇と抗生物質使用とを関連付けるこれまでの報告を支持するものと考えられる(43, 44, 47, 56)。世界的な抗生物質消費量と性特異性に加えて、最近のコロナウイルス疾患2019(COVID-19)の大流行は、社会的孤立(113)、戸締まりや社会的距離による社会活動へのアクセスの減少(114、115)、そして最も重要なこととして抗生物質の過剰使用(116)のためと思われるが、認知症や認知症関連死のリスクを高めている。さらに最近、COVID-19はADのリスクを2倍に増加させ、ADに関連した死亡は16%増加したと推定された(117, 118)。ウイルスがADの病態に直接影響するのか、それともパンデミックの上記の結果による影響なのかは明らかではないが、ウイルスの炎症作用、二次感染、抗生物質の不衛生な使用-これらはすべてPCDの病因に寄与することが知られている-を示唆する証拠がある。10,403人の肺炎患者を調査したところ、COVID-19に関連した肺炎に罹患した患者の3%が新たに認知症を発症しており、この発症率はCOVID-19を発症していない患者よりもはるかに高いことが明らかになった(119)。肺炎は以前にも重症患者のPCDと関連していた(120)。ある研究では、COVID-19による入院が認知機能の低下と関連していることが指摘されており、重症のCOVID-19患者ではその発生率は26%以上に達した(121)。最近のプレプリントでは、重症COVID-19患者の脳内にアミロイド沈着物が存在することも報告されている(122)。重症COVID-19患者は経験的抗生物質治療を受けていることに注意することが重要である(123)。さらに、デンマークの集団ベースの研究で、ZarifkarらはCOVID-19がADとPDの頻度をそれぞれ3.4倍と2.2倍増加させることを発見した(124)。この研究では、COVID-19の後にほとんどの神経疾患の頻度は他の呼吸器感染症の後に比べて高くなかったことから、有害な影響は抗生物質治療や一般的な炎症によるものである可能性が示唆された。
COVID-19とADの関連は、抗生物質管理の乱れや基礎にある二次的な細菌感染によって説明される可能性があるが、AD発症における他のウイルス感染の役割の可能性も確立されている。しかし、コロナウイルス以外にも、単純ヘルペスウイルス、ヒトサイトメガロウイルス、エプスタイン・バーウイルス、C型肝炎、ピコルナウイルス、ボルナ病ウイルス、インフルエンザなどのウイルスが認知機能の低下と関連しており、その存在がADや他のPCDと関連している例もあることを強調しておきたい(125-127)。一般的な細胞外細菌とは異なり、ウイルスは偏性細胞内寄生虫であり、その結果、細胞のタンパク質恒常性維持機構を乗っ取り、しばしば熱ショックタンパク質を本来の役割から遠ざけてしまう(128)。そのため、前述のウイルスの多くが熱ショック反応を活性化し、不安定化した疾患関連宿主タンパク質のミスフォールディングや凝集を引き起こす可能性があることは、驚くにはあたらない(129)。さらに、ウイルスは神経細胞にも影響を及ぼし、変性を引き起こすことが知られている(130, 131)。
抗生物質は細菌を直接標的にし、腸内細菌叢の組成を急速に変化させるが、微生物バランスに影響を与える要因はそれだけではない(132)。アルコール摂取(133、134)、喫煙(135)、身体活動(136)、食事などの因子が腸内細菌叢に影響を与えることが知られている(137)。Louridaらは、20万人近い参加者のコホートにおいて、これらの因子と認知症との関連を調べた。驚くことではないが、適度な飲酒、禁煙、定期的な身体活動、健康的な食事に関連した健康的なライフスタイルは、認知症の発症リスクを低下させた(138)。
まとめると、多くの細菌感染が神経変性PCDの発症に関連しており、特定の細菌が特定のPCDに関連しているのではなく、むしろ宿主のプロテオスタシスを全般的に破壊し、疾患発症に現れる有害なタンパク質の凝集を引き起こすようである。PCDの有病率を低下させるためには、年齢を問わず、感染予防と抗生物質管理の厳格化プログラムを実施する必要がある。
無症候性コロニー形成、抗菌薬耐性、タンパク質コンフォメーション病
抗生物質は驚異の薬として知られる必須医薬品であるが、AMRの増加により、その有効性は徐々に失われつつある。実際、AMRは世界最大の医療問題の一つとして浮上しており、すでに年間495万人が死亡していると推定されている(139)。早急な対策を講じなければ、死亡者数は2050年までに10倍に増加すると予測されている(140)。AMRは、微生物学と神経科学の接点に位置する文献の現在の解釈に基づき、この総説で提唱されているように、PCDの有病率に影響を及ぼす可能性の高い悲惨な危機である。PCDに関連する細菌種、特にグラム陰性菌の多くは、内在性および獲得性の抗生物質耐性で知られている。多くの場合、これらの耐性菌はPCDと関連しており、無症候性にヒトの腸内に定着することが知られている。抗生物質を投与すると、防御的な微生物叢は除去されるが、耐性菌株は豊富になる。最近の研究では、抗生物質を短期間投与するだけでも、腸内細菌叢の中で耐性遺伝子が選択されることが示されている(141)。抗生物質によってこのような無症候性常在菌が増加すると、症状が現れる何年も前に、静かにPCDの発症に関与している可能性がある。例えば、抗生物質の投与は、マウスにおいてKlebsiella pneumoniaeやProteus mirabilisと同様に、試験管内で緑膿菌を増加させることが示された(142, 143)。腸内における緑膿菌と肺炎桿菌の増加はPCDと関連しており、これらの細菌の多剤耐性(MDR)株は病院や地域社会で一般的にみられる(144-146)。P.mirabilisは常在菌とみなされる日和見病原体であり、その存在量は非PD対照群と比較して敗血症PD患者では5倍高かった(147, 148)。さらに、これらの細菌を経口投与すると、マウスの脳でα-シヌクレインの凝集が誘発され、PD様症状が増強された(149)(表1にすべての細菌-動物モデルをまとめた)。興味深いことに、前述の3つの病原体すべてが、線虫の腸に定着すると、毒性ポリQの凝集とそれに伴う毒性を増加させることが示された(71)。
表1
表1 神経変性疾患モデル動物fに対する菌株特異的影響のまとめ
細菌 モデルタンパク質 疾患 発見源
Acinetobacter baumannii Worm polyQ PolyQb タンパク質のフォールディング環境を破壊し、有毒な polyQの凝集を引き起こした。 (71)
Acinetobacter baylyi Worm polyQ PolyQb タンパク質のフォールディング環境が破壊され、毒性を持つポリQが凝集した。 (71)
Agathobaculum butyriciproducens マウス N/A PD PD関連の表現型にポジティブな効果を示した。 (150)
アガソバクラム Butyriciproducens マウス APP/PS1 AD LPS処理した野生型マウスの認知障害を緩和し、APP/PS1マウスのアミロイド斑を減少させた。 (151)
Akkermansia muciniphila マウス APP/PS1 AD 認知機能障害を改善し、脳内 Aβ斑を減少させた。 (152)
Akkermansia muciniphila ラット Aβ AD Aβ沈着物を減少させ、認知障害を緩和した。 (153)
Bacillus subtilis ワーム α-シヌクレイン PD α-シヌクレインの凝集を抑制し、あらかじめ形成された凝集体を除去した。 (154)
Bacillus subtilis Worm Aβ AD 野生型ワームの老化と神経細胞の劣化を遅延させた。Aβモデルでは、この細菌は運動障害を緩和し、寿命を延長した。 (155)
Bifidobacterium bifidumc Mouse MitoParka PD プロバイオティクスカクテルはドーパミン作動性ニューロンの神経保護作用を示し、運動障害を抑制した。 (78)
Bifidobacterium bifidum Mouse APP/PS1 (5xFAD) AD 認知機能とAD病態を低下させた。 (156)
Bifidobacterium breve マウス Aβ AD 脳室内投与したAβにより誘発される認知機能障害を予防した。 (157)
Bifidobacterium infantisd ラット Aβ AD Aβの海馬注射を受けたラットにおいて、記憶を改善し、Aβ斑を減少させた。 (158)
Bifidobacterium longume Fly APP-BACE1 AD プロバイオティクスカクテルは、Aβ斑の形成を経時的に減少させた。 (77)
Bifidobacterium longumc マウス MitoParka PD ドパミン作動性ニューロンに対する神経保護作用と運動障害を抑制した。 (78)
Bifidobacterium longum マウス APP/PS1 AD 認知機能低下を抑制し、海馬におけるAβ斑の蓄積を抑制した。 (159)
Bifidobacterium longum マウス APP/PS1 (5xFAD) AD 認知機能とAD病態を低下させた。 (156)
Chlamydia pneumoniae マウス N/A AD 脳におけるAβ沈着を誘導し、沈着密度、サイズ、数は感染期間に比例して増加した。 (160)
Citrobacter freundii Worm polyQ PolyQb タンパク質のフォールディング環境を破壊し、有毒なpolyQの凝集を引き起こした。 (71)
Clostridium butyricum マウス APP/PS1 AD 認知障害や神経変性が改善し、Aβ沈着が抑制された。 (161)
Enterococcus faecalis ミミズ polyQ PolyQb polyQの凝集を促進した。 (162)
Erwinia carotovora ハエ Aβ AD 脳の液胞変性亢進、運動障害、寿命短縮。 (163)
大腸菌 ハエ polyQ PolyQb polyQ 凝集の亢進、運動障害、寿命低下。 (164)
大腸菌 ミミズ polyQ PolyQb タンパク質のフォールディング環境が破壊され、有毒な polyQ の凝集を引き起こした。 (71)
大腸菌 マウス APP (Tg2576) AD 認知機能の障害と海馬ニューロンの壊死を引き起こした。 (165)
Klebsiella aerogenes Worm polyQ PolyQb タンパク質のフォールディング環境を破壊し、毒性のある polyQ の凝集を引き起こした。 (71)
Klebsiella oxytoca Worm polyQ PolyQb タンパク質のフォールディング環境を破壊し、毒性のあるポリQを凝集させた。 (71)
Klebsiella pneumoniae Worm polyQ PolyQb タンパク質の折りたたみ環境が破壊され、有毒なポリQが凝集した。 (71)
Lactobacillus casei ハエ Aβ AD ADのハエに見られる荒れた目の表現型を回復させた。 (166)
Lactobacillus fermentum Fly Aβ AD ADを持つハエに見られる荒れた目の表現型を回復させた。 (166)
Lactobacillus fermentume Fly APP-BACE1 AD プロバイオティクスカクテルはAβ斑の形成を経時的に減少させた。 (77)
Lactococcus lactisc マウス MitoParka PD プロバイオティクスカクテルはドーパミン作動性ニューロンに対する神経保護作用を示し、運動障害を抑制した。 (78)
Lactobacillus paracasei Fly Aβ AD 目の変性を抑制した。 (167)
Lactobacillus plantarume Fly APP-BACE1 AD Aβ斑の形成を抑制した。 (77)
Lactobacillus plantarumc マウス MitoParka PD ドパミン作動性ニューロンの神経保護作用と運動障害を抑制した。 (78)
Lactobacillus plantarum ラット N/A AD表現型を誘導するD-ガラクトシダーゼの腹腔内注射により誘導される認知障害およびその他の病理学的表現型を改善した。 (79)
Lactobacillus plantarum ハエ Aβ AD ADのハエに見られる荒れた目の表現型を回復させた。 (166)
Lactobacillus reuterid ラット Aβ AD Aβを海馬に注射したラットの記憶力を改善し、Aβ斑を減少させた。 (158)
Lactobacillus rhamnosisc Mouse MitoParka PD プロバイオティクスカクテルは、ドーパミン作動性ニューロンに対する神経保護作用を示し、運動障害を抑制した。 (78)
Lactobacillus rhamnosusd Rat N/A AD プロバイオティクスカクテルは、Aβの海馬注射を受けたラットの記憶を改善し、Aβ斑を減少させた。 (158)
Lactobacillus rhamnosusc Mouse MitoParka PD プロバイオティクスカクテルはドーパミン作動性ニューロンの神経保護作用を示し、運動障害を抑制した。 (78)
Lactobacillus sakei ハエ Aβ AD 眼球変性を抑制した。 (167)
Porphyromonas gingivalis マウス APP AD 認知機能障害、海馬と皮質におけるAβ沈着増加。 (168)
Porphyromonas gingivalis マウス APP AD 生きた細菌(加熱死菌ではない)を脳内注射するとAβ沈着が増加した。 (169)
Porphyromonas gingivalis Rat N/A AD カプセル化株は、認知障害を誘発し、海馬のタウのリン酸化亢進と同様にAβレベルを上昇させた。 (170)
Prevotella corporis ミミズ polyQ PolyQb polyQの凝集とそれに伴う毒性を抑制した。 (71)
プレボテラ・ジシエンス ワムシ polyQ PolyQb ポリQ凝集とそれに伴う毒性を抑制した。 (71)
Proteus mirabilis Worm polyQ PolyQb タンパク質のフォールディング環境を破壊し、有毒なポリQ凝集を引き起こした。 (71)
Proteus mirabilis マウス N/A PD 脳と結腸における運動性の障害とα-シヌクレインの凝集。 (149)
緑膿菌 Worm polyQ PolyQb タンパク質の折りたたみ環境を破壊し、有毒な polyQ の凝集を引き起こした。 (71, 72)
緑膿菌マウス アミロイド・タウAD 肺炎により肺内皮によるアミロイド・タウパチー産生が始まる。 (171)
Pseudomonas entomophila ハエ Aβ AD 脳の空胞変性の亢進、運動障害、寿命の低下。 (163)
Salmonella enterica ワムシ polyQ PolyQb タンパク質の折り畳み環境が破壊され、毒性のある polyQ が凝集した。 (71)
Salmonella Typhimurium マウス APP/PS1 (5XFAD) AD Aβ沈着が増強され、Aβ沈着と共局在化した。 (172)
Shigella sonnei Worm polyQ PolyQb タンパク質のフォールディング環境を破壊し、毒性ポリQの凝集を引き起こした。 (71)
a
TFAMのドパミン作動性特異的欠損により、PDの表現型が再現される。MitoParkは、ドパミン作動性ニューロンが選択的に転写因子TFAM(ミトコンドリア転写因子A)を欠損するPDの遺伝子モデルであり、その結果、PDに見られる症状や表現型が再現される。
b
ポリQはプロテオスタシスのセンサーとして用いられたが、グルタミン "Q "リピートが異常に長く伸びることを特徴とするHDのようなCAGリピート病のモデルでもある。
c
細菌株は、6つの細菌株からなるプロバイオティックカクテルの一部であった: ビフィドバクテリウム・ビフィダム、ビフィドバクテリウム・ロンガム、ラクトバチルス・ラムノーシス、ラクトバチルス・ラムノーサス、ラクトバチルス・プランタラム、ラクトコッカス・ラクティス。
d
細菌株は3つの細菌株からなるプロバイオティックカクテルの一部であった: ラクトバチルス・ロイテリ(Lactobacillus reuteri)、ラクトバチルス・ラムノサス(Lactobacillus rhamnosus)、ビフィドバクテリウム・インファンティス(Bifidobacterium infantis)。
e
細菌株は、3つの細菌株からなるプロバイオティックカクテルの一部であった: ラクトバチルス・プランタラム、ラクトバチルス・ファーメンタム、ビフィドバクテリウム・ロンガム。
f
アルツハイマー病(AD)、パーキンソン病(PD)、ハンチントン病(HD)、筋萎縮性側索硬化症(ALS)。Aβ、アミロイドβ;APP、アミロイド前駆体タンパク質;BACE-1、β部位アミロイド前駆体タンパク質切断酵素1;FAD、家族性アルツハイマー病;N/A、該当なし;polyQ、ポリグルタミン;PS1、プレセニリン-1;TFAM、ミトコンドリア転写因子A。「Worm」はCaenorhabditis elegans、「Fly」はDrosophila melanogaster、「Mouse」はMus musculus、「Rat」はRattus norvegicusの代わりに使用。
老人ホーム入居者の感染症の50%以上がMDR菌によるものであり、高齢で素因のある集団に抗生物質耐性が多く存在することを示している(173)。認知症のアメリカ人の70%近くが老人ホームで死亡すると推定されている(174)。また、介護施設での認知症患者の感染症の再発や、その結果としての抗生物質の使用も頻発している(175)。実際、長期療養者は一般的にタンパク毒性を持つことが知られているMDRグラム陰性菌に汚染されており、このような汚染は進行した認知症と強く関連している(176)。従って、ナーシングホームはMDR菌のホットスポットであり、抗生物質の過剰使用は、認知症や他の神経症状の一因となる耐性グラム陰性蛋白毒性菌の濃縮を促進する可能性が高い。この声明を裏付けるように、最近の研究では、メタゲノム配列決定を用いて、進行した認知症患者グループの微生物叢におけるAMR遺伝子の存在を調査し、耐性遺伝子密度とP. mirabilis、Enterococcus faecalis、Escherichia coliの相対的存在量との間に関連があることを発見した(177)。著者らはさらに、これらの菌株は腸内の多くの常在菌よりも耐性遺伝子を多く持っていることを示した。驚くことではないが、これらの細菌はPCDのリスク増加にも関連している(表1)。例えば、ある研究では、PD患者では腸球菌の存在が増加することが明らかにされており(178)、また線虫ではフェカリス菌が毒性ポリQの凝集を増加させた(162)(表1)。AD患者の脳では大腸菌由来のLPSが豊富であり(179)、PD患者ではEscherichia-Shigellaの量が有意に増加していることが判明した(178)。大腸菌の病原株はまた、polyQショウジョウバエモデルにおける運動能力やADマウスにおける認知機能を障害することが示されている(164, 165)(表1)。先に述べたように、P. mirabilisもヒトのPDと関連していた(148)。
ポルフィロモナス・ジンジバリスは一般的に口腔感染症に関連しているが、口腔疾患のない人の最大25%に認められるように、無症候性にコロニー形成することもある(180)。P.gingivalisの産物はAD患者の脳から発見され、この細菌はマウスにおいて疾患の発症を促進することが示された(181)(表1)。ラットの口蓋粘膜にP. gingivalisのカプセル化株を注射すると、記憶障害、Aβレベルの上昇、海馬でのタウ低リン酸化が起こり、P. gingivalisの脳内注射はマウスのAβ沈着を増加させた(169, 170)。同様の所見は別のマウス研究でも認められ、P. gingivalisを経口接種すると認知機能が低下し、ADマウスの海馬と大脳皮質におけるAβ沈着レベルが上昇した(168)(表1)。広域抗生物質がこの細菌を根絶することはまれであり、MDR株の出現や選択を招く可能性があり(182)、抗生物質の使用がこの細菌の存在を濃縮する懸念が高まっている。このような疾患関連菌の濃縮は、無症候性にコロニー形成されている可能性があり、すでにPCDのリスクを抱えている人々にとって特に問題となる。
患者データから蓄積された証拠は、肺炎クラミジアがAD発症に関与している可能性を示唆している(183)。最も説得力のある証拠としては、C. pneumoniaeのDNAが、健常対照者の〜5%に対し、ADの脳の〜90%に認められたことである(184)。この細菌を経鼻接種すると、感染マウスの脳にAβが沈着した(160)(表1)。C.pneumoniaeは肺炎の原因菌であるが、大半の症例では無症状で存在する可能性が高い。20歳の50%がこの細菌に対する抗体を持ち、60~70歳では75%に増加する。また、3~5年の限られた抗体反応のため、生涯を通じて一般的に人に感染し、再感染すると考えられている(185)。従って、抗生物質の使用は、無症候性で病原体にコロニー形成され、その存在量を増やしている人々における耐性を助長する可能性がある(図2)。
図2
図2 神経変性タンパク質のコンフォメーション病に対する抗生物質の効果。抗菌剤は、常在菌である抗生物質感受性菌(AbS)を死滅させ、腸-脳軸を介してタンパク質のフォールディングを阻害する産物やシグナルを分泌すると考えられているタンパク毒性を有する抗生物質耐性菌(AbR)を抑制する。細菌は直接的または間接的な相互作用を通じてPCDの発症に影響を及ぼす可能性がある。直接的:細菌とその産物は宿主のプロテオスタシス(タンパク質合成、フォールディング、輸送、分解)を直接調節することができる。間接的:細菌は非特異的に炎症と活性酸素・窒素種(RONS)の発生を誘導し、宿主のプロテオスタシスをさらに破壊する。
神経変性PCDのモデル生物
神経変性PCDのモデル生物としてよく用いられるのは、線虫の線虫Caenorhabditis elegans、ミバエのショウジョウバエDrosophila melanogaster、ラットやマウスなどのげっ歯類である。線虫は単一の細菌種によって容易にコロニー形成されるため、宿主と細菌の相互作用を研究するための魅力的なツールとなっている。さらに、その神経細胞ネットワークは完全にマッピングされており、進化的に保存されたタンパク質のホメオスタシスネットワークは、一般的な真核生物のタンパク質フォールディングに関連する生理学的プロセスに関する決定的な文献を生み出す余裕を与えている(187)。従って、線虫は間違いなく、タンパク質フォールディング病に対するバクテリアの影響を研究するのに最も適したモデル生物の一つである。線虫と比較すると、D. melanogasterは高次の生物であり、脳を持つため、より洗練された行動が可能で、認知機能や運動機能の初歩的な評価だけでなく、脳の病理組織学的分析も可能である。例えば、線虫は透明で、蛍光レポーターやセンサーをリアルタイムで検出することが可能であり、線虫とD. melanogasterで同様の実験を行う場合、前者の方が手間がかからないと考えられる。無脊椎動物に分類されるため、ハエも線虫も動物福祉上の制限はない。げっ歯類のモデルは、その生理機能がヒトに近いという点で有利であるが、高価であり、特に寿命がはるかに長いため、加齢に伴う疾患を研究する場合には、実験に時間と労力がかかる。さらに、ネズミはヒトでの失敗率が100%であることから、PCD治療薬を同定するのに適したモデルではないようである(52)。しかしながら、げっ歯類を用いた研究を含め、数多くの研究が動物モデルを用いて、様々な細菌とPCDの病原性を関連付けている。本節では、表1に示した文献の結果の一部を要約するが、表1のすべての情報をここで詳しく説明するわけではない。これらの細菌の一部とPCDとの関連については、前のセクションで詳しく述べている。
すべての神経変性PCDの特徴の一つは、凝集傾向の高いタンパク質を、折り畳まれた無毒な状態で維持する細胞能力の欠如である。蛍光性ポリQレポーターを発現するトランスジェニック線虫は、タンパク質毒性ストレスに応答して定量可能な凝集を示す(71, 162, 188, 189)。ポリQ凝集の変化を検出するセンサーとしてこれらの菌株を用いることで、細胞のプロテオスタシスに影響を与える微生物や微生物産物の発見が可能になった(71, 72, 190)。緑膿菌は、宿主のプロテオスタシスを強固に破壊し、ポリQ凝集を引き起こす微生物のひとつであった(71)。ヒトやマウスモデルで緑膿菌がPCDに関連しているのに加え(145, 171, 191-194)、緑膿菌はADハエモデルでも疾患関連表現型を悪化させた(163)。また、サルモネラ腸炎菌が宿主のプロテオスタシスを破壊することを示すミミズで得られた結果とも一致し、この微生物がADマウスのアミロイド沈着を促進することがわかった(172)。PCDに対する微生物の寄与が、ヒトと動物モデルの間、あるいはモデル内で一致していることは、他の細菌についても明らかである。例えば、前述のPD患者におけるP. mirabilisの役割に加え、この細菌はミミズやマウスなどの動物モデルにおいてもPCDの病原性に寄与していた(71, 149)。病原性大腸菌は線虫のプロテオスタシスを破壊し、HDハエやADマウスモデルにおいて疾患関連表現型を引き起こした(71, 164, 165)。別の研究では、線虫のpolyQモデルを用いて、フェカリス菌が宿主のプロテオスタシスを破壊することを、polyQ凝集の促進によって評価した(162)。E.フェカリス菌は通常、常在細菌叢の一部であるが、腸内細菌叢に異常が生じると、濃縮され、腸管バリアが損なわれ、感染症として現れることがある(195)。前節で述べたように、腸管上皮の損傷は細菌の置換を促進する可能性があり、このことはAD患者の脳における微生物の存在の著しい増加を説明しうる(24, 196)。
腸内細菌異常症は様々な疾患に関与しており、PCD患者では広く報告されている(197)。ヒトや様々な動物モデルを用いた数多くの研究で、神経変性疾患に対する微生物の不均衡の影響をさらに検討するために、細菌を用いて腸内細菌異常症を誘発または逆転させることが行われている。例えば、エルビニア・カロトボーラ(Erwinia carotovora)を用いてADハエに腸内細菌叢異常を誘導し、腸内細菌叢異常がADの表現型に及ぼす影響を調べた(163)。著者らがこの細菌を選んだのは、非病原性でありながら、腸内に留まりコロニー形成することができるからである。そのため、著者らは、この細菌による微生物異常がADの表現型を悪化させ、病原性P. entomophilaを用いても同様の結果が得られたと主張した。プロバイオティクス細菌の摂取は腸内エビオシスの回復に役立つと考えられており、ビフィズス菌や乳酸菌は、ヒトの認知機能にも影響を及ぼすことが知られている代表的な例である(198, 199)。Leeらは、ビフィドバクテリウム・ロンガムがADマウスの認知機能障害を緩和することを示し、このポジティブな効果は腸内微生物共生の回復と関連していた(159)。B. longumは、2つの別々の研究でプロバイオティック・カクテルとして使用され、それぞれハエとマウスにおけるADとPDの病理学的変化に対してポジティブな効果を示した(77, 78)。ビフィドバクテリウム属の保護的役割に関するさらなる証拠は、ハエのPDとげっ歯類のADに対する抑制効果を示した研究から得られている(77, 156-158, 200)。他の有益な細菌はラクトバチルス属に由来し、PDマウスモデル(78)、ADハエモデル(166、167)、ADラットモデル(79)において良好な結果と関連している。
L.plantarumは、タンパク質の凝集を抑制することが示された短鎖脂肪酸である酪酸を産生する能力を持つ一方で、豚では酪酸菌を濃縮することも知られている(71, 201, 202)。酪酸は、ALSマウスにおいて腸管エビオシスを回復させ、神経保護をもたらすことが示された(203)。Walkerらは、外因性酪酸の補給、および酪酸を過剰産生するように操作された細菌が、線虫のプロテオスタシスに有益であることを、ポリQ凝集の減少およびそれに伴う毒性によって評価した(71)。L. plantarumに加えて、枯草菌も酪酸産生菌を増やすことが示された(204)。しかし、枯草菌が線虫の腸に定着すると寿命が延び、α-シヌクレインの凝集が抑制され逆転し、運動障害やその他のADに関連した表現型が緩和されたことから、神経毒性からの保護における枯草菌の役割はより直接的であると思われる(154, 155, 205)。興味深いことに、枯草菌は日本の納豆のような大豆製品の発酵に使われており、その神経保護特性で知られている(206, 207)。Akkermansia muciniphilaは、腸管透過性と酪酸菌の増殖を促進するセンチネル微生物として登場した(208)。この細菌は、ADげっ歯類モデルにおける認知障害やAβ斑の減弱など、多くの健康上の利点があることで知られているが、PCD患者(主にPD)におけるその存在は、病原性と相関している(152, 153, 209, 210)。Agathobaculum butyriciproducensのような酪酸産生菌が豊富な微生物群集は、健康的な植物性食品からなる食事と関連している(211)。A. butyriciproducensは、マウスにおいてADやPDに関連した表現型を改善することが示されている(150, 151)。一般に、Clostridium butyricumを含む酪酸菌は、動物モデルやヒトにおいて神経保護作用と関連している(161, 212, 213)。
細菌が神経変性PCDに関与する可能性のあるメカニズム
細菌が神経変性PCDに影響を及ぼす正確なメカニズムはわかっていない。しかし、よく研究されている宿主と微生物の相互作用に基づくと、影響を受ける経路には、炎症反応と、タンパク質の合成からフォールディング、輸送、分解に至る宿主のプロテオスタシスのあらゆる側面が関与している可能性が高い。炎症とプロテオスタシスの間のクロストークは、プロテオ毒性をさらに誇張する可能性があり、炎症がプロテオスタシスを破壊し、それが炎症を誘発することが知られている(214)。さらに、細菌は宿主の活性酸素と窒素種(RONS)の産生と放出を促進し、これらもまた炎症を引き起こし、プロテオスタシスを破壊する(図2)(215, 216)。上記のような反応は、主に細菌に対する自然免疫反応の一部として引き起こされるため、非特異的に宿主のプロテオスタシスの破壊に寄与するが、他の反応は微生物に特異的である。例えば、緑膿菌は、嚢胞性線維症膜貫通型レセプターのクリアランスに関与する宿主の脱ユビキチン化酵素であるUSP10を阻害し、タンパク質の濃縮と輸送に影響を与える(217)。緑膿菌は、翻訳やタンパク質のフォールディングなど、宿主の他のプロセスにも影響を与える(218, 219)。緑膿菌が宿主の幅広いプロセスに影響を与えることは、細菌が宿主のプロテオスタシス、ひいてはPCDに関連するタンパク質の安定性に影響を与える複数の潜在的メカニズムを示している。他の細菌も宿主のストレス応答を直接制御することがわかった。例えば、クラミジアは小胞体崩壊タンパク質応答の主要なメディエーターであるIRE1αを活性化し、その結果、PCDに影響を及ぼすことが知られている2つの病原体認識受容体(PRR)、NOD1およびNOD2、NF-κBを含む主要な炎症分子のカスケードを活性化する(220-222)。toll様受容体、ヌクレオチド結合オリゴマー化ドメイン様受容体、欠失型メラノーマ-2様受容体など、細菌性病原体に反応する様々なタイプのPRRも炎症に導入され、PCDの病原性に寄与している可能性が高い(223)。
結語
この総説では、神経変性PCDに対する微生物の寄与に関する現在の研究を要約し、細菌は直接的および間接的なメカニズムを通じて、宿主プロテオーム内にコードされている不安定化したタンパク質に無差別に影響を及ぼすことを提案した。このように、細菌やその産物は、ミスフォールディングや凝集を起こしやすい宿主タンパク質に影響を与える。ある種の細菌は、タンパク毒性につながるタンパク質のフォールディングの恒常性に、より強く影響を及ぼすかもしれませんが、その細菌が引き起こす疾患は、準安定化プロテオームの程度と、不安定化変異を緩衝するプロテオスタシスネットワークの能力にのみ依存します。
AMRの出現に抗生物質が関与していることから、抗生物質スチュワードシップは、すべてのOne Health部門(医療、農業、環境)の最優先事項となりつつある。しかし、PCDsの微生物病原体に関するデータは限られており、理解も進んでいないため、これらの衰弱性疾患の予防・管理戦略において抗生物質スチュワードシップは重視されていない。PCDの病因における抗生物質の役割について、抗生物質が不活性ではないことを示唆するエビデンスが増加しており、処方者は、PCD患者だけでなく、高齢者やあらゆる年齢層の人々に抗菌薬治療戦略を推奨または実施する際には、そのことを認識すべきである。
AMRの蔓延が進むにつれ、より多くの細菌が耐性を獲得し、抗菌薬治療により、タンパク毒性を持つグラム陰性菌の濃縮が進むと同時に、保護微生物叢が根絶されることになる(図2)。したがって、AMRは必然的にPCDsの蔓延に影響を及ぼす。
発表された膨大な文献は、主にADとPDに集中している。そのため、これら2つの疾患に対する微生物の寄与については、他のPCDよりもはるかによく理解されている。文献の分析によると、散発性のADとPD、そしておそらく他のPCDは、腸内細菌叢を標的とすることで予防が可能であり、おそらく管理可能であると考えられる。
謝辞
蛋白質コンフォメーション病に対する細菌の寄与に関する我々の研究を支援してくれた、米国国立加齢研究所(R03AG070580およびR03AG069056)、米国感染症学会など、以前および現在の資金提供者に感謝したい。さらに、スタートアップ資金を提供してくれた私の所属する微生物学・細胞科学科に感謝したい。
本総説の長さには限りがあるため、多くの重要かつ関連性の高い研究を引用することはできなかったが、神経変性疾患における細菌の役割の解明に取り組んでいるすべての研究者に感謝の意を表したい。
なお、著者らは競合する利害関係はないと宣言している。
参考文献
1.
Gould K. 2016. 抗生物質:先史時代から現代まで。J Antimicrob Chemother 71:572-575.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
2.
Hippius H、Neundörfer G. 2003。アルツハイマー病の発見。Dialogues Clin Neurosci 5:101-108.
引用文献へ
相互参照
PubMed
グーグル奨学生
3.
ジェームズ・パーキンソン 2002. 外科医のロイヤルカレッジのメンバー、揺さぶり麻痺に関するエッセイ。J Neuropsychiatry Clin Neurosci 14:223-236.
引用文献へ
相互参照
パブコメ
Google Scholar
4.
Bhattacharyya KB. 2016. ジョージ・ハンティントンと彼の病気の物語。Ann Indian Acad Neurol 19:25-28.
引用文献へ
クロスレフ
パブコメ
国際医療福祉大学
Google Scholar
5.
Glicksman MA. 2011. 筋萎縮性側索硬化症治療薬の前臨床探索。Expert Opin Drug Discov 6:1127-1138.
引用文献へ
引用文献
パブコメ
国際医療福祉大学
グーグル
6.
Brumback RA, Leech RW. 1994. アルツハイマー病:病態生理学と治療への希望。J Okla State Med Assoc 87:103-111.
引用文献へ
PubMed
Google Scholar
7.
Braak H, Rüb U, Gai WP, Del Tredici K. 2003. 特発性パーキンソン病:脆弱な神経細胞タイプが未知の病原体による神経浸潤を受ける可能性のある経路。J Neural Transm (Vienna) 110:517-536.
引用文献へ
相互参照
パブコメ
ISI研究所
グーグル
8.
Daey Ouwens IM, Lens CE, Fiolet ATL, Ott A, Koehler PJ, Verhoeven WMA. 2015. オランダの精神病院における心神喪失者の全身麻痺の臨床像、1924-1954年。Eur Neurol 74:54-59.
引用文献へ
Crossref
パブコメ
国際精神医学会
グーグル
9.
Lafond RE, Lukehart SA. 2006. 梅毒の生物学的基盤。Clin Microbiol Rev 19:29-49.
引用文献へ
引用文献
パブコメ
ISI研究所
Google Scholar
10.
Miklossy J. 2015年。スピロヘータ感染とアルツハイマー病の因果関係を支持する歴史的証拠。Front Aging Neurosci 7:46.
引用文献へ
引用文献
PubMed
ISI研究所
グーグル
11.
Miklossy J. 2011年。アルツハイマー病-神経スピロヘータ症。コッホとヒルの基準に従った証拠の分析。J Neuroinflammation 8:90.
引用文献へ
相互参照
パブコメ
ISI(国際標準化機構
Google Scholar
12.
Ghanem KG. 2010. 総説:神経梅毒:歴史的展望と総説。CNS Neurosci Ther 16:e157-68.
引用文献へ
引用文献
パブコメ
国際放射線学会
グーグル
13.
Valent P, Groner B, Schumacher U, Superti-Furga G, Busslinger M, Kralovics R, Zielinski C, Penninger JM, Kerjaschki D, Stingl G, Smolen JS, Valenta R, Lassmann H, Kovar H, Jäger U, Kornek G, Müller M, Sörgel F. 2016. Paul Ehrlich (1854-1915) and his contributions to the foundation and birth of translational medicine. J Innate Immun 8:111-120.
引用文献へ
相互参照
PubMed
Google Scholar
14.
McGeer PL, Harada N, Kimura H, McGeer EG, Schulzer M. 1992. ハンセン病患者における痴呆の有病率:慢性薬物療法の明らかな影響。Dement Geriatr Cogn Disord 3:146-149.
引用文献へ
クロスリファレンス
Google Scholar
15.
Nicolson GL, Nasralla MY, Haier J, Pomfret J. 2002. 湾岸戦争退役軍人および筋萎縮性側索硬化症(ALS)の一般市民における全身性マイコプラズマ感染の高頻度。J Clin Neurosci 9:525-529.
引用文献へ
引用文献
PubMed
国際放射線学会
グーグル
16.
Kim JS, Choi IS, Lee MC. 1995. 肺炎マイコプラズマ感染後の可逆性パーキンソニズムとジストニア。Mov Disord 10:510-512.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
17.
Kountouras J, Tsolaki M, Gavalas E, Boziki M, Zavos C, Karatzoglou P, Chatzopoulos D, Venizelos I. 2006. ヘリコバクター・ピロリ感染とアルツハイマー病の関係。Neurology 66:938-940.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
18.
Kountouras J, Boziki M, Gavalas E, Zavos C, Grigoriadis N, Deretzi G, Tzilves D, Katsinelos P, Tsolaki M, Chatzopoulos D, Venizelos I. 2009. ヘリコバクター・ピロリの除菌はアルツハイマー病の治療に有効である。J Neurol 256:758-767.
クロスレフ
PubMed
ISI研究所
Google Scholar
19.
Chang Y-P, Chiu G-F, Kuo F-C, Lai C-L, Yang Y-H, Hu H-M, Chang P-Y, Chen C-Y, Wu D-C, Yu F-J. 2013. ヘリコバクター・ピロリの除菌は認知症の進行と関連する:集団ベースの研究。Gastroenterol Res Pract 2013:175729.
Crossref
PubMed
ISI研究所
Google Scholar
20.
福田雄一郎、坂庭秀樹、奥井雅人、田村和也、谷田直樹、里見光弘、下山智彦、西上敏明、2001. ヘリコバクター・ピロリ感染による胃および腸の粘膜透過性の亢進。Digestion 63 Suppl 1:93-96.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
21.
McGee DJ, Lu X-H, Disbrow EA. 2018. Stomaching the possibility of a pathogenic role for Helicobacter pylori in Parkinson's disease. J Parkinsons Dis 8:367-374.
引用文献へ
クロスレフ
パブコメ
Google Scholar
22.
Dobbs SM, Dobbs RJ, Weller C, Charlett A. 2000. ヘリコバクター・ピロリ感染と特発性パーキンソニズムとの関連。Med Hypotheses 55:93-98.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
23.
Zhang R, Miller RG, Gascon R, Champion S, Katz J, Lancero M, Narvaez A, Honrada R, Ruvalcaba D, McGrath MS. 2009. 散発性筋萎縮性側索硬化症(sALS)における循環エンドトキシンと全身性免疫活性化。J Neuroimmunol 206:121-124.
Crossref
PubMed
ISIについて
Google Scholar
24.
Emery DC, Shoemark DK, Batstone TE, Waterfall CM, Coghill JA, Cerajewska TL, Davies M, West NX, Allen SJ. 2017. 16S rRNA次世代シーケンサー解析により、アルツハイマー病死後脳の細菌が明らかになった。Front Aging Neurosci 9:195.
Crossref
PubMed
ISI社
Google Scholar
25.
Ambrosini YM, Borcherding D, Kanthasamy A, Kim HJ, Willette AA, Jergens A, Allenspach K, Mochel JP. 2019. 神経変性疾患における腸脳軸とイヌモデルの関連性:レビュー。Front Aging Neurosci 11:130.
引用文献へ
クロスレフ
パブコメ
国際医療福祉大学
グーグル
26.
Shabayek S, Spellerberg B. 2018. B群連鎖球菌のコロニー形成、分子的特徴、疫学。Front Microbiol 9:437.
引用文献へ
クロスレフ
パブコメ
ISI研究所
Google Scholar
27.
Soriani M, Santi I, Taddei A, Rappuoli R, Grandi G, Telford JL. 2006. B群連鎖球菌は、ヒト上皮細胞を副細胞的経路で通過する。J Infect Dis 193:241-250.
引用文献へ
相互参照
パブコメ
ISI研究所
グーグル
28.
McKee DH, Sussman JD. 2005. 症例報告:連鎖球菌感染と大脳皮質基底核抗体に関連した重症急性パーキンソニズム。Mov Disord 20:1661-1663.
引用文献へ
クロスレフ
パブコメ
国際医療福祉大学
グーグル
29.
Kutty SK, Zainulabid UA. 2021. 若年成人における連鎖球菌感染後の急性パーキンソニズム。Bangladesh J Infect Dis 7:110-112.
引用文献へ
クロスリファレンス
Google Scholar
30.
Ben-Pazi H, Livne A, Shapira Y, Dale RC. 2003. 連鎖球菌性咽頭炎後のパーキンソン症状。J Pediatr 143:267-269.
引用文献へ
クロスレフ
パブコメ
桑原邦彦
グーグル
31.
Kelly JR, Kennedy PJ, Cryan JF, Dinan TG, Clarke G, Hyland NP. 2015. Breaking down the barriers: The gut microbiome, intestinal permeability and stress-related psychiatric disorders. Front Cell Neurosci 9:392.
引用文献へ
Crossref
パブコメ
国際医療福祉大学
グーグル
32.
Batista CRA, Gomes GF, Candelario-Jalil E, Fiebich BL, de Oliveira ACP. 2019. Lipopolysaccharide-induced neuroinflammation as a bridge to understand neurodegeneration. Int J Mol Sci 20:2293.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
Google Scholar
33.
ブラウンGC. 2019. 神経変性のエンドトキシン仮説。J Neuroinflammation 16:180.
引用文献へ
相互参照
パブコメ
ISI研究所
Google Scholar
34.
Glaros TG, Chang S, Gilliam EA, Maitra U, Deng H, Li L. 2013. 低悪性度内毒素血症と炎症性疾患の原因と結果。Front Biosci (Schol Ed) 5:754-765.
引用文献へ
引用文献
パブコメ
Google Scholar
35.
Zhan X, Stamova B, Sharp FR. 2018. リポ多糖はアルツハイマー病脳におけるアミロイド斑、神経細胞、オリゴデンドロサイトと会合する:レビュー。Front Aging Neurosci 10:42.
引用文献へ
相互参照
パブコメ
ISI研究所
グーグル
36.
Gorecki AM, Preskey L, Bakeberg MC, Kenna JE, Gildenhuys C, MacDougall G, Dunlop SA, Mastaglia FL, Akkari PA, Koengten F, Anderton RS. 2019. パーキンソン病における腸内細菌叢の変化と、ヒトΑシヌクレイン過剰発現マウスモデルにおけるリポ多糖の影響。Front Neurosci 13:839.
引用文献へ
相互参照
パブコメ
ISI研究所
グーグル
37.
Deng I, Corrigan F, Zhai G, Zhou X-F, Bobrovskaya L. 2020. パーキンソン病のリポ多糖動物モデル:最近の進歩と臨床疾患との関連性。Brain Behav Immun Health 4:100060.
引用文献へ
相互参照
パブコメ
グーグル奨学生
38.
Gautieri A, Beeg M, Gobbi M, Rigoldi F, Colombo L, Salmona M. 2019. ドキシサイクリンの抗アミロイド生成作用:Aβ42との相互作用に関する分子力学的研究。Int J Mol Sci 20:4641.
引用文献へ
相互作用
パブコメ
国際医療福祉大学
Google Scholar
39.
De Luigi A, Mariani A, De Paola M, Re Depaolini A, Colombo L, Russo L, Rondelli V, Brocca P, Adler-Abramovich L, Gazit E, Del Favero E, Cantù L, Salmona M. 2015. ドキシサイクリンはフェニルアラニン線維集合体を阻害し、フェニルケトン尿症における新規治療アプローチの可能性を明らかにした。Sci Rep 5:15902.
引用文献へ
相互参照
PubMed
Google Scholar
40.
Cardoso I, Merlini G, Saraiva MJ. 2003. 4'-Iodo-4'-deoxydoxorubicin and tetracyclines disrupt transthyretin amyloid fibril in vitro producing noncytoxic species: screening for TTR fibril disrupters. FASEB J 17:803-809.
引用文献へ
引用文献
パブコメ
ISI研究所
グーグル
41.
Forloni G, Colombo L, Girola L, Tagliavini F, Salmona M. 2001. テトラサイクリン類の抗アミロイド形成活性:in vitroでの研究。FEBS Lett 487:404-407.
引用文献へ
引用文献
PubMed
国際医療福祉大学
グーグル
42.
Loeb MB、Molloy DW、Smieja M、Standish T、Goldsmith CH、Mahony J、Smith S、Borrie M、Decoteau E、Davidson W、McDougall A、Gnarpe J、O'DONNell M、Chernesky M. 2004年。アルツハイマー病患者に対するドキシサイクリンとリファンピンのランダム化比較試験。J Am Geriatr Soc 52:381-387.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
43.
Mertsalmi TH, Pekkonen E, Scheperjans F. 2020. フィンランドにおける抗生物質曝露とパーキンソン病リスク:全国症例対照研究。Mov Disord 35:431-442.
Crossref
PubMed
ISI研究所
Google Scholar
44.
Sun J, Zhan Y, Mariosa D, Larsson H, Almqvist C, Ingre C, Zagai U, Pawitan Y, Fang F. 2019. スウェーデンにおける抗生物質の使用と筋萎縮性側索硬化症のリスク。Eur J Neurol 26:1355-1361.
クロスレフ
PubMed
国際医学会
Google Scholar
45.
Tuk B, Jousma H, Gaillard PJ. 2017. ペニシリンGとヒドロコルチゾンによる治療はALS関連症状を軽減する:3人の患者のケースシリーズ。F1000Res 6:410.
引用文献へ
Crossref
PubMed
グーグル奨学生
46.
Adams-Carr KL, Bestwick JP, Shribman S, Lees A, Schrag A, Noyce AJ. 2016. パーキンソン病に先行する便秘:系統的レビューとメタ分析。J Neurol Neurosurg Psychiatry 87:710-716.
Crossref
PubMed
ISI社
Google Scholar
47.
Gordon PH, Moore DH, Miller RG, Florence JM, Verheijde JL, Doorish C, Hilton JF, Spitalny GM, MacArthur RB, Mitsumoto H, Neville HE, Boylan K, Mozaffar T, Belsh JM, Ravits J, Bedlack RS, Graves MC, McCluskey LF, Barohn RJ, Tandan R, Western ALS Study Group. 2007. 筋萎縮性側索硬化症患者におけるミノサイクリンの有効性:第III相無作為化試験。Lancet Neurol 6:1045-1053.
Crossref
PubMed
ISI研究所
Google Scholar
48.
Chopra I, Roberts M. 2001. テトラサイクリン系抗生物質:作用機序、用途、分子生物学、耐性菌の疫学。Microbiol Mol Biol Rev 65:232-260.
引用文献へ
引用文献
パブコメ
国際医療福祉大学
グーグル
49.
Mortison JD, Schenone M, Myers JA, Zhang Z, Chen L, Ciarlo C, Comer E, Natchiar SK, Carr SA, Klaholz BP, Myers AG. 2018. テトラサイクリンは、主要なヒトrRNA部分構造を標的として翻訳を修飾する。Cell Chem Biol 25:1506-1518.
引用文献へ
引用文献
パブコメ
ISI研究所
Google Scholar
50.
Cankaya S, Cankaya B, Kilic U, Kilic E, Yulug B. 2019. パーキンソン病におけるミノサイクリンの治療的役割。Drugs Context 8:212553.
引用文献へ
クロスレフ
PubMed
グーグル奨学生
51.
Garrido-Mesa N、Zarzuelo A、Gálvez J. 2013。ミノサイクリン:抗生物質をはるかに超えて。Br J Pharmacol 169:337-352。
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
52.
Mullane K, Williams M. 2019. アルツハイマー病の前臨床モデル:関連性とトランスレーショナル妥当性。Curr Protoc Pharmacol 84:e57.
Crossref
PubMed
グーグル奨学生
53.
Kieser S, Zdobnov EM, Trajkovski M. 2022. マウス微生物叢の包括的ゲノムカタログから、ヒトとの大きな違いが明らかになった。PLoS Comput Biol 18:e1009947.
引用文献へ
引用文献
パブコメ
国際医学総合研究所
Google Scholar
54.
Mehta RS, Lochhead P, Wang Y, Ma W, Nguyen LH, Kochar B, Huttenhower C, Grodstein F, Chan AT. 2022. 女性における中年期の抗生物質使用とその後の認知機能との関連。PLoS One 17:e0264649.
クロスレフ
PubMed
国際標準化機構
グーグル
55.
Sun J, Ludvigsson JF, Ingre C, Piehl F, Wirdefeldt K, Zagai U, Ye W, Fang F. 2022. 人生の初期および中期における病院での感染症とアルツハイマー病、パーキンソン病、筋萎縮性側索硬化症のリスク:スウェーデンにおける全国規模のネステッド症例対照研究。PLoS Med 19:e1004092.
引用文献へ
相互参照
パブコメ
ISI研究所
グーグル
56.
Kim M、Park SJ、Choi S、Chang J、Kim SM、Jeong S、Park YJ、Lee G、Son JS、Ahn JC、Park SM。2022. 抗生物質と認知症リスクとの関連:レトロスペクティブ・コホート研究。Front Pharmacol 13:888333.
Crossref
PubMed
国際医学総合研究所
Google Scholar
57.
Hertzberg VS, Singh H, Fournier CN, Moustafa A, Polak M, Kuelbs CA, Torralba MG, Tansey MG, Nelson KE, Glass JD. 2022. 筋萎縮性側索硬化症患者と配偶者対照の腸内細菌叢の違い。筋萎縮性側索硬化症前頭側頭変性症 23:91-99.
引用文献へ
相互参照
パブコメ
ISI研究所
グーグル
58.
Gerhardt S, Mohajeri MH. 2018. パーキンソン病およびその他の神経変性疾患における大腸細菌組成の変化。Nutrients 10:708.
引用文献へ
クロスレフ
PubMed
グーグル奨学生
59.
Scheperjans F, Aho V, Pereira PAB, Koskinen K, Paulin L, Pekkonen E, Haapaniemi E, Kaakkola S, Eerola-Rautio J, Pohja M, Kinnunen E, Murros K, Auvinen P. 2015. 腸内細菌叢はパーキンソン病と臨床表現型に関連している。Mov Disord 30:350-358.
引用文献へ
Crossref
PubMed
国際医療福祉大学
グーグル
60.
Jin M, Li J, Liu F, Lyu N, Wang K, Wang L, Liang S, Tao H, Zhu B, Alkasir R. 2019. パーキンソン病患者における腸内細菌叢の解析。Front Neurosci 13:1184.
引用文献へ
クロスレフ
パブコメ
国際医療福祉大学
グーグル
61.
Hopfner F, Künstner A, Müller SH, Künzel S, Zeuner KE, Margraf NG, Deuschl G, Baines JF, Kuhlenbäumer G. 2017. 北ドイツのコホートにおけるパーキンソン病の腸内細菌叢。Brain Res 1667:41-45.
引用文献へ
相互参照
PubMed
ISI研究所
グーグル
62.
Barichella M, Severgnini M, Cilia R, Cassani E, Bolliri C, Caronni S, Ferri V, Cancello R, Ceccarani C, Faierman S, Pinelli G, De Bellis G, Zecca L, Cereda E, Consolandi C, Pezzoli G. 2019. パーキンソン病と非定型パーキンソニズムにおける腸内細菌叢の解明。Mov Disord 34:396-405.
引用文献へ
相互参照
PubMed
国際医療福祉大学
グーグル
63.
Aho VTE, Pereira PAB, Voutilainen S, Paulin L, Pekkonen E, Auvinen P, Scheperjans F. 2019. パーキンソン病における腸内細菌叢:時間的安定性と疾患進行との関係。EBioMedicine 44:691-707.
引用文献へ
相互参照
パブコメ
ISI研究所
グーグル
64.
Petrov VA, Saltykova IV, Zhukova IA, Alifirova VM, Zhukova NG, Dorofeeva YB, Tyakht AV, Kovarsky BA, Alekseev DG, Kostryukova ES, Mironova YS, Izhboldina OP, Nikitina MA, Perevozchikova TV, Fait EA, Babenko VV, Vakhitova MT, Govorun VM, Sazonov AE. 2017. パーキンソン病患者における腸内細菌叢の解析。Bull Exp Biol Med 162:734-737.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
65.
Bedarf JR, Hildebrand F, Coelho LP, Sunagawa S, Bahram M, Goeser F, Bork P, Wüllner U. 2017. 早期L-DOPA-Naveパーキンソン病患者における微生物およびウイルス腸内メタゲノム変化の機能的意味。Genome Med 9:61.
引用文献へ
相互参照
PubMed
ISI研究所
グーグル
66.
Mertsalmi TH, Aho VTE, Pereira PAB, Paulin L, Pekkonen E, Auvinen P, Scheperjans F. 2017. 便秘以上の症状-パーキンソン病における腸の症状と腸内細菌叢との関連。Eur J Neurol 24:1375-1383.
引用文献へ
相互参照
パブコメ
ISI研究所
グーグル
67.
Shen L, Liu L, Ji H-F. 2017. Alzheimer's disease histological and nbsp;behavioral manifestations in and nbsp;transgenic mice correlate with and nbsp;specific and nbsp;gut microbiome state. J Alzheimers Dis 56:385-390.
引用文献へ
引用文献
パブコメ
国際医療福祉大学
グーグル
68.
サヴィカR、カーリンJM、グロッサルトBR、バウワーJH、アールスコグJE、マラガノアDM、バルーチャAE、ロッカWA。2009. パーキンソン病に先行する便秘の医療記録:症例対照研究。神経学 73:1752-1758.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
69.
事務局 G. 2022. GBIF事務局: GBIFバックボーン分類法。https://www.gbif.org/species/5284517 から入手可能。
引用
Google Scholar
70.
ギャレット WS. 2015. J. E. Bennett、R. Dolin、M. J. Blaser編。249 - Bacteroides, prevotella, porphyromonas, and Fusobacterium species (and other medically important anaerobic gram-negative bacilli), in mandell, douglas, and bennett's principles and practice of infectious diseases. 第8版、2773-2780頁。W.B. Saunders, Philadelphia.
引用文献へ
グーグル・スカラー
71.
Walker AC, Bhargava R, Vaziriyan-Sani AS, Pourciau C, Donahue ET, Dove AS, Gebhardt MJ, Ellward GL, Romeo T, Czyż DM. 2021. ヒト腸内細菌病原体による線虫の腸内コロニー形成はプロテオスタシスの破壊を引き起こし、酪酸によってその破壊が救済される。PLoS Pathog 17:e1009510.
クロスレフ
PubMed
ISI研究所
Google Scholar
72.
Walker AC, Bhargava R, Dove AS, Brust AS, Owji AA, Czyż DM. 2022. 細菌由来のタンパク質凝集体は、宿主のプロテオスタシスの崩壊に寄与する。Int J Mol Sci 23:4807.
クロスレフ
PubMed
ISI研究所
グーグル
73.
郭麗(Guo L)、張大(Zhang D)、傅斯(Fu S)、張捷(Zhang J)、張旭(Zhang X)、何慈(He J)、彭慈(Peng C)、張耀(Zhang Y)、邱毅(Qiu Y)、葉慈(Ye C)、劉耀(Liu Y)、呉瑞(Wu Z)、胡慈亜(Hu C-AA. 2021. コリスチン硫酸塩がブタの腸内細菌叢に及ぼす影響のメタゲノム解析。Front Vet Sci 8:663820.
クロスレフ
PubMed
Google Scholar
74.
Liu C, Cheng X, Zhong S, Liu Z, Liu F, Lin X, Zhao Y, Guan M, Xiao T, Jolkkonen J, Wang Y, Zhao C. 2022. 広域スペクトル抗生物質による腸内細菌叢の長期的修飾は、ラットにおける脳卒中の転帰を改善する。Stroke Vasc Neurol 7:381-389.
Crossref
PubMed
Google Scholar
75.
Wang T, Hu X, Liang S, Li W, Wu X, Wang L, Jin F. 2015. ラクトバチルス・ファーメンタムNS9は、抗生物質によって誘発されたラットの生理学的・心理学的異常を回復させる。Benef Microbes 6:707-717.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
76.
Westfall S, Lomis N, Kahouli I, Dia SY, Singh SP, Prakash S. 2017. マイクロバイオーム、プロバイオティクス、神経変性疾患:腸脳軸の解読。Cell Mol Life Sci 74:3769-3787.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
Google Scholar
77.
Westfall S, Lomis N, Prakash S. 2019. Drosophila melanogasterにおいて、新規シンバイオティクスが腸-脳-軸シグナル伝達のコンビナトリアルを介してアルツハイマー病の発症を遅延させる。PLoS One 14:e0214985.
クロスレフ
パブコメ
国際医療福祉大学
グーグル
78.
Hsieh T-H, Kuo C-W, Hsieh K-H, Shieh M-J, Peng C-W, Chen Y-C, Chang Y-L, Huang Y-Z, Chen C-C, Chang P-K, Chen K-Y, Chen H-Y. 2020. プロバイオティクスは、パーキンソン病モデルマウスにおける運動機能の進行性低下を緩和する。Brain Sci 10:206.
クロスレフ
PubMed
国際アイソトープ学会
グーグル
79.
Nimgampalle M, Kuna Y. 2017. アルツハイマーを誘発したアルビノラットにおけるプロバイオティクス、ラクトバチルス・プランタラムMTCC 1325の抗アルツハイマー特性。J Clin Diagn Res 11:KC01-KC05.
クロスレフ
PubMed
Google Scholar
80.
Akbari E, Asemi Z, Daneshvar Kakhaki R, Bahmani F, Kouchaki E, Tamtaji OR, Hamidi GA, Salami M. 2016. アルツハイマー病における認知機能と代謝状態に対するプロバイオティクス補給の効果:無作為化二重盲検比較試験。Front Aging Neurosci 8:256.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
81.
Wohlgemuth I, Garofalo R, Samatova E, Günenç AN, Lenz C, Urlaub H, Rodnina MV. 2021. アミノグリコシド系抗生物質が誘発する翻訳エラークラスター。Nat Commun 12:1830.
引用文献へ
相互参照
パブコメ
グーグル奨学生
82.
Bollen C, Dewachter L, Michiels J. 2021. 抗生物質による治療から生き残るための細菌の戦略としてのタンパク質凝集。Front Mol Biosci 8:669664.
引用文献へ
引用
PubMed
グーグル奨学生
83.
Sender R, Fuchs S, Milo R. 2016. ヒトと細菌の体内細胞数の推定値の改訂。PLOS Biol 14:e1002533.
引用文献へ
相互参照
パブコメ
国際標準化機構
グーグル
84.
Gilbert JA, Blaser MJ, Caporaso JG, Jansson JK, Lynch SV, Knight R. 2018. ヒトマイクロバイオームの現在の理解。Nat Med 24:392-400.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
85.
Barnhart MM, Chapman MR. 2006. Curli biogenesis and function. Annu Rev Microbiol 60:131-147.
引用文献へ
クロスレフ
パブコメ
ISI研究所
グーグル
86.
Van Gerven N, Van der Verren SE, Reiter DM, Remaut H. 2018. 細菌の病原性における機能的アミロイドの役割。J Mol Biol 430:3657-3684.
Crossref
PubMed
国際標準化機構
グーグル
87.
Hall CW, Mah T-F. 2017. 病原細菌のバイオフィルムに基づく抗生物質耐性と耐性の分子メカニズム。FEMS Microbiol Rev 41:276-301.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
88.
Costerton JW, Stewart PS, Greenberg EP. 1999. 細菌バイオフィルム:持続性感染症の共通の原因。Science 284:1318-1322.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
89.
Chen SG, Stribinskis V, Rane MJ, Demuth DR, Gozal E, Roberts AM, Jagadapillai R, Liu R, Choe K, Shivakumar B, Son F, Jin S, Kerber R, Adame A, Masliah E, Friedland RP. 2016. 機能性細菌アミロイドタンパク質curliへの曝露は、老化したfischer 344ラットおよび線虫におけるαシヌクレインの凝集を促進する。Sci Rep 6:34477.
引用文献へ
相互参照
PubMed
グーグル
90.
Wang C, Lau CY, Ma F, Zheng C. 2021年。ゲノムワイドスクリーニングにより、宿主の神経変性を促進する細菌成分としてcurliアミロイド線維が同定された。Proc Natl Acad Sci U S A 118:e2106504118.
引用文献へ
引用文献
パブコメ
ISI社
Google Scholar
91.
Sampson TR, Challis C, Jain N, Moiseyenko A, Ladinsky MS, Shastri GG, Thron T, Needham BD, Horvath I, Debelius JW, Janssen S, Knight R, Wittung-Stafshede P, Gradinaru V, Chapman M, Mazmanian SK. 2020. 腸内細菌アミロイドは、マウスにおいてαシヌクレインの凝集と運動障害を促進する。Elife 9:e53111.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
92.
Brouillette J, Caillierez R, Zommer N, Alves-Pires C, Benilova I, Blum D, De Strooper B, Buée L. 2012. 可溶性低分子アミロイドΒ1-42オリゴマーによる神経毒性と記憶障害が、新しい動物モデルを用いてin vivoで明らかになった。J Neurosci 32:7852-7861.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
93.
Zhao J, Wen D. 2017. Pore-scale simulation of wettability and interfacial tension effects on flooding process for enhanced oil recovery. RSC Adv 7:41391-41398.
引用文献へ
Crossref
PubMed
Google Scholar
94.
Christensen LFB, Jensen KF, Nielsen J, Vad BS, Christiansen G, Otzen DE. 2019. 機能性アミロイドタンパク質FapCのアミロイド原性を低下させると、αシヌクレインの細動を抑制する能力が高まる。ACS Omega 4:4029-4039.
引用文献へ
相互参照
パブコメ
ISI研究所
グーグル
95.
Javed I, Zhang Z, Adamcik J, Andrikopoulos N, Li Y, Otzen DE, Lin S, Mezzenga R, Davis TP, Ding F, Ke PC. 2020. 細菌性アミロイドFapCによるアミロイドベータの発症促進。Adv Sci 7:2001299.
引用文献へ
クロスフィルム
グーグル・スカラー
96.
Saiman L, Siegel J, Cystic Fibrosis Foundation Consensus Conference on Infection Control Participants. 2003. 嚢胞性線維症患者に対する感染制御の推奨事項:微生物学、重要な病原体、および患者間感染を予防するための感染制御の実践。Am J Infect Control 31:S1-62.
引用文献へ
クロスレフ
パブコメ
国際感染症学会
グーグル
97.
Roy B, Woo MS, Vacas S, Eshaghian P, Rao AP, Kumar R. 2021. 嚢胞性線維症患者における局所脳組織の変化。J Transl Med 19:419.
引用文献へ
相互参照
パブコメ
ISI研究所
グーグル
98.
Elce V, Del Pizzo A, Nigro E, Frisso G, Martiniello L, Daniele A, Elce A. 2020. 認知機能に対する身体活動の影響:嚢胞性線維症の研究と管理のための新分野。Diagnostics 10:489.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
Google Scholar
99.
Van Den Eeden SK, Tanner CM, Bernstein AL, Fross RD, Leimpeter A, Bloch DA, Nelson LM. 2003. パーキンソン病の発症率:年齢、性別、人種・民族による違い。Am J Epidemiol 157:1015-1022.
引用文献へ
相互参照
パブコメ
ISI研究所
グーグル
100.
ゲレイロR、ブラスJ. 2015。アルツハイマー病における年齢因子。ゲノム医学 7:106.
引用文献へ
相互参照
PubMed
国際医療福祉大学
グーグル
101.
Simpson T, Elston C, Macedo P, Perrin F. 2019. 嚢胞性線維症におけるアミロイドーシス。Paediatr Respir Rev 31:32-34.
引用文献へ
クロスレフ
パブコメ
国際放射線学会
グーグル
102.
Marhaug G, Permin H, Husby G. 1983年。嚢胞性線維症における肺感染の指標としてのアミロイド関連血清蛋白(SAA)。Acta Paediatr Scand 72:861-866.
引用文献へ
相互参照
PubMed
国際医療福祉大学
グーグル
103.
Loikas D, Wettermark B, von Euler M, Bergman U, Schenck-Gustafsson K. 2013. 男女間の薬剤利用の違い:スウェーデンにおける全調剤薬剤の横断的分析。BMJ Open 3:e002378.
引用文献へ
Crossref
パブコメ
国際医療福祉大学
グーグル
104.
Smith DRM, Dolk FCK, Smieszek T, Robotham JV, Pouwels KB. 2018. 抗生物質処方におけるジェンダーギャップの理解:英国のプライマリケアの横断的分析。BMJ Open 8:e020203.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
105.
アルツハイマー病の事実と数字。2021. Alzheimers Dement 17:327-406.
引用文献へ
相互参照
パブコメ
Google Scholar
106.
Chêne G, Beiser A, Au R, Preis SR, Wolf PA, Dufouil C, Seshadri S. 2015. 成人中期からのフレーミンガム心臓研究における性別と認知症発症率。Alzheimers Dement 11:310-320.
引用文献へ
相互参照
PubMed
国際放射線学会
グーグル
107.
Ding T, Schloss PD. 2014. 人体全体の微生物群集タイプの動態と関連性。Nature 509:357-360.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
108.
高木崇史、内藤泰志、井上亮、柏木慎一郎、内山和彦、水島健一郎、土屋聡、土肥雄、吉田直樹、鎌田和彦、石川哲也、半田雄、小西秀樹、奥田和也、辻本祐一郎、大野木寛之、伊藤祐之。健康な日本人における年齢、性別、便の硬さに関連した腸内細菌叢の違い。J Gastroenterol 54:53-63.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
109.
Mueller S, Saunier K, Hanisch C, Norin E, Alm L, Midtvedt T, Cresci A, Silvi S, Orpianesi C, Verdenelli MC, Clavel T, Koebnick C, Zunft H-JF, Doré J, Blaut M. 2006年。年齢、性別、国との関連におけるヨーロッパの異なる研究集団における糞便微生物叢の相違:横断的研究。Appl Environ Microbiol 72:1027-1033.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
Google Scholar
110.
ヨーロッパ A. 2021年。ヨーロッパにおける認知症の有病率。https://www.alzheimer-europe.org/dementia/prevalence-dementia-europe。
引用
グーグル・スカラー
111.
コントロール、E.C.f.D.P.a. 2014. D.P.A.、地域社会における全身用抗菌薬(ATCグループJ01)の消費動向、EU/EEA諸国 2008-2012
引用文献へ
Google Scholar
112.
欧州医薬品庁、E.S.o.V.A.C、. 2017. 2015年の欧州30カ国における動物用抗菌薬の売上高。2010年から2015年の動向
引用文献へ
Google Scholar
113.
Curelaru A, Marzolf SJ, Provost J-CKG, Zeon HHH. 2021. 認知症における社会的孤立:COVID-19の効果。J Nurse Pract 17:950-953.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
114.
嘉澤邦彦、久保利彦、秋下雅彦、石井聡、2022. COVID-19パンデミックが施設や在宅の認知症患者に与えた長期的影響:認知症ケアに携わる専門家からの視点。Geriatr Gerontol Int 22:832-838.
引用文献へ
引用文献
パブコメ
国際医療福祉大学
グーグル
115.
Smaling HJA, Tilburgs B, Achterberg WP, Visser M. 2022. COVID-19パンデミックによる社会的距離感が認知症患者、家族介護者、医療従事者に与える影響:質的研究。Int J Environ Res Public Health 19:519.
引用文献へ
引用文献
パブコメ
国際医療福祉大学
グーグル
116.
ピアースJ、スティーブンスMP。2021. COVID-19と抗菌薬スチュワードシップ:得られた教訓、ベストプラクティス、および今後の意味。Int J Infect Dis 113:103-108.
引用文献へ
クロスレフ
パブコメ
ISI
グーグル
117.
Wang L, Davis PB, Volkow ND, Berger NA, Kaelber DC, Xu R. 2022. COVID-19と新規発症アルツハイマー病との関連。J Alzheimers Dis 89:411-414.
引用文献へ
相互参照
PubMed
グーグル
118.
アルツハイマー病協会。2022. 2022年アルツハイマー病の事実と数字。
引用文献へ
グーグル・スカラー
119.
Qureshi AI, Baskett WI, Huang W, Naqvi SH, Shyu C-R. 2022. 重症急性呼吸器症候群コロナウイルス2感染に伴う肺炎生存者における新規発症認知症。Open Forum Infect Dis 9:ofac115.
引用文献へ
クロスレフ
パブコメ
Google Scholar
120.
Lin MT, Balczon R, Pittet J-F, Wagener BM, Moser SA, Morrow KA, Voth S, Francis CM, Leavesley S, Bell J, Alvarez DF, Stevens T. 2018. Nosocomial pneumonia elicits an endothelial proteinopathy: evidence for a source of neurotoxic amyloids in critically ill patients. Am J Respir Crit Care Med 198:1575-1578.
引用文献へ
クロスレフ
パブコメ
国際医療福祉大学
グーグル
121.
Liu Y-H, Chen Y, Wang Q-H, Wang L-R, Jiang L, Yang Y, Chen X, Li Y, Cen Y, Xu C, Zhu J, Li W, Wang Y-R, Zhang L-L, Liu J, Xu Z-Q, Wang Y-J. 2022. 中国武漢におけるCOVID-19の高齢生存者における認知機能の変化の1年間の軌跡:縦断的コホート研究。JAMA Neurol 79:509-517.
引用文献へ
相互参照
パブコメ
ISI
グーグル
122.
Rhodes CH, Priemer DS, Karlovich E, Perl DP, Goldman J. 2022年。若年COVID患者におけるΒ-アミロイド沈着。SSRNジャーナル。
引用文献へ
引用
Google Scholar
123.
ラングフォードBJ、ソーM、レイバルダンS、レオンV、Soucy J-PR、ウェストウッドD、ダネマンN、マクファデンDR。2021. COVID-19患者における抗生物質処方:迅速レビューとメタ解析。Clin Microbiol Infect 27:520-531.
引用文献へ
引用文献
パブコメ
ISI
グーグル
124.
Zarifkar P, Peinkhofer C, Benros ME, Kondziella D. 2022年。COVID-19、インフルエンザA/Bおよび細菌性肺炎後の神経疾患の頻度。Front Neurol 13。
引用文献へ
相互参照
PubMed
国際インフルエンザ学会
グーグル
125.
Piekut T, Hurła M, Banaszek N, Szejn P, Dorszewska J, Kozubski W, Prendecki M. 2022. 感染因子とアルツハイマー病。J Integr Neurosci 21:73.
引用文献へ
相互参照
パブコメ
国際放射線学会
グーグル
126.
Niklasson B, Lindquist L, Klitz W, Englund E, Netherlands Brain Bank. 2020. アルツハイマー病脳で同定されたピコルナウイルス:発症経路?J Alzheimers Dis Rep 4:141-146.
引用文献へ
相互参照
パブコメ
グーグル奨学生
127.
ニクラッソンB、リンドクイストL、クリッツW、フレドリクソンS、モルゲルR、モハマディRオランダ脳バンクカラペチャンY、エングルンドE。ピコルナウイルスは、黒質のドパミン含有ニューロンにおけるウイルス抗原を介してパーキンソン病と関連している可能性がある。Microorganisms 10:599.
引用文献へ
クロスレフ
パブコメ
グーグル
128.
Aviner R, Frydman J. 2020. ウイルス感染におけるプロテオスタシス: ウイルスとシャペロンの複雑な相互作用を解明する。Cold Spring Harb Perspect Biol 12:a034090.
引用文献へ
引用
パブコメ
ISI研究所
グーグル
129.
Lubkowska A, Pluta W, Strońska A, Lalko A. 2021. ウイルス感染における熱ショックタンパク質(HSP70およびHSP90)の役割。Int J Mol Sci 22:9366.
引用文献へ
引用文献
パブコメ
ISI研究所
Google Scholar
130.
Doll JR, Hoebe K, Thompson RL, Sawtell NM. 2020. 生体内での単純ヘルペスウイルスの再活性化の解決は、神経細胞破壊をもたらす。PLoS Pathog 16:e1008296.
引用文献へ
引用文献
パブコメ
国際医療福祉大学
グーグル
131.
Zhou L, Miranda-Saksena M, Saksena NK. 2013. ウイルスと神経変性。Virol J 10:172.
引用文献へ
相互参照
パブコメ
グーグル奨学生
132.
Lange K, Buerger M, Stallmach A, Bruns T. 2016. 腸内細菌叢に対する抗生物質の影響。Dig Dis 34:260-268.
引用文献へ
相互参照
PubMed
国際医療福祉大学
グーグル
133.
Engen PA, Green SJ, Voigt RM, Forsyth CB, Keshavarzian A. 2015. The gastrointestinal microbiome: alcohol effects on the composition of intestinal microbiota. Alcohol Res 37:223-236.
引用文献へ
PubMed
Google Scholar
134.
Marques C, Dinis L, Barreiros Mota I, Morais J, Ismael S, Pereira-Leal JB, Cardoso J, Ribeiro P, Beato H, Resende M, Espírito Santo C, Cortez AP, Rosário A, Pestana D, Teixeira D, Faria A, Calhau C. 2022. ビールとノンアルコールビールの摂取が腸内細菌叢に及ぼす影響:無作為化二重盲検比較試験。J Agric Food Chem 70:13062-13070.
引用文献へ
相互参照
パブコメ
ISI社
グーグル
135.
Huang C, Shi G. 2019. 口腔、気道、腸およびいくつかの全身疾患における喫煙とマイクロバイオーム。J Transl Med 17:225.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
136.
モンダV、ヴィラーノI、メッシーナA、ヴァレンツァーノA、エスポジートT、モスカテッリF、ヴィッジャーノA、チベッリG、キエッフィS、モンダM、メッシーナG.2017。運動は腸内細菌叢を修正し、健康にプラスの効果をもたらす。Oxid Med Cell Longev 2017:3831972.
引用文献へ
相互参照
PubMed
グーグル奨学生
137.
Singh RK, Chang H-W, Yan D, Lee KM, Ucmak D, Wong K, Abrouk M, Farahnik B, Nakamura M, Zhu TH, Bhutani T, Liao W. 2017. 食事が腸内細菌叢に及ぼす影響とヒトの健康への影響。J Transl Med 15:73.
引用文献へ
相互参照
パブコメ
ISI研究所
グーグル
138.
Lourida I, Hannon E, Littlejohns TJ, Langa KM, Hyppönen E, Kuzma E, Llewellyn DJ. 2019. 生活習慣と遺伝的リスクと認知症発症率との関連。JAMA 322:430-437.
引用文献へ
相互参照
パブコメ
国際認知症学会
グーグル
139.
Murray CJL, Ikuta KS, Sharara F, Swetschinski L, Robles Aguilar G, Gray A, Han C, Bisignano C, Rao P, Wool E, Johnson SC, Browne AJ, Chipeta MG, Fell F, Hackett S, Haines-Woodhouse G, Kashef Hamadani BH, Kumaran EAP, McManigal B, Achalapong S, Agarwal R、 Akech S, Albertson S, Amuasi J, Andrews J, Aravkin A, Ashley E, Babin F-X, Bailey F, Baker S, Basnyat B, Bekker A, Bender R, Berkley JA, Bethou A, Bielicki J, Boonkasidecha S, Bukosia J, Carvalheiro C, Castañeda-Orjuela C, Chansamouth V, Chaurasia S、 Chiurchiù S, Chowdhury F, Clotaire Donatien R, Cook AJ, Cooper B, Cressey TR, Criollo-Mora E, Cunningham M, Darboe S, Day NPJ, De Luca M, Dokova K, Dramowski A, Dunachie SJ, Duong Bich T, Eckmanns T, Eibach D, Emami A, Feasey N, Fisher-Pearson N, Forrest K、 Garcia C, Garrett D, Gastmeier P, Giref AZ, Greer RC, Gupta V, Haller S, Haselbeck A, Hay SI, Holm M, Hopkins S, Hsia Y, Iregbu KC, Jacobs J, Jarovsky D, Javanmardi F, Jenney AWJ, Khorana M, Khusuwan S, Kissoon N, Kobeissi E, Kostyanev T, Krapp F, Krumkamp R、 Kumar A, Kyu HH, Lim C, Lim K, Limmathurotsakul D, Loftus MJ, Lunn M, Ma J, Manoharan A, Marks F, May J, Mayxay M, Mturi N, Munera-Huertas T, Musicha P, Musila LA, Mussi-Pinhata MM, Naidu RN, Nakamura T, Nanavati R, Nangia S, Newton P, Ngoun C, Novotney A、 Nwakanma D, Obiero CW, Ochoa TJ, Olivas-Martinez A, Olliaro P, Ooko E, Ortiz-Brizuela E, Ounchanum P, Pak GD, Paredes JL, Peleg AY, Perrone C, Phe T, Phommasone K, Plakkal N, Ponce-de-Leon A, Raad M, Ramdin T, Rattanavong S, Riddell A, Roberts T、 Robotham JV, Roca A, Rosenthal VD, Rudd KE, Russell N, Sader HS, Saengchan W, Schnall J, Scott JAG, Seekaew S, Sharland M, Shivamallappa M, Sifuentes-Osornio J, Simpson AJ, Steenkeste N, Stewardson AJ, Stoeva T, Tasak N, Thaiprakong A, Thwaites G, Tigoi C、 Turner C, Turner P, van Doorn HR, Velaphi S, Vongpradith A, Vongsouvath M, Vu H, Walsh T, Walson JL, Waner S, Wangrangsimakul T, Wannapinij P, Wozniak T, Young Sharma TEMW, Yu KC, Zheng P, Sartorius B, Lopez AD, Stergachis A, Moore C, Dolecek C, Naghavi M. 2022. 2019年における細菌性抗菌薬耐性の世界的負担:系統的分析。Lancet 399:629-655.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
140.
O'Neill J. 2014. 抗菌薬耐性に関するレビュー:国家の健康と富のための危機に取り組む。抗菌薬耐性に関するレビュー、ロンドン。
引用文献へ
Google Scholar
141.
Anthony WE, Wang B, Sukhum KV, D'Souza AW, Hink T, Cass C, Seiler S, Reske KA, Coon C, Dubberke ER, Burnham C-AD, Dantas G, Kwon JH. 2022. 健康成人における腸内細菌叢とレジストームに対する一般的に使用される抗生物質の急性および持続的影響。Cell Rep 39:110649.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
142.
Ghuneim L-AJ、Raghuvanshi R、Neugebauer KA、Guzior DV、Christian MH、Schena B、Feiner JM、Castillo-Bahena A、Mielke J、McClelland M、Conrad D、Klapper I、Zhang T、Quinn RA。2022. 多菌感染症に対する抗生物質治療の複雑かつ予期せぬ結果。ISME J 16:2065-2075.
引用文献へ
引用文献
パブコメ
国際医療福祉大学
グーグル
143.
Garrett WS, Gallini CA, Yatsunenko T, Michaud M, DuBois A, Delaney ML, Punit S, Karlsson M, Bry L, Glickman JN, Gordon JI, Onderdonk AB, Glimcher LH. 2010. 腸内細菌は腸内細菌叢と協調して、自然発症および母体感染による大腸炎を誘発する。Cell Host Microbe 8:292-300.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
144.
Haran JP, Bhattarai SK, Foley SE, Dutta P, Ward DV, Bucci V, McCormick BA. 2019. アルツハイマー病のマイクロバイオームは、抗炎症性P糖タンパク質経路の調節異常と関連している。
引用文献へ
相互参照
パブコメ
グーグル奨学生
145.
David A S, Taruna I, Andrew S San A, Elfi W, Masoud J A. 2018. 筋萎縮性側索硬化症(ALS)は、ヒト患者における腸内細菌叢異常症&全身性微生物感染と関連している:横断的臨床研究。Int J Neurodegener Dis 1.
クロスレフ
PubMed
Google Scholar
146.
Boucher HW, Talbot GH, Bradley JS, Edwards JE, Gilbert D, Rice LB, Scheld M, Spellberg B, Bartlett J. 2009. 米国感染症学会からの最新情報。Clin Infect Dis 48:1-12.
引用文献へ
相互参照
パブコメ
国際感染症学会
グーグル
147.
Stickler DJ. 2009. Proteus mirabilisのバイオフィルム形成とカテーテル設計、p157-190。In Denstedt J, A Atala (ed), Biomaterials and tissue engineering in Urology. Woodhead Publishing.
引用文献へ
引用
Google Scholar
148.
Su C-M, Kung C-T, Chen F-C, Cheng H-H, Hsiao S-Y, Lai Y-R, Huang C-C, Tsai N-W, Lu C-H. 2018. 救急部におけるパーキンソン病と重篤な感染症患者の症状と転帰。Biomed Res Int 2018:6014896.
Crossref
PubMed
国際医療福祉大学
Google Scholar
149.
Choi JG, Kim N, Ju IG, Eo H, Lim S-M, Jang S-E, Kim D-H, Oh MS. 2018. Proteus mirabilisの経口投与は、マウスのドーパミン作動性ニューロンと運動機能に損傷を与える。Sci Rep 8:1275.
Crossref
PubMed
グーグル奨学生
150.
Lee DW, Ryu Y-K, Chang D-H, Park H-Y, Go J, Maeng S-Y, Hwang DY, Kim B-C, Lee C-H, Kim K-S. 2022. アガソバクラム・ブチリシプロデュセンスは、6-OHDA誘発パーキンソン病モデルマウスにおいて神経保護作用を示す。J Microbiol Biotechnol 32:1168-1177.
クロスレフ
パブコメ
国際医療福祉大学
Google Scholar
151.
Go J, Chang D-H, Ryu Y-K, Park H-Y, Lee I-B, Noh J-R, Hwang DY, Kim B-C, Kim K-S, Lee C-H. 2021. ヒト腸内細菌叢Agathobaculum butyriciproducensは、アルツハイマー病のLPS誘発およびAPP/PS1マウスモデルにおける認知障害を改善する。Nutr Res 86:96-108.
Crossref
PubMed
国際医学総合研究所
Google Scholar
152.
Ou Z, Deng L, Lu Z, Wu F, Liu W, Huang D, Peng Y. 2020. アルツハイマー病モデルマウスにおける認知障害とアミロイド病理に対するアッカーマンシア・ムチニフィラの保護効果。Nutr Diabetes 10:12.
クロスフレフ
PubMed
Google Scholar
153.
He X, Yan C, Zhao S, Zhao Y, Huang R, Li Y. 2022. プロバイオティクスAkkermansia muciniphilaのD-ガラクトース/AlCl3を介したアルツハイマー病様ラットに対する予防効果。Exp Gerontol 170:111959.
クロスレフ
PubMed
ISI研究所
Google Scholar
154.
Goya ME, Xue F, Sampedro-Torres-Quevedo C, Arnaouteli S, Riquelme-Dominguez L, Romanowski A, Brydon J, Ball KL, Stanley-Wall NR, Doitsidou M. 2020. プロバイオティクスの枯草菌は線虫のαシヌクレイン凝集を防ぐ。Cell Rep 30:367-380.
クロスレフ
PubMed
ISI社
グーグル
155.
Cogliati S, Clementi V, Francisco M, Crespo C, Argañaraz F, Grau R. 2020. 枯草菌はアルツハイマー病モデル線虫における神経変性と行動障害を遅らせる。J Alzheimers Dis 73:1035-1052.
クロスレフ
PubMed
国際アイソトープ学会
Google Scholar
156.
Kim H, Kim S, Park S-J, Park G, Shin H, Park MS, Kim J. 2021. ビフィズス菌BGN4およびビフィズス菌BORIの投与は、アルツハイマー病モデルマウスの認知・記憶機能を改善する。Front Aging Neurosci 13:709091.
文献
パブコメ
ISI研究所
Google Scholar
157.
小林恭子、菅原秀樹、島田和彦、光山英樹、久原智子、安岡篤、近藤忠彦、阿部和彦、蕭潔洙。2017. ビフィズス菌A1株のアルツハイマー病における認知機能障害予防の治療可能性。Sci Rep 7:13510.
Crossref
PubMed
グーグル奨学生
158.
Mehrabadi S, Sadr SS. 2020. アルツハイマー病モデルラットにおける記憶機能、炎症マーカー、酸化ストレスに対するプロバイオティクス混合物の評価。Iran Biomed J 24:220-228.
Crossref
PubMed
グーグル奨学生
159.
Lee H-J, Lee K-E, Kim J-K, Kim D-H. 2019. ビフィドバクテリウム・ロンガムによる腸内細菌異常症の抑制は、5XFADトランスジェニックマウスおよび高齢マウスの認知機能低下を緩和する。Sci Rep 9:11814.
クロスレフ
PubMed
Google Scholar
160.
Little CS, Hammond CJ, MacIntyre A, Balin BJ, Appelt DM. 2004. 肺炎クラミジアはBALB/cマウスの脳にアルツハイマー様アミロイド斑を誘導する。Neurobiol Aging 25:419-429.
クロスレフ
PubMed
ISI研究所
Google Scholar
161.
2020年、アルツハイマー病におけるミクログリアを介した神経炎症に対するクロストリジウム酪酸菌の効果。アルツハイマー病におけるミクログリアを介した神経炎症に対するクロストリジウム・ブチリカムの効果は、腸内細菌叢と代謝産物である酪酸の調整を介している。Mol Nutr Food Res 64:e1900636.
クロスレフ
パブコメ
国際医療福祉大学
Google Scholar
162.
毛利塩見 A, ガーシン DA. 2008. インスリンシグナルと熱ショック応答は、感染時の線虫腸管におけるタンパク質ホメオスタシスを調節する *. J Biol Chem 283:194-201.
Crossref
PubMed
ISI社
Google Scholar
163.
Wu S-C, Cao Z-S, Chang K-M, Juang J-L. 2017. 腸内細菌異常症はショウジョウバエのアルツハイマー病の進行を悪化させる。Nat Commun 8:24.
Crossref
PubMed
グーグル奨学生
164.
Chongtham A, Yoo JH, Chin TM, Akingbesote ND, Huda A, Marsh JL, Khoshnan A. 2022. 腸内細菌はショウジョウバエモデルにおけるハンチントン病の発症を制御する。Front Neurosci 16:902205.
クロスレフ
PubMed
国際アイソトープ学会
グーグル
165.
Schütze S, Döpke A, Kellert B, Seele J, Ballüer M, Bunkowski S, Kreutzfeldt M, Brück W, Nau R. 2022. アルツハイマー病モデルマウスTg2576において、大腸菌の脳内感染は空間学習を障害し、海馬ニューロンの壊死を誘導した。J Alzheimers Dis Rep 6:101-114.
クロスレフ
PubMed
グーグル奨学生
166.
Tan FHP, Liu G, Lau S-YA, Jaafar MH, Park Y-H, Azzam G, Li Y, Liong M-T. 2020. 乳酸菌プロバイオティクスは、キイロショウジョウバエのアルツハイマー病モデルの腸内細菌叢プロファイルを改善し、眼の神経変性を緩和した。Benef Microbes 11:79-89.
クロスレフ
パブコメ
国際医療福祉大学
Google Scholar
167.
Liu G, Tan FH-P, Lau S-YA, Jaafar MH, Chung FY-L, Azzam G, Liong M-T, Li Y. 2022. 乳酸菌給餌により、メラノガスター・アルツハイマー病モデルショウジョウバエの奇形眼球構造が回復し、腸内細菌叢プロファイルが改善した。J Appl Microbiol 132:3155-3167.
クロスレフ
パブコメ
国際標準化機構
Google Scholar
168.
石田直樹、石原由美子、石田耕一、多田浩二、船木・加藤雄一、萩原雅彦、フェルドゥスT、アブドゥラM、三谷彰宏、道川正明、松下恭平 2017. 細菌感染による歯周炎は、トランスジェニックマウスにおいてアルツハイマー病の特徴を悪化させる。NPJ Aging Mech Dis 3:15.
Crossref
PubMed
Google Scholar
169.
Aravindraja C, Sakthivel R, Liu X, Goodwin M, Veena P, Godovikova V, Fenno JC, Levites Y, Golde TE, Kesavalu L. 2022. 脳内感染ではあるが末梢感染ではないポルフィロモナス・ジンジバリスが、APP-TgCRND8マウスにおいてアルツハイマー病のようなアミロイド病態を悪化させる。Int J Mol Sci 23:3328.
クロスレフ
PubMed
国際医療福祉大学
Google Scholar
170.
Díaz-Zúñiga J, More J, Melgar-Rodríguez S, Jiménez-Unión M, Villalobos-Orchard F, Muñoz-Manríquez C, Monasterio G, Valdés JL, Vernal R, Paula-Lima A. 2020. 野生型ラットにおけるポルフィロモナス・ジンジバリス(Porphyromonas gingivalis)によるアルツハイマー病様病態の誘発は血清型に依存する。Front Immunol 11:588036.
Crossref
PubMed
国際免疫学会
Google Scholar
171.
Balczon R, Lin MT, Lee JY, Abbasi A, Renema P, Voth SB, Zhou C, Koloteva A, Michael Francis C, Sodha NR, Pittet J-F, Wagener BM, Bell J, Choi C-S, Ventetuolo CE, Stevens T. 2021年。肺炎がタウオパシーを引き起こす。FASEB J 35:e21807.
Crossref
PubMed
ISI研究所
グーグル
172.
Kumar DKV, Choi SH, Washicosky KJ, Eimer WA, Tucker S, Ghofrani J, Lefkowitz A, McColl G, Goldstein LE, Tanzi RE, Moir RD. 2016. アミロイドβペプチドは、アルツハイマー病モデルマウスおよびミミズにおける微生物感染から保護する。Sci Transl Med 8:340ra72.
Crossref
PubMed
グーグル奨学生
173.
Toubes E, Singh K, Yin D, Lyu R, Glick N, Russell L, Mohapatra S, Saghal N, Weinstein RA, Trenholme G. 2003. 長期療養施設から転院してきた入院患者における抗生物質耐性感染の危険因子と治療成績:抗菌薬選択は違いをもたらすか?Clin Infect Dis 36:724-730.
引用文献へ
相互参照
パブコメ
ISI
グーグル
174.
Mitchell SL, Teno JM, Miller SC, Mor V. 2005. 認知症高齢者の死亡場所に関する全国調査。J Am Geriatr Soc 53:299-305.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
175.
チェンJ-H、ランバーグJL、チェンY-C、キーリーDK、ページJH、パーソンCJ、ミッチェルSL。2006. 認知症が進行した長期療養者における肺炎疑いの発生と治療。J Am Geriatr Soc 54:290-295.
引用文献へ
クロスレフ
パブコメ
国際医療福祉大学
グーグル
176.
Pop-Vicas A, Mitchell SL, Kandel R, Schreiber R, D'Agata EMC. 2008. 長期療養施設における多剤耐性グラム陰性菌:有病率と危険因子。J Am Geriatr Soc 56:1276-1280.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
177.
Rowan-Nash AD, Araos R, D'Agata EMC, Belenky P. 2020. 進行した認知症患者集団における抗菌薬耐性遺伝子有病率は、特定の病原体と関連している。
引用文献へ
相互参照
パブコメ
Google Scholar
178.
Li W, Wu X, Hu X, Wang T, Liang S, Duan Y, Jin F, Qin B. 2017. パーキンソン病における腸内細菌叢の構造変化と臨床的特徴との相関。Sci China Life Sci 60:1223-1233.
Crossref
PubMed
Google Scholar
179.
Zhao Y, Jaber V, Lukiw WJ. 2017. ヒト消化管マイクロバイオームの分泌産物とアルツハイマー病(AD)への潜在的影響:AD海馬におけるリポ多糖(LPS)の検出。Front Cell Infect Microbiol 7:318.
引用文献へ
クロスレビュー
パブコメ
国際医療福祉大学
グーグル
180.
Griffen AL, Becker MR, Lyons SR, Moeschberger ML, Leys EJ. 1998. Porphyromonas gingivalisの有病率と歯周病の健康状態。J Clin Microbiol 36:3239-3242.
引用文献へ
相互参照
パブコメ
国際歯周病学会
グーグル
181.
Dominy SS, Lynch C, Ermini F, Benedyk M, Marczyk A, Konradi A, Nguyen M, Haditsch U, Raha D, Griffin C, Holsinger LJ, Arastu-Kapur S, Kaba S, Lee A, Ryder MI, Potempa B, Mydel P, Hellvard A, Adamowicz K, Hasturk H, Walker GD, Reynolds EC, Faull RLM, Curtis MA, Dragunow M, Potempa J. 2019. アルツハイマー病脳におけるポルフィロモナス・ジンジバリス:疾患の因果関係の証拠と低分子阻害剤による治療。Sci Adv 5:eaau3333.
引用文献へ
相互参照
パブコメ
グーグル奨学生
182.
Flemmig TF, Milián E, Karch H, Klaiber B. 1998. Actinobacillus actinomycetemcomitansおよび/またはPorphyromonas gingivalis保有患者におけるメトロニダゾールとアモキシシリンの全身投与後の臨床的治療成績の違い。J Clin Periodontol 25:380-387.
引用文献へ
相互参照
パブコメ
ISI
グーグル
183.
Shima K, Kuhlenbäumer G, Rupp J. 2010. 肺炎クラミジア感染とアルツハイマー病:覚えておくべき関係?Med Microbiol Immunol 199:283-289.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
184.
Balin BJ, Gérard HC, Arking EJ, Appelt DM, Branigan PJ, Abrams JT, Whittum-Hudson JA, Hudson AP. 1998. アルツハイマー病脳における肺炎クラミジアの同定と局在。Med Microbiol Immunol 187:23-42.
引用文献へ
クロスレフ
パブコメ
国際医療福祉大学
グーグル
185.
Kuo CC, Jackson LA, Campbell LA, Grayston JT. 1995. 肺炎クラミジア(TWAR)。Clin Microbiol Rev 8:451-461.
引用文献へ
クロスレフ
パブコメ
ISI研究所
グーグル
186.
Kutlin A, Kohlhoff S, Roblin P, Hammerschlag MR, Riska P. 2005. クラミドフィラ・ニューモニエおよびクラミジア・トラコマティスにおけるリファンピンおよびリファラジル耐性の出現。Antimicrob Agents Chemother 49:903-907.
引用文献へ
クロスレフ
パブコメ
ISI社
グーグル
187.
Hoppe T, Cohen E. 2020. 生物のタンパク質ホメオスタシス機構。Genetics 215:889-901.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
188.
Brignull HR, Moore FE, Tang SJ, Morimoto RI. 2006. 発症閾値にあるポリグルタミンタンパク質は、汎神経細胞モデルにおいて神経細胞特異的凝集を示す。J Neurosci 26:7597-7606.
引用文献へ
相互参照
パブコメ
ISI研究所
グーグル
189.
Morley JF, Brignull HR, Weyers JJ, Morimoto RI. 2002. ポリグルタミン拡大タンパク質の凝集と細胞毒性の閾値は動的であり、線虫の加齢に影響される。Proc Natl Acad Sci U S A 99:10417-10422.
引用文献へ
引用文献
パブコメ
ISI研究所
グーグル
190.
Vaziriyan-Sani AS, Handy RD, Walker AC, Pagolu CN, Enslow SM, Czyż DM. 2021. 線虫における凝集体定量化の自動化。J Vis Exp 176.
引用文献へ
引用
Google Scholar
191.
Ochoa CD, Alexeyev M, Pastukh V, Balczon R, Stevens T. 2012. 緑膿菌エキソトキシンYは、内皮タウのリン酸化と透過性を亢進させる遊走性シクラーゼである。J Biol Chem 287:25407-25418.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
192.
Balczon R, Morrow KA, Zhou C, Edmonds B, Alexeyev M, Pittet J-F, Wagener BM, Moser SA, Leavesley S, Zha X, Frank DW, Stevens T. 2017. 緑膿菌感染症は、伝達性で細胞毒性を有するプリオン・アミロイドを遊離する。FASEB J 31:2785-2796.
引用文献へ
クロスレフ
パブコメ
国際医療福祉大学
グーグル
193.
Choi C-S, Gwin M, Voth S, Kolb C, Zhou C, Nelson AR, deWeever A, Koloteva A, Annamdevula NS, Murphy JM, Wagener BM, Pittet J-F, Lim S-TS, Balczon R, Stevens T, Lin MT. 2022. 緑膿菌感染時に肺微小血管内皮細胞から放出される細胞毒性タウは、神経細胞タウオパシーを促進する。J Biol Chem 298:101482.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
Google Scholar
194.
Morrow KA, Ochoa CD, Balczon R, Zhou C, Cauthen L, Alexeyev M, Schmalzer KM, Frank DW, Stevens T. 2016. 緑膿菌外酵素UおよびYは、伝達性内皮蛋白症を誘発する。Am J Physiol Lung Cell Mol Physiol 310:L337-L353.
引用文献へ
引用文献
パブコメ
ISI研究所
グーグル
195.
Archambaud C, Derré-Bobillot A, Lapaque N, Rigottier-Gois L, Serror P. 2019. 腸球菌の腸内移行には、内腔における腸球菌の過剰増殖の閾値レベルが必要である。Sci Rep 9:8926.
引用文献へ
相互参照
PubMed
グーグル奨学生
196.
カミレリM. 2019。リーキーガット:ヒトにおける測定と臨床的意義。腸68:1516-1526。
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
197.
Vogt NM, Kerby RL, Dill-McFarland KA, Harding SJ, Merluzzi AP, Johnson SC, Carlsson CM, Asthana S, Zetterberg H, Blennow K, Bendlin BB, Rey FE. 2017. アルツハイマー病における腸内細菌叢の変化。Sci Rep 7:13537.
引用文献へ
相互参照
パブコメ
グーグル奨学生
198.
Fijan S. 2014. プロバイオティクス特性を主張する微生物:最近の文献の概要。Int J Environ Res Public Health 11:4745-4767.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
199.
Li Z, Zhu H, Zhang L, Qin C. 2018. 腸内マイクロバイオームとアルツハイマー病:総説。Animal Model Exp Med 1:180-188.
引用文献へ
相互参照
PubMed
Google Scholar
200.
Shamsipour S, Sharifi G, Taghian F. 2021. ビフィズス菌とラクトバチルス・プランタラムの8週間投与と運動トレーニングの併用は、アルツハイマー病モデルラットにおけるAβの神経毒性とアセチルコリンを介した空間学習を緩和する。J Mol Neurosci 71:1495-1505.
引用文献へ
引用文献
パブコメ
国際医療福祉大学
グーグル
201.
Wang J, Ji H, Wang S, Liu H, Zhang W, Zhang D, Wang Y. 2018. プロバイオティクスのラクトバチルス・プランタラムは、上皮を強化し腸内細菌叢を調節することで腸のバリア機能を促進する。Front Microbiol 9:1953.
引用文献へ
クロスレフ
パブコメ
国際医療福祉大学
グーグル
202.
Botta C, Acquadro A, Greppi A, Barchi L, Bertolino M, Cocolin L, Rantsiou K. 2017. Lactobacillus plantarumにおけるゲノム評価により、ブチロジェン経路とグルタミン代謝が関連付けられた。Sci Rep 7:15975.
引用文献へ
相互参照
PubMed
グーグル奨学生
203.
Zhang Y-G, Wu S, Yi J, Xia Y, Jin D, Zhou J, Sun J. 2017. Target intestinal microbiota to alleviate disease progression in amyotrophic lateral sclerosis. Clin Ther 39:322-336.
引用文献へ
相互参照
PubMed
国際医療福祉大学
グーグル
204.
Jacquier V, Nelson A, Jlali M, Rhayat L, Brinch KS, Devillard E. 2019. Bacillus subtilis 29784は、酪酸産生菌へのブロイラー腸内細菌叢のシフトを誘導し、腸の組織形態学と動物の成績を改善する。Poult Sci 98:2548-2554.
引用文献へ
引用
パブコメ
酪酸菌
グーグル
205.
Donato V, Ayala FR, Cogliati S, Bauman C, Costa JG, Leñini C, Grau R. 2017. 枯草菌バイオフィルムは、インスリン様シグナル伝達経路のダウンレギュレーションを通じて線虫の寿命を延ばす。Nat Commun 8:14332.
引用文献へ
相互参照
PubMed
グーグル奨学生
206.
Jang CH, Oh J, Lim JS, Kim HJ, Kim J-S. 2021. 発酵大豆製品:神経変性疾患における有益な可能性。Foods 10:636.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
207.
Hsu R-L, Lee K-T, Wang J-H, Lee LY-L, Chen RP-Y. 2009. 納豆菌由来ナットウキナーゼのアミロイド分解能力。J Agric Food Chem 57:503-508.
引用文献へ
引用文献
パブコメ
旭化成株式会社
グーグル
208.
Ouyang J, Lin J, Isnard S, Fombuena B, Peng X, Marette A, Routy B, Messaoudene M, Chen Y, Routy J-P. 2020. アッカーマンシア・ムチニフィラ(Akkermansia muciniphila)細菌:腸管透過性のセンチネルとHIV関連炎症との関連性。Front Immunol 11:645.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
209.
Zhang T, Li Q, Cheng L, Buch H, Zhang F. 2019. Akkermansia muciniphilaは有望なプロバイオティクスである。Microb Biotechnol 12:1109-1125.
引用文献へ
相互参照
PubMed
グーグル奨学生
210.
Bullich C, Keshavarzian A, Garssen J, Kraneveld A, Perez-Pardo P. 2019. パーキンソン病における腸の波動:微生物叢-腸-脳軸。Mov Disord Clin Pract 6:639-651.
引用文献へ
相互参照
PubMed
グーグル奨学生
211.
Asnicar F, Berry SE, Valdes AM, Nguyen LH, Piccinno G, Drew DA, Leeming E, Gibson R, Le Roy C, Khatib HA, Francis L, Mazidi M, Mompeo O, Valles-Colomer M, Tett A, Beghini F, Dubois L, Bazzani D, Thomas AM, Mirzayi C、 Khleborodova A, Oh S, Hine R, Bonnett C, Capdevila J, Danzanvilliers S, Giordano F, Geistlinger L, Waldron L, Davies R, Hadjigeorgiou G, Wolf J, Ordovás JM, Gardner C, Franks PW, Chan AT, Huttenhower C, Spector TD, Segata N. 2021. 2021年、1,098人の深い表現型から得られたマイクロバイオームと宿主の代謝および習慣的食事との関連。Nat Med 27:321-332.
引用文献へ
引用文献
パブコメ
ISI研究所
グーグル
212.
Liu J, Sun J, Wang F, Yu X, Ling Z, Li H, Zhang H, Jin J, Chen W, Pang M, Yu J, He Y, Xu J. 2015. Clostridium butyricumの代謝性酪酸を介したマウスの血管性痴呆に対する神経保護効果。Biomed Res Int 2015:412946.
引用文献へ
Crossref
パブコメ
国際医療福祉大学
Google Scholar
213.
Zhu X, Li B, Lou P, Dai T, Chen Y, Zhuge A, Yuan Y, Li L. 2021. 腸内細菌叢と神経変性疾患との関係。Neurosci Bull 37:1510-1522.
引用文献へ
相互参照
PubMed
グーグル奨学生
214.
Sonninen T-M, Goldsteins G, Laham-Karam N, Koistinaho J, Lehtonen Š. 2020. 神経変性疾患におけるプロテオスタシス障害と炎症。細胞 9:2183.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
215.
Korovila I, Hugo M, Castro JP, Weber D, Höhn A, Grune T, Jung T. 2017. Proteostasis, oxidative stress and aging. Redox Biol 13:550-567.
引用文献へ
相互参照
PubMed
グーグル奨学生
216.
ワイディンガーA、コズロフAV。2015. 活性酸素と窒素種の生物学的活性:酸化ストレス対シグナル伝達。Biomolecules 5:472-484.
引用文献へ
引用文献
PubMed
グーグル奨学生
217.
Bomberger JM, Ye S, Maceachran DP, Koeppen K, Barnaby RL, O'Toole GA, Stanton BA. 2011. 宿主のユビキチンタンパク質分解系をハイジャックする緑膿菌毒素。PLOS Pathog 7:e1001325.
引用文献へ
論文
パブコメ
ISI研究所
グーグル
218.
Vasquez-Rifo A, Ricci EP, Ambros V. 2020. 緑膿菌は線虫のリボソームの解読中心を切断する。PLOS Biol 18:e3000969.
引用文献へ
クロスレフ
パブコメ
ISI研究所
グーグル
219.
Park SR, Lee KD, Kim UK, Gil YG, Oh KS, Park BS, Kim GC. 2010. 緑膿菌エキソトキシンAは、熱ショックタンパク質70(HSP70)の阻害を介して口腔扁平上皮癌細胞の化学療法抵抗性を低下させる。Yonsei Med J 51:708-716.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
220.
Keestra-Gounder AM, Byndloss MX, Seyffert N, Young BM, Chávez-Arroyo A, Tsai AY, Cevallos SA, Winter MG, Pham OH, Tiffany CR, de Jong MF, Kerrinnes T, Ravindran R, Luciw PA, McSorley SJ, Bäumler AJ, Tsolis RM. 2016. NOD1およびNOD2シグナルは、小胞体ストレスと炎症を関連付ける。Nature 532:394-397.
引用文献へ
相互参照
パブコメ
ISI研究所
グーグル
221.
Cheng L, Chen L, Wei X, Wang Y, Ren Z, Zeng S, Zhang X, Wen H, Gao C, Liu H. 2018. パーキンソン病の6-ヒドロキシドーパミンモデルにおいて、NOD2はNADPHオキシダーゼ2によって制御されるドーパミン作動性変性を促進する。J Neuroinflammation 15:243.
引用文献へ
クロスレビュー
パブコメ
ISI社
グーグル
222.
Saresella M, La Rosa F, Piancone F, Zoppis M, Marventano I, Calabrese E, Rainone V, Nemni R, Mancuso R, Clerici M. 2016. アルツハイマー病ではNLRP3およびNLRP1インフラマソームが活性化する。Mol Neurodegener 11:23.
引用文献へ
相互参照
PubMed
グーグル奨学生
223.
Cheon SY, Kim J, Kim SY, Kim EJ, Koo B-N. 2020. ヒト疾患におけるインフラマソームと認知症状:実験的研究から得られた生物学的証拠。Int J Mol Sci 21:1103.
引用文献へ
相互参照
パブコメ
国際医療福祉大学
グーグル
著者略歴
アリッサ・ウォーカー https://orcid.org/0000-0002-3508-7076
米国フロリダ州ゲインズビル、フロリダ大学微生物学・細胞科学科
フロリダ大学微生物・細胞科学科博士研究員。フロリダ大学で微生物学・細胞科学の博士号を取得し、Daniel Czyz博士の指導の下、彼の研究室でポスドク研究を続けている。博士号取得中、ウォーカー博士は4本の筆頭著者論文を発表し、そのうちの1本はThe Public Library of Science (PLOS)で2021年に最も読まれた論文のトップ5に入った。現職では、博士課程での研究を継続し、バクテリアと神経変性タンパク質のコンフォメーション病との関連を研究している。
Daniel M. Czyz https://orcid.org/0000-0002-7491-5292 dczyz@ufl.edu
米国フロリダ州ゲインズビル、フロリダ大学微生物学・細胞科学部
フロリダ大学微生物・細胞科学科助教授。ノースウェスタン大学で生物科学とバイオテクノロジーの博士号を取得し、リチャード・モリモト博士の指導を受ける。シカゴ大学微生物学部のハワード・シューマン博士とショーン・クロソン博士のもとで、細菌病原と宿主指向性抗菌薬の研究に従事。現職では、2つの抗菌薬耐性コース(講義と実験室)を開発し、上級レベルの学部生および大学院生に教えている。彼の研究グループは、抗生物質耐性菌と闘うための非伝統的なアプローチの開発に重点を置き、タンパク質コンフォメーション病の微生物起源を調査している。Czyz博士は、国立抗菌薬耐性研究教育機構の副理事長および諮問委員会委員長を務めた(2020-2022年)。
全文を見るPDFをダウンロード
私たちは推薦します
腸脳軸を解明するモデル生物としての線虫の出現
mシステムズ、2021
パーキンソン病治療薬が健常ラットの小腸運動と微生物叢組成を変化させる
mSystems, 2022
野獣を飼いならす: 腸内小分子と腸内病原体の相互作用
感染免疫、2019年
腸内細菌と神経変性疾患との関連を示す新たな証拠
フロリダ大学、MedicalXpress、2021年
アルツハイマー病治療のためのAβ凝集とNLRP3インフラマソーム活性化の同時抑制
タオ・ヤンら、RSCケミカルサイエンス、2022年
植物葉緑体がハンチントン病治療の可能性を示す
ケルン大学、Phys.org、2023年
掲載元
アメリカ微生物学会ロゴ
ASMジャーナルロゴ
ジャーナル
抗菌薬と化学療法
応用・環境微生物学
臨床およびワクチン免疫学
臨床微生物学レビュー
エコサル・プラス
真核細胞
感染と免疫
細菌学ジャーナル
臨床微生物学ジャーナル
微生物学・生物学教育ジャーナル
ウイルス学ジャーナル
mバイオ
微生物学・分子生物学レビュー
微生物学リソース
微生物学スペクトラム
mSphere
mシステム
リソース
Microbiologyについて
著者センター
アクセス許可
ASMジャーナルコレクション
出版倫理
移行情報
広告
ASMメンバーシップ
プライバシーポリシー
会員規約
所有権に関する通知
非商用TDMライセンス
いつでもつながる
アラート
RSSフィード
お問い合わせ
ASMコミュニティ
ニュース
プレスリリース
ポリシーステートメント
著作権 © 2023 米国微生物学会
PDF
ヘルプ
