
ヒトのJAK1機能獲得は骨髄異形成と重度のアレルギー性炎症を引き起こす
ヒトのJAK1機能獲得は骨髄異形成と重度のアレルギー性炎症を引き起こす
Catherine M. Biggs, 1,2 Anna Cordeiro-Santanach, 3 Sergey V. Prykhozhij, 4 Adam P. Deveau, 5 Yi Lin, 2 Kate L. Del Bel, 1,2 Felix Orben, 1,2 Robert J. Ragotte,1,2 Aabida Saferali,1,2,6 Sara Mostafavi,7,8 Louie Dinh,7,8 Darlene Dai,2 Katja G. Weinacht,9 Kerry Dobbs,10 Lisa Ott de Bruin,11 Mehul Sharma,1,2 Kevin Tsai,2,12 John J. Priatel,2,12 Richard A. Schreiber,1,2 Jacob Rozmus,1,2 Martin C.K. Hosking,1,2 Kevin E. Shopsowitz,2,12 Margaret L. McKinnon,7 Suzanne Vercauteren,12 Michael Seear,1,2 Luigi D. Notarangelo,10 Francis C. Lynn,2,13 Jason N. Berman,4,14 and Stuart E. Turvey1,2が挙げられる。
著者注:CMB、ACS、SVPは共同筆頭著者。
2022年12月22日掲載 - 詳細はこちら
PDFを見る
要旨
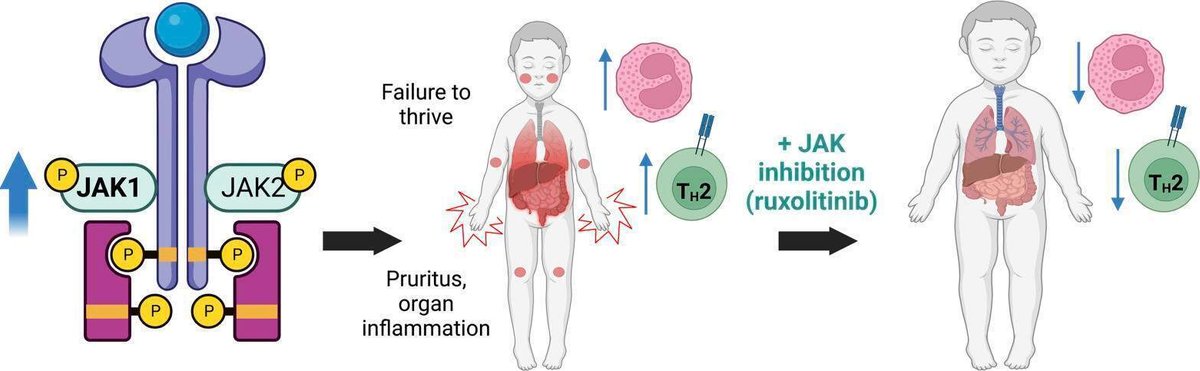
原発性アトピー性疾患は、免疫系が重症のアレルギー性疾患へと偏向する先天性免疫異常の一群である。これらの極端な単発性表現型の根底にある生物学を明らかにすることで、一般的な多発性アレルギー疾患の根底にある共通のメカニズムが明らかになり、創薬ターゲットの可能性が見いだされる。JAK1の生殖細胞系列機能獲得(GOF)変異体は、重症アトピーと好酸球増多の原因である。JAK1GOF (p.A634D) 変異体をゼブラフィッシュとヒト人工多能性幹細胞 (iPSC) でモデル化すると、骨髄造血が促進されることが明らかになりました。JAK1GOFヒト全血、iPSC、トランスジェニックゼブラフィッシュのRNA-Seqにより、IL-4、IL-13、IFNシグナルに関わる調節異常のコアセットが共有されることが明らかになった。JAK1GOF変異体を持つ患者の免疫表現型およびトランスクリプトーム解析により、Th細胞の著しい偏りが明らかになった。さらに、JAK1GOF(p.A634D)変異体を持つ2人の小児にルキソリチニブを長期投与すると、成長、好酸球増加、アレルギー性炎症の臨床症状が顕著に改善されました。この研究により、アトピーの免疫異常におけるJAK1シグナルの役割と、好酸球性疾患およびアレルギー性疾患の治療におけるJAK1/2阻害の臨床的インパクトが強調されました。
グラフィカルアブストラクト
グラフィカルアブストラクト
はじめに
喘息やアレルギーは、世界的に莫大な健康・経済的負担を与えている(1)。アレルギー性炎症を引き起こす細胞および分子メカニズムを理解することは、新しい治療法や予防法を特定する上で重要なステップである。好酸球増加とアレルギー性炎症に関連する単発性先天性免疫異常(IEI)を有する希少なヒト患者を研究することは、アトピーの根底にある分子メカニズムに関する独自の洞察をもたらし、新しい治療標的を特定する可能性があります。
2017年、重度のアトピー性皮膚炎、喘息、食物アレルギー、成長不良、自己免疫性甲状腺炎、末梢血好酸球数の著しい上昇を有する一家でIEIが発見されました(2)。全エキソーム解析の結果、罹患家族においてJAK1の調節型シュードキナーゼドメイン(JAK1GOF)にヘテロ接合性の機能獲得(GOF)変異(c.1901C>A、p.A634D)があることが判明しました。JAK1はプロテインキナーゼのJAKファミリーに属し、細胞性免疫、造血、成長に関与する複数のサイトカインや成長因子の受容体に採用されている(3)。この強力な遺伝子型と表現型の関係をさらに裏付けるものとして、好酸球増加と重度のアレルギー性炎症を有する非血縁の患者が、シュードキナーゼ領域に位置するミスセンスJAK1GOF変異体をヘテロ接合体で有していることが判明した(4)。同様に、N-ethyl-N-nitrosourea(ENU)変異誘発によってJAK1GOF変異体が誘導された2種類のマウス系統(すなわち、Spade R878H およびS645P)も、アトピー性皮膚炎、IgEの上昇、Th2バイアス免疫系を含むアレルギー症状を発症した(5, 6)。
好酸球は、局所的な炎症反応の制御に関与する骨髄由来の細胞であり、アレルギー疾患における重要なエフェクターである(7-10)。好酸球は免疫において重要な役割を果たしているにもかかわらず、好酸球の造血に関与するシグナル伝達経路の定義はいまだ不明である。最近の研究により、初期の好酸球形成におけるIL-33の重要性が明らかになったが、骨髄系前駆体におけるIL-33受容体の発現を促す要因は不明である(11, 12)。IL-5は、好酸球の分化と増殖の調節因子として確立されている(13)。IL-3とGM-CSFはIL-5と共通のβ鎖を持つ受容体で、好酸球の産生と生存の両方に寄与している(9)。
現在のところ、JAK1と好酸球増多との間に明確な生物学的関連性はない。JAK1はIL-33受容体の発現を制御する役割は知られておらず、GM-CSF、IL-3、IL-5は主にJAK2を通じてシグナル伝達を行うと考えられている(3)。これまでの研究では、ウイルスに対する1型IFN応答におけるJAK1の重要性に焦点が当てられていた。抗ウイルス反応の異常は、幼少期のアレルギーの偏りに関与しているが、このパラドックスを引き起こすシグナルは不明である(14)。我々は、ヒト全血、人工多能性幹細胞(iPSC)およびJAK1GOF変異体を持つゼブラフィッシュを用いた研究から得られた知見を組み合わせて、JAK1シグナルの増強がどのようにアレルギー性炎症を促進するかを調べようとした。JAK1がIL-6やIFNシグナルに果たす役割は確立されているにもかかわらず、JAK1シグナルの亢進がTh2表現型を促進することを明らかにし、JAK1GOF患者の重症アレルギー疾患という臨床所見を説明することに成功した。さらに、小児におけるJakinibの長期使用に関するデータは乏しく、骨髄増殖性新生物における研究では、特にウイルスなど感染症のリスクに関する懸念が提起されています(15)。ここでは、ルキソリチニブで6年間治療したJAK1GOF患者の転帰を説明し、Jakinibで治療した小児患者の安全性と臨床に関する重要なデータに貢献します。これらの知見は、特に現在臨床使用が承認されているJakinibの数が増加していることを考慮すると、負担の大きいヒトアレルギー性免疫調節障害の病因と潜在的な治療標的の理解にとって重要な意味を持ちます(16)。
研究成果
JAK1GOF患者におけるアレルギー性免疫異常と血液学的異常、およびルキソリチニブに対する長期持続的奏効。我々は、2人のJAK1GOF患児(家系図ではIII-1とIII-2と命名)(補足図1;本論文でオンライン公開されている補足資料;https://doi.org/10.1172/jci.insight.150849DS1)とその患母(II-2)のアレルギー性炎症について慎重に評価した。既報の通り、臨床評価により、両児童はルキソリチニブによる標的治療を開始する前に、重度の治療抵抗性アトピー性皮膚炎と重度の喘息を患っていたことが判明した(2)。6歳(III-1)と20ヶ月(III-2)に開始したルキソリチニブ治療は、痒みとアトピー性皮膚炎の症状を急速に改善し、外用コルチコステロイドを中止することができました。呼吸器症状もルキソリチニブで改善したが、両患者とも吸入フルチカゾン/サルメテロールを継続使用している。患者III-1の肺機能検査では、有意な気管支拡張剤反応を伴う閉塞性気道疾患が引き続き認められ、慢性肺疾患に起因する非可逆的な閉塞の要素もあることがわかった。患者III-2は、生後8ヶ月で重症のパラインフルエンザ感染を経験したが、ルキソリチニブを開始して以来、重大な呼吸器系の増悪はなく、スパイロメトリーも正常である。患者III-1には、魚に触れた後のアナフィラキシー歴と2歳時の皮膚プリックテスト陽性に基づき診断された魚アレルギーの既往がある。最近の再評価では、皮膚テスト陰性と総IgEの正常化が見られた(図1A)。患者 III-2 は、患者 III-1 よりもずっと若い年齢でルキソリチニブを開始したが、特異的なアレルギーを発症していない。患者 III-1 は、急性特発性蕁麻疹のエピソードにも悩まされている。定期的な痒みの増悪や食欲不振・摂食障害は、ルキソリチニブ投与量の緩やかな増量でうまく対処しており、現在、患者はルキソリチニブ 1.5-2.5mg/kg/ 日を 1 日 2 回に分けて投与してうまくコントロールされている。III-1、III-2と同様に、彼らの母親(患者II-2)は、好酸球増加、アトピー性皮膚炎、喘息、アレルギー性鼻炎、食物・薬物アレルギーなどの重度のアレルギー性炎症に苦しんでいます。選択的JAK1阻害剤ウパダシチニブを15 mg/日の用量で投与すると、患者の痒みと皮膚炎が改善されました(息子たちがルキソリチニブで経験した効果よりも低い程度ですが)。しかし、酒さと体重増加の副作用が伴いました。
ルキソリチニブ投与によるJAK1GOF患者の持続的な臨床的改善.図1
ルキソリチニブ投与によるJAK1GOF患者の持続的な臨床的改善。(A)ルキソリチニブ治療後の患者III-1のIgE値と皮膚プリックテストのサイズの両方が低下している。(B)罹患者は、総WBC数の重度の上昇を示し、その後ルキソリチニブで正常化した。ヘモグロビン値は、ルキソリチニブ投与前は正常/上昇していたが、投与後は正常下限/軽度低値のままであった。血小板数は正常範囲内であったが、ルキソリチニブ治療で血小板数が多くなった。ルキソリチニブ治療により好酸球数は劇的に改善したが、正常上限値(0.5×109/L)以上のままであった。(C) JAK1GOF 変異体を有する患者 III-I と III-2 のルキソリチニブ治療前後の成長チャート。
ルキソリチニブ治療を開始する前に、罹患患者は、血小板を除いて、造血系統の上昇を示し、血小板は、患者III-2では出生時に著しく減少し、その後、患者III-1とIII-2の両方において数は概して正常であった(図1B)。興味深いことに、血小板の数は、ルキソリチニブによる治療で増加傾向にあるようで、WBCとヘモグロビンのレベルが低下したのとは対照的であった。患児は、ルキソリチニブ投与前に単球増加、断続的な好中球増加とリンパ球増加を示し、重度の好酸球増加を示しました(図1Bおよび補足図2)(2)。好酸球数はルキソリチニブ治療で劇的に減少しましたが、中等度の高値を維持し、用量依存性の貧血がルキソリチニブ投与のさらなる増量を制限しています。ルキソリチニブは JAK2 を介したエリスロポエチンのシグナル伝達を阻害するため、ヘモグロビンの減少は予想された副次的症状でした。
成長パラメータは、小児集団の全般的な健康状態を表す有効な指標です。JAK1GOF患者では、成長障害が胎内で始まり、出生後に低身長と体重増加不良が続きます。JAK1GOF変異体が発見される前に、患者III-1は成長不全の臨床評価を受け、成長ホルモン(GH)シグナル軸は、GHに応答して肝臓で産生されるインスリン様成長因子(IGF-1)の血清レベルを測定することで評価されました。IGF-1値は検出されず、繰り返し分析したところ、著しく低下していた(検出されず33μg/L、年齢別参照区間62~361μg/L)。患者 III-1 と III-2 のルキソリチニブ治療開始後、身長と体重増加速度の両方が顕著かつ持続的に改善されました(図 1C)(2)。しかし、ルキソリチニブ治療後の患者III-1のGH軸の再解析では、IGF-1の正常化(63〜138μg/L)が示された。これは、GHが主にJAK2を通じてシグナル伝達し、JAK1およびJAK2シグナルの両方を標的とするルキソリチニブが阻害すると予測されたため、予想外であった(17)。両患者は、甲状腺機能低下症、好酸球性胃腸症(EGID)、および肝線維症の可能性もあると診断されました。ルキソリチニブ投与開始後、両患者は、消化器症状(嘔吐と摂食不耐性)が急速に回復し、肝酵素と線維化マーカーも改善されました。これらの患者に見られるその他の臨床的特徴には、心臓(III-1 の卵円孔開存と III-2 の心房中隔欠損)、血管(III-1 と III-2 の下大静脈のコース異常)、脳の構造異常(III-1 のキアリ奇形と III-2 の伝導難聴を伴う高乗頸球)などがあります。
JAK1GOFはヒトの骨髄造血を促進する。患児に見られる顕著な好酸球増加を考慮し、我々はJAK1GOFが造血に及ぼす影響を評価した。生殖細胞系列JAK1GOF変異体(III-1およびIII-2と呼ぶ)を有する2人の子供のBM研究から、好酸球および好酸球性前駆体の増加が認められた。1人の患児の正式なBM列挙は、9:1(年齢参照の平均3.5:1)(18)という高い骨髄/赤血球比とBM細胞の69%(年齢参照の範囲、0〜6%)(19)が好酸球系列に属している(図2A)ことを示した。JAK1GOFとXY対照iPSCで行った骨髄分化誘導(図2、BおよびC)により、骨髄形成への偏りがさらに確認され、対照と比較してJAK1GOFサンプルでは骨髄コロニーの割合と骨髄/赤血球コロニー比率が増加した(図2、D-F)。
JAK1GofのBMとiPSCは骨髄形成に偏っていることが明らかになった。
JAK1GOFのBMとiPSCは骨髄造血に偏っている。(A)JAK1GOF患者から得られたBM生検スライドは、健常対照BM生検(Ctrl)と比較して好酸球系が増加していることを示す。画像は50倍の倍率で表示。(B)JAK1GOFおよびXY対照(Ctrl)iPSCの代表的な写真であり、明確なエッジを有する密に詰まったiPSCを含む、フィーダーフリー培養で成長したiPSCの正常な形態を実証している。(C) JAK1GOFおよびCtrl iPSCの胚様体(EB)分化。EB分化の10日目に得られた画像。(D)造血前駆体CFUを含む代表的なメチルセルロースプレート。JAK1GOFと比較してCtrlでは、ヘモグロビン化した赤血球前駆体CFUの割合が増加していることが分かる。B-Dに示す実験は3回実施した。(E)JAK1GOFでは、赤血球(CFU-E、BFU-E)CFUの割合がCtrlと比較して減少し、顆粒球/単球前駆体(CFU-G、CFU-M、CFU-GM)の割合が増加した。総CFUの平均割合(データは平均±SEMで表示)は、Welchの補正を用いた両側不対t検定で比較した。(F)JAK1GOFにおける骨髄/赤血球比の増加(平均値±SEMとして示されたデータ)は、Welchの補正を用いた両側不対t検定によりCtrlと比較された。
Jakinib治療に反応するJAK1GOF変異体保有患者におけるThサブセットの歪み。次に、JAK1GOFがリンパ球に及ぼす影響を評価しました。JAK1GOF の臨床表現型の複数の側面は、 罹患した家族全員に見られるアトピーや自己免疫性甲状腺疾患など、 T 細胞の調節障害を示唆しています。JAK1シグナルの増強がT細胞の分化に及ぼす影響を明らかにするため、Jakinib治療を受けていないJAK1GOF患者(家系図ではII-2と指定;補足図1)から分離した末梢血単核細胞(PBMC)におけるTh細胞サブセットの比率を、健常対照(HC)と比較して分析しました。JAK1GOF患者では、Th2、Th17、Th1サブセットの増加が確認され、Th2区画で最も劇的な効果が観察されました(図3、AおよびB)。JAK1シグナルの増強がTh分化に及ぼす影響を別の実験手法でさらに解析するため、HCとJAK1GOF患者から得られた全血RNA-Seqデータを活用した(図3C)。全血発現データの細胞不均一性の中でTh細胞を評価するため、様々なTh集団に特異的であると文献で以前から同定されている遺伝子に絞って解析を行った(20)。主成分分析(PCA)は、Th1、Th2、Th17サブセットの確立された遺伝子発現シグネチャーを患者とHC間で比較するために行われた(20)。フローサイトメトリーベースのT細胞表現型を再現すると、JAK1GOFバリアントが存在する場合、HCと比較してTh2遺伝子シグネチャーの発現が有意に増加したことが検出された(図3C)。重要なことは、ルキソリチニブ治療により、JAK1GOF全血のin vivo Th2遺伝子シグネチャーが有意に減少し、Th1遺伝子シグネチャーが増加したことである。
JAK1GOFにおけるTh2表現型とT細胞活性化の亢進.図3
JAK1GOFにおけるTh2表現型とT細胞活性化の亢進。(A)健常対照者(Ctrl)とJAK1GOF患者(II-2)のTh2、Th17、Th1、およびTh1/17細胞サブセットを、それぞれCCR4+CXCR3-CCR10-CCR6-、CCR4+CXCR3-CCR10-CCR6+、CCR4-CXCR3+CCR10-CCR6-、CCR4-CXCR3+CCR10-CCR6+として特定した生CD3+T細胞に対する割合で表したフローサイト解析プロットの代表図である。赤い長方形は、赤い矢印で示された後続のプロットのためにゲーティングされた細胞集団を強調する。この実験は患者サンプルで2回行った。(B) Thサブセットの平均頻度(データは平均±SEMとして表示)。サブセット頻度は、各サブセットの割合にサンプルのCD4+ T細胞数を掛けることによって計算。(C) 全血RNA-SeqデータからのThサブセット遺伝子発現のPCA。第一主成分(PC)値(データは平均±SEMで表示)を、ボンフェリ多重比較補正を用いた1-way ANOVAを用いて群間で比較した。(D)ナイーブCD4+JAK1GOF T細胞の割合の減少。の代表的フローサイトメトリーと(E)ナイーブ、エフェクターメモリー(TEM)、エフェクターメモリー再表現CD45RA(TEMRA)、およびセントラルメモリー(TCM)CD4+ T細胞の割合。この実験は患者細胞で1回行った。(F)コントロールと比較した、IL-4、IFN-γ、およびIL-17分泌JAK1GOF CD4+T細胞、およびIL-4、IL-9、およびIL-17分泌JAK1GOF CD8+T細胞(CD3+CD4-T細胞として識別)の頻度が増加した。(G)膨張し活性化したJAK1GOF T細胞におけるIL4遺伝子の発現の増加。DMSOコントロール、IL-2、およびIL-2とルキソリチニブ(1mM)で4時間刺激した後、qPCRを用いて測定した。相対的な遺伝子発現CtrlとJAK1GOFは、Livak法(2-ΔΔCt)を用いて算出した。
JAK1シグナルの増強がT細胞の恒常性と機能に及ぼす影響を明らかにするため、Jakinib治療を受けていないJAK1GOF患者(II-2)のT細胞について追加分析を行った(図3、D-G)。まず、年齢をマッチさせたHCと比較して、ナイーブ集団とT細胞メモリー集団の比率を分析した(図3、DおよびE)。トランスクリプトミクスによって同定されたJAK1GOF T細胞におけるThサブセットの増加という発見と一致して、エフェクターおよびセントラルメモリーT細胞の付随する増加とともに、ナイーブCD4+ T細胞の割合が、HCと比較してJAK1GOF PBMC間で減少していることが観察された。拡張T細胞を用いて機能を評価すると、4時間のPMA/イオノマイシン刺激後、JAK1Gof患者はIL-4-、IFN-γ-およびIL-17産生CD4+ T細胞の割合が増加し、最大の違いはIL-4+ 集団に見られた(図3F)。CD8+T細胞サイトカイン発現を評価するために、CD3+CD4-T細胞にゲーティングすると、JAK1GOF細胞をHCと比較した場合、IL-4とIL-17が増加し、IFN-γ発現が同程度であることが明らかになった。なお、この実験は、患者がJAK1阻害剤(ウパダシチニブ)による治療を開始したため、患者サンプルの入手に限界があり、1回のみ実施されたものである。ウパダシチニブで10ヶ月間治療した後、繰り返し分析したところ、患児のIL-4、IL-17、IFN-γ産生CD4+ T細胞の割合が治療前の値と比較して緩やかに減少し、IL-4とIL-17でより大きな割合の減少が観察されました。しかし、IL-4とIFN-γ分泌CD4+ T細胞の頻度はコントロールと比べてまだ高かった(補遺図3)。前処理で採取したサンプルのサイトカイン産生データを検証するため、IL-2、ルキソリチニブ入りIL-2、またはビヒクル対照(DMSO)で4時間処理した後、定量PCR(qPCR)によりIL4遺伝子発現も評価した。HC T細胞と比較して、JAK1GOF患者T細胞は、IL-2での刺激に反応して3倍高いIL4の発現を示し、ルキソリチニブはHCおよびJAK1GOF T細胞の両方でこの反応をベースラインレベルに減少させた(図3G)。
ヒトJAK1GOFにおけるトランスクリプトームとサイトカイン受容体の異常なプロファイル。骨髄系分化が進行したiPSC由来胚様体(EB)(JAK1GOF iPSC)と患者由来の全血において、JAK1シグナルの増強が造血に与える影響についてトランスクリプトーム解析により全体像を把握した。JAK1GOF iPSCは、PCAに基づくユニークな遺伝子発現プロファイルを示した(図4A)。同様に、JAK1GOF変異体を有する患者も独自の遺伝子発現シグネチャーを示し、ルキソリチニブを経口投与した全身療法を最低6週間行うと、遺伝子発現差のパターンはHCで見られるものへと変化した(図4A)。造血系に特異的な変化に着目し、iPSCと全血の両方で差次的に発現する遺伝子を評価しました(図4B)。ヒトJAK1GOF iPSCと全血の両方で発現が上昇した43遺伝子のうち、Reactome PathwayとGene Ontology(GO)用語群解析により、サイトカインシグナリングと白血球分化の転写プログラムに富んでいることが明らかになった(図4、C、D、補足表1および2)。JAK/STAT経路を介したシグナル伝達が知られているIFNとIL経路に加えて、リアクトーム解析ではロイコトリエン/エオキシンとIL-33シグナルが濃縮されており、JAK1シグナルの増強がアレルギー性炎症と好酸球増加を促進する予想外のメカニズムを示唆している。
ヒトJAK1GOFにおける遺伝子発現の異常とサイトカインシグナル伝達の亢進.図4
ヒトJAK1GOFにおける異常な遺伝子発現とサイトカインシグナル伝達の亢進。 A)iPSCと全血のPCAは、対照群と比較してJAK1GOFのクラスタリングを示し、ルキソリチニブを投与した患者からのJAK1GOFサンプルは対照群に近い位置に移動している。3つ以上のサンプルを含むグループについては、独立したクラスタリングを示す楕円が表示されている。(B)JAK1GOFを持つヒトiPSCおよび全血における差次的発現遺伝子の解析では、対照群と比較してiPSCおよび全血の両方で43個の発現が増加し、55個の発現が減少していることが示された。(C) ヒトJAK1GOF iPSCおよび全血の両サンプルで見つかった43個の発現上昇遺伝子において、Reactome Pathway解析により有意に濃縮されたパスウェイのキュレーションされたリスト。y軸はReactome Pathway、x軸は各パスウェイの遺伝子数に対する発現上昇遺伝子の割合、各ドットの大きさはサンプルで同定された遺伝子数に相当する。色は修正P値に対応し、赤がより有意である。(D) ヒトJAK1GOF iPSCおよび全血サンプルにおいて、共有された発現上昇遺伝子に濃縮されたオントロジー用語群からの分散安定化遺伝子発現値のヒートマップ。(E)ヒトJAK1GOF iPSCおよび全血サンプルで発現上昇したサイトカインおよびサイトカイン受容体のウォーターフォールプロット。Y軸はコントロールと比較したJAK1GOFのlog fold change、X軸は遺伝子名に対応する。色は-log(P値)を示し、赤がより有意であることを示している。健常対照者5名、治療前の異なる時点で得られたJAK1GOF患者3名(II-2, III-1, III-2から各2サンプル)、治療後のJAK1GOF患者2名(III-1, III-2)から得られた全血RNA-Seqデータ(異なる時点で得られたIII-1から1サンプルとIII-2から2サンプル)。iPSC分化第7日のiPS細胞由来EBから得られたiPSC RNA-Seq データ(JAK1GOFおよびCtrlから各3サンプル、各サンプル50EB採取した)。
次に、JAK1GOF iPSCまたは全血のいずれかで発現が上昇したサイトカインおよびサイトカイン受容体について、遺伝子発現差の結果をフィルターにかけた。20種類のサイトカイン/サイトカイン受容体がJAK1Gof iPSCで、11種類が全血で発現上昇し、その大部分は以前にアレルギー性炎症に関与していた(図4E、補足表3および4)。TL1AをコードするTNFSF15遺伝子はJAK1GOF iPSCで最も高い発現量を示し、CCL23遺伝子はJAK1GOF患者からの全血で最も高い発現量を示した。IL-33Rをコードする遺伝子(IL1RL1)は、両方の細胞集団で高度にアップレギュレートされていることが注目された(図4E)。
透明ゼブラフィッシュを用いたJAK1GOFのモデリングに成功。p.A634D JAK1GOFが介在するアレルギー性炎症の基礎となるメカニズムをさらに理解するために、ヒト血液疾患の強力なモデルであるゼブラフィッシュ(Danio rerio)を用いて、造血に対するJAK1シグナルの増強の影響を評価した(21-25)。我々は、ヒトJAK1WTまたはJAK1GOF遺伝子とsfGFPを融合させたトランスジェニック株を、casper (mitfaw2/w2; mpv17a9/a9) ゼブラフィッシュ系統、すなわち造血の動態と空間的特性の研究を容易にする透明(目を除く)ゼブラフィッシュ変異体、に作製した(図5A)(26)。F1世代で高発現するJAK1WT鋳型からのトランスジェニック系統は容易に得られたが、JAK1GOF胚は生存率が悪く、複数の発生異常が見られた(図5、BおよびC)。この問題を克服するために、受精後6時間(hpf)から24時間ルキソリチニブを添加したところ、JAK1GOFを発現する魚が十分に回復し、系統を確立しやすくなった(ルキソリチニブ処理群と未処理群の生存率の差のP < 0.0001; Figure 5B)。JAK1GOF導入遺伝子の毒性は、導入遺伝子を高発現させたJAK1GOF F1胚も異常発生を示したので、F0胚に限定されなかった(図5、DおよびE)。
JAK1トランスジェニックゼブラフィッシュの作製(図5
JAK1トランスジェニック・ゼブラフィッシュの作製。(A) JAK1-WT(JAK1WT)とJAK1-A634D(JAK1GOF)のヒトcDNAを含む2つのゼブラフィッシュ系統を作製した。UbiはJAK1と緑色蛍光タンパク質(GFP)を発現させるユビキタス・プロモーターである。このコンストラクトを1細胞期のゼブラフィッシュ胚にマイクロインジェクションした。GFP+の魚が選択された。(B)ルキソリチニブの異なる用量を試験し、両方のトランスジェニック魚の生存のための最適用量を決定した。ルキソリチニブ(1μM)は、3つのトランスジェニック系統すべてについて、より高い生存レベルに基づいて選択された。生存率は、群間(JAK1WTおよびJAK1GOFトランスジェニックゼブラフィッシュと非注射ゼブラフィッシュ)で比較し(P < 0.0001)、また2ウェイ反復測定ANOVAを用いてJAK1GOFトランスジェニックゼブラフィッシュのルキソリチニブの異なる用量にわたって比較した(P < 0.0001)。(C)トランスジーンを発現するJAK1GOF創始者からのF1胚は異常発生を示し、これはルキソリチニブへの曝露により救済され、ゼブラフィッシュにおけるJAK1GOFの保存機能発生的影響が明らかにされた。残りのパーセンテージはGFP陰性ゼブラフィッシュに相当する。(DおよびE)30 hpfのJAK1GOF注入ゼブラフィッシュの代表的な写真で、正常な発生と異常な発生を示す。
ヒトJAK1GOF変異体をトランスジェニックしたゼブラフィッシュでは、骨髄由来造血細胞が増加している。脊椎動物であるゼブラフィッシュの造血は、赤血球や骨髄細胞の前駆体が生成される原始期(0〜約28 hpf)と、造血幹・前駆細胞(HSPC)が生成されて成魚のすべての血球型を生み出す確定期(約36 hpf〜)の2波で完結します(27)。JAK1WTあるいはJAK1GOF導入遺伝子がゼブラフィッシュの造血に及ぼす影響を明らかにするために、24、28、36、48 hpfの胚に対してホールマウントin situ hybridization(WISH)を実施した。c-myb/runx1 (造血前駆細胞および幹細胞), pu.1 (骨髄前駆細胞), mpx (好中球), cpa5 (肥満細胞), および gata1 (初期赤血球)の系統特異的プローブ群を用いた (Figure 6 および補足図 4-8).
ヒトJAK1WTおよびJAKの血液学的表現型の特徴 図6 ヒトJAK1WTおよびJAKの血液学的表現型の特徴
ヒトJAK1WTおよびJAK1GOFトランスジェニック魚の血液学的表現型の特徴。(A)JAK1WTおよびJAK1GOFトランスジェニック遺伝子型のゼブラフィッシュ胚における幹細胞および分化した骨髄系細胞のジゴキシゲニン標識RNAアンチセンスプローブを用いたホールマウントインサイチューハイブリダイゼーション(WISH)。代表的な顕微鏡写真のパネルは、48hpfにおける造血幹細胞のrunx1/c-myb染色、28hpfにおける初期ミエロイド細胞のpu.1染色、48hpfにおける好中球のmpx染色、48hpfにおけるマスト細胞のcpa5染色を示す。また、矢印はマーカー発現の主要な部位を示す。(B) 48 hpfにおけるrunx1/c-myb、28 hpfにおけるpu.1、48 hpfにおけるmpxおよびcpa5についてのマーカー陽性細胞数のプロット。各個体の胚の数は塗りつぶした円で示し、箱ひげ図では95%信頼区間をカバーするひげを付けて四分位分布を示す。黒丸は異常値の位置を示す。一元配置分散分析により,群間の統計的差異を定量化した.***p ≤ 0.001; ****p ≤ 0.0001。
JAK1GOF変異体は、ゼブラフィッシュの造血に著しい影響を及ぼした。JAK1GOF遺伝子導入魚では、36および48 hpfにおいて、非トランスジェニックカスペル(WT)と比較してHSPCが増加した(図6および補足図4)。骨髄系前駆細胞(pu.1)は24および28 hpfでWTと比較してJAK1GOFで増加した(図6および補足図5)。JAK1WTは28 hpfでWTと比較して骨髄前駆細胞の数が多かったが、この差はJAK1GOFの存在下でさらに大きくなった。さらに骨髄系譜の下流に目を向けると、JAK1GOFでは36 hpfと48 hpfでJAK1WTトランスジェニック株とWTゼブラフィッシュの両方と比較して好中球(mpx)が増加した(図6と補足図6)。両トランスジェニック魚で48 hpfでWTゼブラフィッシュと比較して同様の肥満細胞(cpa5)の増加が観察された(図6と補足図7)。これらのデータは、ヒトJAK1WTのトランスジェニック発現によるゼブラフィッシュの骨髄由来造血細胞の増加を示し、それがJAK1GOFの存在下でさらに増強されたことを示している。また、JAK1GOF魚ではWTと比較して24時間後の初期赤血球が増加し、JAK1WTと同様の傾向が見られた(それぞれP = 0.0378, P = 0.0746; 補足図8、AおよびB)。
JAK1GOFトランスジェニック・ゼブラフィッシュのトランスクリプトーム・プロファイリング。JAK1GOFバリアントの発生学的影響についてさらなる洞察を得るため、3つの遺伝子型について28および36 hpfでRNA-Seq実験を行い、グローバルなトランスクリプトームを解析した。WT、JAK1WT、JAK1GOFの3つの遺伝子型(各3グループ、1グループ30胚)を用いて28hpfと36hpfでRNA-Sq実験を行い、グローバルなトランスクリプトームを解析した(図7A)。遺伝子レベルのリードカウントを用いてPCAと多次元尺度法(MDS)を行い、最初の2成分をプロットした(図7Bおよび補足図9A)。28 hpfサンプルについて、PC2またはX2成分は、JAK1GOFサンプルをWTゼブラフィッシュおよびJAK1WTサンプルからきれいに分離することができた(図7B)。
注射していないゼブラフィッシュとヒトJAK1WTおよびJAK1GOFトランスジェニックゼブのRNA-Seq 図7.
注射していないゼブラフィッシュとヒトJAK1WTおよびJAK1GOFトランスジェニックゼブラフィッシュのRNA-Seqにより、JAK1GOF(p.A634D)に関連する明確なトランスクリプトームパターンが明らかになった。(A)ゼブラフィッシュ胚におけるJAK1-A634D(JAK1GOF)により特異的に誘導される遺伝子の同定を目的としたRNA-Seq実験に関わるステップの説明。標準的なサンプル収集とRNA-Seqステップを行った後、解析段階での主な比較はJAK1WTサンプルとJAK1GOFサンプルの間で行われた。(B)WT、JAK1WT、JAK1GOFサンプルからなる28および36 hpfデータセットのPCA。プロットは最初の2成分(PC1、PC2)を含み、28 hpfにおけるJAK1GOFサンプルとJAK1WTまたは非注射サンプルとの明確な違いを特定する。 C)分析したサンプルの全グループにおいて、少なくとも1ステージ(28および36 hpf)でJAK1GOFによって発現が上昇した遺伝子(58遺伝子)に存在するIFN刺激遺伝子の平均分散-安定化遺伝子発現値のヒートマップを示す。(D) JAK1GOFによって発現が上昇した遺伝子のReactome Pathway解析では、免疫関連経路とDNA損傷経路が強く濃縮されていることが示された。遺伝子比率は、入力遺伝子リストに存在したパスウェイの遺伝子の割合である。パスウェイに関連する遺伝子数およびP値は、点の大きさとその色で示される。 E)分析したすべてのサンプル群における「免疫系プロセス」GOタームに関連する遺伝子の平均分散安定化遺伝子発現値のヒートマップ。
JAK1GOFは、ゼブラフィッシュの自然免疫およびIFN刺激遺伝子をアップレギュレートする。JAK1GOFに特異的な効果を特定するために、さらなる解析でJAK1GOF-差次的発現遺伝子をJAK1WTと直接比較した(図7、C-E)。JAK1GOF群では28hpf期と36hpf期にそれぞれ152個と211個の遺伝子の発現が2倍以上増加し、そのうち105個は両期に共通していた(補遺図9B)。JAK1GOF変異体の存在下でダウンレギュレートされた遺伝子は少なく、28 hpfと36 hpfの段階でそれぞれ121と135の遺伝子がダウンレギュレートされ、そのうち75の遺伝子は共有されていた(補足図9B)。28及び36hpfの両方でJAK1GOFによってアップレギュレートされた105遺伝子のReactome Pathway解析は、自然免疫及び1型IFNシグナル伝達経路に濃縮されていることを実証した(図7D)。プロテアソーム遺伝子(psmb8a, psme2, psmb9a)やIFN経路関連遺伝子(irf3, irf7, stat1b, socs3a, socs3b)など多くの経路で遺伝子群が存在した。同様に、28および36 hpfの両方における発現上昇遺伝子のGO解析により、免疫系プロセスおよびウイルスや生物学的刺激に対する応答に関連する用語が同定された(図7Eおよび補足表5)。
IFNシグナル伝達におけるJAK1の役割(28)を考慮し、我々は、ゼブラフィッシュの600以上のISGの包括的リストを用いて、IFN刺激遺伝子(ISG)によって発現上昇遺伝子のどの割合が説明され得るかをさらに深く探った(29)。その結果、JAK1GOFゼブラフィッシュでは、ISGとすべての発現上昇遺伝子の交点が見つかり、それは58遺伝子からなり、したがって、すべての発現上昇遺伝子の約22%を占めていることがわかった。全サンプルにおけるこれらの遺伝子のヒートマップは、これらの遺伝子がJAK1GOFにおいてのみ一貫してアップレギュレートされていることを明確に示している(図7C)。まとめると、JAK1GOFはISGを介してその影響の一部を及ぼしている可能性が高い。
JAK1GOFゼブラフィッシュとヒトモデルに共通する発現差のある遺伝子のコアセットを定義する。ヒトiPS細胞/全血とゼブラフィッシュの遺伝子発現データを解析し、2つの生物種の間でオルソログが知られている遺伝子のみに焦点を当てて、差次的発現遺伝子のコアセットを定義しました。FDRが5%未満のすべての差次的発現遺伝子をグループ間で比較した(図8A)。25の遺伝子が、ヒトJAK1GOF全血、iPSC、JAK1GOFトランスジェニックゼブラフィッシュで差次的に発現していた(図8B)。Reactome Pathway解析により、共有された差次的発現遺伝子の中で最も有意に濃縮されたコア経路としてIL-4/IL-13シグナルが、次いでIFN-α/βシグナル(30、31)であることが判明した(図8C)。3つのモデル全てに共通する差次的発現遺伝子の機能濃縮解析では、予想以上に有意な相互作用が明らかになり(図8D)、タンパク質間相互作用濃縮P値は1.38 × 10-3 (30)であった。IL-4/IL-13経路とIFN-α/β経路の両方に固有の遺伝子が同定されたが、SOCS1とSOCS3はこれらの経路の両方に存在する(図8、CとD)。IL-4/IL-13およびIFNシグナル伝達におけるJAK1の役割が確立されていることを考えると、この発見は、これらのモデルシステムの根本的な妥当性を支持するものである。
JAK1GOFは生物種を超えてIL-4、IL-13、IFNシグナルを駆動する図8
JAK1GOFは、種を超えてIL-4、IL-13、およびIFNシグナル伝達を駆動する。(A)ゼブラフィッシュ、人工多能性幹細胞(iPSC)、ヒト全血の遺伝子発現差を比較するための解析パイプラインの図式的説明。(B)発現量の異なるオーソログ遺伝子の解析により、ヒトJAK1GOF iPSC、ヒトJAK1GOF全血、JAK1GOFトランスジェニックゼブラフィッシュの間で共通する25遺伝子が同定された。(CとD)JAK1GOF患者、iPSC、トランスジェニックゼブラフィッシュで差次的に発現した25遺伝子のReactome Pathway解析とSTRINGタンパク質間相互作用により、タンパク質間相互作用、IFNとIL-4/IL-13シグナル伝達が有意に濃縮されていることが明らかになった。Y軸はReactome Pathway、X軸は各Pathwayの遺伝子数に対する上昇した遺伝子の割合、各ドットの大きさは同定された遺伝子の数に相当する。色は修正 P 値に対応し、赤がより有意である。Dには、Reactome Pathwayで発現が上昇したタンパク質がアノテーションされており、IFNとIL-4/IL-13のシグナル伝達においてSOCSタンパク質が共通して発現していることが明らかにされている。
考察
アレルギー性炎症を引き起こすIEIの研究は、一般的なアレルギー疾患の基礎となる病態生理の理解を深めるための強力な戦略である。さらに、IEIの分子基盤を明らかにすることは、遺伝的欠陥によって障害された特定の経路を標的とした治療法を選択できる「精密医療」の可能性を生み出す(32-34)。より広い集団のレベルでは、重症単原性アレルギー疾患の基礎となるメカニズムを明らかにすることで、一般的なアレルギー疾患を予防・治療するための新しいターゲットが発見されると予想されます(35)。
本研究では、ヒト生殖細胞変異体JAK1GOF (p.A634D) をモデルとして、ヒトとゼブラフィッシュを組み合わせた実験系を活用し、JAK1シグナルの過剰発現が造血異常とアレルギー性免疫調節異常、特にTh偏向と骨髄造血増強につながるいくつかの重要なメカニズムを明らかにした。これは、 IL-4/IL-13 や Th2 遺伝子発現シグネチャー、 および Jakinib 治療に劇的に反応する臨床アレルギー疾患によって示される、 2 型炎症によって引き起こされているという証拠を提供するものである。これは、 IFN シグナルにおける JAK1 の役割を考えると特に驚くべきことで、 JAK1 は従来から、 重篤な神経症状や血管炎/白癬様皮膚病変を含む 1 型 IFN 病変の発現に関連しています (36) 。おそらく最も重要なことは、これらの実験モデルが、JAK1GOF変異体を有する患者に見られる多くの臨床的特徴と一致し、Jakinib経口療法に対する長期的な反応に関する機構的証拠を提供したことである。
独自の分析ツールを用いて、 JAK1 シグナルが亢進している患者には、 様々な Th 系統 (特に Th2 細胞) が増加していることが明らかになりました。この知見は、JAK1GOFがT細胞の活性化と分化を促進し、Th2細胞への偏向が観察される好酸球の一因となっている可能性を示唆しています。興味深いことに、ルキソリチニブ治療後、Th1遺伝子発現シグネチャーが増加した。しかし、ある条件下ではTh2遺伝子とTh1遺伝子の相互調節作用があることから、ルキソリチニブ治療によりTh2シグナルが阻害され、Th1関連遺伝子の発現が一時的に増加した可能性がある。この知見は、さらなる研究を必要とする。フローサイトメトリー、RNA-Seq、および初代細胞培養実験によって得られたデータはすべて、JAK1GOF初代細胞におけるTh2偏向を証明したが、我々は単一家族の研究に特有の問題に直面した。特に、3人の患者のうち2人はすでにルキソリチニブによる治療を受けていたため、T細胞の表現型分析に利用できたのは1人(II-2)のみでした。その後、II-2は選択的JAK1阻害剤ウパダシチニブによる治療を開始したため、T細胞の記憶とサイトカイン産生の評価試験を繰り返すことができませんでした。
患者II-2がウパダシチニブを服用し始めてから10カ月後、細胞内サイトカイン染色では、治療前と比較してIL-4、IL-17、IFN-γを分泌する細胞の割合がわずかに減少していることが確認された。これは、ルキソリチニブ治療患者III-1およびIII-2における観察とは対照的であり、ルキソリチニブ治療後にTh2遺伝子発現シグネチャーの有意な減少が観察された。アトピー性皮膚炎とかゆみは改善したものの、ルキソリチブの投与によりIII-1およびIII-2が経験したような劇的な臨床的改善は見られませんでした。II-2のウパダシチニブによる選択的JAK1阻害とIII-1とIII-2のルキソリチニブによるJAK1/2阻害の反応がそれほど劇的ではなかったことの説明としては、次のようなものが考えられる:JAK1GOF変異体によるJAK1シグナルの増強に完全に対抗するにはウパダシチニブの量が不十分だった、またはJAK1選択的阻害ではJAK1シュードキナーゼによる他のJAKファミリーキナーゼ(JAK2またはTYK2等)の転写活性化を扱えなかった (4). あるいは、アトピー性皮膚炎の改善にもかかわらず、ウパダシチニブの前後で細胞内サイトカイン染色の変化が緩やかであることは、JAK1によるアレルギー性免疫異常が非T細胞によって引き起こされていることを示唆している可能性もあります。実際、自然免疫様リンパ球(ILC)など、他の細胞がJAK1を介したアトピーに与える影響については、調査する必要がある。最近、upadacitinibがアトピー性皮膚炎の治療薬として承認されたため、T細胞の免疫表現型と臨床効果に対する投与量の影響をさらに検討することが重要である。
我々のT細胞に関する知見は、これまでのJAK1GOF動物モデルと一致している。Spade R878H JAK1GOFマウスでは、主に皮膚炎とTh2炎症が見られ、IFN-γの増加も認められた。同様に、我々の患者では、Th2細胞とIL-4の増加が最も顕著であり、Th1およびTh17コンパートメントの増強傾向が見られ、IFN-γ産生の増加が顕著であった。このような複数のサイトカイン軸の関与は、アトピー性皮膚炎などのアレルギー疾患で報告されている。患者は、病気の経過のタイミング、年齢、その他の要因に影響されて、Th1やTh17サイトカイン軸がさらに複雑に絡んだTh2優位の炎症を示すことがある(37)。JAK1は多くのThサブセットの分化に重要なサイトカインの下流で機能するので、JAK1シグナルの増強が複数のサイトカイン軸を介したエフェクター反応の増強につながることは驚くにはあたらない。我々の患者のCD4+T細胞におけるIFN-γ産生の増加は、IFN-γの欠損とマイコバクテリア感染への感受性を逆に示す二遺伝子型JAK1 LOF表現型とも一致する(38)。
我々は、ヒトとゼブラフィッシュの両方のモデル系を用いて、JAK1GOFが骨髄造血を駆動することを実証している。これは、ゼブラフィッシュモデルでは、まずHSPCの増加として観察され、次いで一般的な骨髄系前駆細胞の増加、そして顆粒球-単球系前駆細胞の増加が観察された。ゼブラフィッシュは好酸球を持つが、好酸球は蠕虫の刺激がない場合には稀な集団であるため、現在までのところ、その同定と分離は成魚においてのみ行われている(10)。幼生では好酸球の特異的なマーカーがないため、我々のゼブラフィッシュモデルではWISHによる好酸球の数の評価はできなかった。しかし、好酸球と近縁の細胞である好中球とマスト細胞は、それぞれ自然免疫と適応免疫、アレルギー性炎症に関与しており、その増加が観察された(39)。JAK1GOFにおいて好酸球が不均衡に影響を受ける理由を直接的に特定したわけではないが、この状態が骨髄造血と2型炎症を促進し、JAK1GOF変異体を有する他の患者でも好酸球増加が観察されていることを示している(4)。ヒトJAK1GOF iPSCでは、初期好酸球前駆体コミットメントのマーカーであるIL-33受容体遺伝子(IL1RL1)の発現が増加していることが確認された(12)。IL-33は好酸球の発生と生存を促進する重要なドライバーであり、IL-33遺伝子を包含する染色体重複が、好酸球増多とアトピーを持つ患者で最近確認された(40)。Th2細胞では、IL-33Rの発現はGATA3およびSTAT5の両方に依存している(41)。今後、造血細胞前駆体におけるIL-33Rの発現を促進するJAK1GOFの役割を確認し、これが好酸球系譜のコミットメントと結果として好酸球増加を促進するかどうかを確認することが目標である。
患者由来のJAK1GOF iPSCで観察されるアレルギー体質の偏りには、JAK1とは無関係の遺伝的要因が寄与している可能性があるが、JAK1GOF遺伝子導入ゼブラフィッシュで同時に観察された共通の遺伝子発現シグネチャーは、JAK1が我々のiPSCモデルで観察される免疫異常を促進していることを裏付けている。我々はこの発見に自信を持っているが、S703I GOFやP733L/P832S機能喪失などのJAK1変異体を持つより多くの患者を特定し研究することによって、さらなる確認がなされるであろう(4)。我々の発見は、活性型JAK1のレベルが高くなると、造血中に骨髄系への偏向が促進されることを示唆している。このことは、最終的に好酸球の産生を亢進させ、アレルギー性炎症に寄与している可能性がある。
JAK1GOFヒトとJAK1GOFトランスジェニックゼブラフィッシュの両方で発現が異なるオルソログ遺伝子を評価することにより、JAK1シグナルの増強によって影響を受ける最も重要な遺伝子と経路を特定することができました。RNA-Seq解析により、ゼブラフィッシュとヒトの両方で、抗ウイルス反応とIL-4/IL-13シグナル伝達に関与する多数の異なる発現遺伝子が同定された。これらの知見は、IFNと2型炎症シグナルの両方におけるJAK1の中心的な役割を強調し、JAK1シグナルの制御異常が、Jakinib治療で改善する重度のアレルギー性炎症につながることを裏付けています。Spade JAK1GOFマウスモデル(5)で観察されたように、JAK1GOF変異体を持つゼブラフィッシュとヒトの両方が、SOCS1とSOCS3の発現増加を示しました。これは、ゼブラフィッシュのsocs1の過剰発現が、骨髄異常に亢進したJAK1GOFゼブラフィッシュと同様の表現型を生み出すことから注目される(42)。このことは、サイトカインシグナルの異常の設定における制御分子の過剰発現が、細胞の恒常性を乱し、造血細胞集団の異常偏向に寄与する可能性も示唆している。
ヒトJAK1GOF全血およびiPS細胞で同定された発現量の異なるシグナル伝達分子およびサイトカイン/サイトカイン受容体は、JAK1シグナルの調節異常が、生後早期の過度の2型反応への異常偏向につながる可能性を示唆している。JAK1GOF iPSCにおけるTL1A(TNFSF15)、CSF1、CCL25、TSLP、IL-33R(IL1RL1)の発現増加は、JAK1GOFが自然細胞およびILC2など、JAK1GOF全血でその主要受容体(IL-25R、IL-33R、IL-2RA)が発現しているILCを介して、生後早期のアレルギー性炎症の制御を行うことを示唆するものだった。JAK1GOFの胎児期(子宮内発育不良、肝嚢胞、出生時の呼吸困難など)および乳児期初期(患者III-1とIII-2は好酸球数の最も激しい増加を経験)の特に深刻な症状を考えると、ILCが幼少期のアトピー免疫調節異常の重要なドライバーである可能性がある(43, 44)。このことは、アレルギー疾患予防の「早期の窓」を考える際に重要な意味を持ち、今後の研究の焦点となるであろう(45)。TL1Aはリンパ球のリガンドであり、肝臓、皮膚、粘膜部位に影響を及ぼす炎症や線維化、またILC2を介したIL-5産生による好酸球性喘息への関与が指摘されている(46, 47)。JAK1GOF患者におけるTL1Aの発現増加は顕著であり、これが彼らの多系統の炎症性疾患や肝障害のメカニズムである可能性が示唆される。さらに、JAK1シグナルの増強は、上皮障壁のようなアレルギー疾患の病態生理において重要な役割を果たす非造血系を含む多くの細胞型に影響を及ぼす。我々の患者で観察された非免疫性の症状は、様々な組織におけるJAK1の重要性をも示唆している。この研究の限界は、iPS細胞やゼブラフィッシュの研究を別にすれば、造血器由来の細胞に焦点を当て、皮膚や他の非造血器組織の生検を含まなかったことである。非免疫細胞で発現しているTSLPとTL1Aをコードする遺伝子の発現増加は、JAK1を介したアレルギー性炎症の非造血性ドライバーに関するさらなる調査を支持するものである。
これらのモデルを用いてJAK1が介在するアレルギー性炎症のメカニズムを明らかにすることに加え、その臨床的意義と罹患家族におけるルキソリチニブの影響についても検討した。JAK1GOF患者は、ルキソリチニブにより、成長とアレルギー性免疫異常の急速かつ持続的な改善を経験しました。改善されたものの、患者III-1には、重大な気道過敏性と中程度の好酸球増加が継続しています。ルキソリチニブを2歳未満で投与開始した患者III-2は、食物や環境アレルギーの発症を回避し、呼吸器症状も軽度で、肝炎の兆候も最小限である。これは、歪んだシグナル伝達経路を正常化する薬物療法による早期の疾患修飾が、素因のある人のアレルギー疾患の自然史に影響を与える可能性を示している。ルキソリチニブに関連する主要な有害事象は、投与量の調整により改善された貧血を除いてはありませんでした。この経験により、ルキソリチニブの使用に伴う感染症のリスクや、小児集団における成長への影響の可能性に関する懸念がいくらか軽減されました。これらの結論は、JAK1GOFの家族性症例として発表された本例のみであるため、サンプルサイズが小さいという制約があります。また、この家族で観察されたように、ベースラインのJAK1シグナルが強いJAK1GOF病原性バリアントによって媒介されるものより低い患者は、異なる副作用プロファイルを経験する可能性もある。
結論として、ヘテロ接合型JAK1GOFは、骨髄造血の亢進と2型炎症を引き起こすアレルギー性免疫制御異常症候群を引き起こすことが示された。ゼブラフィッシュ、ヒトiPS細胞、ヒト血液サンプルは、造血および免疫機能に対するJAK1シグナル増強の影響を効果的に示した。これらのツールは、健康および疾患に対するJAK1の影響をさらに調べるために今後の研究で使用することが可能である。この研究により、JAK1がアレルギー性炎症の治療標的として有望であること、およびアレルギー性炎症の予防の「初期の窓」において疾患修飾効果を発揮する可能性が明らかになった。
研究方法
薬物療法。患者III-2は、2mg/kg/dの用量でプレドニゾロンの試用を行った。治療に対する反応がなく、JAK1GOF変異体が発見された後、患者III-1とIII-2はルキソリチニブ(Jakafi; Incyte)治療を開始し、50mg/m2/日の用量で1日2回投与した。投与量は、悪性腫瘍および骨髄増殖性障害の小児に対するルキソリチニブの第I相試験に基づいて通知された(48)。投与量は、掻痒感や摂食不耐性などの症状に基づいて効果的に漸増され、貧血の副作用によって増量が制限された。
iPSC株の作製 JAK1GOF患者の全血から、Ficoll-Hypaque密度勾配遠心法(400g、室温で30分)を用いてPBMCを単離した。PBMCは、StemSpan IIとErythroid Expansion Supplement(STEMCELL Technologies)で7日間培養することにより、赤血球前駆細胞の拡張を受けた。次に、拡大した前駆細胞を、転写因子OCT4、SOX2、KLF4、およびcMYCを有する非集積RNAウイルスベクターであるセンダイウイルスを使って多能性へと再プログラム化した。処理された細胞は、初期化後3日目にマトリゲル上にプレーティングされ、5-7日目にReproTeSR培地(STEMCELL Technologies)に移行した。12-21日目にiPSCコロニーを採取し、継代を行った。センダイウイルスは継代10日目に熱ショックで除去した。XYコントロールiPSC株も著者らによって作製された(49)。JAK1 GOFおよびXYコントロールiPSC株はいずれも、正常な核型および多能性マーカー分析によって確認された多能性を示した(補足図10)。
iPSC株の培養 iPSC株はStemFlex培地で維持し、ReLeSR(STEMCELL Technologies)を用いて10μM ROCK阻害剤を含むStemFlex培地に3〜7日ごとに継代させた。iPSCの多能性と正常な核型は実験を行う前に確認し、JAK1GOF iPSCがJAK1 c.1901C>A変異体を保有していることはPCR配列決定で確認した(補足図10)。JAK1 GOF iPSCから抽出したDNAは、以下のプライマー(5′-3′)を用いたPCRによって増幅された。GGA TCT GGT GCA GGG CGA GC(フォワード)およびGTC GCG GAC ACA GAC GCC AT(リバース)。
EB形成と骨髄系分化。JAK1GOFとXYコントロールのiPSC細胞をReLeSR(STEMCELL Technologies)を用いて超低接着プレート上に分割した。EBは、300 ng/mL FLT3 (PeproTech), 300 ng/mL SCF (PeproTech), 50 ng/mL BMP-4 (R&D Systems), 50 ng/mL G-CSF (R&D Systems), 10 ng/mL IL-3 (PeproTech) および 10 ng/mL IL-6 (R&D Systems) を含むbFGFフリー幹細胞培地で前述 (50, 51) と同様培養された。RNA は、QIAGEN RNeasy Plus Mini Kit を用いて 7 日目に回収した EBs から抽出した。16 日後、1 mg/mL Collagenase B、非酵素的細胞解離バッファー(Thermo Fisher Scientific)および機械的シャーリングを用いて EB を単細胞に解離させた。その後、細胞をメチルセルロース(SCF、EPO、IL-3、GM-CSFを含むMethoCult H4434; STEMCELL Technologies)上にプレーティングし、14日間培養した(50)。実験期間中、サンプルは21%O2、5%CO2、37℃で培養された。
ケモカイン受容体解析によるThサブセットの表現型決定。PBMCを単離し、RPMI完全培地中で1×106個/mLの濃度で一晩インキュベートした。その後、細胞をPBSで2回洗浄し、続いて固定可能な生存率染色剤と以下のヒトタンパク質に対するモノクローナル抗体で染色した。CD3(カタログ641406)、CD4(カタログ552838)、CD8(カタログ562429)、CCR4/CD194(カタログ557864)、CXCR3/CD183(カタログ557185)、CCR10(カタログ564771)及びCCR6/CD196(カタログ564479)(すべてBD Biosciencesから)に対するモノクローナル抗体を用いて染色した。細胞はFACSバッファーで2回洗浄し、その後BD LSR IIマシンでフローサイトメトリーにより解析した。メモリーT細胞の染色は、固定可能な生存率染色剤と以下のヒトタンパク質に対するモノクローナル抗体による染色を行った。CD3(カタログ641406)、CD4(カタログ552838)、CD45RA(カタログ560675)、およびCCR7(カタログ150503)(すべてBD Biosciences製)に対するモノクローナル抗体で染色し、FACSバッファで2回洗浄し、BD LSR IIマシンでフローサイトメトリにより取得してFlowJoソフトウェアで解析した。
初代ヒトT細胞の活性化、拡大、および細胞内サイトカイン染色。PBMCを全血からフィコール勾配上で400gで30分間室温で遠心分離する手段で分離し、抗CD2/CD3/CD28ビーズ(Miltenyi Biotec)の存在下で、10%FBS、2mM L-グルタミン、1×非必須アミノ酸(すべてThermo Fisher Scientific製)および57μMβ-メルカプトエタノールで補足したIMDM(HyClone)を含む完全培地で刺激を加えた。細胞は、ヒト組換えIL-2(40U/mL)を含む培地で2-4日ごとに分割し、細胞濃度を5×105/mLに維持した。実験に十分な細胞を生成するために7日間膨張させた後、T細胞を、完全培地中で製造者の指示に従って、フォルボール12-ミリスチン酸13-酢酸(PMA)、イオノマイシン、およびGolgiStop(BD Biosciences)と共に4時間インキュベートした。その後、BD Cytofix Fixation Buffer BD Perm/Wash Buffer(BD Biosciences社製)をそれぞれ用いて細胞を固定および透過化し、固定化生存率染色剤および以下のヒトタンパク質に対するモノクローナル抗体で染色した。CD3(clone 641406)、CD4(clone SK3)、IFN-γ(clone Β27)、IL-17(clone N49-653)、IL-4(clone MP4-25D2)、IL-9(clone MH9A3)(all from BD Biosciences)に対するモノクローナル抗体で染色した。データはLSR IIサイトメーター(BD Biosciences社製)で収集し、FlowJoソフトウェアで解析した。
in vitro刺激およびJAK阻害剤処理後のサイトカイン遺伝子発現解析。膨張したT細胞を、組換えヒトIL-2(100 U/mL)(PeproTech)、ルキソリチニブ(1μM)(Selleckchem)入り組換えヒトIL-2(100 U/mL)、またはジメチルスルホキシド(DMSO)ビークルを含む完全T細胞培養液とともに4時間インキュベートした。RNAは、RNeasy Mini Kit(QIAGEN)を用いて抽出した。RNAはiScript reverse transcription supermix for qPCR (Bio-Rad) を用いてcDNAに逆転写した。IL4およびハウスキーピング遺伝子RPL13AのqPCRは2×SYBR Green master mixおよびViiA7 Real-Time PCR System (Applied Biosystems) を用いて実施した。遺伝子発現は、2-ΔΔCt(Livak)法を用いて測定した。
全血およびiPSC RNA-Seq。ルキソリチニブによる治療前と治療後2~7ヶ月の間に、HCおよびJAK1GOF患者から全血を静脈穿刺により採取した。RNAを抽出し、Agilent 2100 Bioanalyzerで品質を評価した。Djavad Mowafaghian Centre for Brain HealthにあるUBCのシーケンスコアで、Ion TorrentライブラリーキットとIon Proton次世代シーケンスシステム(Thermo Fisher Scientific)を使用して、メッセンジャーRNAを相補的DNAに変換して増幅し、少なくとも1500万リードの深さでシーケンスしました。Tophat2、Bowtie2の2段階プロトコルでヒトゲノム(hg19)にアライメントした(52, 53)。リードカウントはHTSeq-countを用いて定量した。
RNAは、骨髄分化の7日目にJAK1GOFおよびXYコントロールのiPSC EBから抽出した。サンプルの品質管理は、Agilent 2100 バイオアナライザーを用いて実施しました。その後、NEBNext Ultra II Stranded mRNA (New England Biolabs) の標準プロトコルに沿って適格なサンプルをプレップした。配列決定は、Illumina NextSeq 500でPaired End 42 × 42 bp readsで行った。次に、デマルチプレックスされたリード配列は、STAR single alignerソフトウェアパッケージ(54)を用いて参照配列にアラインメントされた。アセンブリおよび差分発現は、Illumina Sequence Hubで利用可能なバイオインフォマティクスアプリを通じてCufflinksを使用して推定した(55)。
GOおよびリアクトームパスウェイ解析。GO用語のエンリッチメントは、ターゲットおよびバックグラウンド遺伝子用の2つの非ランクリストを用いてGOrillaを使用して実施した(56)。すべてのタイプの GO タームが補足表 2 および 5 に報告されており、1 つまたは複数の関連する GO タームに対応する遺伝子群がヒートマップをプロットするために選択された。Reactome Pathway解析は、ReactomePA Bioconductorパッケージ(57)を用いてedgeRにより差次的発現遺伝子を決定した後に行った。
RNA-Seqバイオインフォマティクス解析。ヒトとゼブラフィッシュのRNA-Seq解析の両方で、2倍のアップレギュレーションまたはダウンレギュレーションの閾値とFDR≤0.05をパラメータとして、edgeR Bioconductorライブラリ(58)を使用して差次的発現遺伝子を同定した。PCAおよびMDSプロットはDESeq2ライブラリ(59)を用いて作成した。ヒートマップは、DESeq2ライブラリの関数を用いて分散安定化変換を行った後、pheatmapパッケージ(60)を用いて作成した。Th細胞サブセットは、文献から得られたTh1、Th2、およびTh17遺伝子発現シグネチャーのPCAを実行することによって、全血RNA-Seqデータから解析された(20)。第一主成分値は、治療前後の患者間および無関係のHCと比較した。
ゼブラフィッシュの飼育、胚の収集、および胚のステージング。このプロジェクトに使用したゼブラフィッシュのすべての系統は、著者らによって作出され、標準プロトコル(61)に従って維持された。胚を採取し、E3胚培地で28℃にて培養する。色素を欠く胚が必要な場合は,0.003% N-phenylthiourea (PTU) (Sigma-Aldrich, P7629) を含む胚培地にて処理した.胚は,Pronase(Roche Applied Science, 10165921001)の 10 mg/mL ストック溶液 50 μL を加えた後,1 mL の卵水で 10 分間インキュベートして脱色させた.胚は標準プロトコルにしたがって発生段階を行った。WT対照としてCasperゼブラフィッシュ(mitfaw2/w2;mpv17a9/a9)を使用した。
JAK1トランスジェニックラインの作成。Q5(NEB、M0492S)を用いて、pCMV6-EntryベクターからJAK1WTおよびJAK1A634D cDNA PCR産物をPacI-JAK1_for(ggacttaaagcatgctectgtgctaaaatg)およびAscI-JAK1_rev(gatcggcgcgacacttatcgtccatcct)プライマ(5´-3´)で増幅させた。次に、PacI(NEB、R0547S)およびAscI(NEB、R0558S)酵素による消化と標準的なクローニング技術を使用して、これらのPCR産物をpCS2+MCS-P2A-sfGFPベクター(Addgene、74668)へ挿入した。得られたpCS2+JAK1-WT-P2A-sfGFPおよびpCS2+JAK1-A634D-P2A-sfGFPベクターを用いて、Q5 with PacI-JAK1_for and sfGFP_rev (ttttgtagagctcatccatg) primers (5′-3′) によりJAK1-WT/A634D-P2A-sfGFP挿入物を増幅させた。次いで、これらのPCR産物を、ベクターシステムの開発者により記載されたように、pME_TAベクターに挿入した(62)。最終的なpME- JAK1-WT-P2A-sfGFP及びpME- JAK1-A634D-P2A-sfGFPベクターを、製造者の指示に従ってLR Clonase Plus II酵素混合物(Thermo Fisher Scientific、12538120)を用いてp5E-ubi(63)p3E-pA及びpDestTol2_cry:ECFP(Tol2キット;文献64)とLR組換えた;これらはTOP10細胞へ形質転換して消化し配列決定を行いスクリーニングを実施した。最終的なubi-JAK1-WT/A634D-P2A-sfGFP-pAゼブラフィッシュ導入遺伝子は、次に、以前に記載したように20ng/μL導入プラスミドおよび35ng/μL pCS2FAトランスポゼmRNAを含む注入ミックスの一部として1細胞期ゼブラフィッシュに注入された(64)。これらのトランスジェニック系統により、共変換切断ペプチドP2Aを介してスーパーフォルダーGFP(sfGFP)遺伝子に融合したヒトJAK1遺伝子cDNAのWT(JAK1WT)変異体およびA634D(JAK1GOF)変異体の両方をユビキタスに発現することが可能となった。導入遺伝子を高発現させたJAK1GOFゼブラフィッシュで胚の生存率の低下を観察した後、胚を魚水中の1μMルキソリチニブ(Cayman Chemical, 941678-49-5)で6 hpfで24時間処理し、生存を促進した。
WISHアッセイ。本研究で使用したプローブは、直鎖化に使用した制限酵素で以下のプラスミドから生成し、Addgeneアクセッション番号は以下を含む:cmyb (pBK-CMV-cmyb; BamHI; Addgene, 191804), cpa5 (pBK-CMV-cpa5; EcoRI; Addgene, 191805), mpx (pBK-CMV-mpx; EcoRI; Addgene, 191826), pU.1 (pBK-pu1; SacI; Addgene, 191827), gata1a (pBSK-gata1a; SacI; Addgene, 191828), lcp1 (pBSK-lcp1; EcoRI; Addgene, 191829), and runx1 (pBSK-runx1; HindIII; Addgene, 191830)の5種。プローブは、T7 RNA polymerase (Thermo Fisher Scientific, EP0111), 10×DIG RNA labeling mix (MilliporeSigma, 11277073910), Protector RNAse inhibitor (Roche, 3335399001) (1 μL/20 μL reaction) を用いて1 μg の直鎖プラスミドテンプレートから37℃、4時間合成し、NucAway Spin Columns (Thermo Fisher Scientific, AM10070) を用いて精製した。24,28,36,48 hpf に,PBS 中の 4%パラホルムアルデヒド(PFA)で一晩固定した胚を,以下の修正を加えた以前のプロトコールに従って WISH アッセイを行った(65).24, 28 hpfの胚は1μg/mL proteinase K溶液でそれぞれ10, 15分間透過処理した。36、48、および144 hpfで採取した胚を、10μg/mLプロテイナーゼKでそれぞれ5、10、および30分間インキュベートした。染色ステップは,染色バッファで希釈したBCIP(Roche,11383221001)およびNBT(Roche,11383213001)試薬で行った.次に,染色した胚を4% PFAで30分間固定し,PBSTで洗浄し,80%グリセロールに包埋して画像化した.画像は、LED落射照明付き実体顕微鏡(Carl Zeiss、SteREO Discovery V20)に取り付けたCCD Zeiss Axiocam 506カラーカメラで撮影された。顕微鏡写真は、遺伝子型ごとに少なくとも15〜20個の胚を用いた少なくとも2つの独立した試験の代表的なものである。
WISH スコアリング。gata1 を除くすべてのプローブについて、Fiji を用いて陽性細胞を手動でカウントした(66)。単細胞を識別できない染色をするgata1については、カウントは不可能であった。そのため、3つの画像のトレーニングセットを使用し、その後、IlastikとCellProfiler(67)を使用して残りのサンプルの評価を進めました。
ゼブラフィッシュのRNA-Seq。RNA を定量化し、Agilent Tape Station で完全性を解析しました。RNAのインテグリティナンバーが8以上のサンプルをライブラリー調製用に選択した。20μgのtotal RNAからDyna beads mRNA direct micro Kit (61021, Thermo Fisher Scientific)を用いてPoly-A濃縮を実施した。合計100 ngのPoly-A濃縮RNAをRNase IIIで断片化し、磁気ビーズクリーンアップモジュール (Ion Total RNA-Seq Kit v2, Thermo Fisher Scientific, 4475936) で精製した。Agilent Tape StationでD1000スクリーンテープを使用し、ライブラリーの収量とサイズ分布を解析した。Ion Pi HiQ OT2 kit (Invitrogen)で供給されたIon Sphere Particles (ISP)に、バーコード付きライブラリーを均等にプールして増幅させた。このISPをIon PI chip V3にロードし、Thermo Fisher Scientific社製のIon Protonでシーケンスを行った。
ATCACCGACを除去し、Trim Galore (v0.4.4) を用いてquality of 20でフィルタリングしたリードを使用しました。このリードは、Ion protonのRNA-Seqデータのための2段階のマッピングを通過しました - 最初はSTAR (v2.7) (54) で、次にBowtie 2 (68) を使用して最初のアライメントからマッピングされなかったリードをマッピングしました。両手順とも参照ゲノムはGenome Reference Consortium Zebrafish Build 11 (danRer11)を使用した。2つのマッピングされたファイルはPicard tools (v2.5.0)でマージされた。HTSeq (V0.9.1) を用いてカウントを抽出した(69)。ゼブラフィッシュのRNA-SeqデータはGSE142599で公開されている。
JAK1GOFゼブラフィッシュとヒトの間の遺伝子発現差の比較。ゼブラフィッシュとヒトのRNA-Seqデータ間の遺伝子発現差を比較するために、ヒト全血から発現が定量された遺伝子リストをEnsembl biomartツールに入力し、オーソログゼブラフィッシュ遺伝子名のリストを作成した(70)。ヒト全血とゼブラフィッシュモデルの両方から得られたRNA-Seqカウントデータは、ヒトとゼブラフィッシュのオーソログを持つ遺伝子のみを含むようにフィルタリングされた。EdgeR Bioconductor library (58)を用いて、FDRパラメータ≦0.05で種間差発現遺伝子を同定した。タンパク質間相互作用と関連するパスウェイは、それぞれSTRINGとReactomeを用いて解析した(30, 31)。
統計学。すべての解析は、PrismとRstudioを用いて行った。統計解析はANOVA(本文中に記載されているように1-wayまたは2-way)またはWelchの補正をかけた2-tailed unpaired t testを用いて実施した。ボンフェローニ多重比較補正は、該当する場合に使用した。RNA-Seq解析は、上記の "RNA Sequencing Bioinformatics Analysis "に記載されているように実施した。P値0.05未満を有意とした。
研究の承認 本研究は、ブリティッシュ・コロンビア大学およびダルハウジー大学のIRBから研究倫理上の承認を受けた。Dalhousie University Animal Care CommitteeはプロトコルNo.に基づいてこの研究を承認した。17-038. 参加者、および未成年の場合はその両親から、書面によるインフォームドコンセントを得た。
著者による貢献
CMB、ACS、SVP、APD、YL、FO、KLDB、RJR、M Sharmaが実験を行い、データを分析した。AS、SM、LD、KESはRNA-Seqデータ解析に貢献した。DDはデータの統計解析に貢献した。KGW、LODB、KD、LDNは、iPS細胞モデリングと骨髄造血に関するトレーニングと指導を行った。SVとKESは、BM吸引スライドとその解釈を提供した。JJPとKTは、T細胞の活性化と増殖に使用する試薬とガイダンスを提供した。MLM、SV、M Seear、JR、RAS、MCKHは、臨床患者のケアを行い、原稿のレビューと準備に貢献した。FCL、JNB、SETは実験の監督を行い、原稿の審査と準備に貢献した。CMB、ACS、SVP はデータ作成に等しく貢献し、共同筆頭著者としてクレジットされている。CMBは原稿の大部分を執筆したためファーストネームに、ACSは執筆に貢献し、ゼブラフィッシュの実験を行ったためセカンドネームに、SVPはゼブラフィッシュRNA-Seq解析を行い、グラフ作成と執筆に協力したためサードネームに選出した。
補足資料
補足データを見る
謝辞
この原稿で紹介した研究に対して、知識と洞察に富んだコメントをくれたBerman Labのメンバー全員に感謝したい。また、ゼブラフィッシュの飼育とケアについて、David Maley, Connor Booker, David Malloy, Matthew Jacques, Karolyn Long, Heather Nadeau, Claire Attridge, Megan Shin, Andrew Czich, Hannah Drake, Kirsten Cyr, Javon Lo, and Nan Chenに感謝したい。また、Turvey研究室、Notarangelo研究室のメンバー、BCCHRI Tissue and Disease Modeling Core、Alexandra Turveyには、原稿の仕上げをサポートしていただき、感謝している。この研究は、Canadian Rare Diseasesからの助成金によって行われた。この研究は、Canadian Rare Diseases: Models and Mechanisms Network Catalyst Grant-CIHR and Genome Canada, the Canadian Institutes of Health Research (PJT 178054), and Genome British Columbia (SIP007) の助成を受けて実施したものです。CMBは、AllerGen Emerging Clinician-Scientist Fellowship、CAAIF/AllerGen research fellowship、Primary Immune Deficiency Treatment Consortium (PIDTC) research grant、Michael Smith Health Research BC health professional-investigator awardによる支援を受けています。PIDTC(U54 AI 082973)は、NCATS(National Center for Advancing Translational Sciences)の希少疾患臨床研究ネットワーク(Office of Rare Diseases Research, NCATSの取り組み)の一部である。PIDTCはNCATSとNIAIDの協力により資金提供されています。LDNはNIAID, NIHのDivision of Intramural Researchの支援を受けています。SETは、小児プレシジョンヘルスのTier 1カナダ研究チェアと小児免疫学のAubrey J. Tingle教授を兼任している。
宛先は以下の通りです。Jason N. Berman, 401 Smyth Road, Ottawa, Ontario K1H 5B2, Canada. 電話番号 613.737.7600 ext. 2957; Email: JBerman@cheo.on.ca。または、こちらへ。Stuart E. Turvey, 950 West 28th Avenue, Vancouver, British Columbia V5Z 4H4, Canada. 電話番号 604.875.3130; Email: sturvey@bcchr.ca.
脚注
利益相反。JNBはOxford Immune Algorithmicsの科学諮問委員会委員である。CMBはAbbVie社から講演謝礼を受け取っている。
著作権:© 2022, Biggs et al. これは、クリエイティブ・コモンズ 表示 4.0 国際ライセンスの条件の下で公開されたオープンアクセス論文である。
参考情報です。JCI Insight. 2022;7(24):e150849.https://doi.org/10.1172/jci.insight.150849.
参考文献
Pawankar R. Allergic diseases and asthma: a global public health concern and a call to action(アレルギー疾患と喘息:世界的な公衆衛生上の懸念と行動への呼びかけ)。World Allergy Organ J. 2014;7(1):12.
この記事を経由して表示する。PubMed Google Scholar
Del Bel KL, et al. JAK1機能獲得は常染色体優性免疫制御異常および好酸球増多症候群を引き起こす。J Allergy Clin Immunol. 2017;139(6):2016–2020.
この記事を経由して見る CrossRef PubMed Google Scholar
O'Shea JJ, et al. JAK-STAT pathway: impact on human disease and therapeutic intervention(JAK-STAT経路:ヒト疾患と治療介入への影響). Annu Rev Med. 2015;66:311-328.
この記事を経由して表示します。CrossRef PubMed Google Scholar
Gruber CN, et al. 複雑な自己炎症症候群は、JAK1キナーゼの転写および生化学的機能の基本原理を明らかにした。Immunity. 2020;53(3):672-684.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Yasuda T, et al. JAK1チロシンキナーゼの高活性化により、段階的に進行するそう痒性皮膚炎が誘発される。J Clin Invest. 2016;126(6):2064–2076.
この記事を経由して見る JCI CrossRef PubMed Google Scholar
Sabrautzki S, et al. 全身性自己免疫疾患の表現型に類似したJak1優性変異を有するENU変異誘発マウスモデル. Am J Pathol. 2013;183(2):352-368.
この記事を経由して見る CrossRef PubMed Google Scholar
フルカーソンPC、ローテンバーグME. アレルギー、炎症、そしてそれ以外における好酸球の標的化。Nat Rev Drug Discov. 2013;12(2):117-129.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Klion A. Recent advances in understanding eosinophil biology. F1000Res. 2017;6:1084.
この記事を経由して表示する。CrossRef PubMed Google Scholar
ウェラーPF、スペンサーLA. 組織常在好酸球の機能。Nat Rev Immunol. 2017;17(12):746-760.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Balla KM, et al. ゼブラフィッシュの好酸球:プロスペクティブな分離、特徴づけ、蠕虫の決定因子による好酸球の誘導。Blood. 2010;116(19):3944–3954.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Johnston LK, Bryce PJ. インターロイキン33と好酸球の発生におけるその役割を理解する。Front Med (lausanne). 2017;4:51.
この記事を経由して見る PubMed Google Scholar
Johnston LK, et al. IL-33は、好酸球コミットメントの制御においてIL-5に先行し、好酸球のホメオスタシスに必要である。J Immunol. 2016;197(9):3445–3453.
この記事を経由して見る CrossRef PubMed Google Scholar
Mori Y, et al. ヒト好酸球系前駆細胞の同定:ヒト共通骨髄系前駆細胞の表現型定義の改訂. J Exp Med. 2009;206(1):183-193.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Friedlander SL, et al. Viral infections, cytokine dysregulation and the origins of childhood asthma and allergic diseases.ウイルス感染症、サイトカイン調節異常、小児喘息およびアレルギー疾患の起源。Pediatr Infect Dis J. 2005;24(11 suppl):S170-S176.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Heine A, et al. ルキソリチニブは強力な免疫抑制化合物である:抗感染症予防の時期が来たのか?Blood. 2013;122(23):3843–3844.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Gadina M, et al.JAKをJakinibsに変換する。J Immunol. 2020;204(8):2011–2020.
この記事を経由して表示する CrossRef PubMed Google Scholar
成長ホルモン受容体は、ヒト肝臓でJak1、Jak2、Tyk2と会合する。成長ホルモンIGF研究会 1999;9(3):212-218.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Glaser K, et al.正常な幼児および小児における骨髄の細胞組成。小児科。1950;6(5):789-824.
この記事を経由して表示します。クロスリファレンス Google Scholar
ガードナーD、他乳幼児期の血液形成。パートI.正常な骨髄。アーチディスチャイルド。1952;27(132):128–133.
経由でこの記事を表示します。CrossRef PubMed Google Scholar
結核抗原特異的T細胞の転写プロファイルは、新しい多機能の特徴を明らかにする。J Immunol. 2014;193(6):2931–2940.
この記事を経由して見る CrossRef PubMed Google Scholar
Davis EE, et al. Interpreting human genetic variation with in vivo zebrafish assays(生体内ゼブラフィッシュアッセイによるヒト遺伝的変異の解釈). Biochim Biophys Acta. 2014;1842(10):1960–1970.
この記事を経由して見る CrossRef PubMed Google Scholar
リッソーネA、バージェスSM. ゼブラフィッシュの希少遺伝性血液疾患モデリング。Front Genet. 2018;9:348.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Dobson JT, et al. Carboxypeptidase A5 identifies a novel mast cell lineage in the zebrafish providing new insight into mast cell fate determination. Blood. 2008;112(7):2969–2972.
この記事を見るには CrossRef PubMed Google Scholar
ゼブラフィッシュのマスト細胞はFc_25BRI様受容体を持ち、自然免疫反応と適応免疫反応に関与している。Dev Comp Immunol. 2011;35(1):125-134.
この記事を経由して見る CrossRef PubMed Google Scholar
KIT-D816Vを発現するトランスジェニック・ゼブラフィッシュモデルは、侵攻性全身性肥満細胞症の特徴を再現する。Br J Haematol. 2014;167(1):48-61.
この記事を経由して見る CrossRef PubMed Google Scholar
White RM, et al. In vivo移植解析のためのツールとしての透明成体ゼブラフィッシュ。Cell Stem Cell. 2008;2(2):183-189.
この記事を見る CrossRef PubMed Google Scholar
Paik EJ, Zon LI. ゼブラフィッシュの造血器官形成。2010;54(6-7):1127-1137.
この記事を見るには PubMed Google Scholar
Schneider WM, et al. インターフェロン刺激遺伝子:宿主防御の複雑な網。Annu Rev Immunol. 2014;32:513-545.
この記事を経由して表示します。CrossRef PubMed Google Scholar
Levraud JP, et al. ゼブラフィッシュとヒトのIFN刺激遺伝子は、抗ウイルス免疫の古代のアーセナルを定義しています。J Immunol. 2019;203(12):3361–3373.
この記事を経由して見る CrossRef PubMed Google Scholar
Szklarczyk D, et al. STRING v11: Protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets.(STRINGバージョン11:カバレッジを拡大したタンパク質-タンパク質関連ネットワーク、ゲノムワイド実験データセットにおける機能発見をサポート)。Nucleic Acids Res. 2019;47(d1):D607-D613.
この記事を経由して見る CrossRef PubMed Google Scholar
Fabregat A, et al. リアクトームパスウェイナレッジベース(The reactome pathway knowledgebase). Nucleic Acids Res. 2018;46(d1):D649-D655.
この記事を経由して表示する。CrossRef PubMed Google Scholar
ノタランジェロLD、フライシャーTA. 分子欠陥に向けられた標的戦略:選択的な原発性免疫不全症のための精密医療に向けて。J Allergy Clin Immunol. 2017;139(3):715-723.
この記事を経由して見る CrossRef PubMed Google Scholar
Leiding JW, Ballow M. Redefining precision medicine in disorders of immune dysregulation. J Allergy Clin Immunol Pract. 2019;7(8):2801-2803.
この記事を経由して見る CrossRef PubMed Google Scholar
Forbes LR, et al. 機能獲得型シグナルトランスデューサおよび転写活性化因子1(STAT1)またはSTAT3変異を有する患者における免疫制御異常の治療に対するJakinibs。J Allergy Clin Immunol. 2018;142(5):1665–1669.
この記事を経由して見る CrossRef PubMed Google Scholar
Jeong JS, et al. ホスホイノシチド3キナーゼデルタ活性化を伴う気管支喘息の定義:エンドタイプ主導の管理に向けて. Int J Mol Sci. 2019;20(14):3525.
この記事を経由して見る CrossRef PubMed Google Scholar
ロデロMP、クロウYJ. I型インターフェロンを介した単発性自己炎症:I型インターフェロパシー、概念的概要。J Exp Med. 2016;213(12):2527–2538.
この記事を経由して見る CrossRef PubMed Google Scholar
Nomura T, et al. アトピー性皮膚炎の病態におけるサイトカイン軸の多極化:年齢、人種、種、病期、バイオマーカーの観点から. Int Immunol. 2018;30(9):419-428.
この記事を経由して見る CrossRef PubMed Google Scholar
Eletto D, et al.マイコバクテリア感染症の免疫不全患者におけるバイレリックJAK1変異。Nat Commun. 2016;7:13992.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Stone KD, et al. IgE、マスト細胞、好塩基球、および好酸球。J Allergy Clin Immunol. 2010;125(2 suppl 2):S73-S80.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Marwaha AK, et al. IL-33を包含する染色体重複は、好酸球性食道炎と全身性自己免疫を特徴とする新しいHyper IgE表現型を引き起こす。Gastroenterology. 2022;163(2):510-513.
この記事を経由して表示します。CrossRef Google Scholar
Alvarez F, et al. CD4+T細胞の分化とエフェクター機能に対するIL-33のプレオトロピック効果。Front Immunol. 2019;10:522.
この記事を経由して表示します。CrossRef PubMed Google Scholar
Hou HA, et al. 急性骨髄性白血病におけるSuppressor of cytokine Signaling 1発現の臨床・生物学的意義. Blood Cancer J. 2017;7(7):e588.
この記事を経由して見る CrossRef PubMed Google Scholar
Moffatt MF, et al. 喘息に関する大規模なコンソーシアムベースのゲノムワイド関連研究. N Engl J Med. 2010;363(13):1211–1221.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Barlow JL, McKenzie AN. アレルギー疾患における2型自然リンパ球。Curr Opin Allergy Clin Immunol. 2014;14(5):397-403.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Starkey MR, et al. 肺の第2群自然リンパ系細胞:驚きと課題。Mucosal Immunol. 2019;12(2):299-311.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Machida K, et al.好酸球性喘息の被験者におけるグループ2自然リンパ球の活性化におけるTL1A/DR3軸の役割. Am J Respir Crit Care Med. 2020;202(8):1105–1114.
この記事を経由して表示します。CrossRef PubMed Google Scholar
Xu W-D, et al. Role of TL1A in inflammatory autoimmune diseases: a comprehensive review. Front Immunol. 2022;13:891328.
この記事を経由して表示します。CrossRef PubMed Google Scholar
Loh ML, et al. 再発または難治性の固形癌、白血病、骨髄増殖性新生物の小児におけるルキソリチニブの第1相投与試験:小児腫瘍グループ第1相コンソーシアム試験(ADVL1011)。小児血液がん. 2015;62(10):1717–1724.
この記事を経由して見る CrossRef PubMed Google Scholar
Krentz NAJ, et al. NEUROG3のリン酸化は、膵臓前駆細胞における内分泌分化と細胞周期をリンクさせる。Dev Cell. 2017;41(2):129-142.
この記事を経由して見る CrossRef PubMed Google Scholar
Rissone A, et al. 網膜異形成関連AK2は、造血幹・前駆細胞の発生を酸化ストレスから保護する。J Exp Med. 2015;212(8):1185–1202.
この記事を経由して見る CrossRef PubMed Google Scholar
Lengerke C, et al.ヒト人工多能性幹細胞からの造血系発生。Ann N Y Acad Sci. 2009;1176:219-227.
この記事を見る CrossRef Google Scholar
TopHat2:挿入、欠失、遺伝子融合がある場合のトランスクリプトームの正確なアライメント。ゲノムバイオロジー2013;14(4):R36.
この記事を経由して表示する。CrossRef PubMed Google Scholar
ラングミードB、他、ヒトゲノムへの短いDNA配列の超高速かつメモリ効率の良いアライメント。ゲノムバイオロジー 2009;10(3):R25.
この記事を見る CrossRef PubMed Google Scholar
Dobin A, et al. STAR: 超高速ユニバーサルRNA-seqアライナー。Bioinformatics. 2013;29(1):15-21.
この記事を見る CrossRef PubMed Google Scholar
RNA-seqによる転写産物のアセンブリと定量化により、細胞分化の過程における未注釈転写産物およびアイソフォームスイッチングが明らかになりました。Nat Biotechnol. 2010;28(5):511-515.
この記事を経由して表示する。CrossRef PubMed Google Scholar
遺伝子リストにおけるGOタームの発見と可視化のためのツール。BMC Bioinformatics. 2009;10:48.
この記事を経由して表示する CrossRef PubMed Google Scholar
Yu G, He QY. ReactomePA: リアクトームパスウェイ解析と可視化のためのR/Bioconductorパッケージ。Mol Biosyst. 2016;12(2):477-479.
この記事を経由して見る CrossRef PubMed Google Scholar
McCarthy DJ, et al. 多因子RNA-Seq実験の生物学的変動に関する発現差解析. Nucleic Acids Res.2012;40(10):4288-4297。
この記事を経由して表示する。CrossRef PubMed Google Scholar
Love MI, et al. DESeq2によるRNA-seqデータのフォールドチェンジと分散のモデレートされた推定。Genome Biol. 2014;15(12):550.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Kolde R. pheatmap: pretty heatmaps. https://cran.r-project.org/package=pheatmap Accessed November 14, 2022.
Westerfield M, ed. The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio). 4th ed. University of Oregon Press; 2007.
Miles LB, Verkade H. TA-クローニングベクターによるゼブラフィッシュのトランスジェネシスコンストラクトの迅速かつ安価なクローニング。Zebrafish. 2014;11(3):281-282.
この記事を経由して見る CrossRef PubMed Google Scholar
Mosimann C, et al. ゼブラフィッシュにおけるユビキチンプロモーターによるトランスジーンの発現とCreベース組換えの駆動。Development. 2011;138(1):169-177.
この記事を経由して見る CrossRef PubMed Google Scholar
Kwan KM, et al. Tol2kit:Tol2トランスポゾントランスジェネシスコンストラクトのためのマルチサイトゲートウェイベースの構築キット。Dev Dyn. 2007;236(11):3088–3099.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Bennett CM, et al. ゼブラフィッシュの骨髄形成, Danio rerio. Blood. 2001;98(3):643-651.
この記事を経由して表示します。CrossRef PubMed Google Scholar
Rueden CT, et al. ImageJ2: 次世代の科学的画像データのためのImageJ. BMC Bioinformatics. 2017;18(1):529.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Carpenter AE, et al. CellProfiler: 細胞の表現型を特定し定量化するための画像解析ソフトウェア. Genome Biol. 2006;7(10):R100.
この記事を表示する CrossRef PubMed Google Scholar
ラングミードB、サルツバーグSL. このような場合、「Bowtie 2」による高速ギャップリード・アライメントが有効です。Nat Methods. 2012;9(4):357-359.
この記事を経由して見る CrossRef PubMed Google Scholar
HTSeq--ハイスループットシーケンスデータを扱うためのPythonフレームワーク。Bioinformatics. 2015;31(2):166-169.
この記事を経由して表示する。CrossRef PubMed Google Scholar
Cunningham F, et al. Ensembl 2022. Nucleic Acids Res. 2022; 50(d1):D988-D995.
この記事を経由して表示する。CrossRef PubMed Google Scholar
バージョン履歴
バージョン1 (2022年12月22日): 電子出版
を推奨します。
Ets1は病原性T細胞応答を抑制することでアトピー性皮膚炎を抑制する
Choong-Gu Leeら、JCIインサイト、2019年
ヒトSTAT3機能獲得バリアントは、マウスにおいて優勢なTreg機能不全を伴わないT細胞制御異常を与える
エリカ・G. シュミットら、JCIインサイト、2022年
黄色ブドウ球菌の菌血症による死亡に対する保護は、ILC2および好酸球に依存する
Paulette A. Krishackら、JCIインサイト、2019年
炎症性疾患の治療のためのソニックヘッジホッグ経路:将来の研究への影響と機会
マルコ・パラら、Jitc、2022年
Be Sure:プラーク乾癬におけるビメキズマブ対アダリムマブの比較試験
リチャード・B・ウォーレンら、NEJM、2021年
ビタミンD受容体とSTAT6の相互作用は、IL-13シグナルに対する食道上皮のバリア応答を支配する
Michael Brusilovskyら、Gut誌、2022年
搭載媒体
Twitter Facebook RSS
著作権 © 2022 米国臨床研究学会
ISSN 2379-3708
メールアラートを登録する
あなたのEメールアドレス
