再発性Clostridioides difficile感染症に対する糞便微生物叢移植の有益な効果
レビュー|31巻5号 p695-711 2023年5月10日発行
全号ダウンロード
再発性Clostridioides difficile感染症に対する糞便微生物叢移植の有益な効果
https://www.cell.com/cell-host-microbe/fulltext/S1931-3128%2823%2900124-5
アッバス・ヤデガー 9
Sepideh Pakpoor 9
ファティマ・F・イブラヒム
カレン・ウォン
ターニャ・M・モナハン 10
ディナ・カオ 10
すべての著者を表示する
脚注を表示する
DOI:https://doi.org/10.1016/j.chom.2023.03.019
概要
糞便微生物叢移植(FMT)は、Clostridioides difficile感染症(rCDI)の再発防止に高い効果がある。しかし、その臨床効果を支えるメカニズムは不完全に理解されている。ここでは、rCDIの病態を概観した後、微生物、代謝、免疫、エピジェネティックなメカニズムを中心に、潜在的な作用機序について議論する。そして、現在の研究ギャップを概説し、研究の質を高め、知識の翻訳を促進するために、今後の研究のための方法論上の推奨事項を提示する。マルチオミクス技術や宿主・環境因子と介入試験を組み合わせ、縦断的に収集した生物試料を分析することで、動物や他のモデルで検証可能な結果を得ることができる。これらを総合して因果関係を確認し、最終的にはFMTに代わる標的治療薬を開発するために、トランスレーションを向上させることができる。


キーワード
再発性Clostridioides difficile感染症
糞便微生物移植術
腸内細菌移行
宿主-微生物相互作用
はじめに
Clostridioides difficileはグラム陽性の芽胞形成細菌で、最も一般的な院内腸内感染症の原因となっている。この病態は、通常、抗生物質の使用によって引き起こされる腸内細菌叢の異常によって生じ、C. difficileが増殖する。C. difficile感染症(CDI)の臨床スペクトルは、軽度の下痢から中毒性巨大結腸症、死亡に至るまで幅広い。
1
CDIの初回エピソードに対する推奨される治療法は、広域スペクトルグラム陽性抗菌薬であるバンコマイシン、または狭スペクトルで高価な抗生物質であるフィダキソミシンのいずれかです。
2
このCDIは、有効な標準薬物療法が存在しないため、1回目の発症後約20%、3回目の発症後約60%の患者さんが再発することが大きな課題となっています。
3
,
4
近年、腸内細菌叢移植として知られる糞便微生物叢移植(FMT)は、最も臨床的に有効で費用対効果の高い治療法であるため、rCDIの治療として日常臨床にますます取り入れられている。治療成績の成功は、通常、少なくとも8週間の追跡調査後にCDIが再発しないことと定義されています。この基準を用いると、FMTの成功率は、投与経路(保持浣腸、経鼻胃管、大腸内視鏡、カプセル)および試験デザイン(無作為プラセボ対照または非盲検)に応じて、60%から90%以上と報告されている。
5
,
6
,
7
プラセボ対照の無作為化試験では、オープンラベル試験よりも成功率が低くなる傾向があります、
5
また、他の投与経路に比べ、留置浣腸によるFMTを用いた研究でも低くなっています。
5
,
7
,
8
FMTは非常に有効であるが、感染症のリスクや長期安全性データの希薄さなど、大きな欠点がある。
9
,
10
FMTの「方法」の解明には大きな進展があったことは間違いないが、ほとんどのヒトの研究は、便のマイクロバイオームのみを分析したものであり、関連性や相関性が高い。これらの研究の結果、rCDIに対するFMTの有効性に影響を与えると思われる微生物相が定義されましたが、臨床試験で観察された成功率のばらつきは、FMTがどのように機能するかについての知識に重大なギャップがあることを示しています。設計された臨床試験に加え、rCDIからの回復を成功に導く微生物-微生物間および宿主-微生物間の相互作用のメカニズム的理解が必要である。これには、菌株レベルのメタゲノム解析を用いて、FMTがレシピエントの微生物叢に及ぼす生態学的影響を特定する研究が含まれる、
11
,
12
,
13
また、ヒトや齧歯類の研究において、FMTの作用機序に関する検証可能な仮説が得られています。そのため、FMTの有益な効果に関与する主要なコンポーネントとその基礎となるメカニズムを特定することは、引き続き研究の優先事項であると考えられる。
本総説では、rCDIに対するFMTの効果にさらに影響を及ぼす可能性のあるC. difficileの宿主と微生物の相互作用について最新の概要を紹介する。まず、CDI の病因と再発の文脈で、これらの概念を要約する。次に、rCDIに対するFMTの潜在的なメカニズム作用に関する現在の理解について、FMTの有効性を支える可能性のある微生物(トランスキングダム)、代謝、免疫、エピジェネティックのメカニズムに焦点を当てて議論します。ヒトの観察研究と動物モデルの両方を検討し、後者は因果関係を推論することができるためである。現在の研究ギャップを議論し、研究の質を高め、トランスレーションを促進するために、今後の研究のための方法論的な推奨事項を提示する予定である。さらに、ヒトにおける因果関係を決定するための課題と潜在的な緩和策を探ります。
病原体
シーディーアイ
CDIの病態の完全な概要は、このレビューの範囲を超えており、他の場所で議論されているためです、
14
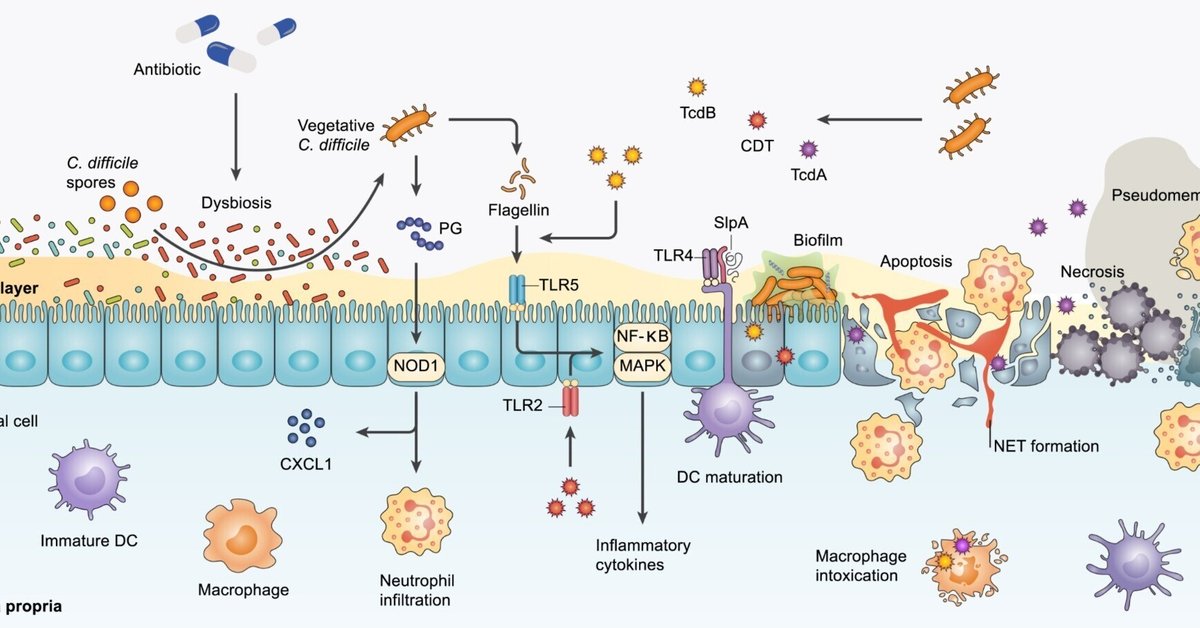
ここでは、FMTの治療効果に影響を与える可能性のあるC. difficileの宿主と微生物の相互作用に焦点を当てます(図1参照)。
図1C.difficileの病原体の基礎となる主な作用機序
フルキャプションを表示
大きな画像を見る
高解像度画像ダウンロード
C. difficile芽胞のコロニー形成と発芽は、この毒素を介した感染を開始するのに重要であり、通常、抗生物質誘発性不和の状況下で発生する。このプロセスは、粘液層への付着とムチン分解菌との微生物間相互作用によって促進されます。C. difficileは、Akkermansia muciniphila、Bacteroides thetaiotaomicron、Ruminococcus torqueなどの他の腸内微生物の助けを借りて、化学誘引物質およびエネルギー源として腸管ムチンを使用します。
15
C. difficileは、生体内で腸内バイオフィルムを形成し、Fusobacterium種と実質的に共棲していることが示されている。
16
これらのプロセスにより、MUC1の生産量が多く、MUC2の生産量が少ない、酸性の腸管粘液層が形成されます。
17
毒素は主要な病原性因子であり、多くのC. difficileリボタイプは、毒素A(TcdA)、毒素B(TcdB)、C. difficile転移酵素またはバイナリートキシン(CDT)の最大3種類の毒素を産生します。臨床的に重要なC. difficile株のほとんどすべてがTcdBを産生し、流行のBI/NAP1/027株は3つの毒素をすべて産生することがあります。受容体介在エンドサイトーシスによるC. difficile毒素の移行は、エンドソーム膜に孔を形成し、アクチン細胞骨格の破壊と細胞の丸み、サイトカイン分泌の変化、細胞増殖とバリアーの完全性の障害をもたらす
18
これらは、臨床的には下痢として現れる。さらに、特にTcdAによる細胞アポトーシスの誘導は、偽膜、クリプト損傷、壊死性病変の発生に寄与すると考えられる。
19
マイトジェン活性化プロテインキナーゼ(MAPK)や核因子κB(NF-κB)などの炎症性転写因子の活性化は、大腸の炎症と宿主免疫細胞の急流入を引き起こす。
20
また、CDT毒素は、Toll様受容体2(TLR2)/TLR6依存的に下流のMAPKやNF-κBの活性化を誘発することができます。
21
毒素の分泌に加え、植物細胞は他の内在性免疫原性因子を発現する。C. difficileの細胞壁ペプチドグリカン(PG)は、ヌクレオチド結合オリゴマー化ドメイン1(NOD1)依存的にCXCケモカインリガンド1(CXCL1)産生と好中球浸潤を刺激することができます。また、C. difficileの表面層タンパク質(SLP)は、樹状細胞(DC)の成熟に対する効果を通じて、宿主の自然免疫および適応免疫応答の活性化に関与しています。
22
また、TLR5によるC. difficileフラジェリン刺激は、宿主上皮細胞においてNF-κBおよびp38 MAPKの活性化をもたらす。さらに、in vitroでTcdBを前処理すると、フラジェリンによる炎症性サイトカインの分泌が増強される。
23
,
24
C. difficileと他の腸内病原体との相互作用は、C. difficileの体力と毒性に影響を与える可能性がある。C. difficileに感染した腸に豊富に存在する腸球菌は、内腔やバイオフィルム内でC. difficileと共局在し、C. difficileのコロニー形成と生存を著しく促進します。
25
相互利益として、C. difficile毒素の生産はEnterococcus faecalisの存在下で促進され、E. faecalisの増殖はマウスモデルにおいてC. difficile毒素の存在下で著しく増加する。
25
さらに、C. difficileの中核代謝は、アルギニンデイミナーゼ経路を通じて、腸球菌の存在下で著しく変化します: E. faecalisはアルギニンを枯渇させ、高レベルの細胞外オルニチンを排出し、その結果、C. difficileがエネルギーとして利用することができます。
25
C.ディフィシル再発
rCDI症例の約50%は、元の菌株による再感染に起因するものです。
26
CDIの推奨治療薬であるバンコマイシンは、グラム陽性菌に対する広域抗生物質であるため、生物学的異常やコロニー形成抵抗性の喪失をさらに永続させ、再発リスクに寄与する。その他、高齢、抗生物質の併用、胃酸抑制、消化管手術、化学療法、造血幹細胞移植、肝硬変、炎症性腸疾患(IBD)、過去のCDI、NAP1/B1/027などの強毒株への感染などがrCDIの危険因子となる。
27
,
28
さらに、最近のエビデンスでは、C. difficile芽胞の腸粘膜へのフィブロネクチン-α5β1およびビトロネクチン-αvβ1依存性のエンドサイトーシスは、芽胞の持続とrCDIに大きく寄与することが示唆されており、bclA3遺伝子欠損または芽胞内在化の薬学的阻害はマウスモデルにおいて再発を減少させている。
29
TcdAおよびTcdBに対する宿主の適応的な免疫応答は、高抗体価がリスク低減と関連することから、rCDIに対するある程度の防御を提供すると考えられる。
30
TcdAではなくTcdBに対するモノクローナル抗体であるbezlotoxumabは、rCDIリスクを40%低下させることが示されている。
31
エフエムティー
FMTは、慎重にスクリーニングされた健康なドナーの糞便をレシピエントの消化管に移植することで、レシピエントの微生物組成を直接変化させ、健康上の利益を与えるプロセスである。
32
米国感染症学会や米国消化器病学会を含むいくつかの診療ガイドラインでは、CDIの2回目の再発または3回目のエピソードの後にFMTを推奨している。
33
,
34
FMTは、米国では生物学的製剤としてFDA(Food and Drug Administration)の規制を受けています。rCDIの治療におけるFMTの使用は、FDAの施行裁量に委ねられています、
35
であり、FMTの供給源は、臨床研究者が運営する「便バンク」またはOpenBiomeによって大きく支えられています。最近、FDAは、rCDIの予防のための最初の糞便微生物叢製品であるRebyotaを承認しました。
36
この決定と同時に、FDAは、FMT製品を提供する便バンクに治験薬(IND)要件への準拠を求めるFMTに関する従来のガイダンスを修正しました。
35
FMTがC. difficileの再発防止に高い成功率を示すことを考えると、
37
この治療法を、潰瘍性大腸炎(UC)など、腸内細菌の異常と関連する他の慢性疾患に適用することに強い関心が持たれています。
38
,
39
したがって、rCDIに対するFMTは、病態に関連した宿主と微生物の相互作用の結果や、因果関係などの重要な側面を研究するためのパラダイムとなっている。
40
以下では、rCDIの予防に寄与すると考えられるメカニズムについてまとめる(図2参照)。
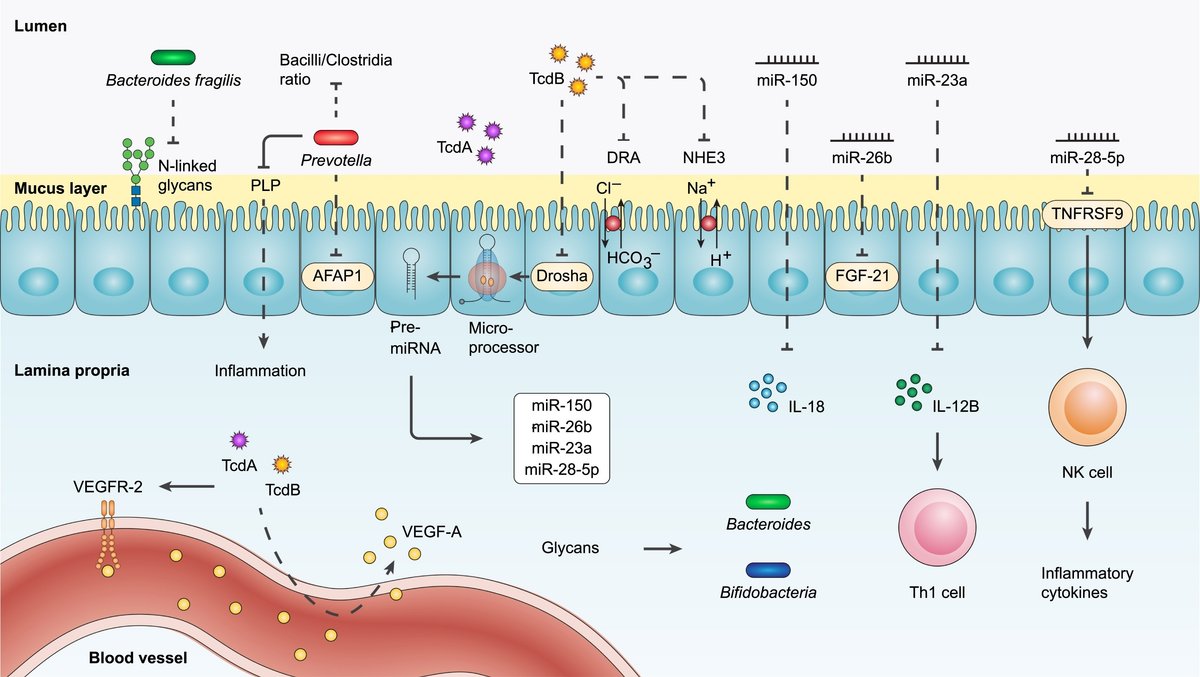
図2 C.ディフィシル、腸内細菌叢、免疫系間の相互作用を支えるFMT前後のメカニズム
フルキャプションを表示
大きな画像を見る
高解像度画像ダウンロード
rCDIにおけるFMTの有効性に寄与する可能性のあるメカニズム
復活した微生物生態
マイクロバイオームとは、細菌、真菌、ウイルス、原虫、寄生虫などすべての微生物と、それらが生息する環境中のゲノムや代謝物の集合体からなる群集を指す言葉である。これまで、ほとんどの研究は、FMTの前後における細菌の多様性とコミュニティ構造に焦点を当ててきた。
41
また、常在菌(「マイコバイオーム」)やウイルス(「ビローム」)を含むマイクロバイオームの他の構成要素は、FMTの有効性に寄与するような方法で共存し、相互作用しています、
42
,
43
が、これらの側面はまだ研究されていない。
FMTが腸内細菌叢に与える影響
FMT前のrCDI患者の糞便細菌群集プロファイルは、多様性と豊かさが低く、潜在的な病原性と炎症を引き起こす可能性のあるProteobacteria、口腔内細菌、酸素耐性菌が過剰に存在しています。
11
,
44
,
45
,
46
,
47
FMT成功後7日目には、バクテロイデーテスとファーミキューテスの相対量が増加し、プロテオバクテリアの相対量が減少するという、一貫した微生物シフトが研究により示されています。
7
,
11
,
44
,
46
Aggarwalaらは、ショットガンメタゲノミクスシーケンス技術を用いて、ドナーとレシピエント双方の細菌株を追跡した結果、主にバクテロイデス目および関連するクロストリジアルス目に属するドナー株の70%が、13人のレシピエントの腸内に定着し、FMT後5年まで持続していることを発見しました。
48
IBDを合併したrCDI患者において、FMT後のバクテロイデーテス(特にPrevotella種)の濃縮がBacillis/Clostridia比を調節した。
49
他の病態のFMTと比較して、より高いレベルの細菌生着が、菌株レベルの分解能のメタゲノミクスを用いた3つの研究において、rCDI患者でも検出されました。
11
,
12
,
13
Podlesnyらは、FMTが、dysbiosisの分類学的特徴(すなわち、α多様性の低下、β多様性の変化)と機能的特徴(すなわち、口腔および酸素耐性種の相対存在量の増加)を解決するだけでなく、レシピエント微生物叢においてドナー株の60%~90%が寄与するという結果を示した。
50
様々な病態のメタゲノミクスデータを用いたモデリングにより、菌株の生着は抗生物質の投与、レシピエントのα多様性の低下、ドナーにおける種の存在比がレシピエントに比べて高いことと関連することが立証されました、
11
,
12
このことから、rCDIにおける高い生着率は、抗生物質によって誘発されたdysbiosisとコロニー形成抵抗性の低下によって促進されることが示唆された。rCDIにおけるFMTの高い成功率を考えると、ドナー株の生着がコロニー形成抵抗性の再確立とCDI再発防止に重要な役割を担っていると考えられる。しかし、最近のメタゲノム研究では、治療成績が成功した症例でのみFMT前後を比較したため、生着と臨床成績との関連は不明である。FMTが機能するためには、細菌の生着が必要であり、必須であることを確認するための追加研究が必要である。
最近の菌株レベルのメタゲノム解析は、FMTの効果について生態学的な枠組みを提供するものである。
11
,
12
FMT後の生態ダイナミクスは複雑であるが(いくつかの生態学的プロセスが作用している)、これらの研究は、FMT後のマイクロバイオーム構築における決定論的でニッチベースのプロセス、特に近縁のレシピエント株とドナー株の間の競合と排除の重要性を支持している。
11
このような競争の結果は、菌株の体力と、入荷株と入荷株の相対的な体力(腸内環境への適応度)の差によって決定される。生態系に早く到着した菌株が有利になる優先効果、
51
一般に未開拓のコミュニティでは受信者系統を支持する
11
であり、微生物相が乱れていない患者における株移植が低レベルであることの説明となる。
11
rCDI患者では、抗生物質による常在細菌叢の枯渇が生態学的ニッチを解放し、ドナー株の生着率を高め、優先効果を効果的に克服しています。抗生物質の反復投与やIBDのような基礎的な慢性疾患など、さらなる擾乱がない場合、新たに確立された微生物群集は長期的に安定した状態を維持するようです。
52
FMTの腸内ビロームへの影響
健康なヒトの腸内には、安定した個体特異的なウイルスコミュニティが存在し、温帯バクテリオファージ、主にCrAss様、Caudovirales、Microviridaeバクテリオファージのメンバーによって支配されています。
53
,
54
,
55
ファージは細菌群集の構造や代謝の重要な調節因子として機能し、そのメタゲノム組成は特定の疾患と関連しているが、腸内での実際の挙動についてはまだ不明な点が多い。
56
近年、バクテリオファージが腸内細菌叢の分類学的構成と機能的能力の両方を調節することが示されている。
56
,
57
,
58
例えば、Hsuたちは、マウスモデルにおけるバクテリオファージの移植が、アミノ酸、ペプチド、炭水化物、脂質、ヌクレオチド、補酵素、ビタミン、ゼノバイオティクスなどのKyoto Encyclopedia of Genes and Genomes(KEGG)パスウェイをほぼ全て変化させていることを示していた。
56
Campbellらは、Bacteroides phage BV01がin vitroで胆汁酸のゲノム全体のトランスクリプトームプロファイルを変化させることを明らかにした。
58
しかし、rCDIに対するFMTの文脈で腸内ウイルス/ファージオームを調べた研究はほとんどない。これらの研究では、rCDI患者と便提供者の間で異なる腸内ウイルス量と組成、およびFMT後のレシピエントビロームの変化が観察されている。しかし、rCDIにおけるFMTの効果に対するウイルス/ファージオームの因果関係については、ほとんどの研究が相関関係にとどまっているため、現時点での理解は極めて不十分である。例えば、予備的な研究では、レシピエントにおけるドナー由来のCaudoviralesバクテリオファージの高レベルは、FMTの有効性と関連している。
42
また、FMTの成功は、バクテロイデス属を捕食すると考えられている温帯性クラッスファージの相対的な存在量と正の相関があり、これはrCDI患者で減少しています。
59
,
60
,
61
Fujumotoらは、FMT後のrCDI患者において、プロテオバクテリアの減少に関連してミクロウイルス科の割合が増加していることを発見し、溶菌性ミクロウイルス科が細菌叢を調節する役割を担う可能性を示唆した。
41
FMTの有効性におけるウイルス群の役割を裏付ける新たな証拠として、5人の患者が無菌糞便濾過液を投与された後、CDIの再発を起こさなかったというパイロット研究がある。その研究では、驚くべきことに、ほとんどがCaudoviralesからなるレシピエントのウイルス組成は、治療後のドナーのものと似ていたが、細菌組成は似ていなかった。
62
ビロームがFMTの有効性に寄与する可能性をさらに裏付ける証拠として、C. difficileを標的としたファージ療法の利用が挙げられる。例えば、Naleらは、4つのC. difficile myovirus(CDHM1、2、5、6)のカクテルを用いて、バッチ発酵モデルでC. difficileの増殖と毒素産生を阻害することに成功しました。
63
Meaderらは、特定のバクテリオファージがヒト大腸モデルにおいてC. difficileの負荷を大幅に軽減することを示しました。
64
さらに、FMT後の真核ウイルスのコロニー形成は、宿主免疫と常在細菌叢の両方を調節することによって腸のホメオスタシスにとってその存在が重要であるため、治療効果に寄与すると考えられる。
65
,
66
,
67
バクテリオファージ/真核生物ウイルス、細菌、ヒト宿主の間の相互作用と拮抗作用は、今後も絡め取るのが難しいでしょう。その他、生物学的サンプルにおけるウイルス濃縮の技術的限界、二本鎖DNA(dsDNA)ウイルスに対する抽出およびシーケンスライブラリの偏り、一本鎖DNA(ssDNA)およびRNAウイルスの除去、参照データベースで利用できる注釈付きウイルスゲノム配列の数の制限、ウイルス系統学および分類学的分類の手法の改良と変更の必要性などの克服しなければならない課題。
腸内マイコバイオームに対するFMTの影響
健康なヒトの腸内には多くの種類の真菌が検出されており、腸のホメオスタシスや疾患発症に重要な役割を担っていると考えられる。腸内で増殖し、コロニーを形成できる真菌は、少数の種に限られており、そのほとんどがカンジダ酵母である。
68
カンジダ属の増加は、多くの慢性疾患において、細菌の多様性と逆相関することが一貫して観察されている
43
,
69
,
70
従って、これはディスバイオシスのマーカーと見なすことができる。その他のよく検出される真菌は、食事や環境に由来するものであり(SaccharomycesとAspergillus)、微生物の生態系にも寄与していると思われます。
68
rCDIに対するFMTに関連して、腸内マイコバイオームを調べた研究はほとんどない。FMTが成功したCDI患者では、SaccharomycesとAspergillusの相対存在量が高いことが報告されているが、非応答者ではCandidaの存在が顕著であった。
43
また、FMT前のドナーにおけるCandida albicansとレシピエントにおけるYarrowia spp.の存在量は、FMTの有効性と負の相関があることが示されている。
43
,
71
ナイスタチンなどの抗真菌剤投与が、マウスモデルにおけるFMTの有効性の再確立と関連していることが確認された
29
と同時に腸内マイコバイオームも変化させました。しかし、FMTに対するマイコバイオームの影響の理解はまだ始まったばかりであり、食事由来のものをコントロールした後のマイコバイオームの役割を特徴づけるためには、さらなる研究が必要である。菌叢の特徴づけにおける方法論的な欠点を改善することが極めて重要である。特に、18S rRNA遺伝子の配列は、増幅能力が高く、異なる種を識別できるため、他のマーカー(例えば、内部転写スペーサー1 [ITS1], ITS2, 28S rRNA)よりも優れているのが普通である。しかし、いくつかの糸状菌のrRNA領域は多コピーであるため、コピーの多いものに強い偏りがある。一方、ITS領域は真菌のDNAバーコーディングの標準的なマーカーである。しかし、ITS1を増幅するプライマーではオンディカリアが優先的に増幅され、ITS2では子嚢菌に偏ってしまう。
72
最後に、ITS1、ITS2マーカーの長さは50bpから数kbまで様々である。
73
誤ったマッピング、ひいては分類は、FMTに関連する偽陽性を含むか、有効な分類群を除外することにつながる。
微生物由来の代謝産物の変化
大きく分けて、FMT研究で最もよく知られている代謝物は、胆汁酸と短鎖脂肪酸(SCFA)の2つのクラスであり、これらについて以下に概説する。
胆汁酸
胆汁酸は肝臓でコレステロールから合成されるステロイドで、脂肪や脂溶性の栄養素の吸収を促進するほか、シグナル伝達分子としても機能する。
74
胆汁酸は、ファルネソイドX受容体(FXR)-線維芽細胞増殖因子(FGF)軸を通じて、グルコースとエネルギー代謝、および胆汁酸の恒常性を制御しています。宿主で生産された一次胆汁酸(PBA)は、腸内に分泌されると細菌を介して二次胆汁酸に変換され、その両方の形態が宿主の生理機能に加え、C. difficileの病原性に影響を与えることが証明されている。
哺乳類には存在しない2つの重要な腸内細菌酵素が、胆汁酸の変換を促進することが知られています。まず、タウリンとグリシンは、バクテロイデーテス、ファーミキューテス、アクチノバクテリアなどの常在菌に広く分布する遺伝子によってコードされる胆汁酸ヒドロラーゼ(BSHs)によって脱共役されることができます。さらに、胆汁酸誘導性遺伝子(baiCD)がコードする7α-デヒドロキシラーゼを触媒として、PBA(コール酸[CA]およびチェノデオキシコール酸[CDCA])をそれぞれの第二胆汁酸(デオキシコール酸[DCA]およびリトコール酸[LCA])に変換する第二段階を経て、PBAの変換が起こることがある。7α-デヒドロキシラーゼを持つ細菌は、主にCluster XIVaとIV Clostridia(例:Clostridium scindens)のごく一部に過ぎないが、
75
,
76
最近の研究では、他のアミノ酸との共役を含む他の二次胆汁酸の産生における微生物叢の役割が十分に認識されていないことが示唆されている。
77
胆汁酸のCDI発症への重要な寄与は、in vivoおよび相関研究に基づいて、多くの研究が確立されている。C. difficileの芽胞は可溶性の偽プロテアーゼ受容体CspCを持ち、この受容体は胆汁酸によって刺激され、発芽を促進する。
78
,
79
しかし、このプロセスはCDCAによって競合的に阻害される。
80
生体内では、CDCAの阻害作用は、腸肝再循環後の存在量が少ないために制限されていると考えられる。
81
タウロコール酸(TCA)を含むコール酸ファミリーのメンバーは、in vitroでC. difficileの胞子の発芽を強力に誘導し、LCAやウルソデオキシコール酸(UDCA)を含むCDCAファミリーのメンバーは胞子の発芽と成長を阻害する。
79
,
80
,
82
RCDI患者では、FMT前にPBA(特にTCA)の増加、および二次胆汁酸の減少が観察されている。この変化した胆汁酸組成は、FMT成功後、健常ドナーのものと同様に回復する、
83
,
84
,
85
という、腸内細菌異常症の回復に関連する結果が得られました。さらに、FMT前のrCDI患者では、PBAsの増加はBSHレベルの減少も伴っていた。
83
FMTの成功により、BSHを産生する微生物が腸内に豊富に存在し、BSHの機能が回復することが示されています。
85
同様に、7α-デヒドロキシラーゼをコードするbaiCDオペロンも、FMT前のサンプルでは欠損していた。
85
Buffieらは画期的な研究で、抗生物質を投与したマウスに単一の細菌であるC. scindensを投与することにより、C. difficileに対するコロニー形成抵抗性が確立され、その結果、微生物の7α-デヒドロキシラーゼ活性が回復してDCAレベルが増加することを証明した。
86
さらに、C. scindensは、トリプトファン由来の抗生物質である1-acetyl-β-carbolineとturbomycin Aの分泌によりC. difficileに対する抑制効果を示し、これはDCAとLCA存在下でさらに増強されます。
87
C. difficile耐性には胆汁酸形質転換菌が関与していると思われるが、宿主はその存在によってPBAの循環を調節することもできる。胆汁酸はFXR受容体に対する親和性の程度が異なり、CDCAは最も強力な内因性アゴニストであり、DCAおよびLCAは中程度のアゴニストである。
88
FMT後、二次胆汁酸LCAとDCAの増加、PBAs CDCAとCAの減少は、rCDI患者における回腸FXRシグナルのアップレギュレーションと循環FGF-19の上昇と関連しています。二次胆汁酸LCAとDCAの増加、およびFXR受容体の中程度だが集団的な活性化は、より強力なリガンドであるCDCAの減少を補うかもしれない、
88
その結果、負のフィードバック反応によって肝PBA合成が減少する、
81
は、C. difficileの発芽に不利な環境を作り出しています。これらは興味深いヒトの予備データですが、マウスに自然に存在するFXRアンタゴニストであるタウロ-β-ムリコール酸(TβMCA)はヒトには存在しないため、マウスモデルでFXRシグナルがC. difficileに与える影響を検証するのは困難でしょう。
89
胆汁酸代謝の回復がコロニー形成とFMT効果の確立に重要な役割を果たすという概念は、最近Aguirreらによって否定された。
90
Cyp8b1-/-変異(コール酸欠乏症)を有する無菌マウスモデルを用いて、Cyp8b1-/-株とCyp8b1+/-株のC. scindensとの単縁性で、Cyp8b1-/-マウスでコール酸由来の二次胆汁酸が存在しないにもかかわらず、疾患感受性に差がないことを確認した。このことは、7α-デヒドロキシル化がCDIに対する保護に必要でないことを示唆している。著者らは、C. difficileがスティックランド経路を利用してアミノ酸を代謝し、腸内での成長をサポートする能力を実証した。これは、C. scindensでモノコロニー化したマウスにおいて、プロリンおよびグリシン(スティックランド基質)の低下と5-アミノバレレート(スティックランド代謝産物)の増加から明らかで、C. difficileによるコロニー形成を克服する胆汁酸非依存の機構を示唆している。C.difficileのスティックランド代謝の重要性は、最近、別の独立した研究でも観察されました。無菌マウスに別のアミノ酸発酵細菌であるParaclostridium bifermentansを単コロニー化すると、CDIが減弱することがわかりました。
91
SCFAs
SCFAは、腸内細菌が炭水化物やアミノ酸を嫌気性発酵させる際に生成されます。生成されると、腸管上皮細胞(IEC)によって吸収されます。マルチオミクス解析により、抗生物質を投与したマウスモデルでSCFA濃度が著しく低下していることが初めて示されました。
92
同じ研究では、SCFAが高濃度であるほどC. difficileの増殖から保護されることが指摘されています。FMT後のヒトの便サンプルの分析でも、主要なSCFAである酢酸、プロピオン酸、酪酸の回復が確認された。
93
さらに、この増加は、SCFA生産者として知られるLachnospiraceaeやRuminococcaceaeといったClostridialesやFirmicutesの未分類のファミリーがFMTによって回復することと正の相関があった。
94
急性CDIマウスモデルにおいて酪酸を投与すると、低酸素誘導因子(HIF)-1依存的なメカニズムにより、腸上皮バリアの維持が直接促進された。
95
酪酸によるHIF-1の安定化は、IECの上皮タイトジャンクションを増加させ、C. difficile毒素を介したダメージに抵抗できる可能性がある。この研究では、酪酸が毒素産生やC. difficileのコロニー形成に影響を与えることはなかったが、IECの完全性を直接保護し、抗炎症性サイトカインであるインターロイキン10(IL-10)の増加、炎症性サイトカインのIL-6とケモカインリガンド1の減少による酪酸媒介免疫調節効果が確認されている。
95
さらに、酪酸は、炎症を抑制することができるT細胞集団であるTレギュラトリー(Treg)細胞の細胞外への生成を促進することにより、腸の炎症を抑制しました。これについては、以下の適応免疫のセクションでさらに説明します。
96
もう一つのSCFAであるバレレートも、FMTの効果を媒介する上で重要な役割を担っている可能性がある。CDIのケモスタットモデルにおいて、バレレートの回復はFMT後にのみ観察され、抗生物質の中止により回復する他のSCFAとは異なっていた。
97
バレレートは、いくつかのC. difficileリボタイプの植物成長を用量依存的に阻害したが、他の常在菌には影響を与えなかった。
97
バレラートの経口投与によりマウスのC. difficile総生存数が95%減少したこと、およびFMT後にrCDI患者の便サンプルにおけるドナー様のバレラート濃度が持続的に回復したことは、in vivoおよびin vitroの両方で、バレラートの重要性をさらに検証しています。
98
FMTの免疫介在性メカニズム
CDIの発症は、TcdAとTcdBのIECへの作用によるところが大きいのですが、
99
ほとんどのFMT研究は、臨床と微生物に関連する変化に焦点を当てていますが、免疫に関連する変化はまだ十分に理解されていません。このセクションでは、C. difficile患者におけるFMTの免疫効果について知られていることと、マイクロバイオームが免疫系にどのように影響を与えるかに焦点を当てます。
自然免疫への影響
自然免疫系は、主に細胞表面のパターン認識受容体(PRR)が微生物関連分子パターン(MAMP)に結合することにより、非特異的に微生物に応答する。PRRシグナルが活性化すると、炎症が起こり、マクロファージや好中球などの貪食性細胞が動員される。したがって、FMTによって誘発される炎症は、貪食作用によって残存するC. difficileを除去する上で保護的であると考えられるが、理想的な治療法としては、新規常在菌に対するIL-23やIL-6などの炎症性サイトカインの誘導が最小限であることが求められる。
好酸球は粘膜表面の重要な自然免疫細胞であり、CDIにおいて保護的な役割を果たす可能性がある。好酸球数が検出されない場合、院内死亡率の上昇と重症敗血症に関連する。
100
同様に、あるマウス研究では、NAP1/027 C. difficile株の病原性は、バイナリートキシンCDTによって好酸球反応を抑制することで増強されることが判明しました。
101
興味深いことに、微生物が制御するサイトカインIL-25を回復させると、マウスの大腸の好酸球の蓄積が促進され、CDIから保護された、
102
と、CDI患者のFMT後の結腸生検で、治療前の生検よりも高いレベルのIL-25が確認されました。
103
同様に、別の微生物制御サイトカインであるIL-33は、マウスのFMT後に増加し、グループ2の自然リンパ系細胞を活性化することによりCDI関連死亡を予防することができた。
104
どのような常在菌がこれらの「保護」サイトカインの分泌を促進し、「損傷」サイトカインを減衰させるかを理解することは、理想的なFMT組成を決定するのに役立つ。
適応免疫への影響
重要な適応免疫細胞はT細胞とB細胞で、それぞれ長命な細胞性免疫と液性免疫を媒介する。適応免疫がFMTの有効性に寄与するという概念は、T細胞およびB細胞を欠くマウスでは、FMT後にCDIが持続し、免疫不全マウスは完全に回復したことを示す研究によって支持されている。
105
T細胞には、細胞傷害性CD8+ T細胞とヘルパーCD4+ T細胞(Th)があり、Th細胞のサブセットには、タイプ1(Th1)、タイプ2(Th2)、タイプ17(Th17)、Treg細胞(転写因子FOXP3を発現するサブセット(FOXP3+ Treg)およびFOXP3陰性だがIL-10の大量分泌があるTr1細胞)などがあります。トレグは、自己抗原と外来抗原の両方を認識することができ、炎症反応を抑制し、組織の保護と回復を仲介することにより、自己寛容を維持し、免疫病態を予防する上で重要な役割を担っています。
106
驚くべきことに、トレグを欠損させたマウスを用いたCDIの研究では、炎症性メディエーターが増加し、ドナー菌の生着が損なわれ、FMTでは治癒しないことがわかった。
105
SCFAやビタミンA、Dなどの様々な代謝物が、Tregの数や機能を増加させることが示されています、
107
また、最近では、二次胆汁酸がTregの発達を促進する役割があることが分かってきた。特定の代謝物を多く含む食事は、Tregを活性化し、ドナーの微生物叢に対する耐性を確立・維持することができるため、FMTの結果はレシピエントの食事によって影響を受ける可能性がある。
IL-17Aを分泌するTh17細胞は腸の恒常性と抗真菌反応に重要な役割を果たし、IFNγを分泌するTh1(およびCD8+)細胞は細胞内病原体に対する重要な反応に、IL-4を分泌するTh2細胞は寄生虫に対する反応に関与している。しかし、調節不全の腸内では、Th1細胞とTh17細胞の両方が過剰な炎症を引き起こす可能性がある。
108
最近の研究で、CDI患者におけるTcdAおよびTcdBに対する強固なCD4+ T細胞応答が同定され、これらの応答は大部分がTh17細胞で構成されていることが判明した。重要なことは、rCDI患者では、循環するTcdB特異的Th17細胞のレベルが有意に減少していたことである。
109
を健常対照者と比較しました。その後の研究で、FMTが成功すると、rCDI患者のTcdB特異的Th17細胞がかなり増加することが確認され、FMT後、これらの細胞はIL-17AおよびIL-22サイトカインの分泌が増加していることが予備データとして示された。
110
また、FMT成功後には、全身の抗毒素IgAおよびIgGレベルの同時上昇が検出された、
110
は、以前からCDI再発のリスク低減と関連付けられています。
108
Cookらの知見と一致して、免疫不全マウスにおけるFMTによるCDIの回復は、生着成功、Th17細胞の増加、大腸のラミナプロプリアにおけるIL-17AおよびIL-22レベルの上昇と関連していた。
105
しかし、Th1細胞欠損マウス(Tbet-/-)、IL-17A-/-、IL-22-/-マウスはいずれもFMT後に回復したことから、FMTによるマウスのCDI治癒はTh1またはTh17細胞のみに依存しないことが示唆された。
105
また、免疫老化(加齢に伴う免疫低下)がFMT失敗の一因となることも提唱されています、
111
抗生物質不応性の劇症型CDIに対して順次FMTを受けた4人の患者の観察研究では、FMT反応者3人と比較して非反応者で循環免疫血清細胞集団の増加が見られた。
111
これらのデータは、FMTのもう一つのメカニズム的な機能が、TcdB特異的CD4+ T細胞のレパートリーを形成し、アンチエイジング効果を誘発する可能性があることを示唆している。これらのデータを総合すると、理想的なFMTの組成は、腸の恒常性を維持するために、Tregと他のTh細胞の正確かつ未確定のバランスを活性化する必要があることが示唆されます。in vivo研究から得られたメカニズム的な洞察は、大腸特異的な免疫応答の重要性を強調しており、臨床研究においてさらなる検証が必要である。
FMTで治療したCDIに関するこれらのヒト研究は予備的なものであるが、FMTの生着には適応免疫系が必須であり、抗毒素抗体だけでなくTregおよびTh17細胞の機能が有効性の向上に関連することを示唆している。
105
,
109
,
110
腸内における宿主と微生物の相互作用の研究から、免疫の発達、耐性、長期生存免疫の形成にマイクロバイオームがいかに重要であるかが分かっています。そのため、FMTによってマイクロバイオームを変化させることが、長期にわたる防御免疫にどのような影響を及ぼすかということが、未解明の大きな疑問となっています。ある研究では、FMT後に小児ワクチンに対するT細胞応答が低下したことが示されています。
110
FMTの有効性を支える完全なメカニズムを理解するためには、理想的には末梢血と腸組織の両方で、マイクロバイオーム/メタボロームの変化と並行して免疫の変化を評価する大規模な研究が不可欠となるであろう。
エピジェネティック関連メカニズム
CDIでは、腸内細菌の異常や微生物の多様性の低下が、栄養素や代謝物のレベルを変化させ、エピジェネティック経路に影響を与え、遺伝子発現を変化させると考えられています。近年、FMTは微生物叢の構成とマイクロRNA(miRNA)発現の相互関係を探る有用なツールとして登場した。このような背景から、ある研究では、rCDI患者の2つの独立したコホートにおいて、遺伝子発現を転写後に制御する小さなノンコーディングRNAである循環miRNAの抑制が報告されています。
112
この効果は、その後、FMTに成功すると逆転し、FMT処理したマウスモデルおよびex vivoヒト大腸腺で再現されました。解析の結果、TcdBは、miRNAの生合成に重要な役割を果たす酵素であるDroshaの発現を調節することによって、CDIのmiRNAに対する抑制効果を媒介することが確認されました。
112
FMT成功後にrCDI患者およびマウスモデルの両方で発現が上昇した特定のmiRNAは、miR-26b、miR-23a、miR-150、およびmiR-28-5pでした。これらのmiRNAをヒト血液中で過剰発現させると、FGF-21、IL-12B、IL-18、TNF receptor superfamily member 9(TNFRSF9)の炎症性遺伝子ターゲットのmRNAレベルがそれぞれ低下した。
112
また、同じ研究において、miR-23a-3pとmiR-150-5pの複合過剰発現が、TcdBによるIECへのダメージから保護できることも明らかにした(図3参照)。FMTがヒトの循環、糞便、組織のmiRomeとより広い宿主エピゲノムに与える影響についてはまだ理解が不十分であり、rCDIや腸内細菌異常症に関連する他の疾患状態に対するFMTの長期的エピゲノム効果を調べるには、さらなるメカニズム研究が必要である。今後の研究では、CDI、FMT、食事操作戦略に関連するエピトランスクリプトーム変化を包括的にマッピングすることが必要である。FMTで制御されるmiRNAはユニークな治療標的であり、単独で、あるいは生きた生物治療薬と組み合わせて、C. difficileに対する治療効果を増強し、薬剤耐性に対抗するのに役立つ可能性があります。
113
図3FMT後のmiRNAと糖鎖の免疫系および腸内細菌叢との相互作用
フルキャプションを表示
大きな画像を見る
高解像度画像ダウンロード
洞察と今後の方向性
このレビューで強調されたように、rCDIにおけるFMTの仕組みに関する我々の理解はまだ不完全である。生態学的、代謝学的、免疫学的、エピジェネティックなメカニズムはすべて異なる深さで研究されているが(表1に要約)、それらの個々の貢献は依然として不明であり、臨床効果に寄与する原因成分(細菌、ウイルス、真菌、特定の代謝物)はまだ完全に解明されてはいない。最近のメタアナリシスでは
11
,
12
,
13
メタゲノム解析と菌株レベルの解像度と予測モデリングを組み合わせた研究では、抗生物質処理、レシピエント要因(α-多様性や種の分布など)、およびドナーとレシピエントの相補性が、生着率の重要な決定因子として明確に立証されましたが、これらの研究は、生着率が成功のために必要かどうかを判断するには十分な検出力ではありませんでした。しかしながら、確立された生態学的および統計学的アプローチは、今後の研究に役立つ枠組みを提供するものである。
表1再発性C. difficile感染症(rCDI)に対するFMTの作用の仮説メカニズム
メカニズムエビデンスナレッジギャップ細菌の生着や非細菌成分の調節によるコロニー形成抵抗性の回復動物実験:
定義された細菌コンソーシアム(6株)が、マウスの再発性CDIを消失させる
114
人体実験:
細菌の組成と多様性が回復し、高いレベルの耐久性のある細菌移植に関連する臨床的利益
7
,
11
,
12
,
13
,
44
,
45
,
46
,
47
,
50
,
52
胞子製剤(SER-109、固形物入り)
115
は、プラセボ対照の無作為化試験において、FMTと同様の臨床効果を示した
定義済み細菌コンソーシアム(MET-2、40株入り)
116
は、オープンラベルの予備試験において、FMTと同様の臨床効果を示した
は、有効性のために生着が必要ですか?
有効性を維持するために必要な最小限の菌株数は何株ですか?
食事は生着や効果にどのような影響を与えるのでしょうか?
は有効性に生きた菌が必要なのか?
C. difficileに対する直接的な効果、またはビローム/ファージオームによる微生物生態の変調を通じたin vitro試験:
Bacteroides phage BV01が胆汁酸のゲノムワイドなトランスクリプトームプロファイルを変化させる
58
ファージ療法がC. difficileの増殖と毒素産生を抑制する
63
ex vivo試験:
バクテリオファージがC.ディフィシルの負担を減らす
64
動物実験
C.ディフィシル感染マウスの治療に有効なファージ療法
117
ファージ投与により、マイクロバイオームとメタボロームが変化する。
56
人体実験:
FMTの有効性は、レシピエントにおけるドナー由来のCaudoviralesの濃度が高いことと関連することを示す相関性試験。
42
相関研究により、レシピエントにおける微生物科の増加とプロテオバクテリアの減少が示された。
41
非盲検予備試験において、生菌を含まない滅菌糞便濾液はrCDIの予防に有効であり、レシピエントのウイルス組成はドナーのものと同様で、ほとんどがCaudoviralesからなる。
62
ウイルス・ファージオームやマイコバイオームなどの非細菌成分が、微生物の生態やFMTの有効性をどのように調節しているのか?
は、ファージだけでFMTの有効性は十分か?
細菌由来の代謝物によるC. difficileの増殖・発芽阻害in vitro試験:
一次胆汁酸はC. difficileの発芽・増殖を促進し、二次胆汁酸は発芽・増殖を抑制する。
78
,
79
,
80
,
82
動物実験
抗生物質を投与したマウス(C. difficile感受性)では、一次胆汁酸の増加、二次胆汁酸の減少、SCFA(バレレートなど)の減少が見られる。
92
C. scindens単独で胆汁酸を介したC. difficile耐性を媒介する。
86
経口バレラートサプリメントは、腸内常在菌に悪影響を与えることなく、C. difficileの増殖を抑える。
98
人体実験:
胆汁酸の代謝が回復したことを示す相関研究
83
,
84
,
85
,
93
と、FMT成功後の胆汁酸-FXR-FGF経路のシグナルの増加
88
相関研究により、FMT成功後の便サンプルにバレラートを含むSCFAが増加することが示された。
93
,
98
他の微生物由来の代謝産物(トリプトファンやインドールなど)は、有効性にどのような影響を与えるのか?
FMTの有効性は胆汁酸やSCFAに依存するか?
宿主免疫反応の調節動物実験
微生物が制御するサイトカインIL-33分泌の調節機能
104
ドナー微生物に対する免疫寛容の確立
105
人体実験:
微生物が制御するサイトカインIL-25分泌のモジュレーション
102
C.ディフィシル毒素特異的細胞免疫の健常対照者に見られるような回復
109
,
110
FMT成功後、全身性の抗毒素IgAおよびIgGが高水準であった。
110
FMT反応者における循環型免疫血清シグナルの減少
111
FMTの有効性における自然免疫反応と適応免疫反応の相対的な寄与は何か?
ヒト白血球抗原(HLA)多型は、生着や有効性にどのような影響を及ぼすのか?
FMT反応者におけるTregの特徴的なプロファイル(組織特異的な適応や転写の動態など)は?
FMT反応形成における免疫老化の正確な役割とは?
臓器オンチップモデルを利用して、ドナーの微生物叢と宿主の免疫応答との相互作用をリアルタイムで明らかにすることができるのか?
元のレシピエントマイクロバイオームで教育された長寿命な免疫反応に対するFMTの影響は何か?
宿主のエピジェネティックな反応の調節 ヒトと動物のメカニズム研究:
112
ヒトのrCDIに対するFMT後、循環miRNA(miR-26b、miR-23a、miR-150、miR-28-5p)の発現が増加し、それに伴いFGF-21、IL-12B、IL-18、TNFRSF9 mRNAの発現がそれぞれ減少したこと
FMTは、rCDIモデルマウスにおいて、C. difficileが循環およびセカール組織のmiRNAに与える影響を逆転させた
C. difficile TcdBはマウス大腸およびヒト大腸菌のmiRNAに対するCDIの抑制効果を媒介する
特定のmiRNAが特定の細菌株の増殖にどのような影響を与えるのか?
微生物の代謝物や副産物は、miRNAの生合成にどのような影響を与えるのか?
は、FMTの有効性を説明するのに循環miRNAだけで十分なのでしょうか?あるいは、治療の補助として、あるいは治療成績の予測因子として使用することができるのでしょうか?
rCDIとFMTは、糞便中のmiRNAプロファイルにどのような影響を与えるのでしょうか?
ヒトの宿主における(抗炎症)miRNAの発現に影響を与える特定の食事成分は何か?
は、外因性の食事(植物由来のmiRNAなど)がC. difficileの増殖に直接影響を与えることができるか?
新しいタブで表を開く
FMTがrCDIの予防に非常に有効であるにもかかわらず、rCDI患者のごく一部がFMTの恩恵を受けられない理由はまだわかっていない。rCDIにおけるFMTの研究では、食事や宿主の遺伝などの生態学的要因が考慮されておらず、これらの「FMT失敗例」のミッシングリンクとなる可能性があります。食事は、FMT後のマイクロバイオーム動態の生態系に影響を与えるため、関連性があると提唱されているが、この話題は事実上実験的に検証されていない。また、マイクロバイオーム形成における宿主遺伝の相対的重要性は低く(10%以下の変動しか説明できない)、
118
の食事は、いくつかの方法でFMTの結果に影響を与える可能性がある。第一に、レシピエントの食事は、流入する微生物が利用できる基質や資源(栄養素の形)の多様性に影響を与えるため、生着に利用できるニッチに直接影響を与えるであろう。そのため、ドナーとレシピエントの食事パターンや嗜好に基づいた組み合わせは、ドナーの微生物叢がレシピエントの食事にあらかじめ適応しているため、効果をさらに最適化することができる。その他、有効性を高めるために移植や生菌が必要なのか、他の非細菌成分が微生物の生態をどのように調節するのか、適応免疫反応や自然免疫反応が結果に与える相対的な寄与は何か、免疫老化などの特定の免疫学的因子は必要なのか、などの知識不足に対処しなければならない。
119
や低いIgA多様性が有効性に影響を与える可能性がある。
120
rCDIにおけるFMTがもたらした臨床的およびメカニズム的な洞察は、FMTの潜在的な治療価値を他のディスバイオシス関連慢性疾患にも拡大しました。clinicaltrials.govで最近検索したところ、様々な疾患でFMTを利用した429件の研究が見つかり(2023年2月7日アクセス)、微生物ベースの治療薬を取り巻く関心の高さが浮き彫りになりました。多くの慢性疾患の病因は複雑で多因子であり、ディスバイオシスはパズルの一片に過ぎず、病態の原因ではない可能性があることは、注目に値する。
121
例えば、IBDは、免疫調節異常、腸内細菌異常、環境トリガー、遺伝的感受性によって引き起こされると考えられている。したがって、これらの慢性疾患におけるFMT後の治療効果の大きさや移植の程度は、dysbiosisが主な病因であるrCDIほど高くなく、耐久性もないと予想されます。
11
,
12
その最たる例が、IBDの一種であるUCで、無作為化プラセボ対照試験による最も強いエビデンスが存在する適応症である。FMTの実施方法、FMTの実施頻度、FMTが単一のドナーからのものか複数のドナーをプールしたものかにかかわらず、軽度から中等度のUCにおける寛解率はわずか30%から40%であった。
38
,
39
,
122
,
123
さらに、これらの研究はすべて比較的短期間のもので、主要なアウトカムはFMT後7-12週頃に評価されます。さらに、試験中の反応者の多くは、試験終了後に疾患の再燃に至っている。
38
一方、過敏性腸症候群に対するFMTは、無作為化プラセボ対照試験で相反する結果が得られており、いくつかの研究では緩やかな有効性が示されています、
124
,
125
がある一方、効果が見られないものもありました。
126
,
127
,
128
また、メタボリックシンドロームなどの他の適応症についても、FMTで有望な予備的結果が得られています、
129
,
130
肝性脳症です、
131
チェックポイント阻害剤誘発性大腸炎、
132
移植片対宿主病です、
133
,
134
多剤耐性菌の除菌、
135
を挙げることができる。しかし、FMTに良好な反応を示す可能性の高い患者の選択方法、最適な投与レジメンの設計方法、反応の持続性を向上させる方法など、不明な点が多く残っている。
FMTは非常に有効であるが、いくつかの欠点もある。まず、便がドナーから供給されるため、感染症を伝播するリスクがある。このようなリスクは、FDAの安全警告を促したESBL産生大腸菌による死亡例で強調されている。
10
,
136
SARS-CoV-2やサルモドキウイルスなど、便から検出される新たな病原体は、FMTの安全性に懸念を抱かせる要因となっています、
137
,
138
そのため、厳格なドナー検査プロトコルが不可欠である。第二に、各FMT治療薬の組成は不明であり、同じドナーから採取したものでも時間の経過とともに変化する。便は複雑な混合物であり、医薬品に関する現行の規制の枠組みが適用されないため、規制当局の承認は困難である。第三に、長期的な安全性データが不足していることである。多くの慢性疾患は腸内細菌の異常と関連しているため、ドナーの表現型がレシピエントに移行する可能性がある。第四に、FMTの正確な作用機序が未知数である。したがって、rCDIの治療法として、標的を絞り、安全で、ドナーに依存しない、より良い治療法が望まれている。
FMTの欠点を認識することにより、より洗練された生体治療薬の開発という還元主義的アプローチがとられてきた。系統学的に多様な6種類の腸内細菌の混合物は、マウスの再発性CDIを解決することができる。
114
さらに、SER-109、
115
胞子を形成するFirmicutesのみを含む製品、およびMET-2を含む製品です、
116
また、40株の常在細菌を含む「エーザイ株式会社」の製品は、rCDI患者の治療に有望であり、成功率はそれぞれ88%、79%で、FMTと同程度である。興味深いことに、12株の細菌の混合物は、ランダム化臨床試験において、rCDI患者に対するFMTほど有効ではなく、FMTの76%と比較して、52%の有効性を示した。
139
彼らは、少なくともrCDIでは、FMTの全微生物スペクトルが臨床効果に必要でないことを強調している。おそらく、「足場」または早期の機能回復を提供できる重要な菌株が存在し、それらは中・後期コロニー形成者にとって必須であり許容的である。有効性を維持するためにコンソーシアムに必要な最小限の微生物数、あるいはどの微生物が必要なのか、またこれが宿主要因に依存するのかどうかは、依然として不明である。
FMTのメカニズムの理解を深め、因果関係を明らかにするためには、便だけでなく、組成や特性を定義した便の派生物、あるいは細菌、ウイルス、代謝成分の単独または組み合わせで定義したコンソーシアムを用いたヒト介入試験が重要な実験プラットフォームとして機能することになる。これらの試験では、明確に定義されたアウトカムを使用し、マルチオミクス(メタゲノム、トランスクリプトミクス、プロテオミクス、メタボロミクス)、宿主ベース(免疫表現型)、食事またはその他の環境因子を組み合わせて、レシピエントとドナーの両方のサンプルを分析し、生態学の枠組みを用いて予測モデリング(例えば、機械学習や人工知能[AI]による)して臨床および生態学のアウトカムの主要決定要素の相対重要度を決定すべきである。統合マルチオミクス研究の課題は、それぞれの「オーミック」技術の欠点に対処するだけでなく、異なる分子データセットをどのように統合するかという点にある。特にビロームとメタボロームについては、データライブラリーをさらに開発する必要がある。また、マルチモデル実験の正規化と統合を標準化するためのバイオインフォマティクスツールの追加も必要である。理想的には、原因因子の特定を可能にする統計的アプローチ(例えば、媒介分析)を可能にするために、レシピエントにおける臨床評価とサンプリングは縦断的であるべきである。動物モデルやその他のモデル(オルガノイド、オルガンオンチップなど)は、その移植性に限界があるものの、メカニズムの確立、因果関係の確認、原因成分の特定には重要であることに変わりはない(図4参照)。この研究は、FMTのアプローチ(例えば、マイクロバイオームや食事に基づくドナーとレシピエントのペアリング)を改良するための情報を提供する一方で、FMTに代わる洗練された標的バイオ治療薬の開発を待ち望んでいます。
図4FMTに統合されたマルチオミクスアプローチを使用する
フルキャプションを表示
大きな画像を見る
高解像度画像ダウンロード
謝辞
D.K.は、カナダ保健研究機構およびアルバータ大学病院財団の支援を受けた。
利益申告
D.K.は、Finch Therapeuticsの裁定委員を務め、Rebiotix/Ferring Pharmaceuticalsからコンサルティング料と講演謝礼を受け取っています。A.M.S.は、Finch Therapeutics社およびRebiotix/Ferring Pharmaceuticals社からコンサルティング料を受領しています。
参考文献
スミッツ・W.K.
ライラスD.
レイシーD.B.
ウィルコックス M.H.
カイパー E.J.
クロストリジウム・ディフィシル感染症
Nat. Rev. Dis. プライマー.2016; 216020
記事で見る
スコープス (419)
パブコメ
クロスリファレンス
Google Scholar
ジョンソン S.
ラヴァーニュV.
スキナー A.M.
ゴンザレス=ルナ A.J.
ギャリー K.W.
ケリー C.P.
ウィルコックス M.H.
米国感染症学会(IDSA)および米国医療疫学学会(SHEA)による臨床実践ガイドライン:成人におけるクロストリジオイデスディフィシル感染症の管理に関する2021年重点更新ガイドライン。
Clin. Infect. Dis. 2021; 73: 755-757
記事で見る
スコープス (45)
パブコメ
クロスリファレンス
Google Scholar
フェケティ R.
マクファーランドL.V.
スラウィッチ・C.M.(Surawicz C.M.
グリーンバーグR.N.
エルマーG.W.
Mulligan M.E.
再発性Clostridium difficile下痢症:前向き無作為化二重盲検試験に登録された患者の特徴と危険因子。
Clin. Infect. Dis. 1997; 24: 324-333
記事で見る
パブコメ
クロスリファレンス
Google Scholar
ケラー J.J.
カイパーE.J.
再発性および重症のクロストリジウム・ディフィシル感染症に対する治療法
Annu. Rev. Med. 2015; 66: 373-386
記事で見る
スコープス (26)
パブコメ
クロスリファレンス
Google Scholar
ダバーク E.R.
リーC.H.
オレンシュタインR.
カンナ S.
ヘクト G.
ゲルディング D.N.
クロストリジウム・ディフィシル感染症の再発予防を目的としたRBX2660-Aマイクロバイオータに基づく薬剤の無作為化プラセボ対照臨床試験結果。
Clin. Infect. Dis. 2018; 67: 1198-1204
記事で見る
スコープス (73)
パブコメ
クロスリファレンス
Google Scholar
ヴァン・ヌードE.
ヴリーゼ A.
ニーウードロップM.
フエンテス S.
ゾーテンダール E.G.(Zoetendal E.G.
デ・フォスW.M.
ヴィッサーC.E.
カイパー E.J.
バーテルスマンJ.F.(Bartelsman J.F.
ティッセン・J.G.(Tijssen J.G.
et al.
再発性クロストリジウム・ディフィシルに対するドナー糞便の十二指腸注入。
N. Engl. J. Med. 2013; 368: 407-415
記事で見る
スコープス (2599)
パブコメ
クロスリファレンス
グーグルシュラー
カオ D.
ローチB.
シルバ M.
ベック P.
リュー・K.
カプラン G.G.
チャン・H.J.
カワード S.
グッドマンK.J.
Xu H.
他。
クロストリジウム・ディフィシル感染症の再発に対する、経口カプセル投与と大腸内視鏡投与による糞便微生物移植の効果: 無作為化臨床試験。
JAMA. 2017; 318: 1985-1993
記事で見る
スコープス(350)
パブコメ
クロスリファレンス
Google Scholar
ケリーC.R.
コルッツA.
ステイリーC.
サドウスキーM.J.
アブド M.
アラーニ M.
バコウ B.
カラン P.
マッケニー J.
ティッシュ A.
ら.
多発性クロストリジウム・ディフィシル感染症における再発に対する糞便微生物移植の効果: 無作為化試験。
Ann. Intern. Med. 2016; 165: 609-616
記事で見る
パブコメ
クロスリファレンス
Google Scholar
パーラーB.K.
チェン B.
フェルプス E.
アレグレットティ J.R.
フィッシャー・M.
ガナピニ V.
クラジケック E.
クマール V.
マーカス J.
ナティヴL.
ら。
再発性Clostridioides difficile感染症の治療に対する糞便微生物移植の長期的な有効性と安全性。
J. Clin. Gastroenterol. 2020; 54: 701-706
記事で見る
スコープス (24)
パブコメ
クロスリファレンス
Google Scholar
デフィリップ Z.
ブルーム・P.P.
トーレス・ソトM.
マンスール M.K.
セイターM.R.A.
ハントリーM.H.
ターベット S.
チョン R.T.
チェン・Y.B.
Hohmann E.L.
糞便微生物叢移植により感染した薬剤耐性大腸菌による菌血症
N. Engl. J. Med. 2019; 381: 2043-2050
記事で見る
スコープス (564)
パブコメ
クロスリファレンス
グーグルシュラー
ポドルスニーD.
ドゥルデヴィッチM.
パラムソティS.
カアクーシュ N.O.
ヘーゲナウアーC.
ゴーキエヴィッチ G.
ウォルター J.
Fricke W.F.
メタゲノム解析による糞便微生物移植後の菌株生着の臨床的・生態的決定要因の同定。
セル・リップ・メド. 2022; 3100711
記事で見る
パブコメ
グーグルシュラー
シュミット T.S.B.
リー・S.S.
マイストレンコ O.M.
アカンニ W.
コエリョ・L.P.
ドライ S.
フラム A.
グラゼックA.M.
ヘルコグR.
ヘレマH.
他。
糞便微生物移植後の菌株動態の原動力と決定要因。
Nat. Med. 2022; 28: 1902-1912
記事で見る
スコープス (10)
パブコメ
クロスリファレンス
Google Scholar
イアニーロG.
プンチョーチャール M.
カーチャーN.
ポルカリS.
アルマニーニF.
アスニカーF.
ベギーニF.
ブランコ=ミゲス A.
クンボ F.
マンギP.
et al.
異なる疾患における糞便微生物移植後の菌株生着のばらつきとマイクロバイオーム組成の予測可能性。
Nat. Med. 2022; 28: 1913-1923
記事で見る
スコープス (19)
パブコメ
クロスリファレンス
Google Scholar
アブト M.C.
マッケニー・P.T.
パマー E.G.
クロストリジウム・ディフィシル大腸炎:病因と宿主防御。
Nat. Rev. Microbiol. 2016; 14: 609-620
記事で見る
スコープス (286)
パブコメ
クロスリファレンス
Google Scholar
エンゲヴィークM.A.
エンゲヴィークA.C.
エンゲヴィークK.A.
オーヒトゥンJ.M.
チャン・グレアムA.L.
ルアン・W.
ルナR.A.
ハイザー・J.M.
スピンラーJ.K.
バーサロビッチJ.
ムチン分解微生物が放出する単糖類がClostridioides difficileを化学吸引し、ヒト腸管粘液層のコロニー形成を促進する。
ACS Infect. Dis. 2021; 7: 1126-1142
記事で見る
スコープス (24)
パブコメ
クロスリファレンス
Google Scholar
エンゲヴィークM.A.
ダンホフH.A.
アウフタクトJ.
エンドレスB.T.
ルアン・W.
バセール E.
エンゲヴィーク A.C.
ウー・Q.
ニコルソンM.
ルナ R.A.
et al.
FusobacteriumnucleatumはRadDアドヒシンを介してClostridioides difficileに付着し、腸管粘液中でバイオフィルム形成を促進する。
Gastroenterology. 2021; 160: 1301-1314.e8
記事で見る
スコープス (0)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
エンゲヴィーク M.A.
ヤサイシンM.B.
エンゲヴィーク・K.A.
ワン・J.
ダリエン B.
ハセットD.J.
ヤシシンB.R.
Worrell R.T.
ヒトClostridium difficile感染症:粘液の産生と組成の変化。
Am. J. Physiol. Gastrointest. 肝臓フィジオール. 2015; 308: G510-G524
記事で見る
スコープス (91)
パブコメ
クロスリファレンス
Google Scholar
チェン・ビー
リュウ Z.
ペリー K.
ジン・アール
TcdAのグルコシルトランスフェラーゼドメインとRhoAとの複合体の構造から、基質認識に関する知見が得られた。
Sci. Rep. 2022; 129028
記事で見る
Google Scholar
チュンブラー N.M.
ファローM.A.
ラピエール・L.A.
フランクリンJ.L.
レイシーD.B.
Clostridium difficile毒素TcdAおよびTcdBは、異なるメカニズムで大腸組織障害を引き起こす。
Infect. Immun. 2016; 84: 2871-2877
記事で見る
スコープス (0)
パブコメ
クロスリファレンス
Google Scholar
Li Y.
Xu S.
Xu Q.
Chen Y.
クロストリジウム・ディフィシル毒素Bは、TRIM46/DUSP1/MAPKsおよびNF-κBシグナル経路を通じて大腸炎症を誘発する。
Artif. Cells Nanomed. Biotechnol. 2020; 48: 452-462
記事で見る
スコープス (18)
パブコメ
クロスリファレンス
グーグルシュラー
シンプソン M.
フリスビーA.
クマール P.
シュワン C.
アクトリーズ K.
ペトリ W.A.
Clostridioides difficile binary toxinはtoll-like receptor 2/6ヘテロダイマーに認識され、核因子κB応答を誘導する。
J. Infect. Dis. 2022; 225: 1296-1300
記事で見る
スコープス (5)
パブコメ
クロスリファレンス
グーグルシュラー
ライアン A.
リンチ・M.
スミス S.M.
アミュ S.
ネル・H.J.
マッコイ C.E.
ダウリングJ.K.
ドレイパー E.
オライリー V.
マッカーシー C.
他
クロストリジウム・ディフィシル感染と表層タンパク質の認識におけるTLR4の役割。
PLoS Pathog. 2011; 7e1002076
記事で見る
スコープス (113)
クロスレフ
Google Scholar
吉野由香里
北澤 毅
池田真一
辰野 圭一
柳本 聡
奥川 聡
四ツ柳秀樹
太田裕之.
Clostridium difficileフラジェリンはtoll-like receptor 5を刺激し、トキシンBはTLR5を介してフラジェリン誘発ケモカイン産生を促進する。
ライフサイエンス 2013; 92: 211-217
記事で見る
スコープス (0)
パブコメ
クロスリファレンス
Google Scholar
バタ J.
ドゥネーブ・ララゼC.
ジョリヴォットP.A.
キューネ S.
コリニョン A.
マルボーJ.C.
カンザウ I.
Clostridium difficileの鞭毛は、上皮細胞においてTLR5と連動したNF-κB経路を優位に活性化する。
Anaerobe. 2016; 38: 116-124
記事で見る
スコープス (0)
パブコメ
クロスリファレンス
Google Scholar
スミス A.B.
ジェニアン・M.L.
キーナン O.
ハートJ.L.
スペッカー J.
アバス・A.
ランジェル P.C.
ディC.
グリーン J.
バスティンK.A.
他
腸球菌はClostridioides difficileの病原性を高める。
Nature. 2022; 611: 780-786
記事で見る
スコープス (8)
パブコメ
クロスリファレンス
グーグルシュラー
ツェピエル J.
ドロジュドM.
ピトゥチ H.
クイパー E.J.
ペルッキ・W.
ミエリモンカ A.
ゴールドマン S.
ヴルタンスカD.
ガルリッキ A.
ビエシアダG.
クロストリジウム・ディフィシル感染症:レビュー。
Eur. J. Clin. Microbiol. Infect. Dis. 2019; 38: 1211-1221
記事で見る
スコープス (224)
パブコメ
クロスリファレンス
Google Scholar
ソン J.H.
Kim Y.S.
再発性Clostridium difficile感染症:危険因子、治療、予防。
Gut Liver. 2019; 13: 16-24
記事で見る
スコープス (0)
パブコメ
クロスリファレンス
Google Scholar
ブッシュマンF.D.
コンラッド M.
レン Y.
Zhao C.
グー C.
ペトゥッチ C.
キム M.S.
Abbas A.
ダウネス K.J.
デバスN.
他。
Clostridioides difficile感染と小児炎症性腸疾患との相互作用に関するマルチオーム解析。
Cell Host Microbe. 2020; 28: 422-433.e7
記事で見る
スコープス (30)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
カストロ=コルドバP.
モラ-ウリベP.
レイエス=ラミレスR.
コフレ・アラネダG.
オロスコ=アギラル J.
ブリト=シルバ C.
メンドーサ=レオン M.J.
キューネ S.A.
ミントン N.P.
ピサロ=グアハルドM.
他
腸管上皮細胞への芽胞の侵入は、Clostridioides difficile感染症の再発に寄与する。
Nat. Commun. 2021; 121140
記事で見る
スコープス (31)
パブコメ
クロスリファレンス
Google Scholar
リーズW.D.
スタイナー T.S.
クロストリジウム・ディフィシル感染に対する適応的免疫反応: 予防と治療への展望。
Eur. J. Immunol. 2018; 48: 398-406
記事で見る
スコープス (14)
パブコメ
クロスリファレンス
Google Scholar
ウィルコックス M.H.
ゲルディングD.N.
ポクストン I.R.
ケリー C.
ネイサンR.
バーチ T.
コーネリーO.A.
ラハブG.
ブーザ E.
リーC.
ら。
クロストリジウム・ディフィシル感染症の再発予防のためのベズロトクスマブ。
N. Engl. J. Med. 2017; 376: 305-317
記事で見る
スコープス (514)
パブコメ
クロスリファレンス
グーグルシュラー
グプタ S.
アレン=ヴァーコー E.
ペトロフE.O.
糞便微生物移植:展望する。
Therap. Adv. Gastroenterol. 2016; 9: 229-239
記事で見る
スコープス (224)
パブコメ
クロスリファレンス
Google Scholar
マクドナルド L.C.
ゲルディングD.N.
ジョンソンS.
ら。
成人および小児におけるクロストリジウム・ディフィシル感染症の診療ガイドライン:米国感染症学会(IDSA)および米国医療疫学会(SHEA)による2017年アップデート。
Clin. Infect. Dis. 2018; 66: e1-e48
記事で見る
スコープス (1190)
パブコメ
クロスリファレンス
Google Scholar
ケリーC.R.
フィッシャー・M.
アレグレットティ J.R.
ラプランテK.
スチュワートD.B.
リムケットカイ B.N.
ストールマンN.H.
ACG臨床ガイドライン:Clostridioides difficile感染症の予防、診断、および治療。
Am. J. Gastroenterol. 2021; 116: 1124-1147
記事で見る
スコープス (112)
パブコメ
クロスリファレンス
グーグルシュラー
Food and Drug Administration(食品医薬品局
標準治療に反応しないクロストリジオイデスディフィシル感染症を治療するための移植用糞便微生物群の使用に関する治験薬要件に関する施行方針について
2022
https://www.fda.gov/media/86440/download
記事で見る
グーグルシュラー
Food and Drug Administration(食品医薬品局
FDAが初の糞便微生物学製品を承認
2022
https://www.fda.gov/news-events/press-announcements/fda-approves-first-fecal-microbiota-product?fbclid=IwAR2We_37cYnGLOcVcU2dY7mTfQ6q5ROmEIZovtVM1ukgNP-pivg0zvgybws
記事で見る
グーグルシュラー
クライシ M.N.
ウィドラックM.
バーラ N.
ムーア D.
プライス M.
シャルマ N.
Iqbal T.H.
メタアナリシスによる系統的レビュー:再発性および難治性のクロストリジウム・ディフィシル感染症の治療に対する糞便微生物移植の有効性。
Aliment. Pharmacol. Ther. 2017; 46: 479-493
記事で見る
スコープス (367)
パブコメ
クロスリファレンス
Google Scholar
パラムソティ S.
カームM.A.
カアコウシュN.O.
ウォルシュ A.J.
ヴァン・デン・ボガエルデJ.
サミュエル・D.
レオン・R.W.L.
コナー・S.
ウン・W.
パラムソティR.
ら。
活動性潰瘍性大腸炎に対するマルチドナー集中糞便微生物移植:無作為化プラセボ対照試験。
Lancet. 2017; 389: 1218-1228
記事で見る
スコープス (753)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
コステロS.P.
ヒューズ・P.A.
ウォーターズ O.
ブライアント R.V.
ヴィンセントA.D.
ブラッチフォードP.
カティケロスR.
マカニャンガJ.
カンパニエッロM.A.
マヴランゲロスC.
他
潰瘍性大腸炎患者の8週間寛解に対する糞便微生物移植の効果: 無作為化臨床試験。
JAMA. 2019; 321: 156-164
記事で見る
スコープス(415)
パブコメ
クロスリファレンス
Google Scholar
マーズ T.
ウォルター・J.
. 賛否両論:糞便微生物叢移植は腸内細菌異常症の安全で効率的な治療法なのか?
Allergy. 2021; 76: 2312-2317
記事で見る
スコープス (8)
パブコメ
クロスリファレンス
グーグルシュラー
藤本和彦.
木村陽子
アレグレットティ J.R.
山本真一
チャン・Y.Z.
片山 圭一
トレンメル G.
カワグチヨシ
下樋口雅彦
ハヤシ・タケシ
他.
糞便微生物叢移植によるバクテリオームとビロームの機能回復.
胃腸病学. 2021; 160: 2089-2102.e12
記事で見る
パブコメ
アブストラクト
全文表示
全文PDF
グーグルシュラー
Zuo T.
ウォン・S.H.
ラム・K.
Lui R.
Cheung K.
Tang W.
Ching J.Y.L.
チャン・P.K.S.
チャン・M.C.W.
ウー・J.C.Y.
et al.
クロストリジウム・ディフィシル感染症における糞便微生物叢移植時のバクテリオファージ移行は治療成績と関連する。
Gut. 2018; 67: 634-643
記事で見る
パブコメ
グーグルシュラー
Zuo T.
ウォン・S.H.
Cheung C.P.
ラム K.
Lui R.
Cheung K.
Zhang F.
Tang W.
Ching J.Y.L.
ウー J.C.Y.
et al.
腸内細菌異常症は、Clostridium difficile感染症における糞便微生物移植の有効性低下と相関する。
Nat. Commun. 2018; 93663
記事で見る
スコープス (130)
クロスリファレンス
Google Scholar
フエンテス S.
ファン・ヌードE.
ティムス S.
ハイカンプ・デ・ヨング I.
テルブラークC.J.
ケラー・J.J.
ゾーテンダール E.G.(Zoetendal E.G.
de Vos W.M.
危機的に乱れた微生物生態系のリセット:再発性クロストリジウム・ディフィシル感染症における糞便移植。
ISME J. 2014; 8: 1621-1633
記事で見る
スコープス (135)
パブコメ
クロスリファレンス
Google Scholar
シーカッツ A.M.
アアス J.
ゲゼルC.E.
ルービン・T.A.
サマンD.M.
バッケン J.S.
ヤング V.B.
糞便微生物叢移植後の腸内細菌叢の回復。
mBio. 2014; 5 (e00893-e00814)
記事で見る
スコープス (220)
パブコメ
クロスリファレンス
Google Scholar
ケリングレイL.
ギャルG.L.
デフェルネズ M.
ビールズ I.L.P.
フランスレム=エルモゴ N.
ナルバド A.
クロストリジウム・ディフィシル感染症治療のための糞便微生物移植における微生物の分類学的および代謝学的変化。
J. Infect. 2018; 77: 107-118
記事で見る
スコープス (24)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ブラウン J.R.
フレマー B.
ジョイス S.A.
ズルケナイン A.
シーハン D.
シャナハン F.
O'Toole P.W.
Clostridioides difficile感染症に対する糞便微生物移植の成功による微生物叢組成、胆汁および脂肪酸の代謝の変化。
BMC Gastroenterol. 2018; 18131
記事で見る
スコープス (50)
パブコメ
クロスリファレンス
Google Scholar
アッガーワラ V.
モグノ I.
リー Z.
ヤン C.
ブリトン G.J.
チェン・リアウ・A.
ミッチャム J.
ボンガースG.
ゲヴァースD.
クレメンテJ.C.
et al.
糞便微生物移植後の細菌株の正確な定量化により、長期生着が明らかになり、転帰が説明できる。
Nat. Microbiol. 2021; 6: 1309-1318
記事で見る
スコープス (29)
パブコメ
クロスリファレンス
Google Scholar
アジミラッドM.
ジョ Y.
キム M.S.
Jeong M.
シャーロク・S.
アサドザデ・アグダイ・H.
ザリ M.R.
リー・S.
ヤデガーA.
シン・J.H.
炎症性腸疾患を背景にしたイラン人再発性Clostridioides difficile感染症に対する糞便微生物移植後の腸内細菌叢の機能プロファイルの変化と予測: パイロットスタディ。
J. Inflamm. Res. 2022; 15: 105-116
記事で見る
スコープス (7)
パブコメ
クロスリファレンス
グーグルシュラー
ポドルスニーD.
アーゼ C.
ドーナーE.
ヴェルマ S.
ダッタ S.
ウォルター J.
Fricke W.F.
SameStrを用いたメタゲノム菌株検出:糞便移植により移行可能な持続的コア腸内細菌叢の同定。
Microbiome. 2022; 1053
記事で見る
スコープス (7)
パブコメ
クロスリファレンス
グーグルシュラー
マルティネス I.
マルドナド-ゴメス M.X.
ゴメス-ネトJ.C.
キッタナ H.
ディン・エイチ
シュマルツR.
ジョグルカーP.
カルドナR.J.
マーステラーN.L.
ケンベルS.W.
他
早期の腸内細菌叢形成におけるコロニー形成履歴の重要性を実験的に評価した。
eLife. 2018; 7e36521
記事で見る
スコープス (94)
クロスリファレンス
グーグルシュラー
スミリー・C.S.
サウクJ.
ゲバースD.
フリードマンJ.
ソンJ.
ヤングスター I.
ホーマン E.L.
ステイリーC.
コルッツA.
サドウスキー M.J.
他
糞便微生物移植後のヒト腸内細菌生着の決定要因を菌株追跡で明らかにした。
Cell Host Microbe. 2018; 23: 229-240.e5
記事で見る
スコープス (187)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
シュコポーロフ A.N.
ヒル C.
ヒト腸内細菌のバクテリオファージ:マイクロバイオームの「既知の未知」。
セルホストマイクロベ。2019; 25: 195-209
記事で見る
スコープス (261)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
レイエス A.
ヘインズM.
ハンソン N.
アングリーF.E.
ヒースA.C.
ローワー F.
ゴードン・J.I.
一卵性双生児とその母親の糞便微生物叢に含まれるウイルス。
Nature. 2010; 466: 334-338
記事で見る
スコープス (817)
パブコメ
クロスリファレンス
Google Scholar
リム・イーエス
Zhou Y.
Zhao G.
バウアー I.K.
ドロワ・L.
ンダオ I.M.
ワーナー・B.B.
タール P.I.
ワン・ディー
ホルツ・L.R.
乳児におけるヒト腸内ウイルスと細菌マイクロバイオームの初期生育ダイナミクス。
Nat. Med. 2015; 21: 1228-1234
記事で見る
スコープス (374)
パブコメ
クロスリファレンス
Google Scholar
シュー B.B.
ギブソン・T.E.
イェリセーエフ V.
リュウ Q.
リオン L.
ブライ L.
シルバーP.A.
Gerber G.K.
マウスモデルにおけるバクテリオファージによる腸内細菌叢とメタボロームの動的変調。
Cell Host Microbe. 2019; 25: 803-814.e5
記事で見る
スコープス (222)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
レイエス V.
ウー・M.
マクナルティN.P.
ローワー・F.L.
ゴードン・J.I.
ヒト腸内におけるファージ-細菌宿主動態のGnotobioticマウスモデル。
Proc. Natl. Acad. Sci. USA. 2013; 110: 20236-20241
記事で見る
スコープス (218)
パブコメ
クロスリファレンス
Google Scholar
キャンベル D.E.
ライ・L.K.
リドロンJ.M.
Hsiao A.
ウィテカー R.J.
デグナン P.H.
バクテロイデスファージBV01の感染により、ヒト共通の腸内微生物における宿主のトランスクリプトームおよび胆汁酸代謝が変化する。
セル・リップ 2020; 32108142
記事で見る
スコープス (15)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
エドワーズ R.A.
ベガA.A.
ノーマン・H.M.
オハエリ・M.
レヴィ K.
ディンズデールE.A.
シネック O.
アジズR.K.
マクネア K.
バー・J.J.
他
広範なヒト腸管ウイルスcrAssphageのグローバル系統地理学と古代進化。
Nat. Microbiol. 2019; 4: 1727-1736
記事で見る
スコープス (109)
パブコメ
クロスリファレンス
Google Scholar
ドレイパー L.A.
ライアン F.J.
スミス・M.K.
ジャランカ J.
マッティラ E.
アークキラ P.A.
ロスR.P.
サトカリR.
ヒル C.
糞便微生物移植成功後のドナーバクテリオファージによる長期コロニー形成。
Microbiome. 2018; 6220
記事で見る
スコープス (77)
クロスリファレンス
Google Scholar
シラノシアンB.A.
タンブリーニF.B.
シャーロックG.
Bhatt A.S.
ヒト腸内常在菌CrAss様ファージの獲得、伝播および菌株多様性。
Nat. Commun. 2020; 11280
記事で見る
Google Scholar
オット S.J.
ウェッツィッヒ・G.H.
レーマンA.
モルツァウ・アンダーソンJ.
バーティ R.
グラシスJ.A.
キャシディL.
トーリーA.
フィッケンシャーH.
ゼーガートD.
他
クロストリジウム・ディフィシル感染症患者の治療における無菌糞便濾過液の移送の有効性。
Gastroenterology. 2017; 152: 799-811.e7
記事で見る
スコープス (393)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ネール J.Y.
レッドグウェル T.A.
ミラード A.
Clokie M.R.J.
バッチ発酵モデルにおけるClostridium difficile除去のための最適化されたバクテリオファージカクテルの有効性。
アンチバイオティクス(バーゼル)。2018; 713
記事で見る
パブコメ
Google Scholar
ミーダー E.
メイヤーM.J.
ステバーディング D.
カーディングS.R.
ナルバド A.
In vitroヒト結腸モデル系におけるClostridium difficileおよび毒素産生を制御するためのバクテリオファージ療法の評価。
Anaerobe. 2013; 22: 25-30
記事で見る
スコープス (60)
パブコメ
クロスリファレンス
Google Scholar
ダラーリ S.
ヒーニーT.
ロサス=ビレガス A.
ニール・J.A.
ウォン・S.Y.
ブラウン J.J.
ウルバネク K.
ハーマン C.
デプレッジ D.P.
ダーモディT.S.
et al.
腸管ウイルスは、細菌マイクロバイオームが引き起こす免疫反応に似た広範な宿主免疫反応を引き起こす。
Cell Host Microbe. 2021; 29: 1014-1029.e8
記事で見る
スコープス (19)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
キャンベル D.E.
ボールドリッジ M.T.
腸管ウイルスは免疫調節のニッチをつかむ。
セルホストマイクロベ。2021; 29: 858-861
記事で見る
スコープス (0)
パブコメ
アブストラクト
全文表示
全文PDF
グーグルシュラー
ヤン J.Y.
キム M.S.
キム E.
Cheon J.H.
Lee Y.S.
キム・Y.
Lee S.H.
Seo S.U.
シン・S.H.
Choi S.S.
et al.
腸管ウイルスは、toll様受容体3およびtoll様受容体7を介したインターフェロン-β産生を介して腸の炎症を改善させる。
Immunity. 2016; 44: 889-900
記事で見る
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ハレン-アダムズ H.E.
スール M.J.
健康なヒトの胃腸管における真菌。
Virulence. 2017; 8: 352-358
記事で見る
スコープス(247)
パブコメ
クロスリファレンス
Google Scholar
ソコル H.
ルドゥックV.
アシャール H.
ファムH.P.
ジェグーS.
ランドマンC.
コーエン D.
リグオリG.
ブーリエA.
ニオン=ラルムリエI.
ら。
IBDにおける真菌性微生物叢の異常。
Gut. 2017; 66: 1039-1048
記事で見る
スコープス (688)
パブコメ
クロスリファレンス
Google Scholar
ガルシア-ガンボアR.
キルヒマイヤーM.R.
グラディラ=ヘルナンデスM.S.
ペレス-ブロカル V.
モヤ A.
ゴンサレス-アビラ M.
腸内細菌叢と過体重、肥満および栄養面との関係。
J. Hum. Nutr. Diet. 2021; 34: 645-655
記事で見る
スコープス (5)
パブコメ
クロスリファレンス
グーグルシュラー
カゼミアンN.
ラメザンクハニM.
セガール A.
カリードF.M.
カルクホランA.H.Z.
ナラヤンA.
ウォン・G.K.
カオ・D.
パクプール S.
ドナーとレシピエントの腸内細菌叢の王国を超えた戦いが糞便微生物移植の結果に影響する。
Sci. Rep. 2020; 1018349
記事で見る
スコープス (15)
パブコメ
クロスリファレンス
グーグルシュラー
ベルマンE.
カールセン T.
ブロッホマン C.
コワサック E.
タベレP.
Kauserud H.
真菌の環境DNAバーコードとしてのITS:インシリコアプローチにより、潜在的なPCRバイアスが明らかになった。
BMC Microbiol. 2010; 10189
記事で見る
スコープス (694)
パブコメ
クロスリファレンス
グーグルシュラー
ギャロウェイ-ペーニャJ.R.
コントワイアニス D.P.
腸内マイコバイオーム:癌やその他の免疫抑制状態にある患者の臨床結果と治療合併症の見落とされた構成要素。
PLoS Pathog. 2020; 16e1008353
記事で見る
スコープス (18)
パブコメ
クロスリファレンス
グーグルシュラー
イスラム K.B.
蕗谷 悟
萩尾望都
藤井直樹
石塚聡
大岡 毅
小倉康夫.
林 毅
横田 晃。
胆汁酸はラットの腸内細菌叢の組成を制御する宿主因子である。
Gastroenterology. 2011; 141: 1773-1781
記事で見る
スコープス (616)
パブコメ
アブストラクト
全文表示
全文PDF
グーグルシュラー
北原幹雄
高嶺史朗
今村太一
ベノ Y.
高い胆汁酸7α-脱水素活性を有するEubacterium sp. VPI 12708および関連株をClostridium scindensに帰属させ、ヒト糞便から分離したClostridium hylemonae sp.nov.
Int. J. Syst. Evol. Microbiol. 2000; 50: 971-978
記事で見る
パブコメ
クロスリファレンス
グーグルシュラー
ウェルズ J.E.
ハイレモンP.B.
ヒト糞便から分離した高活性7α-デヒドロキシル化株Clostridium sp. TO-931株における胆汁酸7α-デヒドロキシル化オペロンの同定と特徴づけ。
Appl. Environ. Microbiol. 2000; 66: 1107-1113
記事で見る
スコープス (116)
パブコメ
クロスリファレンス
グーグルシュラー
クイン・R.A.
メルニクA.V.
ヴルバナックA.
フー T.
パトラスK.A.
クリスティ M.P.
ボダイ Z.
ベルダ=フェールP.
トリパティ A.
チョンL.K.
et al.
微生物がもたらすグローバルな化学的影響には、新しい胆汁酸の結合が含まれる。
Nature. 2020; 579: 123-129
記事で見る
スコープス (198)
パブコメ
クロスリファレンス
Google Scholar
フランシス M.B.
アレンC.A.
シュレスタR.
ソルグ J.A.
Clostridium difficileの生殖細胞受容体であるCspCによる胆汁酸の認識は、感染の確立に重要である。
PLOS Pathog. 2013; 9e1003356
記事で見る
スコープス (182)
クロスリファレンス
Google Scholar
ソルグ J.A.
ソネンシャインA.L.
Clostridium difficile芽胞のコガーミン物質としての胆汁酸塩とグリシン。
J. Bacteriol. 2008; 190: 2505-2512
記事で見る
スコープス (467)
パブコメ
クロスリファレンス
グーグルシュラー
ソルグ J.A.
ソネンシャインA.L.
胆汁酸の一種であるチェノデオキシコール酸のアナログを用いたClostridium difficile胞子の発芽開始の阻害作用。
J. Bacteriol. 2010; 192: 4983-4990
記事で見る
スコープス (232)
パブコメ
クロスリファレンス
グーグルシュラー
マリシュ・B.H.
アレグレッティJ.R.
Clostridioides difficile感染症の病態における胆汁酸代謝の寄与について
Therap. Adv. Gastroenterol. 2021; 1417562848211017725
記事で見る
スコープス (17)
パブコメ
クロスリファレンス
Google Scholar
タニセリー R.
ウィンストン・J.A.
セリオット C.M.
腸内細菌叢由来の二次胆汁酸による臨床関連C. difficile株の胞子発芽、増殖、毒素活性の阻害作用。
Anaerobe. 2017; 45: 86-100
記事で見る
スコープス (113)
パブコメ
クロスリファレンス
Google Scholar
アレグレットティ J.R.
カーニーS.
リー・N.
ボガート E.
ブロック K.
ガーバー G.K.
ブライ L.
クリッシュ C.B.
アルム E.
Korzenik J.R.
Clostridium difficile感染症の再発は、異なる胆汁酸およびマイクロバイオームプロファイルと関連する。
Aliment. Pharmacol. Ther. 2016; 43: 1142-1153
記事で見る
パブコメ
クロスリファレンス
Google Scholar
ワインガーデンA.R.
ドーサ・P.I.
デウィンター E.
ステア C.J.
シャウネッシー M.K.
ジョンソン J.R.
コルッツ A.
サドウスキー M.J.
便微生物移植後の大腸胆汁酸組成の変化は、Clostridium difficileの発芽と増殖を制御するのに十分である。
PLoS One. 2016; 11e0147210
記事で見る
スコープス (104)
パブコメ
クロスリファレンス
Google Scholar
マリシュ・B.H.
マクドナルドJ.A.K.
ペクリバニスA.
アレグレットティ J.R.
カオ D.
バーカーG.F.
カピラ D.
ペトロフ E.O.
ジョイス S.A.
ガハン C.G.M.
他
胆汁酸ヒドロラーゼは、再発性Clostridioides difficile感染症の治療における糞便微生物叢移植の有効性を媒介する。
Gut. 2019; 68: 1791-1800
記事で見る
スコープス (130)
パブコメ
クロスリファレンス
グーグルシュラー
バフィー C.G.
ブッチV.
スタイン R.R.
マッケニー・P.T.
リン L.
ゴボーン A.
リュー H.
キネブリューM.
ヴィアレA.
ら。
精密なマイクロバイオーム再構成により、クロストリジウム・ディフィシルに対する胆汁酸を介した抵抗性が回復した。
Nature. 2015; 517: 205-208
記事で見る
スコープス (1133)
パブコメ
クロスリファレンス
グーグルシュラー
カン・J.D.
マイヤーズC.J.
ハリスS.C.
カキヤマ・ジー
リー・I.K.
Yun B.S.
マツザキ・ケイ
Furukawa M.
Min H.K.
Bajaj J.S.
他
胆汁酸7α-デヒドロキシル化腸内細菌はClostridium difficileを抑制する抗生物質を分泌する:二次胆汁酸の役割。
セル・ケム. Biol. 2019; 26: 27-34.e4
記事で見る
スコープス (93)
パブコメ
アブストラクト
全文表示
全文PDF
グーグルシュラー
モナハン T.
マリシュ・B.H.
パターソン J.
ウォン・G.K.
マルケージ・J.R.
シュー・エイチ
ジラニ T.
Kao D.
ヒトの再発性Clostridioides difficile感染症に対する有効な糞便微生物叢移植は、胆汁酸-ファルネソイドX受容体-線維芽細胞増殖因子経路におけるシグナル伝達の増加と関連している。
Gut Microbes. 2019; 10: 142-148
記事で見る
スコープス (32)
パブコメ
クロスリファレンス
Google Scholar
サイイン・S.I.
ワールストレム A.
フェリン J.
ヤンティ S.
マルシャル H.U.
バンベルク K.
アンジェリン B.
ヒョーティライネンT.
オレシッチ M.
Bäckhed F.
腸内細菌叢は、天然由来のFXRアンタゴニストであるタウロ-β-ムリコール酸のレベルを低下させることにより胆汁酸代謝を調節している。
Cell Metab. 2013; 17: 225-235
記事で見る
スコープス (1394)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
アギーレ A.M.
ヤルシンカヤN.
ウー Q.
スウェンズA.
テシエ M.E.
ロバーツ P.
ミヤジマ F.
サビッジ T.
ソルグ J.A.
Clostridioides difficile感染に対する胆汁酸非依存的な保護。
PLoS Pathog. 2021; 17e1010015
記事で見る
スコープス (20)
パブコメ
クロスリファレンス
Google Scholar
ギリナサンB.P.
ディベネデットN.
ウォーリー・J.N.
ペルティエ J.
アリエッタ=オルティス M.L.
インマヌエル S.R.C.
ラヴィンR.
デラニーM.L.
カミンズC.K.
ホフマンM.
他
Clostridioides difficileの病原性を生体内で制御する。
Cell Host Microbe. 2021; 29: 1693-1708.e7
記事で見る
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
セリオット C.M.
ケーニヒスクネヒトM.J.
カールソンJr.P.E.
ハットンG.E.
ネルソン・A.M.
リーB.
ハフナグル G.B.
Z Li J.
ヤング V.B.
マウス腸内細菌叢とメタボロームにおける抗生物質誘発性のシフトは、Clostridium difficile感染への感受性を高める。
Nat. Commun. 2014; 53114
記事で見る
スコープス (597)
パブコメ
クロスリファレンス
Google Scholar
シーカッツ A.M.
セリオットC.M.
ラオ・K.
チャン・Y.M.
フリーマン A.E.
カオ・J.Y.
Young V.B.
再発性Clostridium difficile感染症患者における糞便微生物移植後の短鎖脂肪酸および胆汁酸代謝の回復。
Anaerobe. 2018; 53: 64-73
記事で見る
スコープス (97)
パブコメ
クロスリファレンス
Google Scholar
マルタン-ガラウシアオC.
マリネッリL.
ブロッティエール H.M.
ララウフィP.
ラパック N.
SCFA:腸管におけるメカニズムと機能的重要性。
Proc. ニュートロジー学会 2021; 80: 37-49
記事で見る
スコープス (234)
パブコメ
クロスリファレンス
グーグルシュラー
ファチ J.L.
フェリペ・J.S.
プラールL.P.
ダ・シルヴァB.K.
コレーアR.O.
デ・アンドラーデM.C.P.
ダ・フォンセカD.M.
バッソ P.J.
カマラ N.O.S.
デ・セールス・E・ソウザ É.L.
et al.
酪酸はHIF-1依存的なメカニズムを通じてClostridium difficile誘発性大腸炎からマウスを保護する。
セル・レップ 2019; 27: 750-761.e7
記事で見る
スコープス (148)
パブコメ
アブストラクト
全文表示
全文PDF
グーグルシュラー
アルパイア N.
キャンベルC.
ファン X.
ディキイS.
ヴァン・デル・ヴィーケンJ.
デローズP.
リュウ H.
クロス J.R.
プフェッファーK.
コファーP.J.
他
常在菌が産生する代謝産物は、末梢制御性T細胞の生成を促進する。
Nature. 2013; 504: 451-455
記事で見る
スコープス (2716)
パブコメ
クロスリファレンス
Google Scholar
マルティネス=ギリ L.
マクドナルド・J.A.K.
リュウ・Z.
カオ・D.
アレグレットティJ.R.(Allegretti J.R.
モナハン T.M.
バーカー G.F.
ミグエンス・ブランコ J.
ウィリアムズ H.R.T.
ホームズ E.
他
再発性Clostridioides difficile感染症の治療における糞便微生物移植の有効性のメカニズムの解明とその先:腸内細菌由来の代謝物の寄与。
Gut Microbes. 2020; 121810531
記事で見る
スコープス (25)
パブコメ
クロスリファレンス
Google Scholar
マクドナルド J.A.K.
マリシュ・B.H.
ペクリバニスA.
リュウ・Z.
ブリニャーデロ J.
カオ D.
ホームズ E.
リー J.V.
クラーク・T.B.
サーズM.R.
ら。
腸内細菌叢から産生されるバレラートの回復によるClostridioides difficileの増殖抑制.
Gastroenterology. 2018; 155: 1495-1507.e15
記事で見る
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
スン X.
廣田 聡明
Clostridium difficile感染症の発症における宿主・病原体因子および自然免疫応答の役割について。
Mol. Immunol. 2015; 63: 193-202
記事で見る
スコープス (0)
パブコメ
クロスリファレンス
グーグルシュラー
クライラット A.S.
ブオノモE.L.
スカリーK.W.
ホレンビークC.S.
クック H.
ペトリ W.A.
Stewart D.B.
クロストリジウム・ディフィシル感染症で入院した末梢性好酸球減少症患者における死亡率と有害転帰の予測モデルの開発と検証。
JAMA Surg. 2018; 153: 1127-1133
記事で見る
スコープス (36)
パブコメ
クロスリファレンス
グーグルシュラー
カワーディン C.A.
ブオノモ E.L.
サレーM.M.
ウィルソン・M.G.
バージェスS.L.
キューネS.A.
シュワン C.
アイヒホフ A.M.
コッホ=ノルテF.
ライラスD.
他
バイナリー毒素CDTは、保護的な大腸好酸球を抑制することにより、Clostridium difficileの病原性を増強する。
Nat. Microbiol. 2016; 116108
記事で見る
スコープス (112)
パブコメ
クロスリファレンス
Google Scholar
ブオノモ E.L.
カワーディンC.A.
ウィルソン・M.G.
サレーM.M.
プラムーンジャゴ P.
ペトリ W.A.
微生物が制御するIL-25は、クロストリジウム・ディフィシル感染時に好酸球数を増加させて保護を提供する。
セル・レップ 2016; 16: 432-443
記事で見る
スコープス (81)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ヤン・N.
ヘイズR.A.
オークランドD.N.
クマールP.
ラマクリシュナンG.
ベームB.W.
ペトリW.A.
マリー C.
糞便微生物叢移植は、再発性Clostridioides difficile患者において、大腸IL-25を増加させ、組織炎症を減衰させる。
mSphere. 2021; 6e0066921
記事で見る
スコープス (3)
パブコメ
クロスリファレンス
Google Scholar
フリスビー A.L.
サレーM.M.
ヤングM.K.
レスリーJ.L.
シンプソンM.E.
アビャンカーM.M.
カワーディン・C.A.
マ J.Z.
プラモンジャゴP.
ターナーS.D.
他
IL-33は、クロストリジウム・ディフィシル感染時のグループ2自然リンパ球を介した防御を駆動する。
Nat. Commun. 2019; 102712
記事で見る
スコープス (64)
パブコメ
クロスリファレンス
Google Scholar
リットマン E.R.
リーJ.J.
デニーJ.E.
アラムZ.
マスランカJ.R.
ザリン I.
マツダ R.
カーターR.A.
スサック B.
サファーンM.S.
他
宿主免疫は、Clostridioides difficile感染症の治療に対する微生物叢移植の有効性を調節する。
Nat. Commun. 2021; 12755
記事で見る
スコープス (23)
クロスリファレンス
Google Scholar
クック・L.
シュタール M.
ハン X.
ナズリ A.
マクドナルド・K.N.
ウォン・M.Q.
ツァイ K.
ディゼル S.
ジェイコブソン K.
ブレスラーB.
他
ヒト1型T制御細胞の抑制的および腸管修復的機能。
Gastroenterology. 2019; 157: 1584-1598
記事で見る
スコープス (0)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ヘップリ・R.E.
ウー・D.
クック・L.
レヴィングス M.K.
制御性T細胞生物学の環境:サイトカイン、代謝産物、およびマイクロバイオーム。
Front. Immunol. 2015; 661
記事で見る
スコープス (105)
パブコメ
クロスリファレンス
グーグルシュラー
エルナンデス・デル・ピノ R.E.
バルベロ A.M.
エスパニョールL.Á.
モロ・L.S.
パスキネリ V.
Clostridioides difficileに対する適応的免疫反応: 免疫防御と免疫病態の間の微妙なバランス。
J. Leukoc. 2021; 109: 195-210
記事で見る
スコープス (3)
パブコメ
クロスリファレンス
グーグルシュラー
クック L.
リーズW.D.
ウォン・M.Q.
クオック・W.W.
レヴィングス M.K.
Steiner T.S.
Clostridioides difficile感染症の再発は、C difficile毒素Bに対するTヘルパー17型免疫の障害と関連している。
Gastroenterology. 2021; 160: 1410-1413.e4
記事で見る
スコープス (4)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
クック L.
リーズW.D.
ウォン・M.Q.
ピーターズ H.
レヴィングス M.K.
スタイナー T.S.
再発性Clostridioides difficile感染症に対する糞便微生物叢移植は、C difficile毒素Bに対する適応免疫を増強する。
Gastroenterology. 2021; 160: 2155-2158.e4
記事で見る
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
モナハン T.M.
ドゥグガル N.A.
ロザティ E.
グリフィン・R.
ヒューズ J.
ローチ B.
ヤン D.Y.
ワン・C.
ウォン K.
サクシンガーL.
他
医学的難治性のClostridioides difficile感染症患者における糞便微生物逐次移植に関する多因子観察試験。
Cells. 2021; 103234
記事で見る
スコープス (5)
パブコメ
クロスリファレンス
Google Scholar
モナハン T.M.
シーカッツA.M.
マーカムN.O.
ヤウ T.O.
ハツィアポストルーM.
ジラニ T.
クリストドゥルーN.
ローチ B.
ビルリ E.
ポメニア O.
et al.
再発性Clostridioides difficile感染症に対する糞便微生物叢移植は、循環マイクロRNAの機能変化と関連している。
Gastroenterology. 2021; 161: 255-270.e4
記事で見る
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
モナハン T.M.
ポリターチョーC.
カオ D.
アレクサンダーC.
Gurnani P.
Clostridioides difficile感染症におけるmiRNAの治療可能性。
Future Microbiol. 2022; 17: 315-318
記事で見る
スコープス (0)
パブコメ
クロスリファレンス
Google Scholar
ローリーT.D.
クレア・S.
ウォーカーA.W.
スタアーズM.D.
コナーT.R.
ライセンC.
グールディング D.
ラド R.
シュライバー F.
ブラントC.
et al.
シンプルで明確な細菌療法による腸内細菌叢の標的化修復は、マウスの再発性クロストリジウム・ディフィシル病を解決する。
PLoS Pathog. 2012; 8e1002995
記事で見る
スコープス (387)
パブコメ
クロスリファレンス
Google Scholar
フォイアシュタットP.
ルーイ T.J.
ラシュナー B.
ワン・E.E.L.
ディアオ・L.
ブライアント J.A.
シムズ M.
クラフト C.S.
コーエンS.H.
ベレンソンC.S.
他
再発性クロストリジオイデスディフィシル感染症に対する経口マイクロバイオーム療法、SER-109。
N. Engl. J. Med. 2022; 386 (ser): 220-229
記事で見る
スコープス (76)
パブコメ
クロスリファレンス
Google Scholar
カオ D.
ウォン・K.
フランツ・R.
コクレーンK.
シェリフK.
チュイ L.
ロイド C.
ローチ B.
バイ・A.D.
ペトロフE.O.
et al.
微生物生態系治療薬(MET-2)の再発性Clostridioides difficile感染に対する効果:第1相、非盲検、単一グループ試験。
Lancet Gastroenterol. Hepatol. 2021; 6: 282-291
記事で見る
スコープス (24)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ラメッシュV.
フラリック・J.A.
Rolfe R.D.
バクテリオファージによるClostridium difficile -induced ileocecitisの予防。
Anaerobe. 1999; 5: 69-78
記事で見る
スコープス (61)
クロスリファレンス
Google Scholar
ロスチャイルドD.
ワイスブロッド O.
バーカンE.
クリルシコフA.
コレム T.
ゼーヴィ D.
コステア P.I.
ゴドネバA.
カルカ I.N.
バーN.
他
ヒトの腸内細菌叢を形成する上で、宿主の遺伝学よりも環境が優位に立つ。
ネイチャー(Nature)。2018; 555: 210-215
記事で見る
スコープス (1385)
パブコメ
クロスリファレンス
グーグルシュラー
パーカー A.
ロマーノS.
アンソージュR.
アボエルヌールA.
ル・ガールG.
サヴァG.M.
ポンティフェックスM.G.
テラティンA.
ベーカー D.
ジョーンズ E.
et al.
若齢マウスと高齢マウスの間の糞便微生物叢の移行は、腸、眼、脳の老化の特徴を逆転させる。
Microbiome. 2022; 1068
記事で見る
スコープス (36)
クロスリファレンス
Google Scholar
ヤン C.
モグノ I.
コンティジョック E.J.
ボーガーディングJ.N.
アッガーワラ V.
リー Z.
シウ S.
グラセット E.K.
ヘルマスD.S.
ダビンスキーM.C.
et al.
糞便中IgA濃度はBacteroides ovatusの菌株レベルの違いによって決定され、腸内細菌叢の操作によって修正可能である。
Cell Host Microbe. 2020; 27: 467-475.e6
記事で見る
スコープス (87)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ウォルター・J.
アーメットA.M.
フィンレイB.B.
シャナハン F.
腸内細菌叢の因果関係の確立または誇張:ヒト微生物関連齧歯類からの教訓。
Cell. 2020; 180: 221-232
記事で見る
スコープス (226)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ロッセン N.G.
フエンテス S.
ヴァン・デル・スペックM.J.
ティッセン・J.G.(Tijssen J.G.
ハートマンJ.H.
デュフルーA.
レーウェンベルグM.
ファンデンブリンクG.R.
マトゥス=ヴリーゲン E.M.
デ・ヴォスW.M.
他
潰瘍性大腸炎患者に対する糞便移植のランダム化比較試験による所見。
Gastroenterology. 2015; 149: 110-118.e4
記事で見る
スコープス (668)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
モアイェディ・P.
スレットM.G.
キム・P.T.
リベルトゥッチJ.
ウォルフェ M.
オニスキ C.
アームストロング D.
マーシャル J.K.
カッサムZ.
ライニシュ W.
ら。
無作為化比較試験において、活動性潰瘍性大腸炎患者において、便微生物移植が寛解を誘導した。
Gastroenterology. 2015; 149: 102-109.e6
記事で見る
スコープス (1012)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ホルヴォート T.
ヨーセンズ M.
ヴァスケス=カステジャーノス J.F.
クリスティアンス E.
ヘイリック・L.
ボーレンス J.
バーハッセルト B.
ファン・ヴリエルベルヘH.
デ・ヴォス M.
レーズJ.
et al.
便微生物移植は、腹部膨満感を主とする過敏性腸症候群の一部の患者において症状を軽減する:プラセボ対照無作為化試験の短期および長期の結果である。
Gastroenterology. 2021; 160: 145-157.e8
記事で見る
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
エルサルヒーM.
ハトレバクJ.G.
ギルヤO.H.
ブローセン・クリストファーセン A.
Hausken T.
過敏性腸症候群患者に対する糞便微生物移植の有効性を無作為化二重盲検プラセボ対照試験で検証した。
Gut. 2020; 69: 859-867
記事で見る
スコープス (208)
パブコメ
クロスリファレンス
Google Scholar
アロニアディスO.C.
ブラント・L.J.
オネトC.
フォイアスタットP.
シャーマンA.
ウォルコフA.W.
カッサムZ.
サドフスキーR.G.(Sadovsky R.G.
エリオットR.J.
ブドリー・S.
他
下痢を主訴とする過敏性腸症候群に対する便微生物移植:二重盲検無作為化プラセボ対照試験。
Lancet Gastroenterol. Hepatol. 2019; 4: 675-685
記事で見る
スコープス (81)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
ハルキア S.I.
クリステンセン A.H.
ロー B.Z.S.
ブラウン・P.D.(Browne P.D.
ギュンターS.
ハンセン L.H.
Petersen A.M.
過敏性腸症候群患者において、糞便微生物移植は腸内細菌叢を変化させる:無作為化二重盲検プラセボ対照試験による結果。
Gut. 2018; 67: 2107-2115
記事で見る
スコープス (206)
パブコメ
クロスリファレンス
Google Scholar
ホルスター S.
リンドクヴィスト C.M.
レプシルバーD.
サロネン A.
デ・ヴォスW.M.
ケーニッヒ J.
ブルマー・R.J.
過敏性腸症候群の症状、内臓知覚、糞便・粘膜微生物叢に対する同種糞便微生物叢移植と自家糞便微生物叢移植の影響: ランダム化比較試験。
Clin. Transl. Gastroenterol. 2019; 10e00034
記事で見る
スコープス (59)
パブコメ
クロスリファレンス
Google Scholar
ヴリーズ A.
ヴァン・ヌードE.
ホレマンF.
サロヤルヴィJ.
クートR.S.
バーテルスマンJ.F.(Bartelsman J.F.
ダリンガ=ティーG.M.
アッカーマンスM.T.
セルリーM.J.
ウーズィーアール.
et al.
赤身のドナーからの腸内細菌叢の移入は、メタボリックシンドローム患者におけるインスリン感受性を高める。
Gastroenterology. 2012; 143 (913-6.e7)
記事で見る
スコープス(1975年)
パブコメ
アブストラクト
全文表示
全文PDF
Google Scholar
モカヌV.
チャン・Z.
ディーハン E.C.
カオD.H.
ホッテ N.
カルマリS.
バーチ D.W.
サマラシンゲ・K.K.
ウォルター J.
マドセンK.L.
重度の肥満とメタボリックシンドローム患者における糞便微生物移植と食物繊維補給:無作為二重盲検プラセボ対照第2相試験。
Nat. Med. 2021; 27: 1272-1279
記事で見る
スコープス (71)
パブコメ
クロスリファレンス
Google Scholar
バジャージ J.S.
カッサムZ.
フェイガン A.
ガヴィス E.A.
リュー E.
コックス I.J.
ケラドマンR.
ヒューマン D.
ワング J.
ガリーT.
et al.
合理的な便ドナーからの糞便微生物移植は肝性脳症を改善する: 無作為化臨床試験。
Hepatology. 2017; 66: 1727-1738
記事で見る
スコープス (361)
パブコメ
クロスリファレンス
Google Scholar
ワン・イー
ウィエスノスキーD.H.(Wiesnoski D.H.
ヘルミンクB.A.
ゴパラクリシュナン V.
チョイ K.
デュポンH.L.
ジアンZ.D.
アブ-スベイH.
サンチェスC.A.
チャン・C.C.
et al.
難治性免疫チェックポイント阻害剤関連大腸炎に対する糞便微生物叢移植。
Nat. Med. 2018; 24: 1804-1808
記事で見る
スコープス (395)
パブコメ
クロスリファレンス
Google Scholar
ゲーザー F.
シフト B.
シュタイン・トゥーリンガー C.
ファロウスキー F.
ストラスブルグC.P.
ブロッサートP.
ヒギンズP.G.
シャイドC.
ウルフ D.
ホルダリードT.A.W.
他
難治性腸管移植片対宿主病に対する糞便微生物移植-ドイツの2つの3次センターからの経験。
Eur. J. Haematol. 2021; 107: 229-245
記事で見る
スコープス (0)
パブコメ
クロスリファレンス
Google Scholar
ビリンスキーJ.
リス・K.
トマシェフスカ A.
Grzesiowski P.
ジエチアトコウスキ T.
ティシュカ M.
カラクルスカ・プリストゥピウク E.
ボグラツキー P.
トルマノフスカM.
ハラブルダK.
他。
急性および慢性移植片対宿主病患者における糞便微生物移植-反応スペクトルと安全性プロファイル。多施設共同前向き研究の結果。
Am. J. Hematol. 2021; 96: e88-e91
記事で見る
スコープス (13)
パブコメ
クロスリファレンス
Google Scholar
ラングドン A.
シュワルツD.J.
ブローC.
サン X.
ヒンク T.
レスケ K.A.
ジョーンズ C.
バーナム C.D.
ダバーク E.R.
ダンタスG.
他
微生物相の回復により、クロストリジオイデスディフィシル感染症の再発患者における抗生物質耐性菌の腸内コロニー形成が減少したオープンラベルのPUNCH CD試験から。
Genome Med. 2021; 13: 28
記事で見る
スコープス (25)
パブコメ
クロスリファレンス
グーグルシュラー
エフディーエー
糞便微生物群の移植への使用と多剤耐性菌の伝播による重篤な副作用のリスクに関する重要な安全性注意事項
2019
https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/important-safety-alert-regarding-use-fecal-microbiota-transplantation-and-risk-serious-adverse
記事で見る
グーグルシュラー
エフディーエー
SARS-CoV-2およびCOVID-19に係る移植用糞便微生物叢の使用に関する安全性の注意喚起および安全性の追加的保護について
2020
https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/safety-alert-regarding-use-fecal-microbiota-transplantation-and-additional-safety-protections
記事で見る
グーグルシュラー
エフディーエー
糞便微生物群の移植使用に関する安全性の注意喚起とサルモドキウイルスに関する安全性確保の追加について。
2022
https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/safety-alert-regarding-use-fecal-microbiota-transplantation-and-additional-safety-protections-0
記事で見る
Google Scholar
ロデ A.A.
チェリ M.
クロッグスガード・L.R.(Krogsgaard L.R.
ヘノ K.K.
スヴェンセンA.T.
リッバーホルト I.
ヘルムス M.
エングベリ J.
ショーンニング K.
Tvede M.
他
無作為化臨床試験:再発性Clostridioides difficile感染症に対する12株細菌混合物対糞便微生物移植対バンコマイシン。
Aliment. Pharmacol. Ther. 2021; 53: 999-1009
記事で見る
パブコメ
Google Scholar
記事情報
アイデンティフィケーション
DOI: https://doi.org/10.1016/j.chom.2023.03.019
著作権について
© 2023 Elsevier Inc.
サイエンスダイレクト
ScienceDirectでこの記事にアクセスする
数値
図1C.ディフィシル菌の発病を支える主な作用機序
図2 C. difficile、腸内細菌叢、免疫系間の相互作用を支えるFMT前後のメカニズム
図3FMT後のmiRNAと糖鎖の免疫系および腸内細菌叢との相互作用
図4FMTへの統合的なマルチオミクスアプローチの利用
テーブル
表1再発性C. difficile感染症(rCDI)に対するFMTの作用機序の仮説
関連記事
本サイトのコンテンツは、あらゆる分野の医療従事者や研究者を対象としています。
研究雑誌
セル
がん細胞
セルケミカルバイオロジー
セルゲノミクス
細胞宿主と微生物
細胞メタボリズム
セルレポート
セルレポート医学
Cell Reports Methods
セルレポート 物理科学
細胞幹細胞
セルシステム
ケム
ケム・キャタリシス
カレントバイオロジー
発生細胞
ヘリヨン
イミュニティ
アイサイエンス
ジュール
マター
メド
分子細胞
ニューロン
ワンアース
パターン
STARプロトコル
構造
トレンドレビュー ジャーナル
生物化学系
バイオテクノロジー
がん(Cancer
細胞生物学
ケミストリー
コグニティブサイエンス
エコロジー&エボリューション
内分泌・代謝内科
遺伝学
免疫学
微生物学
分子医学
ニューロサイエンス
寄生虫学
薬理科学
植物科学
パートナージャーナル
AJHG
バイオフィジカルジャーナル
バイオフィジカルレポート
EBioMedicine(バイオメディスン
HGGアドバンス
モレキュラープラント
分子療法ファミリー
プラントコミュニケーション
ステムセルレポート
ザ・イノベーション
コレクションズ
ベスト・オブ・セルプレス
セルプレスのレビュー
セルプレスセレクション
コンソーシアムハブ
Nucleus Collections
SnapShotアーカイブ
誌面を越えて
セルキャリアネットワーク
セルメンター
細胞シンポジューム
ラボリンクス
ウェビナーズ
奉加帳
コミュニティレビュー
Figure360
スニークピーク
STARメソッド
社会科学
セル画展
セルプレスポッドキャスト
セルプレスの動画
カラーリングとコミック
リサーチアーク
コネクト
セルプレスについて
採用情報
連絡先
ヘルプ&サポート
ニュースルーム
パブリケーションアラート
ACCESS
サブスクライブ
リード・イット・ナウ
ライブラリアンへの推薦
INFORMATION
広告主様向け
採用担当者様へ
ライブラリアン向け
ご利用条件
プライバシーポリシー
アクセシビリティ
当社は、サービスの提供や強化、コンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を変更するには、本サイトのクッキー設定にアクセスしてください。
Copyright © 2023 Elsevier Inc. 第三者から提供された一部のコンテンツを除く。
