
腸内細菌叢と神経内分泌系
腸内細菌叢と神経内分泌系
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5794709/

アイタック・ファージ、1 エスター・E・フレーリッヒ、1 ピーター・ホルツァー1,2
著者情報 著作権およびライセンス情報 免責事項
関連データ
補足資料
移動する
要旨
すべての哺乳類の消化管に生息する微生物生態系(腸内細菌叢)は、何千年もの間、宿主と共生関係を保ってきた。現代技術により、腸内細菌が制御・調節する無数の機能が明らかにされつつある。その中で、腸内細菌叢と密接な相互作用を示すシステムの一つが、ストレスに応答して身体の様々なプロセスを制御する身体の主要な神経内分泌システムである視床下部-下垂体-副腎(HPA)軸であることがわかってきました。この相互作用は極めて重要であり、微生物叢-腸-脳軸の様々な障害は、HPA軸の調節障害と関連しています。今回の寄稿では、腸内細菌叢とHPA軸の双方向のコミュニケーションについて述べ、その潜在的な基礎メカニズムを明らかにする。この点で、腸内細菌叢とHPA軸のコミュニケーションは、免疫系、腸管バリアや血液脳関門、微生物代謝物、腸管ホルモンなどの他のシステム、さらには感覚神経系や自律神経系と密接に関連していることに注目することが重要である。これらのコミュニケーション経路は、初期ストレスの前臨床モデル、プロバイオティクスとプレバイオティクスの有益な役割、無菌マウスからの証拠、抗生物質による腸内細菌叢の変調などを通じて例示される予定です。
電子補足資料
本論文のオンライン版(10.1007/s13311-017-0600-5)には補足資料が含まれており、許可されたユーザーはこれを利用できます。
キーワード 抗生物質、コルチコステロン、無芽胞マウス、HPA軸、プロバイオティクス、ストレス
このページのトップへ
はじめに
神経内分泌系は、古典的には、ホルモンや神経ペプチドを産生する、神経決定を伴う組織化された細胞の集合体として定義されている[1, 2]。視床下部-下垂体-副腎(HPA)軸は、心理的ストレス要因や感染症を含む身体的ストレス要因に反応して様々な身体プロセスを制御し、ストレス要因に対する適切な反応を確保する主要な神経内分泌系と考えられています [3]。HPA軸の主要な制御因子であるコルチコトロピン放出因子(CRF)は、ストレスに応答して視床下部の室傍核(PVN)から放出され、全身循環に副腎皮質刺激ホルモン(ACTH)の放出を誘発する。ACTHはその後、副腎皮質からグルココルチコイド(ヒトではコルチゾール、げっ歯類ではコルチコステロン)の分泌を誘導する [3] 。グルココルチコイドの分泌は、転写調節を介して、ストレス応答性の脳領域に局在するグルココルチコイド受容体(GR)にグルココルチコイドが結合することでフィードバック抑制につながる[4]。
神経内分泌系と腸内細菌叢(哺乳類の腸管に存在する微生物の複雑な共同体)の間には双方向のコミュニケーションがあることを示す新たな証拠が示されています。幼少期の腸内細菌叢の形成は、ストレスに対する神経内分泌応答を含む、脳機能と行動のいくつかの側面に影響を与えることが次第に認識されるようになってきました[5, 6]。腸内細菌叢と神経内分泌系との間の潜在的な関連性は、うつ病や過敏性腸症候群(IBS)など、両システムの障害と関連する疾患によってさらに示唆されています。うつ病患者、特にメランコリック型では、HPA軸の活性化が繰り返し観察されています [7] 。IBSにおけるHPA軸活性の評価には一貫した結果が得られていませんが、ほとんどの研究がIBSにおけるHPA軸の活性増加を支持しています [8]。さらに、早期生活ストレスや慢性的なストレス因子は、うつ病やIBSの発症の危険因子である [9-11] 。慢性的に上昇したコルチゾールレベルが脳機能に悪影響を及ぼす一方で [11、12]、HPA軸の活性化は、腸内細菌叢の構成に影響を与え、胃腸の透過性を高めることもできます [13 、14]。腸内細菌叢のディスバイオシスと細菌の移動は、IBSやうつ病患者のサブセットで観察される慢性的な低グレードの炎症に寄与することが提案されている [15, 16] 。完全に一致するわけではないが、いくつかの研究では、IBS患者の少なくとも一部において、ファーミキューテスの存在量が増加し、バクテロイデーテスの存在量が減少したことが報告されている [17, 18]. うつ病患者でも微生物叢の組成の変化が報告されているが、この病態に関する微生物の特徴はまだ定義されていない [19-21] 。うつ病とIBSの両方の発症における微生物叢の因果的な役割は、糞便移植研究によってさらに証明されている。うつ病患者の微生物叢をげっ歯類に移植すると、うつ病様行動を誘発することができる [22] 。Kellyら[19]は、うつ病患者の糞便微生物叢の移植に反応して、ラットに無感情と不安が観察されました。微生物叢の移植は免疫活性化の指標を誘導したが、ストレスによって誘導されたコルチコステロンレベルは影響を受けなかった[19]。この結果はむしろ驚くべきものですが、HPA軸パラメータを1つの時点で測定すると、信頼性の低い結果になる可能性がありました[19]。下痢を伴うIBS(IBS-D)患者の糞便微生物叢を、不安の有無にかかわらず無菌(GF)マウスに移植すると、胃腸通過の速さ、腸管バリア機能障害、自然免疫活性化、不安様行動が引き起こされた [23]. 特に、不安様行動を呈するIBS-D患者由来の糞便微生物叢を用いた場合、レシピエントマウスの大腸における免疫活性化は顕著であった。また、これらのマウスは、GR経路のシグナル伝達に関与する大腸遺伝子の発現が亢進していた[23]。これらの多因子疾患の神経内分泌障害における微生物叢の機能的意義はまだ詳しく解明されていないが、腸管透過性や免疫パラメータの変化も観察される神経内分泌異常に寄与している可能性があることはもっともである [24] 。この寄稿では、腸内細菌叢、神経内分泌系、および脳の間のコミュニケーションを示唆する、主に前臨床研究をレビューする。この研究は、以下を含む複数の直接および間接経路を介して行われる: 1)体液性経路(微生物代謝物、腸内ホルモン経由)[25, 26]、2)免疫経路(炎症性サイトカインなど)[27]、3)神経経路(腸神経系、迷走神経、脊髄求心性神経経由)[28]。
に進む:
早期ライフイベントとHPA軸
早期のライフイベントは、HPA軸を持続的にプログラムすることが可能である。母親の世話や新生児への対応といったポジティブな経験は、後年、HPA反応の減衰につながる可能性がありますが [29, 30] 、ストレスの多い出来事にさらされると、HPA軸の不適応が生じ、後年のストレス感受性の変化に対する機構的根拠となります [31] 。したがって、一般に、生後早期のストレスは、ストレスに対するHPA反応性の上昇をもたらし、これは、CRFシグナルの増加とGRを介した負のフィードバックの障害に起因する [31]。他のメカニズムの中でも、早期生活ストレスの影響は、発達中の脳のコルチコステロイド曝露の増加によってもたらされ、GRの発現に変化をもたらす [31, 32] 。さらに、早期生活ストレスは、扁桃体、海馬、前頭前野など、HPA軸を調節することができる脳のさまざまな領域の機能に影響を及ぼします[31]。一般に、早期生活ストレスは扁桃体の過活動をもたらすが [33] 、シナプス可塑性を阻害し、HPA軸の抑制効果を発揮する領域である海馬 [34] のN-methyl-D-aspartate receptor (NMDA) 受容体のNR1およびNR2Bサブユニットの発現を低下させる。同様に、前頭前野はHPA軸の活動を抑制することができ、早期生活ストレスは様々なメカニズムで前頭前野の機能を低下させる[31, 35]。さらに、主に脳幹の孤束路核から発生するノルアドレナリンニューロンは、HPA軸の活性化に極めて重要な役割を担っています[36]。孤束路核は迷走神経から内臓の求心性を受け、炎症性疾患によって活性化されるため、腸脳軸に関して特に重要である [37, 38]。
初期ストレスのもう一つの特徴は、自然免疫系の活性が上昇し、それが成人期まで続くことであるが、獲得免疫系はむしろ損なわれる [39, 40]。HPA軸が慢性的に活性化すると、エピジェネティックな変化によりGRシグナルが代償的に減少し [41]、コルチゾールの抗炎症作用に対する免疫細胞の抵抗性が生じるため、この反応にはHPA軸が機構的に関与しています [39, 42]。また、ストレスが腸内細菌叢の構成に影響を与え [43]、腸管粘膜バリアを弱めることから、このプロセスにおける腸内細菌叢と腸管透過性の役割を示す新たな証拠もある [14].ストレスによる腸内細菌叢の組成の変化は、ノルエピネフリン(NE)やドーパミン(DA)などの神経内分泌ホルモンによって誘発される可能性があり、これらのホルモンはグラム陰性菌の増殖を高めることが古くから知られています[44]。腸管透過性の増加は、腸管内腔を通過する細菌成分の移動を通じて、炎症反応を誘発することが提案されている [13].最後に、炎症性サイトカインやプロスタグランジンなどの炎症性メディエーターは、HPA軸の強力な活性化因子であり [45] 、微生物-免疫-神経内分泌の相互作用に複雑さを加えている。
に進む:
HPA軸を活性化させる微生物成分の供給源としての腸内細菌叢
炎症が起きると、炎症性サイトカインやプロスタグランジンが放出され、HPA軸が活性化することは明らかですが、免疫系の刺激因子として腸内細菌叢が寄与するメカニズムについては、現在、広く研究が行われています。腸内細菌叢によるHPA軸の活性化は、腸管バリアの透過性が高まり、微生物叢主導の炎症性状態となることで起こりうるという指標がある[13]。最近では、ほとんどの細菌の細胞壁成分である腸内細菌叢由来のペプチドグリカンが脳内に移行し、自然免疫系の特定のパターン認識受容体を活性化することで、脳の発達や行動に影響を与えることが示唆されています [46] 。さらに、腸内細菌叢由来のペプチドグリカンは、その受容体の一つであるヌクレオチド結合オリゴマー化ドメイン含有タンパク質-1(Nod1)を活性化することによって自然免疫を活性化することが実証されています[47]。ペプチドグリカンとは別に、グラム陰性菌の外膜の構成成分でToll様受容体(TLR)4を活性化するリポポリサッカライド(LPS)は、ストレスや高脂肪食(HFD)などの特定の条件に反応して腸管上皮バリアを通過し、それによって免疫とHPA軸を活性化することが提案されている。様々な細菌成分の移動と相互作用、および免疫系とHPA軸への影響は、幅広い病態生理学的関連性を持つ可能性がある。この点に関して、LPSとNodアゴニスト、およびLPSとTLR2アゴニストであるリポテイコ酸の相乗的相互作用が報告されている[48、49]。
細菌成分は免疫系とHPA軸を急性的に活性化することができるが、新生児ネズミをこれらの因子に暴露すると、長期的な効果を誘発することができる。したがって、ストレスと同様に、新生児期のLPSへの曝露は、拘束ストレスに対するACTHおよびコルチコステロン反応の上昇をもたらし、成体ではグルココルチコイドのフィードバック抑制が低下する。このことは、拘束ストレスに対するデキサメタゾンによるACTH反応の抑制が弱まることで例示される [50] 。また、新生児期のLPS曝露により、脳内GR密度が低下し、CRFの発現が増加することが知られている[50]。さらに、新生児期のLPS曝露は、成人期のLPSに対するプロスタグランジンを介したHPA軸の反応性の亢進を誘導する[51]。HPA軸への影響に加え、新生児期のLPSへの暴露はカテコールアミン作動性ニューロンを再プログラムすることができる [52]。したがって、LPSに暴露された新生児は、成人期においてチロシン水酸化酵素の活性とタンパク質発現の著しい増加を示し、特にコアラ座において顕著である [52] 。
に進む:
微生物による短鎖脂肪酸:腸管ホルモン分泌の中枢作用と誘導因子
難消化性の炭水化物繊維を発酵させ、短鎖脂肪酸(SCFA)に変換する微生物の能力は、様々な生理的および病態生理学的プロセスにおいて特に重要であることが分かってきている。酢酸、酪酸、プロピオン酸は最も広く研究されているSCFAであり、消化管の内外で多様な機能を有している。消化管内では、SCFAは腸内細菌叢自身や腸管上皮細胞にとって重要なエネルギー源となります。また、腸上皮の健全性を高め、粘液産生を増加させ、腸の運動性を調節し、核因子κBの不活性化や制御性T細胞の促進など、抗炎症作用を発揮する[53-55]。さらに、腸管内分泌細胞からグルカゴン様ペプチド1(GLP-1)やペプチドYY(PYY)などのホルモンや神経ペプチドの分泌を誘導する[56]。一方では、これらの効果はGタンパク質共役型受容体(GPR)GPR43、GPR41、GPR109Aの活性化によって媒介されるが、他方では、SCFAはエピジェネティックレギュレーターでもあり、ヒストン脱アセチル化酵素の阻害剤として作用して遺伝子発現に影響を及ぼす。興味深いことに、SCFAは中枢神経系(CNS)の常在マクロファージであるミクログリアの成熟と機能にとって重要な因子として浮上してきた[57]。したがって、GFマウスのミクログリアは未熟な表現型を持ち、自然免疫応答が損なわれている [58]。重要なことは、GFマウスのSCFAの欠乏とGPR43(Ffar2がコードする)に対する作用が、これらの欠損の背景にあることが証明されたことである。したがって、SCFAを4週間投与すると、GFマウスのミクログリアの奇形と未熟さが回復するが、Ffar2-/-マウスではGFマウスのミクログリアを思わせるような奇形のミクログリアが見られる[57]。特に注目すべきは、CNSのどの細胞タイプ(ミクログリアを含む)でもFfar2 mRNAの発現が認められなかったのに対し、脾臓では高い発現が検出されたことである。したがって、SCFAが血液脳関門のトランスポーターを通じて脳に入ることができるにもかかわらず、SCFAがミクログリアに直接作用することは、観察された効果を媒介するとは考えにくい[26]。Ffar2-/-マウスにおけるSCFAの効果を決定することは、SCFAが誘発するミクログリアの成熟に寄与するメカニズムについてさらなる洞察を与えるだろう。
ミクログリアは、その免疫機能に加えて、発達中の脳の神経回路の形成に重要であるため、その微生物叢に依存する機能は、HPA軸を制御する回路に関係している可能性がある[59]。興味深いことに、ミクログリアへの影響以外にも、酪酸の全身投与は抗うつ効果を発揮し、神経伝達を調節する [28, 60, 61]。
他の機能とは別に、SCFAに反応して腸内分泌細胞から放出される神経ペプチドGLP-1とPYYは、内分泌および迷走神経依存性の経路を通じて満腹感を促進する[62、63]。SCFAsに加えて、最近の研究では、細菌性タンパク質が腸の局所的なメカニズムまたは循環を介して食欲を制御する可能性があることが示唆されている[64]。この研究結果は、栄養供給が大腸菌の指数関数的成長を安定させること、および大腸菌の定常期タンパク質が全身に注射されると血漿PYYレベルを上昇させ、食物摂取を抑制することができることを示している[64]。興味深いことに、同じ研究室は以前、大腸菌のタンパク質カゼイン分解プロテアーゼBが、重要な満腹神経ペプチドであるα-メラノサイト刺激ホルモンの抗原模倣体であることを明らかにしていた[65]。さらに、カゼイン分解プロテアーゼBを視床下部スライスに塗布すると、α-メラノサイト刺激ホルモンを産生するプロオピオメラノコルチンニューロンの活動電位頻度が増加することを明らかにした[64]。
GFマウスでは、GPR41とGPR43、そしてPYY、GLP-1、同じく腸管満腹ペプチドであるコレシストキニンの発現が低下する(図(1)1)[66]。さらに、GFマウスでは、循環レプチンが低下し、循環グルコースが減少し、脂肪代謝が亢進し、空腹状態に似た代謝プロファイルを示す[66]。GFマウスの視床下部では、オレキシジェニック神経ペプチドY(NPY)が増加し、一方、拒食性神経ペプチドは減少している[67]。したがって、これらの神経ペプチドが食欲への影響以外に、行動、脳機能、神経内分泌系に影響を与えることができることを考えると、これらの違いがGFマウスのHPA軸の反応性の増加にどの程度寄与しているかが問題となる(図(2)2) [25, 68] 。
図.1
無胚葉マウスの神経発達の変化。無菌マウスは、視床下部-下垂体-副腎の活動に影響を与えうる身体の様々なシステムに影響を与える発達的な変化を示す
BDNF = 脳由来神経栄養因子、NPY = 神経ペプチドY、GALT = 腸関連リンパ組織、GPR = Gタンパク質共役受容体、PYY = ペプチドYY、GLP-1 = グルカゴン様ペプチド1、CCK = コレシストキニン、CRF = コルチコトロピン放出因子、GR = グルココルチコイド受容体、ACTH = 副腎皮質刺激ホルモン
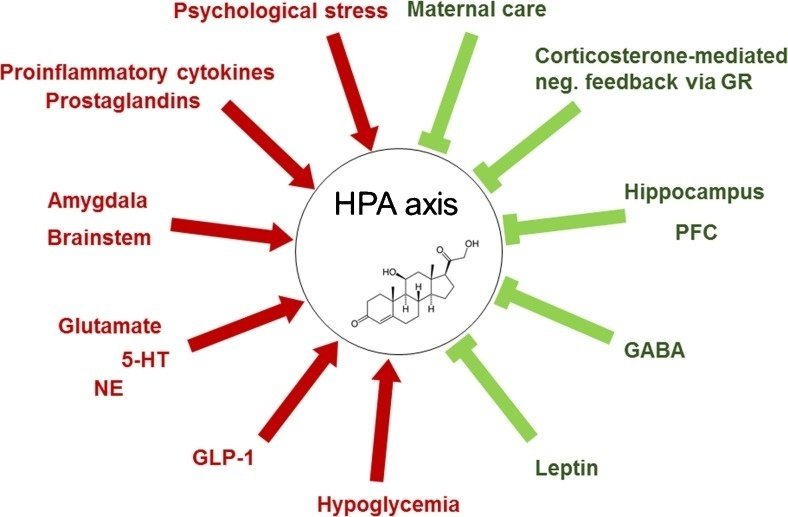
図2
視床下部-下垂体-副腎(HPA)軸の調節因子。HPA軸には複数の活性化因子(→)と抑制因子(✞)が存在する。
GR = グルココルチコイド受容体、PFC = 前頭前野、GABA = γ-アミノ酪酸、GLP-1 = グルカゴン様ペプチド1、NE = ノルエピネフリン、5-HT = 5-ヒドロキシトリプタミン
また、微生物叢は様々な腸内ペプチドの放出を制御するだけでなく、自ら様々な神経伝達物質を産生する。例えば、ラクトバチルス・ブレビスやビフィドバクテリウム・デンティウムはγ-アミノ酪酸(GABA)を産生することができるが [69]、他の細菌種はカテコールアミンを産生する [70] 。これらの神経伝達物質は局所的な効果を発揮すると考えられるが、これらの細菌の神経伝達物質が腸-脳軸に何らかの影響を及ぼすかどうかについては、まだ検討する必要がある[71]。
に進む:
神経内分泌系に最も有益な調節因子としてのプロバイオティクスとプレバイオティクス
ストレスや食事によって引き起こされる)腸内細菌群集のアンバランスは、炎症プロセスやHPA軸の活性化につながるが、実験的研究は、このプロセスにおける乳酸菌やビフィズス菌を含むプロバイオティクスの有益な役割の可能性を指摘している(表(Table11)。
表1
神経内分泌系への前臨床作用が報告されているプロバイオティクスのセレクション
プロバイオティクス/動物種追加介入HPA軸その他の効果行動学的効果参考文献Bifidobacterium pseudocatenulatum (P2-P21)
C57BL/6J ♂MS(P2~P21)↓CORT(P41)
┤MSによるCORTの増加(P41)↑TNF-α(腸、P21)
↓IFN-γ(腸、P21)
┤MSによるIL-18の増加(血清、P21)
MSによるBacteroidetesの増加(P21)┤MSによる不安(P41)[76]B. pseudocatenulatum (W7-21)
C57BL/6マウス ♂HFD (W7-W21)↓CORT (W20)
┤社会的ストレスによる↑CORT(W20)
┤HFDによるGR低下(W21)┤HFDによるTLR2増加(腸、海馬、W21)
↓ HFDによる体重増加┤HFDによる無気力感
┤HFDによる不安(W18)[73]Bifidobacterium infantis (P50-P95)
Sprague-Dawley ラット ♂MS (P2-P14) ↔CORT (P95) ┤ストレスによる IL-6 増加 (WBCS, ConA 刺激, P95) ┤MS による無気力 (P90)[74]Bifidobacterium longum または Bifidobacterium breve (W8-W14)
BALB/cマウス ♂↔CORT (W14)↓ 不安症 (W12)
↓ うつ病様行動(W13)
┤ストレス誘発性高熱(B. longum, W11)[75]Bifidobacterium animalis subsp. lactis + Propionibacterium jensenii (P10-P22)
Wistar ratsMS (P2-P14)↑CORT (♀, P24)
↑ACTH (P24)┤MS による IgA の減少
MSによるEscherichia coli[76]ラクトバチルス・ラムノサス菌の増加(W7-W11)
BALB/cマウス ♂↓ ストレス誘発性CORT(W11) ↓ 不安症(W10)
↓ うつ病様行動(W10)[77]Lactobacillus farciminis(2週間)
Wistar ラット ♀PRS┤PRS 誘発 CORT + ACTH 増加(血漿)。
PRSによるCRFの増加(mRNA、PVN)┤PRSによるLPSの増加(門脈血)。
PRSによるIL-1β, IL-6 + TNF-αの増加(mRNA, 視床下部)
PRSによる腸管透過性[80]Lactobacillus helveticus + B. longum (2 weeks)
C57BL/6マウス ♂WAS┤WASによるCORTの増加┤WASによるc-Fosの増加(PVN、扁桃体、海馬)。
WASによる神経新生抑制(海馬)
WASによる腸管透過性[81]L. rhamnosus + L. helveticus (P4-P19)
Sprague-Dawley ratMS (P4-P19)┤MS による CORT 増加┤MS による腸管透過性[82]Lactobacillus fermentum (P6-P21)
Sprague-Dawley ratsMS (P10) WAS (P20)┤MS による CORT 増加 (P10)
WASによるCORT上昇(P20) ↓ 腸管透過性(P20)
MS誘発腸管透過性
┤WASによる腸管透過性
↑ IFN-γ(活性化脾臓細胞、P21) ↑ 運動量[83]。
別ウィンドウで開く
┤=予防、↓=減少、↑=増加、↔=変化なし、HPA=視床下部-下垂体-副腎、P=出生後日、B=ビフィズス菌、MS=母体分離、CORT=コルチコステロン、TNF=腫瘍壊死因子、IFN=インターフェロン、IL=インターロイキン、HFD=高脂肪食、W=出生後週; GR = グルココルチコイド受容体、TLR = トール様受容体、WBCS = 全血培養上清、ConA = コンカナバリンA、ACTH = 副腎皮質刺激ホルモン、L = 乳酸菌、PRS = 部分拘束ストレス、PVN = 視床下部の傍室核、WAS = 水回避ストレス
最近の研究では、プロバイオティクスであるBifidobacterium pseudocatenulatum CECT 7765を出生後2日目(P2)からP21まで投与すると、母体分離(MS)ストレスによる神経内分泌の変化を修正することが示されました[72]。P21で試験したところ、B. pseudocatenulatumはMSのストレスによって誘発されたコルチコステロン濃度の上昇を減衰させなかったが、視床下部と小腸のカテコールアミンのストレス誘発増加はプロバイオティクスによって減衰した。しかし、P41では、B. pseudocatenulatumは、ストレスによって誘発される便中のコルチコステロンと視床下部のカテコールアミンの増加、および不安様行動を完全に消失させた[72]。B.pseudocatenulatumの免疫調節作用の関与の可能性は、プロバイオティクス処理マウスの小腸における基礎およびストレス誘発インターフェロン(IFN)-γレベル、およびストレス誘発インターロイキン(IL)-18レベルの著しい減少によって示唆されている。これらの免疫調節作用と並行して、プロバイオティクスは、主にバクテロイデーテス門に属する操作分類単位のMS誘発性の増加を防止した[76]。
同じ研究室によるさらなる研究で、B. pseudocatenulatum CECT 7765は、成体雄マウスにHFDを投与した際の様々な神経内分泌の変化を抑制することができることが示されました [73].このプロバイオティクスは、HFDによって誘発された糞便中のコルチコステロンレベル(基礎および急性ストレス因子に対する反応)を正常化し、さらに、HFDが海馬のGRレベルを低下させる傾向を逆転させました。さらに、B. pseudocatenulatumは抗炎症作用を発揮し、HFD誘発の行動および代謝障害を鈍化させた(表(Table1)1)[73]。最後に、このプロバイオティクスは、小腸と脳におけるDA、NE、エピネフリン、5-ヒドロキシトリプタミン(5-HT)レベルに影響を与えました。これらのプロバイオティクス効果の正確な経路は明らかにされていませんが、これらのデータは、B. pseudocatenulatumが、おそらく抗炎症作用と神経内分泌系の調節を通じて、HFD誘発性肥満の影響を改善できることを明確に示しています。
上記の研究は、ビフィズス菌の特定の菌株が神経内分泌系に影響を与える能力を指摘しているが、異なる実験プロトコルと異なるビフィズス菌の菌株を用いた他のグループでは、他のパラメータに影響を与えたものの、コルチコステロンには変化が見られなかった。したがって、ビフィドバクテリウム・インファンティス35624を母体分離ラットにP50から犠牲の日(P95)まで6週間投与しても、ベースラインのコルチコステロン値は変化せず、一方、ストレス誘発レベルは評価されなかった[74]。しかし、B. infantisはMS誘発のうつ病様行動を正常化し、一定の抗炎症作用を示し、中枢のNEと5-HTの主要代謝物である5-ヒドロキシインドール酢酸レベルに影響を与えた[74]。同じグループによって行われた別の研究では、雄のBALB/c成体マウスにおいて、ビフィドバクテリウム・ロンガム1714とビフィドバクテリウム・ブレーベ1205の効果を比較しました [75].ここでも、両プロバイオティクスは、さまざまな抗不安作用や抗うつ作用に似た効果を示したものの、ベースラインやストレス誘発性のコルチコステロン濃度には影響を与えませんでした[75]。したがって、これらの後者の研究から、ビフィドバクテリウムの特定の菌株は、神経内分泌系に依存しない特定の行動効果を発揮すると結論づけることができる。これらの知見とは対照的に、Bifidobacterium animalis subsp. lactis BB-12とPropionibacterium jensenii 702(乳製品から分離したプロバイオティクス)の組み合わせをウィスターラットに妊娠10日前から離乳まで投与したところ、雌児のコルチコステロン濃度が上昇しました [76].
また、さまざまなグループが、異なる株の乳酸菌の中枢・神経内分泌作用について調査しています。特に、プロバイオティクスであるLactobacillus rhamnosus(JB-1)を28日間、非ストレス状態の成体雄BALB/cマウスに慢性投与すると、コルチコステロンレベルが低下し、強制水泳試験におけるうつ様行動が減少し、高所順路(EPM)における不安様行動が減少するという発見は、科学界内外で多くの注目を集めています[77]。しかし、L. rhamnosus (JB-1) のこれらの効果は、系統や種に依存するようです。このプロバイオティクスは、雄C57BL/6マウスのベースラインの社会的行動や不安様行動に影響を与えませんでしたが、ストレスによる行動障害は減少しました [78] 。同様に、健康な男性被験者29人がL. rhamnosus(JB-1)を8週間摂取しても、唾液コルチゾール、気分、不安、睡眠の質、主観的ストレス、視空間記憶パフォーマンス、注意スイッチ、急速視覚情報処理、感情認識、および関連脳波パラメータに変化はなかった [79]。
BALB/cマウスのL. rhamnosusに反応する行動効果は、迷走神経を刺激したマウスでは見られないことから、迷走神経はプロバイオティクスシグナルとCNSの間の重要なコミュニケーション経路であることが示唆された[77]。同様に、迷走神経切断により、L. rhamnosusによって誘発される中枢のGABA受容体発現の一部の変化が抑制されたが、迷走神経切断マウスにおけるコルチコステロンレベルは報告されていない[77]。
これらの情動・感情や神経化学的な変化に加え、乳酸菌は様々なストレスプロトコルで有益な効果を発揮することが繰り返し報告されている(表(Table1).1)。雌のWistarラットにLactobacillus farciminisを2週間投与した後に部分拘束ストレスを与えると、ストレスによるACTHとコルチコステロンの増加、およびPVNのCRFの増加をブロックすることができます[80]。さらに、このプロバイオティクスは、ストレスによって誘発される腸管バリアの過透過性、および門脈血中のLPSレベルの上昇を抑制することができた。これらの効果と一致して、L. farciminisは、視床下部におけるIL-1β、IL-6、および腫瘍壊死因子(TNF)-α mRNA発現のストレス誘発性の増加を防止した[80]。その後の研究で、同じグループは、Lactobacillus helveticus R0052とB. longum R0175を含むプロバイオティクス製剤で2週間前処理すると、水回避ストレス(WAS)に反応する成体雄マウスのコルチコステロン、NE、エピネフリンのレベル増加を鈍らせることを報告しました[81]。これらの効果は、ストレスに応じた腸管バリア障害の防止、PVNや扁桃体などのストレス感受性脳領域における神経細胞活性(c-Fos発現)の低下、海馬の神経新生の増加が、対照動物とストレス動物で並行して確認された。さらに、プロバイオティクス製剤は、ストレスマウスにおいて、シナプス可塑性に関わる視床下部遺伝子に影響を与え、脳由来神経栄養因子(BDNF)の発現を増加させる一方、ミクログリア活性化マーカーの発現を減少させました[81]。同様に、L. rhamnosus R0011とL. helveticus R0052を組み合わせたプロバイオティクスを母子分離したラットの仔に投与すると、コルチコステロン濃度の上昇、および大腸バリアの透過性の上昇が抑制されました[82]。さらに、新生ラットにLactobacillus fermentum CECT5716を投与すると、生体内で基礎条件下およびMSやWASに応答して腸管透過性が低下することが最近報告されている[83]。MSまたはWASに反応したコルチコステロン濃度の上昇は、プロバイオティクスによって抑制された。さらに、プロバイオティクスは、活性化した脾臓細胞からのIFN-γ(Tヘルパー(Th)1反応のマーカー)分泌を増加させたが、IL-4(Th2反応のマーカー)分泌は阻害された。最後に、L. fermentumは、運動量と探索行動を増加させました[83]。
複数のプロバイオティクス種を組み合わせることで相加的な効果を発揮することが示唆されているため、最近の研究では、HFD(4週齢から)と8つの細菌株(Bifidobacterium bifidum W23, Bifidobacterium lactis W52, Lactobacillus acidophilus W37, L. brevis W63, L. L. fermentum)を含む多種類のプロバイオティクス処方(9週齢から)についての相互作用を調査しています。brevis W63、Lactobacillus casei W56、Lactobacillus salivarius W24、Lactococcus lactis W19、Lactococcus lactis W58)の雄スプラグ・ドーリーラットでの摂取を確認しました[84]。プロバイオティクス製剤は、HFDによる血漿LPSレベルの上昇と代謝の変化に影響を与えなかったが、製剤は食事に依存しない様々な効果を発揮した。したがって、プロバイオティクス処理は、うつ病様行動とCRF受容体(CRFR)1およびCRFR2の海馬mRNA発現を減少させ、HPA軸の活性を潜在的に低下させることを示しています。他の報告と同様に、プロバイオティクス製剤は、刺激された血液単核細胞によるサイトカイン産生をTリンパ球由来のサイトカイン(IFN-γ、IL-2、IL-4)へと調節し、マクロファージ関連サイトカイン(TNF-α、IL-6)は減少した。さらに、プロバイオティクス製剤は、神経保護作用と中枢神経系の炎症を抑えることが実証されている微生物のトリプトファン代謝物であるインドール-3-プロピオン酸のレベルを増加させた[85]。
齧歯類におけるプロバイオティクスの優勢な有益性の発見は、ヒトにおける様々なプロバイオティクス菌株のいくつかのポジティブな効果によって一致している。例えば、無作為化二重盲検プラセボ対照試験において、Lactobacillus plantarum 299vを試験を控えた学生41名に投与したところ、10日後にコルチコステロンレベルが低下することが確認されました[86]。同様に、L. helveticus R0052とB. longum R0175(マウスで効果があった)からなるプロバイオティクス製剤は、二重盲検、対照、無作為化、並行試験で26人の健康なボランティアに30日間投与すると、中央尿遊離コルチゾールレベルと心理的苦痛が減少しました [87]. 同様に、B. longum 1714を22人の健康な男性ボランティアに投与したプラセボ対照試験では、急性ストレス要因に反応するコルチゾールレベルと主観的不安の増加を抑制しました [88]。これらの効果は、海馬に依存する視空間記憶能力の向上と、脳波で評価される脳活動の変化と並行していました[88]。
プロバイオティクスに加えて、プレバイオティクス(有益な細菌の増殖を刺激する非消化性の繊維化合物)も、微生物叢-腸-脳軸にプラスの効果を発揮することが報告されています。最近の研究では、成体雄マウスにプレバイオティクスであるフラクトオリゴ糖(FOS)、ガラクトオリゴ糖(GOS)、およびそれらの組み合わせを3週間投与した場合の効果を比較しました [89] 。プレバイオティクスを投与すると、ストレスで誘発される血漿コルチコステロン濃度が低下し、GOSおよびFOSとGOSの組み合わせが最も強い効果を示し、海馬のCRFR1 mRNA発現を抑制しました。この発見に伴い、GOSおよびFOS+GOSの投与は、不安およびうつ病様行動を抑制しました。特に、FOS + GOSの組み合わせは、海馬のBDNFとGABAB受容体の発現を増加させ、前頭前野の5-HTレベルを増加させました。プレバイオティクスは腸内細菌叢の組成にも変化をもたらし、乳酸菌とビフィズス菌の相対存在量は驚くほど減少した。一方、プレバイオティクスによって、セカールのSCFAである酢酸とプロピオン酸は増加し、イソ酪酸は減少した。驚くべきことに、SCFAレベルの変化は、行動の変化と相関していた。これらのベースライン効果に加えて、FOS + GOSの3週間投与は、コンカナバリンAでの刺激に応答してコルチコステロンレベルと脾臓サイトカイン産生を増加させ、ストレス誘発性の行動障害を悪化させる慢性的な社会ストレスの影響を鈍らせることが実証されました [89]。マウスにおけるこれらの有益な効果と同様に、臨床研究では、健康なボランティアにおいて、FOSではなくGOSが唾液コルチゾールの覚醒反応を減少させることができると報告されました[90]。
しかし、プレバイオティクスやプロバイオティクスが、HPA軸や行動に悪影響を及ぼす可能性があることも見逃せません。L.カゼイ54-2-33、プレバイオティクスであるイヌリン、またはプロバイオティクスとプレバイオティクスの混合物(シンバイオティクス)を、P21から14日間、雄スプラグドーリーラットに投与した最近の研究では、プロバイオティクスまたはプレバイオティクス単独ではベースラインコルチコステロンレベルが上昇するのに対し、シンバイオティクスはストレスによるコルチコステロンの増加を抑制しました [91]. また、オープンフィールドテスト(OFT)においては、すべての処理で不安誘発作用が見られたが、シンバイオティクスはEPMテストにおいて抗不安作用が見られたという驚くべき結果が得られた。
に進む:
腸内細菌叢とHPA軸:GFマウスからのエビデンス
GFアイソレーター内で飼育され、微生物を一切含まないマウスで行われた研究は、神経内分泌系を形成する腸内細菌叢の役割をさらに明らかにする上で大いに役立っている(表(Table2).2)。したがって、GFマウスは、拘束ストレスに応答して、CRF発現の増加、大脳皮質におけるGR発現の減少、および血漿ACTHおよびコルチコステロンレベルの上昇を示すことが実証されている(表(Table2)2)[93、95]。新生児GFマウスにB. infantisをコロニー形成すると、GFマウスのHPA軸の反応性上昇を減衰させることができるが、腸管病原性大腸菌をコロニー形成すると拘束ストレスに対するHPA反応が増悪する [93].正確な経路は解明されていないが、HPA軸に対する免疫介在作用の変化が重要な役割を担っていることが示唆されている。大腸菌とB. infantisは、接種後6時間で血漿コルチコステロンとPVNのc-Fos mRNAレベルの上昇を、12時間でIL-6レベルのわずかな上昇を引き起こすが、これらの効果は大腸菌の接種に対してより顕著であり、より長く続く。さらに、大腸菌のみが血漿中のIL-1βの増加をもたらし、接種後12時間後に最も高い値を示した[93]。6週齢のGFマウスに特異的病原体フリー(SPF)マウスの糞便をコロニー形成すると、HPA反応の悪化を防ぐことができるが、14週齢のコロニー形成はHPA軸に影響を与えないことから、重要な発達段階における細菌コロニー形成の年齢依存的影響が示された[93]。
表2
無菌(GF)マウスの神経内分泌系における変化
マウス系統HPA軸(GF vs colonized)関連システム参考GF BALB/c mouse ♂ ↑ CORT(拘束ストレス後)
↑ CRF mRNA + タンパク質(視床下部)
↓ GR mRNA(大脳皮質) ↓ NR-1 mRNA(大脳皮質)
NR-2 mRNA(大脳皮質+海馬) ↓ NR-2 mRNA(大脳皮質+海馬)。
↓ BDNFタンパク質(大脳皮質+海馬)[93]GF BALB/c mouse↓ NEとDAのターンオーバー(海馬、線条体、脳幹)。
↓↑ 5-HT ターンオーバー(線条体、脳幹)[101]GF Swiss Webster マウス ♀ ↑ CORT(到着後48時間) ↓ NR2b mRNA(扁桃体)。
海馬) ↑ BDNF mRNA(Hippocampus
↓ 5HT1A mRNA(海馬)[98]GF NMRIマウス ♂ ↑ NE、DA、5-HTのターンオーバー(線条体)。
NGFI-A mRNA(PFC)↓(海馬
海馬+扁桃体) ↓ BDNF mRNA(海馬+扁桃体
DAD1 受容体 mRNA(海馬) ↑ DAD1 受容体 mRNA(海馬
↑ シナプトフィシン+PSD-95(線条体)[97]GF Swiss Webster mouse ♀+♂↑ CORT(新規環境ストレス後)↓ BDNF mRNA(海馬、雄)。
海馬、雄) ↑ 5-HT(海馬、雄
海馬、雄) ↑ 5-HIAA(海馬、雄
↓ TNF-α(脾臓細胞+LPS)
↓ キヌレニン/トリプトファン(血漿)[99]GFストレス感受性F344ラット ♂ ↑ OFT後のCORT
↑ CRF mRNA(PVN)。
↓ GR mRNA(海馬) ↓ DAターンオーバー(前頭皮質、海馬、線条体)[102]GF C57BL/6N マウス ♀+♂↔ MS後のCORT ↑ MS後のBDNF蛋白(海馬)
海馬) ↑ 5-HT (海馬)
↓ NE(海馬)[100]です。
別ウィンドウで開きます
HPA = 視床下部-下垂体-副腎;CORT = コルチコステロン;CRF = コルチコトロピン放出因子;GR = グルココルチコイド受容体;NR = N-メチルD-アスパルテート受容体; BDNF = 脳由来神経栄養因子; NE = ノルエピネフリン;DA = ドーパミン;5-HT = 5-ハイドロキシトリプタミン;NR2b = N-メチルD-アスパルテート受容体の2bサブユニット; NGFI-A=神経成長因子誘導性クローンA、PFC=前頭前野、PSD-95=シナプス後密度タンパク質95、5-HIAA=5-ヒドロキシインドール酢酸、TNF=腫瘍壊死因子、LPS=リポ多糖、OFT=オープンフィールドテスト、PVN=視床下部傍核、MS=母親分離
GFマウスは、微生物叢の関与の可能性を示唆する多くの神経内分泌および神経化学的変化を示している。例えば、GFマウスでは、NMDA受容体サブユニットとBDNFの中心的な遺伝子発現が低下しているという証拠がある(表(Table2)2)[93]。BDNFとNMDA受容体サブユニットはともにシナプス可塑性のメディエーターとしての役割を担っており、その発現量の変化は精神疾患と関連している [92, 94, 95] 。興味深いことに、海馬のBDNF、およびグルタミン酸NMDA受容体サブユニットの減少は、母性剥奪によって誘導され、脳機能の長期的な障害に寄与することが提案されている [96]。GFマウスの海馬と扁桃体におけるBDNF量の減少は、神経成長因子誘導性クローンAの発現低下と関連しているが、シナプス形成と成熟に関連するマーカーであるシナプス後密度タンパク質95とシナプトフィジンは、GFマウスで増加している。さらに、NE、DA、5-HTのターンオーバーが増加し、DAD1受容体のmRNAも増加する[97]。
Neufeldら[98]は、雌のGFマウスでコルチコステロンレベルが増加していることを報告した。雄マウスの海馬におけるBDNFレベルの低下とは対照的に、彼らは雌マウスの海馬におけるBDNF mRNAの増加を観察した。Clarkeら[99]もGFマウスの雌雄を比較し、神経化学的パラメータに顕著な性差を観察できたが、神経内分泌および免疫学的パラメータは男女間で差がなかった。前述の研究と同様に、GFマウスの雄は海馬のBDNFレベルが低下しているのに対し、雌のBDNFレベルはわずかに上昇する傾向にあることが示された。また、海馬の5-HTとその主要代謝物である5-ヒドロキシインドール酢酸についても性差が見られ、雄のGFマウスでのみレベルの上昇が見られた。一方、新規環境ストレスに応答するコルチコステロンのレベルは、オスとメスの両方のマウスで誇張されていた[99]。免疫系と神経内分泌系の潜在的な関連性を確立する試みとして、LPSで刺激した脾臓細胞からのサイトカイン放出がGFマウスでは鈍化していることが判明しました。サイトカイン形成の減少は性別とは無関係であったことから、血漿コルチコステロンの増加は、むしろGFマウスの免疫学的変化ではなく、神経化学的変化に関連していると推測される。
MSを早期生活ストレスのモデルとして調査した研究では、MSに反応するHPA軸の変化は腸内細菌叢とは無関係であり、行動障害は腸内細菌叢のディスバイオシスと関連していると結論付けている [100]. この結論は、MSによって誘発されるコルチコステロンレベルの上昇はGFマウスとSPFマウスで同等であるのに対し、不安様行動と行動的絶望は腸内細菌叢が存在するMSによってのみ誘発されるという発見に基づくものである[100]。
まとめると、GFマウスではHPA軸の反応性亢進が頻繁に見られると結論づけられる。神経化学的変化や行動など、性別やマウス系統などに依存して変化する他のパラメータとは対照的に、GFマウスやラットでは、これまで限られたGFマウス系統しか試験されていないが、HPA軸の反応性の増加が頻繁に見られる(表(Table22))。
様々なグループが、HPA軸に関連する神経回路の変化とともに、GFマウスにおけるHPA軸の感受性の上昇を実証しているが、この相互作用の方向性は明らかでない。HPA軸は、大脳辺縁系、中脳、脳幹核の神経系や、交感神経系、副交感神経系と相互関係にある[3]。したがって、腸内細菌叢の不足によるストレスホルモンの変調は、神経伝達系に変化を引き起こす可能性がある一方で、他の要因が神経回路に影響を与え、その後にHPA軸に影響を与える可能性もあります。この点で、GFマウスの免疫系の発達障害や代謝の変化は、腸内細菌叢の欠如による神経内分泌の表現型に寄与していると考えられる。
続きはこちら
GFマウスの神経内分泌に関連した行動表現型
GFマウスのHPA軸の反応性の上昇に伴い、GF BALB/c マウスはOFTにおける不安様行動の増加、および自発的な運動活動の増加を示すことが実証されている [101]. しかし、他の2つの報告では、HPA軸の反応性が上昇しているにもかかわらず、明暗箱テストやEPMテストではGFマウスの不安様行動が減少することが示されている[97, 98]。さらに、行動試験(それぞれステップダウンテストとライトプレファレンス)に応じて、GFマウスの不安様行動の増加と減少の両方が認められたという報告もあり、所見の矛盾が明らかにされている[100]。最後に、雄のF344ラットを用いて行われた研究では、OFTで不安様行動の増加が認められました[102]。したがって、採用した行動試験、試験した動物種、遺伝的背景がGFげっ歯類の行動表現型に影響を及ぼすと結論づけることができる。BALB/cマウスやF344ラットのようなストレスに敏感な系統はGF条件下で不安の増加を示すが[101, 102]、スイスマウスやNMRIマウスのような中程度の感情を持つ系統はそうではないように見える[97, 98]。さらに、マウス系統の違いによる行動の違いは、腸内細菌叢にも影響される[103]。したがって、BALB/cマウスからGF NIH Swissマウスへの微生物叢の移植は、NIH Swissの微生物叢によるコロニー形成に対して探索行動を減少させるが、BALB/cマウスをNIH Swissマウスの微生物叢でコロニー形成すると探索行動は増加する[103]。GFマウスにおける不安様行動の評価におけるもう一つの潜在的な交絡因子は、GFマウス [98, 101] およびGFゼブラフィッシュ [104] で一貫して観察されている運動亢進であると考えられる。したがって、運動量の増加は、不安およびうつ病様行動の評価を妨害することができ、逆説的な「抗不安薬様」行動パターンとして誤って解釈される可能性がある [105, 106].
に進む:
潜在的なメカニズムに向けて GFマウスの発達障害
神経内分泌系の変化とは別に、GFマウスは消化管の発達障害を示す(図(Fig.1)1)[107]。興味深いことに、Th17細胞依存性関節炎や実験的自己免疫性脳脊髄炎の動物モデルの重症度は、GFマウスで試験すると顕著に減弱する [108, 109]。一方、GFマウスでは、大腸固有層における不変性ナチュラルキラーT細胞の数が多く、オキサゾロン誘発大腸炎などの不変性ナチュラルキラーT細胞に依存する炎症状態にかかりやすい [110]。免疫系の成熟における微生物叢の役割は、新生児GFマウスに従来の微生物叢をコロニー形成するとオキサゾロン誘発性大腸炎を予防できるが、成体GFマウスにコロニー形成しても予防できない、という観察結果から示されている[110]。
リンパ球の分化不全が、GFマウスの神経内分泌障害にどの程度寄与しているかは明らかではない。しかし、興味深いことに、成熟したBおよびTリンパ球を持たないリコンビナーゼ活性化遺伝子1欠損マウスは、非空間記憶の障害や不安様行動の増加、コルチコステロン濃度の上昇を示す [111] 。また、離乳期以降にL. rhamnosusとL. helveticusを含むプロバイオティクス混合物を投与すると、行動障害が改善され、腸内細菌叢の異常が一部回復するが、コルチコステロン値は上昇したままである [111]. さらに、GFマウスは脳の様々な機能的・生化学的変化を示し [57, 112-114]、これらも神経内分泌や行動障害の発症の要因であると考えられる。そのため、GFマウスの扁桃体のゲノムワイド転写プロファイリングでは、神経細胞活性が上昇する一方で、免疫系関連遺伝子がダウンレギュレーションされる特徴が明らかになった [115]。さらに、GFマウスは扁桃体と海馬が肥大し、扁桃体ニューロンのサブセットの樹状突起肥大が見られるが、海馬ニューロンでは樹状突起萎縮が見られた [116]。また、転写後の遺伝子発現も腸内細菌叢によって制御されていることが実証されている。GFマウスでは、扁桃体と前頭前野のマイクロRNA(miRNA)発現プロファイルに変化が見られるからである [117]。興味深いことに、微生物が誘導する腸管上皮透過性の上昇には、小型グアノシン三リン酸酵素であるアデノシン二リン酸リボシル化因子4のアップレギュレーションを通じて、miRNA miR-21-5pの役割が証明されている [118]。
に進む:
潜在的なメカニズムに向けて GFマウスにおける代謝不全について
腸内細菌叢は宿主の消化と代謝に重要な貢献をしており、ビタミンの重要な供給源である [119]。したがって、GFマウスは、食事に外因性のビタミンKとビタミンBを必要とする [119]。したがって、特に幼少期のような敏感な時期に、微生物相が欠落しているか、あるいは生物相が異常になっている状況下で、脳の高い代謝需要が十分にカバーされているのか、また、食事の欠乏がHPA軸に影響を与えることが知られていることから、これらの潜在的欠乏がどのように長期間の神経内分泌障害に寄与し得るのかという問題が生じる [120-122]。興味深いことに、多価不飽和脂肪酸のエイコサペンタエン酸はGFマウスでは検出されないが [114]、エイコサペンタエン酸を含む多価不飽和脂肪酸混合物の長期補充はMS誘発性ディスバイオシスを逆転させ、急性ストレスに対するコルチコステロン応答を減衰させる [123]. 一方、遊離脂肪酸はラットおよびヒトにおいて、それぞれHPA軸を活性化および抑制することが報告されている[124、125]。
GFマウスの血液中には、他にも多くの代謝物の変化が見られる。例えば、トリプトファンに由来する生理活性インドール含有代謝物の細菌媒介による産生が損なわれる一方で、5-HTの前駆体であるトリプトファンの利用率が上昇する[114]。Clarkeら[99]は、雌ではなく雄のGFマウスの海馬で5-HTレベルの増加を認めたが、雄のGFマウスの前頭前野のメタボローム評価では、5-HTレベルの差は認められなかった[113]。一方、GFマウスでは解糖経路に関与する代謝物が変化しており、GFマウスは従来型マウスに比べて解糖によるエネルギー消費が少ないことが示唆された。変化が見られなかった脳内GABAとは異なり、GFマウスではDA濃度が2倍高く、これらの動物で見られる運動活性の上昇の背景にあることが示唆された[113]。
次へ
抗生物質による腸内細菌叢の操作と神経内分泌システム
GFマウスを飼育した場合、その発達に影響を及ぼす様々なシステムを考慮すると、抗生物質による腸内細菌叢の異常は、発達上の変化を誘発することなく、成体動物の腸内細菌叢を操作する代替方法であり、原因となる異常の時期や重症度を選択できる利点がある。腸内細菌叢の組成はストレスそのものによって変化する可能性があるため[126]、まず抗生物質による腸内細菌叢の異常が神経内分泌、神経化学、行動パラメータに与える影響について述べ、次に異なる急性および慢性ストレスプロトコルと組み合わせた場合の異常の影響について考察する。
こちらへ
抗生物質が誘発する腸内細菌異常症: 神経内分泌、神経化学、行動学的パラメータへの影響
成熟した微生物叢の確立を妨げる初期のディスバイオシスは、微生物叢、HPA軸の発達、および宿主の全体的な健康に長期的な影響を及ぼす可能性がある(表(Table3).3)。GF動物における知見と同様に、いくつかの研究では、抗生物質による腸内環境の異変に反応してコルチコステロン値が上昇することが示されています。Scheerら[127]は、早期の抗生物質処理の役割を調べるために、アンピシリン、ストレプトマイシン、バンコマイシン、メトロニダゾールを含む抗生物質カクテルと人工甘味料スクラロースを妊娠から離乳(P21)までマウスに曝露しました。P7での血清コルチコステロンレベルは、コントロールと抗生物質で処理した仔マウスで同程度であったが、P21とP42での血清コルチコステロンレベルは抗生物質で処理したマウスで増加する傾向にあった。興味深いことに、離乳1週間後(P28)に抗生物質処理マウスをコントロール動物と同居させると、P56で評価した血清コルチコステロン濃度の上昇を逆転させることができた。本研究では腸内細菌叢の組成は調査していないが、この結果は、抗生物質による腸内細菌叢の組成の変化とそれに続くHPA軸への影響が、腸内細菌叢の組成を正常化することによって同居によって逆転しうることを示唆するものと考えられる。また、コルチコステロン値の上昇に加え、粘膜T細胞応答の免疫制御の欠陥によりCD4+ T細胞に反応して大腸炎を発症するリコンビナーゼ活性化遺伝子1欠損マウスに抗生物質処理マウスのCD4+ T細胞を移植すると、ストレス応答、細胞代謝、細胞周期制御、細胞死関連遺伝子の発現が変化し、より早い大腸炎発症を誘導した [128].
表3
抗生物質誘発性ディスバイオシスモデルとその神経内分泌系への影響
抗生物質投与
期間動物モデルストレスモデルHPA軸参考文献AMP(0.5g/l)、ストレプトマイシン(0.5g/l)、バンコマイシン(0.5g/l)、メトロニダゾール(0.5g/l)、
splenda(4g/l)飲料水;
妊娠中および離乳まで(21日目)C57BL/6バックグラウンドのFoxp3レポーターマウス;性別は記載なしストレスなし↔CORT(7日目、血清、胸腺、近位結腸、盲腸)。
(↑)CORT(21日目および42日目、血清)
↑CORT(21日目、42日目、胸腺、近位結腸、盲腸)[127]バシトラシン(24mg/ml)、ネオマイシン(24mg/ml)、AMP(9.6mg/ml)、メロペネム(4.8mg/ml)、バンコマイシン(1.44mg/ml)経口ガベージ;
10日C57BL/6Nマウス;
ストレスなし↑CORT(血漿、投与最終日後)[129]AMP(120mg/kg)
またはAMP(120mg/kg)
およびLactobacillus fermentum NS9
(AMP明期、水/NS9暗期)飲料水;
41日Sprague-Dawley ラット;
ストレスなし↑CORT(AMP、血清、投与最終日のMWM後)
↔GR (HIP)
↓MR (AMP, HIP)[131]Vancomycin 10, 30, or 100 mg/kgOral gavage;
10 日間Sprague-Dawley ラット;
ストレスなし↔CORT(血漿、投与10週後)[132]0.5%ネオマイシン、1%AMP飲水;
12日Wistar rat; ♀急性部分拘束ストレス(2時間) ┤CORT(血漿、ストレス直後)
┤CRF mRNA(HYP)[80]AMP(1 mg/ml)、バンコマイシン(5 mg/ml)、ネオマイシン(10 mg/ml)、メトロニダゾール(10 mg/ml)、アンフォテリシン B(0.1 mg/ml)飲料水を用いた;
59日NIHスイスマウス
急性拘束ストレス(30分)↔CORT(血漿、ストレス直後)
↔CRF mRNA(HYP)[133]AMP(1 g/l)、バンコマイシン(500 mg/l)、シプロフロキサシンHCl(20 mg/l)、
イミペネム(250 mg/l)、メトロニダゾール(1 g/l)飲料水;
13 週間Sprague-Dawley ラット;
♂急性FST↔CORT(FST中)
↓NR3C1 mRNA (AMY, HIP)
↔NR3C2 mRNA (AMY, HIP)
↓CRFR1 mRNA (AMY、HIP)
↔CRFR2 mRNA (AMY, HIP)
FST後3週間[134]硫酸ストレプトマイシン(2mg/ml)、ペニシリンG(1500U/ml)飲水;
21日Sprague-Dawley ラット;
心理的ストレス-慢性軽度ストレス(21日間)┤CORT(血漿、ストレス直後)[135]最小用量:マウス1匹あたり0.4mgバシトラシン、0.4mgネオマイシン、0.1mgアンフォテリシンB/日経口投与及び飲料水;
7日C57BL/6Nマウス;
反復性心理ストレス-WAS(1時間/日、7日間)↔CORT(ストレス直後)
↔副腎の重量[136].
別ウィンドウで開く
↔=変化なし、┤=ストレスによる増加の防止、↓=減少、↑=増加、()=傾向、HPA=視床下部-下垂体-副腎、CORT=コルチコステロン; NS9 = Lactobacillus fermentum NS9; AMP = ampicillin; MWM = Morris water maze; GR = glucocorticoid receptor; HIP = hippocampus; MR = mineralocorticoid receptor; CRF = corticotropin-releasing hormones; HYP=視床下部、FST=強制水泳試験、NR3C1=核内受容体サブファミリー3、グループC、メンバー1(グルココルチコイド受容体)、NR3C2=核内受容体サブファミリー3、グループC、メンバー2(ミネラルコルチコイド受容体)、AMY=扁桃体、CRFR1=コルチコトロピン解放ホルモン受容体1、CRFR2=コルチコトロピン解放ホルモン受容体2、WAS=水分回避ストレス
成体雄マウスを抗生物質カクテル(アンピシリン、バシトラシン、メロペネム、ネオマイシン、バンコマイシン)で10日間処理すると、大腸の微生物組成(16S rDNA)を著しく破壊し、腸-脳軸の様々なレベルに影響を与えることが実証されている [129]. この場合も、抗生物質投与動物では血漿中の基礎コルチコステロン濃度が上昇し、非空間記憶も抗生物質投与によって障害された。さらに、抗生物質投与マウスでは、大腸内容物のSCFAレベルが低下し、血漿中の脂質種および変換菌由来代謝物のレベルが変化した。抗生物質投与動物の脳における遺伝子発現は、部位特異的に変化した。扁桃体および視床下部では、ストレス耐性 [130] を促進するオレキシジェニック神経ペプチドであるNPY mRNAの発現が抗生物質投与マウスで増加し、扁桃体および海馬でNPY受容体の発現が減少した。5-HTトランスポーターとNMDA受容体のサブユニットの発現は抗生物質投与マウスの扁桃体で増加し、BDNF mRNAの発現は内側前頭前野、海馬、視床下部で減少していました。血液中のサイトカイン濃度は抗生物質投与によって増加しなかったが、IL-1βのmRNA発現は海馬と視床下部で減少した。また、扁桃体と海馬における3つのタイトジャンクションタンパク質のmRNA発現パターンは、抗生物質処理によって影響を受けた[129]。これらの知見は、抗生物質による腸内環境の異常に伴うHPA軸活性の上昇が、腸と脳の相互作用の複雑な変化に関連している可能性を示唆している。
アンピシリンのみを投与すると、ラットの糞便微生物叢組成(定量ポリメラーゼ連鎖反応による評価)が顕著に変化し、血清コルチコステロン値が上昇することが示されている [131] 。ラットを明期にはアンピシリンで、暗期には水またはプロバイオティクスL. fermentum NS9(NS9)で処理すると、抗生物質が誘発する血清コルチコステロンの上昇はNS9によって逆転された。海馬のGRとBDNFのレベルは変化しなかったが、ミネラルコルチコイドとNMDA受容体のレベルは抗生物質投与ラットで減少した。NS9を投与すると、同様に海馬のNMDA受容体とミネラルコルチコイド受容体のレベルを正常化することができました。行動レベルでは、抗生物質の単独投与は、軽度の不安様行動と空間記憶保持の欠損を誘発したが、これらの障害は、プロバイオティクスNS9との共処理によって防止された[131]。これらの研究とは対照的に、雄ラットの仔ラットをP4からP13まで異なる濃度のバンコマイシンで処理しても、成体における血漿中のコルチコステロンの基礎レベルには影響しなかったが、内臓感受性と疼痛関連行動はこの抗生物質処理によって用量依存的に増加した [132].さらに、最高用量の100 mg/kgのバンコマイシンを投与されたラットでは、脾臓細胞においてIL-6および好中球の基礎レベルが上昇したが、全血におけるサイトカインレベルには差が認められなかった [132].
に行く:
急性または慢性ストレス因子との組み合わせによる抗生物質誘発性ディスバイオーシス
HPA軸に対する急性ストレスの影響を調査する抗生物質誘発性ディスバイオシス研究では、基礎およびストレス誘発性のコルチコステロンレベルを測定する機会がある。Ait-Belgnaouiら[80]は、急性部分拘束ストレス(2時間)を受けた雌ラットの血漿中のコルチコステロン濃度の増大を、12日間の抗生物質処理(アンピシリン、ネオマイシン)で防止することを示した。さらに、抗生物質の投与は、ストレスによって誘発された視床下部でのCRF、IL-1β、IL-6、TNF-α mRNA発現の増加を逆転させることができた。腸内環境の異常は調べられなかったが、門脈血中のLPSの濃度は抗生物質投与動物で有意に減少した[80]。Desbonnetら[133]は、離乳期から抗生物質を投与し、犠牲直前の動物に急性拘束ストレス(30分)を与えることで、抗生物質誘発性腸内細菌異常症モデルを検討しました。抗生物質は、ストレスによって誘発される細菌数と多様性の増加を抑制した。抗生物質投与は、ベースラインおよび急性拘束ストレス後の視床下部CRF mRNA発現に影響を与えず、コルチコステロン値の血漿レベルも変化させなかったが、行動およびHPA軸関連システムの変化が観察された [133]. このように、海馬のBDNF mRNAと視床下部のバソプレシン mRNAの発現は抗生物質処理によって減少した[133]。抗生物質投与は、海馬のNE、および扁桃体のL-3,4-ジヒドロキシフェニルアラニンおよびDA代謝物ホモバニリック酸のレベルをさらに上昇させた[133]。別の研究では、成体雄ラットを抗生物質カクテル(アンピシリン、バンコマイシン、シプロフロキサシン、イミペネム、メトロニダゾール)で13週間治療し、その間、急性ストレス要因として強制水泳試験を1回実施した [134]. 抗生物質の長期投与は、基礎およびストレス誘発性コルチコステロン濃度を変化させなかったが、抗生物質投与動物では、ストレス誘発性糞便排出量が増加した。GR mRNAとCRFR1 mRNAのレベルは、抗生物質処理ラットの扁桃体と海馬で減少したが、BDNF mRNAの発現は抗生物質処理ラットの扁桃体で増加した [134]. 行動レベルでは、抗生物質投与はうつ病様行動を増加させ、空間記憶障害を引き起こし、いくつかの脳領域におけるモノアミンレベルに影響を与えた[134]。
慢性的な軽いストレス(21日間)にさらされた時の抗生物質処理(ペニシリンG、硫酸ストレプトマイシン)の効果を調査した研究では、抗生物質が成体雄ラットの血漿中のコルチコステロン濃度のストレスによる上昇を防ぐことができることが観察されました[135]。さらに、ストレス動物において、抗生物質投与により、ストレスに起因する皮質の炎症メディエーターレベル(シクロオキシゲナーゼ-2、IL-1β、プロスタグランジンE2など)の上昇が抑制されたことから、抗生物質投与は脳内で抗炎症効果を発揮したことが確認されます。このような抗炎症作用と同様に、抗生物質の投与は、前頭前野における抗炎症メディエーター15-deoxy-delta12,14-prostaglandin J2のストレス誘発性の減少をブロックした。また、ストレスによって誘発された皮質の核因子κBレベルの変化も、抗生物質投与によって阻止された。興味深いことに、うつ病様行動は抗生物質処理によって影響を受けなかったが、修正強制水泳試験中に排泄された糞便ボリの数は、ストレスプロトコルとは無関係に抗生物質処理したマウスで増加した[135]。腸内環境の異常は調べられませんでしたが、ストレスによって誘発された血漿中のLPSとLPS結合タンパク質の濃度の上昇は、抗生物質処理動物で防止されました。これらの結果と同様に、ストレスによって誘発された前頭前野のTLR4濃度の上昇は、抗生物質処理によって阻止された[135]。
WASを反復的な心理的ストレッサー(7日間)として用いた別の研究では、抗生物質による異食は慢性ストレスに対する内分泌反応を変化させないが、ストレスを受けた雌マウスに見られる内臓痛関連反応の亢進を防ぐことを示した[136]。いくつかの炎症マーカー(IL-6、TNF-α)は変化しなかったが、セカール内腔の分泌性免疫グロブリンAレベルは、ストレスとは無関係に抗生物質処理動物で増加した [136]。
ここでレビューした研究では、抗生物質によるディスバイオシスがHPA軸活性に及ぼす影響は一貫しておらず、腸内細菌叢と神経内分泌系の相互作用について包括的な枠組みを提案することは困難である(図(3).3)。この点で一貫性のない知見は、動物の種、系統、性別の違い、抗生物質の選択、および/または治療レジメンなど、多くの交絡因子に関連していると考えられる。抗生物質の効果を腸内細菌叢の組成の特定の変化に絞り込むことは、細菌叢の組成が決定されていない、あるいは部分的にしか決定されていない、あるいはベースライン時の微生物群集が試験ごとに異なるため、しばしば不可能である。さらに、次節で述べるように、抗生物質そのものが観察されたパラメータに影響を及ぼす可能性も否定できない。
図3
視床下部-下垂体-副腎(HPA)軸に対する腸内細菌叢の操作の効果。腸内細菌叢の操作により、基礎条件下または様々なストレス要因に応答して、HPA軸を活性化(+)または抑制(-)することができる ()
へ行く:
GFと抗生物質誘発性ディスバイオシスモデルの比較
現在の微生物相研究の大きな課題の一つは、特定の生理的および病態生理学的プロセスにおける腸内細菌相の因果関係を証明する証拠を得ることである。この問題に対する主な実験的アプローチは、現在、一方ではGFげっ歯類、他方では抗生物質投与による腸内細菌異常症の動物の使用にかかっています。どちらのアプローチにも利点と欠点があり、GFの状態をヒトで研究することができないことから、そのトランスレーショナルな価値にも違いがある。抗生物質投与によるディスバイオシスモデルは、従来型/正常な微生物相で生まれ育った動物において、微生物の変化とその(病的)生理学的影響を研究する機会を提供します。抗生物質を用いた有効な研究を行うには、抗生物質の選択とその薬物動態に特別な注意を払う必要がある。なぜなら、抗生物質自体が研究対象のプロセス(例えば、神経内分泌反応)に直接影響を与える可能性があるからである。したがって、消化管から吸収されないか、あるいは最小限にとどまる抗生物質を選択し、使用する実験動物種でその条件を検証することが重要である [137] 。この点で、Bercikら[103]が追求したアプローチは、マウスの行動と脳生化学における抗生物質誘発性ディスバイオシスの影響を研究するためのベンチマークモデルである。SPFマウスに抗生物質ミックスを経口投与すると、腸内細菌の異常が起こり、探索行動が増加し、脳のBDNFレベルが変化することがわかった。抗生物質による行動障害に腸内細菌叢が関与していることは、抗生物質を腹腔内ではなく経口投与した場合にのみ腸内細菌叢の異常と行動変化が見られるという発見によって検証された。また、抗生物質ミックスを経口投与したGFマウスでは、行動変化は観察されなかった[103]。血液や研究対象の臓器における抗生物質の存在を測定することは、抗生物質の作用部位を特定し、脳のような臓器への直接的な影響を除外するためのさらなるアプローチである[129]。消化管から容易に吸収され、血液脳関門を通過することさえ可能な抗生物質を含む研究は、したがって、腸内細菌叢、脳機能、および行動との関係については結論が出ていない。例えば、抗生物質のメトロニダゾール[137, 138]は、腸から吸収されて脳に入るだけでなく、神経毒性を発揮する可能性がある[139, 140]など、このような不確実性が当てはまる。
次へ
結論
プロバイオティクスや非吸収性抗生物質の経口投与を含む研究や、GF動物の分析から、腸内細菌叢と神経内分泌系の多方向的な相互作用が明らかになった。神経内分泌生理学に対するプロバイオティクスの恒常性維持効果の実証は、治療介入の新たな可能性を示唆するものであり、トランスレーショナルバリューが高い。実際、前臨床試験のデータの大半は、特定のプロバイオティクス株が、特にストレス条件下で腸-脳軸に有益な効果を発揮する可能性を裏付けています。この有益な効果は、プロバイオティクスの免疫調節作用と、腸関門を通過する微生物成分の腸内移行を減少させる能力によって媒介されると思われます。しかし、このような有望な証拠にもかかわらず、これらのプロバイオティクス菌株の臨床効果だけでなく、その基礎となるメカニズムが証明されることはまだありません。HPA軸の活性に対するプロバイオティクスの主な抑制効果とは対照的に、HPA軸の活性上昇はGFマウスの一貫した所見であり、これは生後早期に一定の時間枠内で腸をコロニー形成すると回復することができます。この観察は、HPA軸の発達と制御における腸内細菌叢の中心的な役割を示唆しているが、免疫系、腸機能、代謝、脳の発達など、GFマウスで影響を受ける多くのシステムを考えると、その根本的なプロセスはまだ解明されていない。最後に、抗生物質の経口投与による腸内細菌叢の操作も、神経内分泌系に影響を与えることが証明されていますが、その方法はやや異なっています。一方では、GF環境と同様に、抗生物質による腸内細菌叢の破壊はコルチコステロン値を上昇させることが報告されている。一方では、プロバイオティクスの効果と同様に、ストレス条件下での抗生物質による腸内細菌叢の減少による保護効果も示されている。後者の効果は、ストレスに応答して微生物に関連した免疫系の活性化が減少することで説明できると考えられる。このように、抗生物質の経口投与は、腸内細菌叢や神経内分泌系に有益または有害な影響を及ぼす可能性があり、それは腸内細菌叢の既存の組成、抗生物質との相互作用、抗生物質の標的外作用(例えば、免疫・内分泌系や中枢神経系に対する微生物とは無関係な作用)および環境の影響に依存する。
腸内細菌叢と神経内分泌系の双方向のコミュニケーションを支える正確なメカニズムを解明することは、腸内細菌叢を制御することで神経内分泌系の疾患に対する新たな治療の可能性をもたらすと考えられます。
に移動します:
電子補足資料
ESM 1(1.1M, pdf)
(PDF 1224 kb)
こちらへ
謝辞
グラーツ医科大学からオープンアクセス資金を提供された。著者らの研究室での作業は、オーストリア科学基金(FWF助成金P23097-B18、P25912-B23、W1241-B18)およびオーストリア研究振興庁(FFG)のCBmed K1 Competence Centre内の支援を受けています。
必要な著者フォーム
著者から提供された情報開示フォームは、本論文のオンライン版で入手可能です。
にアクセスしてください:
脚注
電子補足資料
本論文のオンライン版(10.1007/s13311-017-0600-5)には補足資料が含まれており、正規ユーザーが利用可能です。
に移動します:
参考文献
神経内分泌系:組織と恒常性の役割。J Endocrinol Invest. 2004;27(6 Suppl):35-47. [PubMed] [Google Scholar].
Prevot V. 神経内分泌系の可塑性. Eur J Neurosci. 2010;32(12):1987–1988. [PubMed] [Google Scholar] 3.
Smith SM, Vale WW. ストレスに対する神経内分泌反応における視床下部-下垂体-副腎軸の役割。Dialogues Clin Neurosci. 2006;8(4):383-395. [PMC free article] [PubMed] [Google Scholar].
Keller-Wood ME, Dallman MF. 副腎皮質ホルモンによるACTH分泌の抑制。Endocr Rev. 1984;5(1):1-24. [PubMed] [Google Scholar]を参照。
Dinan TG, Cryan JF. 腸内細菌叢によるストレス反応の制御:精神神経内分泌学への示唆。Psychoneuroendocrinology. 2012;37(9):1369–1378. [PubMed] [Google Scholar].
O'Mahony SM, Clarke G, Dinan TG, Cryan JF. 早世の逆境と脳の発達: マイクロビオームはパズルの欠片か?Neuroscience. 2017;342:37-54. [PubMed] [Google Scholar].
Juruena MF, Bocharova M, Agustini B, Young AH. 非定型うつ病と非定型うつ病: HPA軸機能はバイオマーカーになるか?システマティックレビュー。J Affect Disord. 2017 Oct 6 [Epub ahead print]. [PubMed].
Videlock EJ, Shih W, Adeyemo M, et al. 性と過敏性腸症候群がHPA軸反応と末梢グルココルチコイド受容体発現に及ぼす影響. Psychoneuroendocrinology. 2016;69:67-76. [PMC free article] [PubMed] [Google Scholar].
Whitehead WE, Crowell MD, Robinson JC, Heller BR, Schuster MM. ストレスフルなライフイベントが腸の症状に及ぼす影響:過敏性腸症候群の被験者と腸の機能障害のない被験者の比較。Gut. 1992;33(6):825-830. [PMC free article] [PubMed] [Google Scholar].
Bradford K, Shih W, Videlock EJ, et al. Early adverse life events and irritable bowel syndrome間の関連性。Clin Gastroenterol Hepatol. 2012;10(4):385–90.e1-e3. [PMC free article] [PubMed] [Google Scholar].
セロトニンから神経可塑性へ:大うつ病性障害に対する理論の進化。Front Cell Neurosci. 2017;11:305. [PMC free article] [PubMed] [Google Scholar].
Heim C, Newport DJ, Heit S, et al. 小児期の性的・身体的虐待を受けた女性のストレスに対する下垂体・副腎・自律神経反応. JAMA. 2000;284(5):592-597. [PubMed] [Google Scholar].
de Punder K, Pruimboom L. Stress induces endotoxemia and low-grade inflammation by increasing barrier permeability. Front Immunol. 2015;6:223. [PMC free article] [PubMed] [Google Scholar].
Kelly JR, Kennedy PJ, Cryan JF, Dinan TG, Clarke G, Hyland NP. Breaking down the barriers: the gut microbiome, intestinal permeability and stress-related psychiatric disorders. Front Cell Neurosci. 2015;9:392. [PMC free article] [PubMed] [Google Scholar].
Camilleri M, Lasch K, Zhou W. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. 過敏性腸症候群における透過性亢進、炎症、痛みの合流点。Am J Physiol Gastrointest Liver Physiol.2012;303(7):G775-G785. [PubMed][Google Scholar].
Slyepchenko A, Maes M, Jacka FN, et al. 腸内細菌叢、細菌転流、食事との相互作用:大うつ病性障害と非感染性医学的併存疾患の病態生理学的関連性. Psychother Psychosom. 2017;86(1):31-46. [PubMed] [Google Scholar].
Rajilic-Stojanovic M, Jonkers DM, Salonen A, et al. IBSにおける腸内細菌叢と食事:原因、結果、またはエピフェノメナ?Am J Gastroenterol. 2015;110(2):278-287. [PMC free article] [PubMed] [Google Scholar].
コリンズSM. 過敏性腸症候群における腸内細菌叢。Int Rev Neurobiol. 2016;131:247-261. [PubMed][Google Scholar].
Kelly JR, Borre Y, O'Brien C, et al. Transferring the blues: うつ病に関連する腸内細菌叢は、ラットの神経行動学的変化を誘発する。J Psychiatr Res. 2016;82:109-118. [PubMed]を参照してください。
Naseribafrouei A, Hestad K, Avershina E, et al. ヒトの糞便微生物叢とうつ病の相関性. Neurogastroenterol Motil. 2014;26(8):1155–1162. [PubMed][Google Scholar].
Jiang H, Ling Z, Zhang Y, et al. Altered fecal microbiota composition in patients with major depressive disorder. Brain Behav Immun. 2015;48:186-194. [PubMed] [Google Scholar].
Zheng P, Zeng B, Zhou C, et al. 腸内細菌叢のリモデリングは、宿主の代謝を介した経路でうつ病様行動を誘発する。Mol Psychiatry. 2016;21(6):786-796. [PubMed][Google Scholar].
De Palma G, Lynch MD, Lu J, et al. 過敏性腸症候群患者からの糞便微生物叢の移植は、レシピエントマウスの腸の機能と行動を変化させる。Sci Transl Med. 2017;9(379). [PubMed】をご参照ください。]
Doolin K, Farrell C, Tozzi L, Harkin A, Frodl T, O'Keane V. Diurnal hypothalamic-pituitary-adrenal axis measures and inflammatory marker correlates in major depressive disorder. Int J Mol Sci. 2017;18(10). [PMC無料記事】【PubMed】をご覧ください。
Holzer P, Reichmann F, Farzi A, Neuropeptide Y. peptide YY and pancreatic polypeptide in the gut-brain axis. Neuropeptides. 2012;46(6):261-274. [PMC free article] [PubMed] [Google Scholar].
クラークG、スティリングRM、ケネディPJ、スタントンC、クライアンJF、ディナンTG。Minireview:腸内細菌叢:無視された内分泌器官。Mol Endocrinol. 2014;28(8):1221–1238. [PMC free article] [PubMed] [Google Scholar].
El Aidy S, Dinan TG, Cryan JF. 腸内細菌叢:免疫-神経内分泌コミュニケーションのオーケストラにおける指揮者。Clin Ther. 2015;37(5):954-967. [PubMed] [Google Scholar].
Sherwin E, Sandhu KV, Dinan TG, Cryan JF. May the force be with you: the light and dark sides of the microbiota-gut-brain axis in neuropsychiatry. CNS Drugs. 2016;30(11):1019–1041. [PMC free article] [PubMed] [Google Scholar].
Meaney MJ, Aitken DH, Bhatnagar S, Sapolsky RM. 生後処理により、雌ラットの老化に伴う特定の神経内分泌、解剖学的、認知機能障害が減衰する。Neurobiol Aging. 1991;12(1):31-38. [PubMed] [Google Scholar].
Singh-Taylor A, Molet J, Jiang S, et al. NRSF依存エピジェネティック機構は、新生児経験によるストレス感受性ニューロンのプログラミングに寄与し、レジリエンスを促進する。Mol Psychiatry 2017 Jan 10 [Epub ahead of print]. [PMCフリー記事] [PubMed]を参照。
van Bodegom M, Homberg JR, Henckens M. Modulation of the hypothalamic-pituitary-adrenal axis by early life stress exposure. Front Cell Neurosci. 2017;11:87. [PMC free article] [PubMed] [Google Scholar].
Levitt NS, Lindsay RS, Holmes MC, Seckl JR. 妊娠最終週のデキサメタゾンは、ラットの海馬グルココルチコイド受容体遺伝子発現を減衰させ、成体子孫の血圧を上昇させる。Neuroendocrinology. 1996;64(6):412-418. [PubMed] [Google Scholar].
Sadler TR, Nguyen PT, Yang J, et al. Antenatal maternal stress alters functional brain responses in adult offspring during conditioned fear. Brain Res. 2011;1385:163-174. [PMC free article] [PubMed] [Google Scholar].
Son GH, Geum D, Chung S, et al. Maternal stress produces learning deficits associated with impairment of NMDA receptor-mediated synaptic plasticity. J Neurosci. 2006;26(12):3309–3318. [PMC free article] [PubMed] [Google Scholar].
Sowa J, Bobula B, Glombik K, Slusarczyk J, Basta-Kaim A, Hess G. Prenatal stress enhances excitatory synaptic transmission and impairs long-term potentiation in the frontal cortex of adult offspring rats. PLOS ONE. 2015;10(3):e0119407. [PMC free article] [PubMed] [Google Scholar].
Herman JP, McKlveen JM, Ghosal S, et al. 視床下部-下垂体-副腎皮質ストレス応答の制御. Compr Physiol. 2016;6(2):603-621. [PMC free article] [PubMed] [Google Scholar].
Holzer P, Wultsch T, Edelsbrunner M, et al. 胃炎マウスにおける胃酸による脳幹への求心性入力の増加. Neuroscience. 2007;145(3):1108–1119. [PMC free article] [PubMed] [Google Scholar].
Dantzer R, O'Connor JC, Freund GG, Johnson RW, Kelley KW. 炎症から病気やうつ病へ:免疫系が脳を従わせるとき。Nat Rev Neurosci. 2008;9(1):46-56. [PMC free article] [PubMed] [Google Scholar].
Danese A, Baldwin JR. 隠された傷?幼少期のトラウマと精神病理学との間の炎症性リンク。Annu Rev Psychol. 2017;68:517-544. [PubMed][Google Scholar]。
シャツクリフEA、コーCL、ポラックSD. 幼児期のストレスは、単純ヘルペスウイルス1型に対する抗体レベルの上昇と関連している。Proc Natl Acad Sci U S A. 2009;106(8):2963-2967. [PMC free article] [PubMed] [Google Scholar].
Weaver IC, Cervoni N, Champagne FA, et al. 母性行動によるエピジェネティックプログラミング。Nat Neurosci. 2004;7(8):847-854. [PubMed] [Google Scholar].
Klengel T, Mehta D, Anacker C, et al. Allele-specific FKBP5 DNA demethylation mediates gene-childhood trauma interactions. Nat Neurosci. 2013;16(1):33-41. [PMC free article] [PubMed] [Google Scholar].
Bailey MT, Coe CL. 母子分離は乳児アカゲザルの腸内細菌叢の完全性を崩壊させる。Dev Psychobiol. 1999;35(2):146-155. [PubMed] [Google Scholar].
Lyte M, Ernst S. Catecholamine induced growth of gram negative bacteria. Life Sci. 1992;50(3):203-212. [PubMed] [Google Scholar].
Serrats J, Schiltz JC, Garcia-Bueno B, van Rooijen N, Reyes TM, Sawchenko PE. 免疫から脳へのシグナル伝達における血管周囲マクロファージの二重の役割。Neuron. 2010;65(1):94-106. [PMC free article] [PubMed] [Google Scholar].
Arentsen T, Qian Y, Gkotzis S, et al. 細菌ペプチドグリカン感知分子Pglyrp2が脳の発達と行動を調節する。Mol Psychiatry. 2017;22(2):257-266. [PMC free article] [PubMed] [Google Scholar].
Clarke TB, Davis KM, Lysenko ES, Zhou AY, Yu Y, Weiser JN. Nod1による微生物叢からのペプチドグリカンの認識は、全身の自然免疫力を高める。Nat Med. 2010;16(2):228-231. [PMC free article] [PubMed] [Google Scholar].
NOD1またはNOD2の活性化とTLR4の活性化がマウスの病気行動に及ぼす相乗効果と免疫および脳活動マーカーとの関連。Brain Behav Immun. 2015;44:106-120. [PMC free article] [PubMed] [Google Scholar].
Mayerhofer R, Frohlich EE, Reichmann F, et al. マウスにおける神経炎症、血液脳関門破壊、不安に対するリポテイコ酸およびリポポリサッカライドの多様な作用。Brain Behav Immun. 2017;60:174-187. [PMC free article] [PubMed] [Google Scholar].
シャンクス N、ラロック S、ミーニー MJ. 新生児エンドトキシン曝露は視床下部-下垂体-副腎軸の発達を変化させる:初期の病気とストレスに対する後の反応性。J Neurosci. 1995;15(1 Pt 1):376-384. [PMC free article] [PubMed] [Google Scholar].
Mouihate A, Galic MA, Ellis SL, Spencer SJ, Tsutsui S, Pittman QJ. 早期のtoll-like receptor 4の活性化により、神経の抗炎症経路が再プログラムされる。J Neurosci. 2010;30(23):7975–7983. [PMC free article] [PubMed] [Google Scholar].
Ong LK, Fuller EA, Sominsky L, Hodgson DM, Dunkley PR, Dickson PW. 早世末梢リポポリサッカライドチャレンジはカテコールアミン作動性ニューロンをリプログラムする。Sci Rep. 2017;7:40475. [PMC free article] [PubMed] [Google Scholar].
Chang PV, Hao L, Offermanns S, Medzhitov R. The microbial metabolite butyrate regulates intestinal macrophage function via histone deacetylase inhibition. Proc Natl Acad Sci U S A. 2014;111(6):2247-2252. [PMC free article] [PubMed] [Google Scholar].
酪酸とトリコスタチンAは、ヒト末梢血単核細胞における核因子κB活性化と腫瘍壊死因子α分泌を減衰させ、プロスタグランジンE2分泌を増加させる。Nutr Res. 2008;28(5):321-328. [PubMed][Google Scholar].
酪酸は大腸制御性T細胞の分化を誘導する。Nature. 2013;504(7480):446–450. [PubMed] [Google Scholar].
ルークスMG、ギャレットWS. 腸内細菌叢、代謝産物、宿主免疫。Nat Rev Immunol. 2016;16(6):341-352. [PMC free article] [PubMed] [Google Scholar].
Erny D, Hrabe de Angelis AL, Jaitin D, et al. 宿主微生物叢はCNSのミクログリアの成熟と機能を絶えず制御している。Nat Neurosci. 2015;18(7):965-977. [PMC free article] [PubMed] [Google Scholar].
Castillo-Ruiz A, Mosley M, George AJ, et al. 微生物は周産期マウス脳における細胞死とミクログリアのコロニー形成に影響を与える. Brain Behav Immun. 2018;67:218-229. [PMC free article] [PubMed] [Google Scholar].
Bilimoria PM, Stevens B. Microglia function during brain development: new insights from animal models. Brain Res. 2015;1617:7-17. [PubMed】【Google Scholar】。
Schroeder FA, Lin CL, Crusio WE, Akbarian S. Antidepressant-like effects of the histone deacetylase inhibitor, sodium butyrate, in the mouse. Biol Psychiatry. 2007;62(1):55-64. [PubMed] [Google Scholar].
Han A, Sung YB, Chung SY, Kwon MS. 酪酸ナトリウムの抗うつ剤様メカニズムの追加可能性:海馬を標的とする。Neuropharmacology. 2014;81:292-302. [PubMed] [Google Scholar].
デ・シルバA、ブルームSR. 腸内ホルモンと食欲制御:肥満の治療標的としてのPYYとGLP-1に着目して。Gut Liver. 2012;6(1):10-20. [PMC free article] [PubMed] [Google Scholar].
Brooks、Viardot A、Tsakmaki A、他 発酵性炭水化物はFFAR2依存的な大腸PYY細胞拡大を刺激して満腹感を増大させる。Mol Metab. 2017;6(1):48-60. [PMC free article] [PubMed] [Google Scholar].
Breton J, Tennoune N, Lucas N, et al. 腸内常在性大腸菌タンパク質は、栄養誘導性細菌増殖に続いて宿主の満腹経路を活性化する。Cell Metab. 2016;23(2):324-334. [PubMed][Google Scholar].
Tennoune N, Chan P, Breton J, et al. Bacterial ClpB heat-shock protein, anorexigenic peptide α-MSH の抗原模倣体、摂食障害の起源にある. Transl Psychiatry. 2014;4:e458. [PMC free article] [PubMed] [Google Scholar].
Duca FA, Swartz TD, Sakar Y, Covasa M. Increased oral detection, but decreased intestinal signaling for fats in mice lacking gut microbiota. PLOS ONE. 2012;7(6):e39748. [PMC free article] [PubMed] [Google Scholar].
Schele E, Grahnemo L, Anesten F, Hallen A, Backhed F, Jansson JO. 腸内細菌叢はレプチン感受性を低下させ、中枢神経系における肥満抑制神経ペプチドであるプログルカゴン(Gcg)および脳由来神経栄養因子(Bdnf)の発現を抑制する。Endocrinology. 2013;154(10):3643–3651. [PubMed][Google Scholar].
Holzer P, Farzi A. Neuropeptides and the microbiota-gut-brain axis. Adv Exp Med Biol. 2014;817:195-219. [PMC free article] [PubMed] [Google Scholar].
Dhakal R, Bajpai VK, Baek KH. 微生物によるギャバ(γ-アミノ酪酸)の生産:レビュー。Braz J Microbiol. 2012;43(4):1230–12s41. [PMC free article] [PubMed] [Google Scholar].
マウスの腸管内腔における生理活性の高い遊離カテコールアミンの産生には、腸内細菌叢が重要な役割を果たす.Am J Physiol Gastrointest Liver Physiol.2012;303(11):G1288-G1295. [PubMed] [Google Scholar].
Mazzoli R, Pessione E. The neuro-endocrinological role of microbial glutamate and GABA signaling. Front Microbiol. 2016;7:1934. [PMC free article] [PubMed] [Google Scholar].
Moya-Perez A, Perez-Villalba A, Benitez-Paez A, Campillo I, Sanz Y, ビフィドバクテリウムCECT. 7765は、マウスの初期ストレス誘発性免疫、神経内分泌、行動変化を調節する。Brain Behav Immun. 2017;65:43-56. [PubMed][Google Scholar].
Agusti A, Moya-Perez A, Campillo I, et al. Bifidobacterium pseudocatenulatum CECT 7765 ameliorates neuroendocrine alterations associated with an exaggerated stress response and anhedonia in obese mouse. Mol Neurobiol 2017 Sep 18 [Epub ahead of print]. [PubMed]を参照してください。
Desbonnet L, Garrett L, Clarke G, Kiely B, Cryan JF, Dinan TG. うつ病の母体分離モデルにおけるプロバイオティクスBifidobacterium infantisの効果. Neuroscience. 2010;170(4):1179–1188. [PubMed] [Google Scholar].
Savignac HM, Kiely B, Dinan TG, Cryan JF. ビフィズス菌はBALB/cマウスのストレス関連行動と生理に菌株特異的な影響を及ぼす。Neurogastroenterol Motil. 2014;26(11):1615–1627. [PubMed] [Google Scholar].
Barouei J, Moussavi M, Hodgson DM. 過敏性腸症候群のラットモデルにおけるHPA軸、免疫、腸内細菌叢に対する母親のプロバイオティクス介入の影響。PLOS ONE. 2012;7(10):e46051. [PMC free article] [PubMed] [Google Scholar].
乳酸菌の摂取は迷走神経を介してマウスの情動行動と中枢性GABA受容体の発現を制御する。Proc Natl Acad Sci U S A. 2011;108(38):16050-16055. [PMC free article] [PubMed] [Google Scholar].
Bharwani、Mian MF、Surette MG、Bienenstock J、Forsythe P. Lactobacillus rhamnosusの経口投与は、慢性社会ストレスにおける行動障害と免疫変化を減弱させる。BMC Med. 2017;15(1):7. [PMC free article] [PubMed] [Google Scholar].
Kelly JR, Allen AP, Temko A, et al. Lost in translation? 潜在的なサイコバイオティクスであるラクトバチルス・ラムノサス(JB-1)は、健康な男性被験者のストレスや認知パフォーマンスを変調させることができない。Brain Behav Immun. 2017;61:50-59. [PubMed][Google Scholar]。
Ait-Belgnaoui A, Durand H, Cartier C, et al. Prevention of gut leakiness by a probiotic treatment leads to attenuated HPA response to an acute psychological stress in rats. Psychoneuroendocrinology. 2012;37(11):1885–1895. [PubMed] [Google Scholar].
Ait-Belgnaoui A, Colom A, Braniste V, et al. Probiotic gut effect prevents the chronic psychological stress-induced brain activity abnormality in mice. Neurogastroenterol Motil. 2014;26(4):510-520. [PubMed][Google Scholar].
Gareau MG, Jury J, MacQueen G, Sherman PM, Perdue MH. ラット仔のプロバイオティクス処理は、コルチコステロン放出を正常化し、母体分離によって誘発される大腸機能不全を改善する。Gut. 2007;56(11):1522–1528. [PMC free article] [PubMed] [Google Scholar].
L. fermentum CECT 5716は、新生児ラットのストレスによる腸管バリア機能不全を予防する。Neurogastroenterol Motil. 2017;29(8). [PubMed】をご参照ください。]
Abildgaard A, Elfving B, Hokland M, Wegener G, Lund S. Probiotic treatment reduces depressive-like behaviour in rats independently of diet. Psychoneuroendocrinology. 2017;79:40-48. [PubMed][Google Scholar]。
Rothhammer V, Mascanfroni ID, Bunse L, et al. タイプIインターフェロンとトリプトファンの微生物代謝物は、アリール炭化水素受容体を介してアストロサイトの活性と中枢神経系の炎症を調節する。Nat Med. 2016;22(6):586-597. [PMC free article] [PubMed] [Google Scholar].
Andersson H, Tullberg C, Ahrne S, et al. Lactobacillus plantarum 299vの経口投与は、試験誘発ストレス時のヒト唾液中のコルチゾールレベルを低減する:無作為化二重盲検比較試験。Int J Microbiol. 2016;2016:8469018. [PMC free article] [PubMed] [Google Scholar].
Messaoudi M, Lalonde R, Violle N, et al. プロバイオティクス製剤(Lactobacillus helveticus R0052 and Bifidobacterium longum R0175)のラットおよびヒトにおける向精神薬的特性の評価。Br J Nutr. 2011;105(5):755-764. [PubMed] [Google Scholar].
Allen AP, Hutch W, Borre YE, et al. Bifidobacterium longum 1714 as a translational psychobiotic: modulation of stress, electrophysiology and neurocognition in healthy volunteition. Transl Psychiatry. 2016;6(11):e939. [PMC free article] [PubMed] [Google Scholar].
Burokas A, Arboleya S, Moloney RD, et al. Targeting the microbiota-gut-brain axis: prebiotics has anxiolytic and antidepressant-like effects and reverse the impact of chronic stress in mice. Biol Psychiatry. 2017;82(7):472-487. [PubMed] [Google Scholar].
Schmidt K, Cowen PJ, Harmer CJ, Tzortzis G, Errington S, Burnet PW. プレバイオティクスの摂取は、健康なボランティアにおいて、起床時のコルチゾール反応を減少させ、感情バイアスを変化させる。Psychopharmacology (Berl). 2015;232(10):1793–1801. [PMC free article] [PubMed] [Google Scholar].
Barrera-Bugueno C, Realini O, Escobar-Luna J, et al. 健常幼若ラットに対する乳酸菌、イヌリン、シンバイオティックの不安抑制効果。ニューロサイエンス. 2017;359:18-29. [PubMed] [Google Scholar].
Lu B, Nagappan G, BDNF LY. シナプス可塑性、認知機能、機能障害. Handb Exp Pharmacol. 2014;220:223-250. [PubMed][Google Scholar].
須藤直樹、千田陽子、相葉陽子、他:出生後の微生物コロニー形成は、マウスのストレス応答に関する視床下部-下垂体-副腎系をプログラムする。J Physiol. 2004;558(Pt 1):263-275. [PMC free article] [PubMed] [Google Scholar].
Duman RS. うつ病の病態生理と革新的治療:グルタミン酸作動性シナプス結合のリモデリング。Dialogues Clin Neurosci. 2014;16(1):11-27. [PMC free article] [PubMed] [Google Scholar].
Cohen SM, Tsien RW, Goff DC, Halassa MM. 統合失調症の病態生理におけるNMDA受容体低機能のGABA作動性ニューロンへの影響。Schizophr Res. 2015;167(1-3):98-107. [PMC free article] [PubMed] [Google Scholar].
Roceri M, Hendriks W, Racagni G, Ellenbroek BA, Riva MA. 早期母性剥奪はラット海馬のBDNFとNMDA受容体サブユニットの発現を低下させる。Mol Psychiatry. 2002;7(6):609-616. [PubMed] [Google Scholar].
Diaz Heijtz R, Wang S, Anuar F, et al. Normal gut microbiota modulates brain development and behaviour. Proc Natl Acad Sci U S A. 2011;108(7):3047-3052. [PMC free article] [PubMed] [Google Scholar].
Neufeld KM, Kang N, Bienenstock J, Foster JA. 無菌マウスにおける不安様行動の低減と中枢神経化学的変化。Neurogastroenterol Motil. 2011;23(3):255-264. [PubMed] [Google Scholar].
Clarke G, Grenham S, Scully P, et al. 幼少期の微生物-腸-脳軸は、海馬のセロトニン作動系を性依存的に調節する。Mol Psychiatry. 2013;18(6):666-673. [PubMed] [Google Scholar].
De Palma G, Blennerhassett P, Lu J, et al. Microbiota and host determinants of behavioural phenotype in maternally separated mouse. Nat Commun. 2015;6:7735. [PubMed][Google Scholar]。
西野理恵子、三上和彦、高橋秀樹、他:培養法にて確認された厳密なコンタミネーションフリー環境下での通性微生物相によるマウス行動の変調。Neurogastroenterol Motil. 2013;25(6):521-528. [PubMed] [Google Scholar].
Crumeyrolle-Arias M, Jaglin M, Bruneau A, et al. 腸内細菌叢の欠乏はラットの急性ストレスに対する不安様行動と神経内分泌反応を増強する. Psychoneuroendocrinology. 2014;42:207-217. [PubMed][Google Scholar].
Bercik P, Denou E, Collins J, et al. 腸内細菌叢はマウスの脳由来神経刺激因子の中枢レベルおよび行動に影響を与える。Gastroenterology. 2011;141(2):599-609. [PubMed] [Google Scholar].
Phelps D, Brinkman NE, Keely SP, et al. Microbial colonization is required for normal neurobehavioral development in zebrafish. Sci Rep. 2017;7(1):11244. [PMC free article] [PubMed] [Google Scholar].
Weiss SM, Wadsworth G, Fletcher A, Dourish CT. 不安の高架式迷路モデルにおける運動量の交絡を克服するためのエソロジー解析の有用性。1998年、23(2):265-271.Neurosci Biobehav Rev. [PubMed] [Google Scholar].
(注) 1.本データは、本電子書籍が刊行された当時に掲載されていたものです。Behav Pharmacol. 2005;16(3):171-180. [PubMed] [Google Scholar].
Round JL, Mazmanian SK. 腸内細菌叢は健康時および疾患時の腸管免疫応答を形成する。Nat Rev Immunol. 2009;9(5):313-323. [PMC free article] [PubMed] [Google Scholar].
LeeYK、Menezes JS、Umesaki Y、Mazmanian SK. 腸内細菌に対する炎症性T細胞応答は実験的自己免疫性脳脊髄炎を促進する。Proc Natl Acad Sci U S A. 2011;108(Suppl. 1):4615-4622. [PMC free article] [PubMed] [Google Scholar].
HJ W, Ivanov II, Darce J, et al. 腸に常駐する分割型糸状菌がTヘルパー17細胞を介して自己免疫性関節炎を駆動する。Immunity. 2010;32(6):815-827. [PMC free article] [PubMed] [Google Scholar].
Olszak T, An D, Zeissig S, et al. 幼少期の微生物曝露はナチュラルキラーT細胞機能に持続的な影響を及ぼす。Science. 2012;336(6080):489–493. [PMC free article] [PubMed] [Google Scholar].
プロバイオティクスは、免疫不全マウスの腸-脳-微生物叢軸を正常化する。Am J Physiol Gastrointest Liver Physiol. 2014;307(8):G793-G802. [PMCフリー記事] [PubMed] [Googleスカラー]。
Braniste V, Al-Asmakh M, Kowal C, et al. The gut microbiota influences blood-brain barrier permeability in mice. Sci Transl Med. 2014;6(263):263ra158. [PMC free article] [PubMed] [Google Scholar].
腸内細菌叢が影響する脳内低分子代謝物:パイロットスタディ(Matsumoto M, Kibe R, Ooga T, et al.). Front Syst Neurosci. 2013;7:9. [PMC free article] [PubMed] [Google Scholar].
Wikoff WR, Anfora AT, Liu J, et al. Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites. Proc Natl Acad Sci U S A. 2009;106(10):3698-3703. [PMC free article] [PubMed] [Google Scholar].
Stilling RM, Ryan FJ, Hoban AE, et al. Microbes & neurodevelopment-absence of microbiota during early life increases activity-related transcriptional pathways in the amygdala. Brain Behav Immun. 2015;50:209-220. [PubMed][Google Scholar].
Luczynski P, Whelan SO, O'Sullivan C, et al. 成体マイクロバイオータ欠損マウスは樹状突起の形態変化が異なる:扁桃体と海馬における差分効果. Eur J Neurosci. 2016;44(9):2654–2666. [PMC free article] [PubMed] [Google Scholar].
Hoban AE, Stilling RM, M Moloney G, et al. 扁桃体および前頭前野におけるマイクロRNA発現の微生物による制御。Microbiome. 2017;5(1):102. [PMCフリー記事] [PubMed]を参照。
中田耕一、杉祐樹、楢林秀樹、他 コメンスール微生物が誘導するマイクロRNAは、small GTPase ARF4を介して腸管上皮の透過性を調節する。J Biol Chem. 2017;292(37):15426–15433. [PMC free article] [PubMed] [Google Scholar].
Smith K, McCoy KD, Macpherson AJ. 哺乳類の常在腸内細菌叢への適応を研究する際のアクセニック動物の使用。Semin Immunol. 2007;19(2):59-69. [PubMed] [Google Scholar].
Chen HF, Su HM. 脳の発達期に母体のn-3脂肪酸欠乏食にさらされると、雄ラット子孫のストレスに対する視床下部-下垂体-副腎軸の過剰反応とうつ病と不安の行動指標を後年誘発する。J Nutr Biochem. 2013;24(1):70-80. [PubMed] [Google Scholar].
Sartori SB, Whittle N, Hetzenauer A, Singewald N. Magnesium deficiency induces anxiety and HPA axis dysregulation: modulation by therapeutic drug treatment. Neuropharmacology. 2012;62(1):304-312. [PMC無料記事] [PubMed] [Google Scholar].
Marissal-Arvy N, Hamiani R, Richard E, Moisan MP, Pallet V, Vitamin A. regulates hypothalamic-pituitary-adrenal axis status in LOU/C rats. J Endocrinol. 2013;219(1):21-27. [PubMed] [Google Scholar].
Pusceddu MM, El Aidy S, Crispie F, et al. N-3 polyunsaturated fatty acids (PUFAs) reverse the impact of early-life stress on the gut microbiota. PLOS ONE. 2015;10:e0139721. [PMC free article] [PubMed] [Google Scholar].
Widmaier EP, Rosen K, Abbott B. Free fatty acids activate the hypothalamic-pituitary-adrenocortical axis in rats. Endocrinology. 1992;131(5):2313–2318. [PubMed] [Google Scholar].
Lanfranco F, Giordano R, Pellegrino M, et al. Free fatty acids exertify an inhibitory effect on adrenocorticotropin and cortisol secretion in human. J Clin Endocrinol Metab. 2004;89(3):1385–1390. [PubMed] [Google Scholar].
Bailey MT, Dowd SE, Parry NM, Galley JD, Schauer DB, Lyte M. Stressor exposure disrupts commensal microbial populations in the intestines and leads to increase colonization by Citrobacter rodentium. InfectImmun. 2010;78(4):1509. [PMC free article] [PubMed] [Google Scholar].
Scheer S, Medina TS, Murison A, et al. 早期抗生物質投与は、腸内炎症時のCD4+ T細胞の病原性を高める。J Leukoc Biol. 2017;101(4):893. [PubMed][Google Scholar].
Trobonjaca Z, Leithauser F, Moller P, et al. MHC-II-independent CD4+ T cell induce colitis in immunodeficient RAG-/- host. J Immunol. 2001;166(6):3804–3812. [PubMed][Google Scholar].
Fröhlich EE, Farzi A, Mayerhofer R, et al. antibiotic-induced gut dysbiosisによる認知機能障害: 腸内細菌叢-脳間コミュニケーションの解析。Brain Behav Immun. 2016;56:140-155. [PMC free article] [PubMed] [Google Scholar].
Farzi A, Reichmann F, Holzer P. The homeostatic role of neuropeptide Y in immune function and its impact on mood and behaviour. Acta Physiol (Oxf) 2015;213(3):603-627. [PMC free article] [PubMed] [Google Scholar].
Wang T, Hu X, Liang S, et al. Lactobacillus fermentum NS9は、抗生物質によるラットの生理的・心理的異常を回復させる. Benef Microbes. 2015;6(5):707. [PubMed][Google Scholar]。
O'Mahony SM, Felice VD, Nally K, et al. 幼少期の腸内細菌叢の乱れは、雄ラットの認知行動や不安関連行動に影響を与えずに成人期の内臓痛に選択的に影響を与える。Neuroscience. 2014;277:885. [PubMed][Google Scholar].
Desbonnet L, Clarke G, Traplin A, et al. マウスにおける思春期初期からの腸内細菌叢の枯渇: Implications for brain and behaviour. Brain Behav Immun. 2015;48:165. [PubMed][Google Scholar].
Hoban AE, Moloney RD, Golubeva AV, et al. Behavioural and neurochemical consequences of chronic gut microbiota depletion during adulthood in the rat. Neuroscience. 2016;339:463-477. [PubMed][Google Scholar].
Garate I, Garcia-Bueno B, Madrigal JL, et al. Origin and consequences of brain Toll-like receptor 4 pathway stimulation in an experimental model of depression. J Neuroinflammation. 2011;8:151. [PMC free article] [PubMed] [Google Scholar].
Aguilera M, Vergara P, Martinez V. Stress and antibiotics alterinal and wall-adhered microbiota and enhance the local expression of visceral sensory-related systems in mice. Neurogastroenterol Motil. 2013;25(8):e515. [PubMed][Google Scholar].
Kim S, Covington A, Pamer EG. 腸内細菌叢:抗生物質、コロニー形成抵抗性、腸内病原体。Immunol Rev. 2017;279(1):90. [PMC free article] [PubMed] [Google Scholar].
Nau R, Sorgel F, Eiffert H. Penetration of drugs through the blood-cerebrospinal fluid/blood-brain barrier for treatment of central nervous system infections. Clin Microbiol Rev. 2010;23(4):858. [PMC free article] [PubMed] [Google Scholar].
Roy U, Panwar A, Pandit A, Das SK, Joshi B. Clinical and neuroradiological spectrum of metronidazole induced encephalopathy: our experience and the review of literature. J Clin Diagn Res. 2016;10(6):OE01. [PMC free article] [PubMed] [Google Scholar].
Goolsby TA, Jakeman B, Gaynes RP. メトロニダゾールと末梢神経障害の臨床的関連性:文献のシステマティックレビュー。Int J Antimicrob Agents 2017 Sep 5 [Epub ahead of print]. [PubMed】をご参照ください。]
Neurotherapeuticsの記事はSpringerの提供でこちらになります。
AMA APA MLA NLM
NCBIをフォローする
NLMとつながる
国立医学図書館
8600 Rockville Pike
ベセスダ、MD 20894
ウェブポリシー
FOIA
HHS 脆弱性の開示
ヘルプ
アクセシビリティ
採用情報
NLM
NIH
米国保健省
USA.gov
