2_7_分子の形を表す言葉
「molと聞いて頭痛を起こす人たちのための化学+」シリーズ-7
【分子の形を表す言葉】
前回までは原子同士の繋がり方とそれを理解するための基礎的な知識を並べてきました。今回からはやっと分子の形を説明していきます。基本的にC(炭素)とH(水素)を主体とした物質(炭化水素)を扱っていきますが、これを理解できると日頃耳にするシス型とかトランス型とか異性体とか言ったものが何であるかが分かってきます。
1.分子の形を説明する用語
これらが分かると簡単な分子であればどんな形をしているかが想像がつくようになります。ここではいきなりすべてを覚える必要はありません。最初は見出しに書かれている単語が何を意味するかを理解するだけで構いません。個別の名前はそれぞれの物質が登場した時に覚えましょう。
1-1.直鎖状炭化水素と環状炭化水素
直鎖状炭化水素(straight hydrocarbon)とはCH2が線状に繋がった物質です。線状とは言っても直線ではなく、前回説明した通り、角度が付いてジグザクに繋がっています。途中で枝分かれした場合でも直鎖状炭化水素であって、最も長い”鎖”を主鎖(main chain)、枝分かれの部分を側鎖(side chain)と言います。
身近にはメタンやプロパンなどの燃料、アルコール、酢酸、足の裏の臭い臭いの元であるイソ吉草酸、リノール酸やリノレン酸などの食材に含まれる脂肪酸(酢酸のCH2の鎖が伸びたもの)、一般的な石鹸(脂肪酸にNaが付いたもの)、PETボトルの原料の1つであるエチレングリコール(アルコールでもある)、など全部上げると切りがない程たくさんあります。
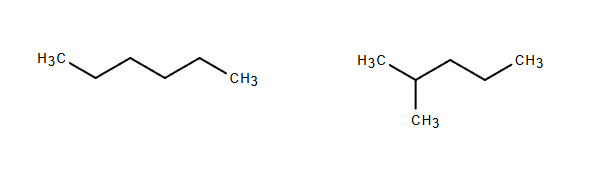
一方で環状炭化水素(cyclic hydrocarbon)はCH2が輪っかを作っている物質です。輪っかを作るCの数で〇員環(〇にはCの数が入る)と言います。恐らくCが6つで亀の子型の六員環は見覚えがあると思います。
環状炭化水素には特別の呼び名を持って分類されるものがあります。芳香族炭化水素(ベンゼン環)と複素環式化合物(ヘテロ環、heterocyclic compound)です。
芳香族炭化水素(aromatic hydrocarbons)はベンゼン環(benzene cycle)を持った炭化水素のことです。ベンゼン環は六員環のC同士の単結合と二重結合が交互に並んだ物質(厳密には違います)で、独特の臭いを放つことから「芳香」の名が付いています。
複素環式化合物はその輪っかの中に複数の種類の元素を含む環状の化合物のことで、厳密には炭化水素だけを示すものではありませんが、ほとんどがCを含むのでここで説明しました。
身近なものはたくさんあるのですが、化学が嫌いだった方々にとっては直鎖より聞いたことがない物質が多いと思います。シンナーの材料の一つであるトルエンは芳香族炭化水素です。単結合だけでなる六員環シクロヘキサンは工業で溶媒としてよく登場します。アセチルサリチル酸は頭痛薬(アスピリン)として使われる芳香族炭化水素です。似た名前のサリチル酸メチルはやはり芳香族炭化水素で、こちらは湿布の原料です。フランと聞くと人の名前と思うかも知れませんが、そういう名前の複素環式化合物があり、その”親戚”であるテトラヒドロフラン(THF)は分析の際に頻繁に使われる物質です。(因みに私はTHFの使い過ぎで健康を損ねて退職した経験があります。)PETボトルのもう1つの原料である原料であるテレフタル酸は芳香族炭化水素です。こちらも全て挙げるととんでもない数になります。

1-2.飽和炭化水素と不飽和炭化水素
単結合だけでできた炭化水素を飽和炭化水素(saturated hydrocarbon)、二重/三重結合(多重結合とも言う)を持つ炭化水素を不飽和炭化水素と言います。
多重結合は単結合だけの状態と比べて不安定なので、ちょっとしたことで一部の結合が外れて他の原子・分子と結合し易くなっています。この結合が外れて他の原子・分子が結合することを付加(addition)と言います。ポリエチレンが良い例で、エチレン(CH2CH2)の二重結合が外れて他のエチレンと延々と繋がってできた物質です。ポリエチレンのポリ(polyethylene)のポリは「たくさんの」と言う意味があります。ついでですが、この同じ分子がたくさん付加される反応を付加重合反応(additional polymarization)と言います。
日常的に聞く飽和/不飽和は食用の脂肪酸が多いのではないでしょうか。二重結合を持つ不飽和脂肪酸にはシス型とトランス型があり、こちらは後述します。

1-3.官能基
官能基(functional group)とは大雑把に言えば分子を構成する”部位”のことです。分子の名前の一部にこの官能基の名前を入れることで表現されます。例えば先程登場したシクロヘキサンに官能基の一種であるメチル基を1個付ければメチルシクロヘキサンです。2個付けた場合は”2個”を表す「ジ」を頭に付けてジメチルシクロヘキサンです。
これら官能基が元の原子・分子と入れ替わることを置換(displacement、substituent)と言い、この時は置換基(substituent group)と言います。
官能基の種類はそんなにたくさんあるわけではありませんが、元化学が嫌いだった方々にいきなり全てを覚えろとは言いません。最初は「メチル」とか「エチル」とか言う分子の形を説明する言葉があるのだと言うぼんやりとした理解で構いません。新しい化学物質を登場させた段階でそれぞれの形を説明していくのでその時に覚えていきましょう。
1-4.異性体
同じ数の同じ原子を持つけれど形が違う分子のことを異性体(isomer)と言います。例えば、先程登場したイソ吉草酸はノルマル(normal)吉草酸(一般的にはn-吉草酸と略す)の異性体です。以下の図からCH2の鎖が枝分かれしているだけで同じ数の同じ原子を持つことが分かります。

性質は似てはいるものの微妙に異なっていて沸点186℃/176℃(n/iso)、融点-34℃/-29℃(同)、密度0.94g/mL/0.93g/mL(同)とされています。両方とも使い古した靴下の様な強烈な臭いを放つ物質で、嗅ぎ分けはできませんでした。
性質がよく似た異性体がある一方で全く異なる異性体もあります。身近な例であればエタノールとジメチルエーテルです。エタノールの用途はご存じの通り。ジエチルエーテルは燃料として使われます。

性質は全く異なっていて沸点78℃/-24℃(エタノール/ジメチルエーテル)、融点-114℃/-142℃(同)、引火点13℃/-41℃(同)とされています。前者は常温で液体、後者は気体ですし、燃え易さがまるで違います。
そんな異性体の中でも特に名のついている異性体を続けて説明します。
1-5.鏡像異性体と不斉炭素原子
1個のC原子に4つの異なる官能基などの原子の集まりが1つずつ結合した場合、この分子は鏡で合わせたような2つの構造を持つことになります。文章だと分かり難いので図にしてみます。

馴染みのない描き方だと思うので図の解説を入れます。R1~4はそれぞれ異なる原子の集まり(原子団といます)で、C原子と単結合で繋がっています。三角形は紙面(画面)の奥行方向に伸びた結合を表しています。実線はこちら側に伸びている結合、点線は向こう側に伸びている結合です。この図の場合、R1とR2を基準の平面として、R3はこちら側、R4は向こう側に向かって結合しています。
図.1-5の左右の分子は平行移動でも回転させても重ね合わせることができません。左右の手の様に鏡で映したような構造をしています。従って、この性質をキラリティ(カイラリティ、chirality)、対掌性と言い、この異性体を鏡像異性体(enantiomer)と言います。そして、この時のC原子を不斉炭素原子(asymmetric carbon atom)と言います。
この異性体の沸点・融点・密度などは全く同じで、それらを使って分離することはできません。
これは化学では余り出番のない異性体ですが、生物学・生化学に於いては非常に重要な(場合によっては致命的な)問題が発生します。
薬害問題と言ったら最初に挙げられるであろうサリドマイドにはこの鏡像異性体が存在し、片方は催眠鎮静剤として使えますが、もう片方は催奇性があり大きな問題となりました。詳細は色々ありますが、本稿ではここまでとします。興味がある方は登録販売者のテキスト(気合の入った方は薬学部で採用されている教科書)などで調べるとお手軽です。
生物の中ではの酵素を含む蛋白質などの構造によって厳密に反応できるものとできないものが振り分けられるのでこういった複雑なことが起こります。簡単に言えば鍵穴にはまる鍵が決まっている様なものです。
1-6.シス/トランス異性体
シス/トランス異性体(cis-trans isomer)は3つのパターンがありますが、ここでは簡単な2つのパターンを説明します。
C原子やN原子の二重結合で見られる場合と環状炭化水素で見られる場合です。

環状炭化水素の場合もそうですが、シスは同じ側、トランスは逆の側に結合が伸びています。二重結合で見られる場合で最も有名なのはシス型脂肪酸とトランス型脂肪酸でしょう。図.1-6-1には脂肪酸(パルミトレイン酸)を描きました。
生物学・生化学ではこの異性体は重要な問題を起こしますが、化学の範囲では沸点・融点・密度が微妙に異なる程度です。ただ、この微妙に異なる性質を用いてシス/トランス異性体を分離する手法は分野を問わず広く使われます。

環状炭化水素で見られる場合は立体的な描写が必要です。図.1-6-2にはジメチルシクロヘキサンを描いていますが、このシクロヘキサンの部分を平面(実際には平面ではない)として同じ側に結合が伸びているのがシス体、逆の側に伸びているのがトランス体です。(慣れていない方には難しいかも知れませんが、メチル基がついているC原子にはH原子が結合しています。)
ここで少し難しい話をします。このジメチルシクロヘキサンは正確にはメチル基のついている位置からcis/trans-1,2-ジメチルシクロヘキサンと言います。この2つの異性体は似た構造をしているにもかかわらず、安定性が異なります。結論から申しますと、シス体の方が不安定で合成し難いです。一寸考えてみてください、メチル基が1つしか付いていないメチルシクロヘキサンのメチル基の隣にもう1つのメチル基が結合する際、同じ側からと逆の側からのどちらからの方が近づき易いでしょうか。同じ側の場合は既に結合しているメチル基が邪魔になりますが、逆の側から近付く場合は障害になりません。従って、合成しようとするとトランス体の方が作り易くなります。この様に作り難くなったり不安定になったりすることを立体障害(steric hindrance)と言います。蛋白質や脂肪などの有機物を取り扱う際はこの立体障害が重要な要素となることが多いです。
私が大学の卒業研究で取り扱ったのもこの物質で、cis-1,2-ジメチルシクロヘキサンにγ線を照射し、結合が不安定にした後、シス体がトランス体にどれだけ変化(異性化)したか、そこにどの様な反応機構(仕組みのこと)があるのかを検討しました。
1-7.オルト/メタ/パラ位
オルト/メタ/パラ位はベンゼン環を取り扱う時しか使いませんが、説明が便利なので説明しておきます。こちらも図を見ながら説明した方が楽です。

ベンゼン環に付いた官能基の1つを基準として、その官能基の位置を1位、右回りで2位・3位・・・と番号を付けていきます。1位にとっての2位と6位はオルト位(ortho)、3位と5位をメタ位(meta)、4位をパラ位(para)と言います。物質の名前にも付くことがあり、図.1-7はオルトキシレン、メタキシレン、パラキシレンです。
如何だったでしょうか。名前がたくさん出てきて混乱しているかも知れません。しかし、毎度のことですが、一度に覚えようとしなくても結構です。今後使われた時に読み返せば良いだけです。これらを覚えることが目的ではなく、これから説明する難しい話を簡単に理解するための手段です。それは絶対に間違えないでください。
最後に本稿で使ったお絵描きツールを紹介します。無料版を使っています。他にも使う候補だったけれど、今回は見送ったものも挙げておきます。
Ketcher2.4デモサイト
https://nao-tokyo.jp/chemistry/demo-of-ketcher/
molview(モルビュー)
https://molview.org/
デモ版 2D Sketcher
https://web.chemdoodle.com/demos/2d-sketcher/
