2_10_熱の伝わり方
「molと聞いて頭痛を起こす人たちのための化学+」シリーズ-10
【熱の伝わり方】
今回は物質を伝わる熱と分子或いは原子の運動について説明します。そのついでではありますが分子間に働く力についても説明します。
本来は分子間に働く力はついでで話せる程度の内容ではないのですが、本稿の対象者である化学が嫌いな子供だった方々には雰囲気程度が伝われば良いので流す程度で済ませます。また、この部分は私が学生だった四半世紀前と幾分変わったことがあるので、薄っすら覚えていらっしゃる方々は違和感を覚えるかも知れません。
一つ注意点として、金属やガラスなどは本来分子とは呼びません。今回は原子或いは幾つかの原子の集まりを”分子”として扱います。また、ヘリウム(He)などの希ガスは他の原子と結合することがないので原子1個だけで”分子”として扱います。
1.分子の運動=熱
分子にエネルギーを与えると動きます。このエネルギーは以前も説明したように赤外線やマイクロ波などの波長の長い放射線や他所から飛んできた他の分子の衝突です。例えば風船に入った空気を加熱すると風船が膨らみます。これはエネルギーを与えられた酸素分子(O2)や窒素分子(N2)が動き回って風船の内側からぶつかることで風船を膨張させるからです。これを計算式で表すと以下のようになります。
体積 / 温度 = 一定
これをシャルル(Charle)の法則と言い、物質の出入りがなく、圧力が一定の気体の場合この式が成り立ちます。この計算には分子の大きさや分子間に働く力は入っていないので厳密にはこの通りにはなりません。しかし、細かい計算を考えなくて良いのであればこの程度の感覚で十分です。また、計算の通りにはなりませんが、固体や液体でも程度の差こそあれ同じ現象は起こります。夏になると線路(鉄)が伸びるのも同じ原理です。
シャルルの法則を出したのでセットで説明されるボイル(Boyle)の法則も説明しておきます。
体積 × 圧力 = 一定
簡単な例としては風船を潰そうとするとその分の反発が返ってくる現象が挙げられます。これまた、物質の出入りがなく、温度が一定の気体であれば細かいことを抜きにしてこの式が成り立ちますし、固体や液体でも同じことが起こります。そしてこの二つを組み合わせると以下のように表すことができます。
体積 × 圧力 = 定数 × 温度
本来は定数の部分も含めもう少し細かく書かなければなりませんが、これを気体の状態方程式(equation of state)と言います。くどいようですが、気体の分子の大きさと分子間に働く力は無視されています。
この式から気体に熱(エネルギー)を与えると体積或いは圧力が増すこと、即ち分子が持つ運動エネルギー(kinetic energy 、動くためのエネルギー)を増やすことになると言うことが分かります。
2.分子間力
さて、先程から何度も「分子の大きさ」「分子間に働く力」と書いていますので、こちらを少しだけ説明しておきます。
分子同士の間に働く力の総称を分子間力(inter-molecular force)と言います。この分子間力の中に幾つかの分子同士を引き合わせる或いは押しのける力があります。
押しのける力のことを斥力(repulsion)と言いますが、これには特に名前はなく一種類しかありません。簡単に言えば一つの分子が占有している空間に他の分子が入ってこれないだけです。誤解を恐れずに言えばこれが分子の大きさです。入ろうとすると反発する力が働きます。これを無理やりくっつけてしまうのが核融合です。反発する力に関しては量子力学ではもう少し細かい説明がありますが本稿ではそこまで踏み込みません。
続いて引き合う力(引力、 attraction)の説明です。ここが四半世紀前と変わっています。(周りの化学科出身者からの聞き込みで2010年以降に変わったと分かりました。)しかし、名前が変わったり新しく分かった内容が追加された程度で大枠が変わったわけではありません。従って併記して書いていきます。
引き合う力は四つあります。既に説明してあるのが水素結合とイオン結合です。水素結合は最近の高校生向けの書籍で原子間の結合として扱われていたのでそちらで説明しました。イオン結合は以前は原子間の結合としてだけ取り扱われていましたが、現在は両方で扱われているようです。これらは既に説明しているので省略します。
残りの片方は双極子相互作用(dipolar interaction)です。以前は静電気力と言われていました。中身は変わっていません。同じ分子の中で電気的な重心が偏っている分子を極性分子(polar molecule)と言います。例えば水(H2O)やアンモニア(NH3)などは水素原子(H)に正の電荷が、酸素原子(O)及び窒素原子(N)に負の電荷が偏っています。これは元素の周期律表で軽元素であり炭素族より左側にあるものが正の電荷を、右側にあるものが負の電荷を持つ性質があるためで、より詳しく言えば原子中の電子の偏り(原子核と非共有電子対の分布)が関係しています。このため、分子全体が磁石のような物になって電気的に引き合う力が働きます。水素結合はこの一部と言うこともできます。この力のために極性分子は極性分子同士で引き合い易く、極性を持たない(非極性、無極性)分子(ベンゼン、トルエンなど)とは混ざり難い性質を持ちます。水と油が混ざらないのもこれのせいです。以下に極性分子と非極性分子の例を挙げます。
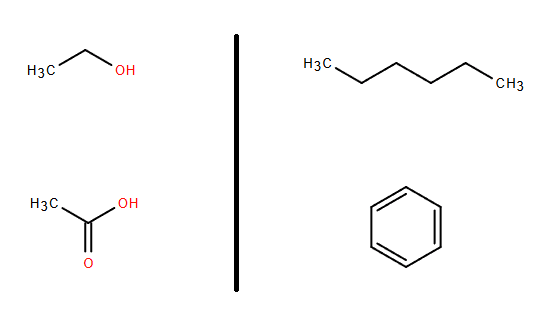
ここで注意点を書いておきます。非極性分子の構造式は対称形(点対称)になっていることが多いですが、対称形だからと言って極性がないとは限りません。直鎖の両端に水酸基(-OH)がついていたり、中央を酸素(O)がつないでいたりする場合、炭素鎖(-CH2-)が曲がことがあるのでその時は極性が現れます。従って、強くはないけれど極性を持つことがあります。逆に一つしか水酸基を持たないアルコール類であっても炭素鎖が長くなってくると全体としての電気的な力が弱くなるので極性が弱くなっていきます。
もう片方はファンデルワールス力(van der Waals force)です。以前は原理は不明でほとんど万有引力のような説明がされていました。現在では原子・分子の中で電子のわずかな分布の偏りができてそれによって引き合っているとされています。双極子相互作用ほどはっきりした電気的な偏りはなく、量子力学で説明される一時的な分布です。従って、ここから先の説明はしません。この力には分子量が大きいほど、分子の表面積が大きいほど強くなる特徴があります。水素結合の説明の際に少しだけ触れましたが、分子量が大きいほど沸点が高くなる原因の一つはこのためです。分かり易い例として分子量と沸点の比較として直鎖のアルコール類を挙げておきます。

これら分子間力は原子間の結合と比べると非常に弱く、低いエネルギーを与えるだけで引き離すことができます。放射線の説明でも書きましたが長い波長の放射線(低エネルギー)を与えると原子や分子が動き、短い波長の放射線(高エネルギー)を与えると結合が切れることがそれを示しています。
3.分子の運動エネルギー vs 分子間力
ここまで熱つまり分子に与えられる運動エネルギーと分子間に働く力について説明してきました。ここからはそれらを合わせて考えていきます。
物質に熱即ち運動エネルギーを与えると分子が動き始めます。物質が固体の場合、運動エネルギーが小さく分子間力を振り切るだけの力がありません。当然分子には質量がありますから重い分子はほんの少し揺さぶられる程度です。この段階では分子同士が近いため分子が動くと直ぐに隣の分子にぶつかります。ぶつかった分子の運動エネルギーの一部はぶつかられた分子の運動エネルギーとして受け渡されます。従って、熱の伝わり方は液体・気体と比べて速くなります。断熱材が穴だらけ(空気を多く含む)の理由はこれです。
ここから更に運動エネルギーを与えると分子間力をある程度まで振り切って動き回れるようになります。これが液体です。液体は分子同士の位置関係が固定されず、一つにまとまりながらも動けます。ある程度動き回れるようになると沸点でもないのに液面から空気中に飛び出す分子が出始めます。これが揮発(volatilization)です。揮発は液面の分子が空気に向かう運動エネルギーを持った時に分子間力が弱く分子量が小さいとより起こり易くなります。揮発した分子はその時の温度は沸点ではないので一寸冷えた物質にぶつかると直ぐに液体に戻ります。これが凝縮(condensation)で、日常的に言われる結露(水の場合のみ)です。
ここから更に運動エネルギーを与えると蒸発(evaporation)して分子間力の影響をほとんど受けずに飛び回るようになります。これが気体です。隣の分子までの距離(分子間距離、inter-molecular distance)が非常に遠いため如何に速く動くとは言え隣の分子にぶつかる機会が減ります。そのため熱の伝わりが遅くなります。同じ50℃でも気温と水温では火傷する・しないが違ってくるのはこのためです。
ここで、これらの現象を利用した小手先技の原理を説明します。真夏に車の中が異様に暑い時にエアコンを使いますが、最初は窓を開けたほうが良いと言われます。エアコンの働きは、空気の分子が持つ熱(高い運動エネルギー)を冷たい物質(冷媒、cooling medium 、熱媒体の一種)に移動させた後、車外に吐き出すことです。狭い空間(小さい熱媒体)で分子の運動エネルギーの受け渡しをしているわけですから非常に遅くなります。「分子の運動エネルギーの受け渡し」と書くとピンと来ないかも知れませんが、単純に言えば分子による玉突き(ビリヤード)或いはバケツリレーです。
ここで窓を大きく開けた場合、高い運動エネルギーを持った分子が車外に飛び出していきます。元より動き回って体積を増やしているのですから、風を送らなくても勝手に(?)出ていきます。出ていかなかった分子も車外の分子とぶつかって運動エネルギーを渡してから車内に戻ります。これが広い空間で起こるので速やかに熱を排出することができます。そしてある程度排熱したところで窓を閉めてエアコンで冷やした(運動エネルギーが低い)空気の分子を外に逃がさないようにすれば車内を効果的に冷やすことができます。これらの理由から走りながら窓を開けたほうがより効果的に排熱ができます。一方で車外の気温が絶望的に高い場合は効果が薄れます。
今回は内容自体は薄いですが、分子の運動と分子間力をどれだけ想像できるかが重要になってくると思います。そのため、実感のある日常的な例を小刻みに入れました。あまり好きな考え方ではありませんが、これが分かると日常で非常に役に立つと思います。
