
はじめに
M1輪講も残すところ, 今回を含めて残り3回となりました.
今回はM1中尾が担当します.
よろしくお願いします!
化学反応の速度論ですが, 6章では溶液反応を取り扱います.
今回は"6章 溶液反応の速度論"について勉強しました.
溶液内での化学反応は, 有機化学や生物化学を含めて化学の広い分野で普通に見られる現象ですが, 分子論的な理解をするには, 気相中の分子の化学反応とは異なった見方が必要になります.
溶液反応の特徴は, 反応する分子の周囲に存在する溶媒によって生じるものであり, 本書では溶媒の果たす役割を捉えるための基本的な概念を学びました.
6.1では気相反応と溶液反応の違いを例示し, 溶液反応における溶媒の役割として, 動的な効果と平衡論的な効果の二種類があることについて学びました. また, 6.2および6.3で動的な効果について詳しく学びました.
6.1 気相反応と溶液反応の違い
溶液反応を気相反応と区別する違いは, 反応する分子の周囲に絶えず溶媒分子が存在していることであり, 溶媒の存在や種類によって反応速度や反応性がしばしば大きく異なります.
溶液反応における溶媒の役割には, 次のような大きく2通りの効果が見られます.
緩和現象や拡散運動:動的な効果
自由エネルギー面の形状を変化させる:静的な効果, 平衡論的な効果
6.2 拡散律速反応
拡散方程式の導出
濃度分布$${\rho(\bm{r},t)}$$と流速密度$${\bm{j} ( \bm{r}, t) }$$との間に以下の関係式が成り立ちます.

上の関係式から流速密度を消去して, 拡散方程式を得ます.

拡散律速反応について
拡散律速反応について, 分子AとBの反応を用いて説明します.

以下に, 二つの場合で律速反応での速度定数を求めます.
完全な拡散律速反応の場合
完全な拡散律速反応の場合は, 「速度定数が分子間の距離に比例する」ことを示します.

この条件では拡散方程式は次のように書くことができます.

以下の境界条件を与えて, 解を求めてみます.

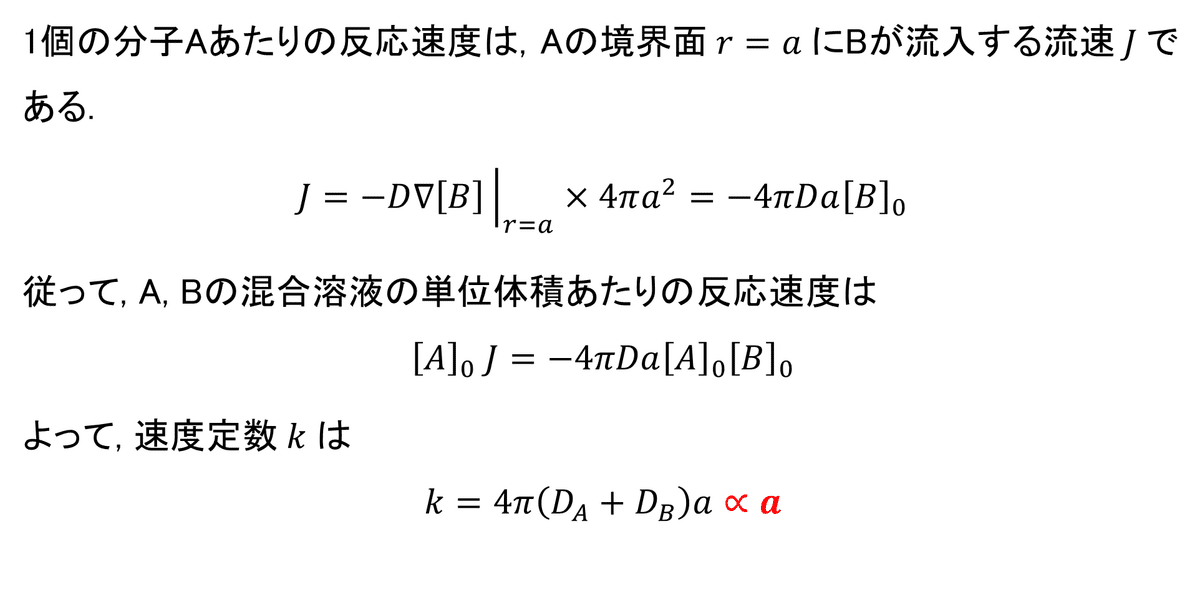
拡散速度と反応速度が関与する場合
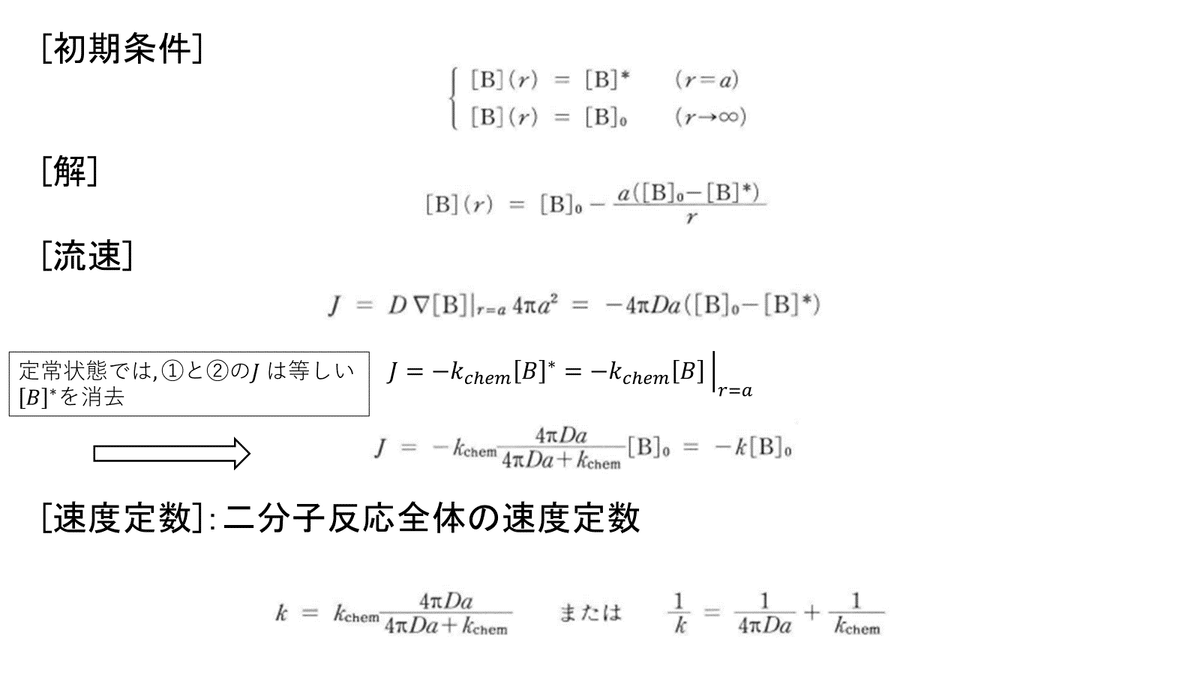
完全な拡散律速ではない場合は, 「定常状態での全体の反応の速度定数の逆数は, 各素過程の逆数の和で与えられる」ことを示します.

6.3 活性化障壁を超える反応
6.2で扱ったような活性化障壁がない化学反応では,
② 衝突したABが化学反応で変化する過程
の反応速度が非常に速く,
① AとBが近づいてくる過程
の拡散過程が反応速度を支配することを学びました.
しかし多くの化学反応では, 反応系から生成系に至る途中で遷移状態を超える必要があり, その過程が全体の反応速度にとって重要です.
この節では, 自由エネルギーを定義し, さらに自由エネルギー面上でのダイナミクスとして, 溶液反応における溶媒の役割を統一的にとらえます.
自由エネルギー面
溶質と溶媒からなる溶液系の微視的な配置を表す自由度の座標を$${ \{ r, x_1, x_2, \ldots \} }$$とします. ここで$${r}$$は反応の進行を表す座標で, $${\{ x_1, x_2, \ldots \}}$$はそれ以外の座標とします. 溶液系全体のポテンシャルエネルギー$${V(r, x_1, x_2, \ldots)}$$の座標依存性は, 溶液系のポテンシャル曲面と考えられます. ポテンシャル曲面$${V(r, x_1, x_2, \ldots)}$$の代わりに, $${r}$$以外の座標を熱浴とみなして消去して, $${r}$$のみに着目した自由エネルギー面を次の様に定義します.

自由エネルギーは次の二つの重要な性質をもつことが導かれます.
熱平衡状態において, 系が$${r=r_1}$$に存在する確率$${P(r_1)}$$と$${r=r_2}$$に存在する確率$${P(r_2)}$$の比は. 自由エネルギーの差$${U(r_1) - U(r_2)}$$で決まることが分かる.
力の平均値が自由エネルギーの勾配と対応する.
Kramersの理論
以下では, 自由エネルギー面上で活性化障壁がある場合を考えます.
反応座標上の運動をブラウン運動として表す理論が, Kramersによって提案されました. 具体的には, 次の運動方程式(Langevin方程式)によって記述します.
$${ \dot{p} = \frac{\partial U(r)}{\partial r} -\eta p + f(t) }$$
第一項:熱平衡での力の平均値
第二項:溶媒との摩擦力
第三項:熱ゆらぎからくるランダル力で平均値は0
右辺の第二項と第三項は周囲の溶媒分子との衝突による効果を表します.
このLangevin方程式は通常の運動方程式とは異なり, ランダム力を含むので, 反応座標$${r}$$上の運動は初期条件を与えても一意的に決まりません. この確率的な運動の様子を統計的に扱うと,存在確率分布関数$${ \rho(r, p, t) }$$は
$${\frac{\partial \rho (r, p, t) }{\partial t} =[ -p\frac{\partial }{\partial r} -K\frac{\partial }{\partial p} + \eta \frac{\partial }{\partial p}(p + k_{B} T\frac{\partial }{\partial p}) ]\rho (r, p, t) }$$
の方程式を満たすことが知られています. この式を位相空間$${(r ,p)}$$上のFokker-Planck上方程式, あるいはKramers方程式と呼ばれます.
Kramersの理論の要点は, 溶液反応の自由エネルギー面$${U(r)}$$が与えられたとき, 溶媒の動的効果が反応速度に及ぼす影響を整理して統一的に理解できることです.
溶媒分子との衝突あるいは摩擦の強さに応じて, 溶媒の役割として定性的に異なった状況が現れることを以下に3つの場合に分けて説明します.
1. 溶媒との摩擦が大きい場合
溶媒との摩擦が大きい場合は, 運動量$${p}$$が速やかに緩和することを意味します. そこで摩擦係数$${\eta}$$が十分に大きいと, 反応座標上の各点$${r}$$で運動量$${p}$$の分布は熱平衡のMaxwell-Boltzmann型となります.
また, $${Q}$$は活性化障壁の自由エネルギーで, 熱エネルギー$${k_{B}T}$$よりも十分に大きいとき, 反応速度定数は摩擦係数$${\eta}$$に反比例することを導出することができます.
2. 溶媒との摩擦が中間的な場合
この場合は, Kramersの式に基づいて時間発展を考える必要があります.
溶媒との摩擦が中間的な場合の反応速度定数$${k}$$を遷移状態理論の速度定数$${k_{TST}}$$で割った係数$${\kappa}$$を定義します.
$${\kappa = \frac{k}{k_{TST}} }$$
$${\kappa}$$が以下の性質を持つことが導出できます.
係数$${\kappa}$$は, 摩擦係数$${\eta}$$の関数として単調減少する
反応速度定数$${k}$$は, 遷移状態理論の速度定数$${k_{TST}}$$以下の値をとる($${k \leq k_{TST}}$$)
遷移状態を通過した流速のうちで, 実際に反応する割合として解釈され, 透過係数と呼ばれます
3. 溶媒との摩擦が小さい場合
熱平衡分布への緩和は溶媒との衝突によって実現されるので, 溶媒との衝突・摩擦が小さくなるにつれて緩和が遅くなります.
この場合, 活性化障壁を超える反応において熱励起過程が律速段階となることが知られています.
これは溶媒との摩擦が反応を促進することを意味します.
以上の三つの場合をまとめると, 活性化障壁を超える反応速度に対して溶媒分子の衝突・摩擦が及ぼす効果は, 二つの要因として示すことが出来ました.
活性化障壁を通過する運動を妨げるはたらきであり, 遷移状態よりも小さな反応速度を与える.
反応座標でエネルギー緩和を促進して熱平衡を維持するはたらきであり, 溶媒の摩擦が小さい場合には遷移状態近くに熱励起する段階が反応の律速段階となる.
従って, 反応速度定数$${k}$$は溶媒の摩擦係数$${\eta}$$に対して極大を持つカーブを描くことが予想され, これをKramersの反転と呼びます. $${\eta}$$の全域にわたって$${k}$$は一般に遷移状態理論よりも小さな反応速度となり, 溶液内で遷移状態理論が最も成り立ちやすいのは, 中間的な摩擦係数をもった場合に限られることがわかります.
最後に
今回は6章途中の6.3.2まで進めました.
特に大切な概念は, 「自由エネルギー面」「Kramersの理論」であると感じました. 私にとって, Kramersの理論は非常に難しかったので, 時間を見つけて復習する必要があります…
