松廼屋|論点解説 薬剤師国家試験対策ノート問 109-106【化学】論点:アミノ酸 / 静電相互作用 / 分散力 / 酵素-基質相互作用 / プロトン供与 / 酸塩基触媒
第109回薬剤師国家試験|薬学理論問題 /
問106
一般問題(薬学理論問題)【物理・化学・生物】
化学|問 109-106
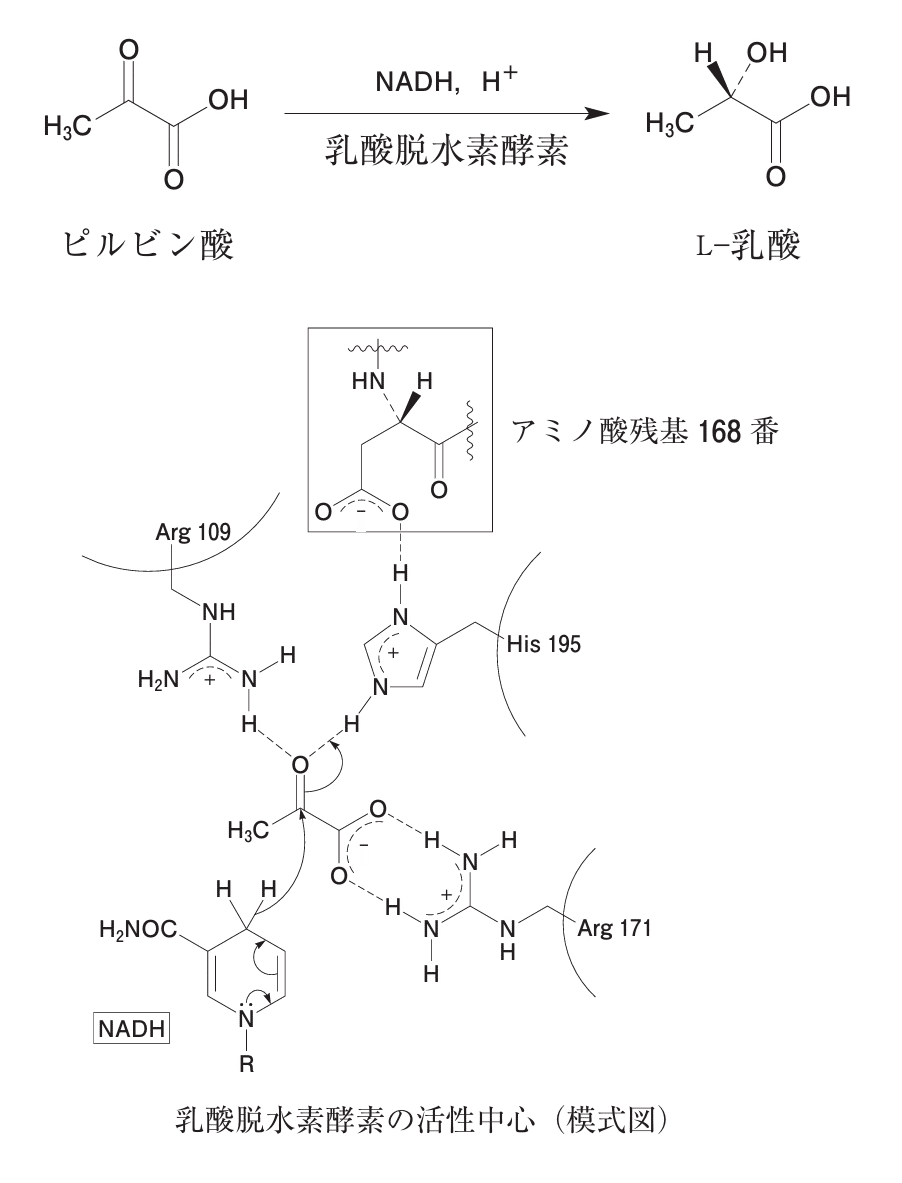
Q. 下図に示したように、乳酸脱水素酵素(乳酸デヒドロゲナーゼ)はピルビン酸からL-乳酸への変換を触媒する。この酵素の活性中心に関する記述のうち、正しいのはどれか。2つ選べ。
■選択肢
1. 109番のArgはピルビン酸のカルボニル炭素の求電子性を高めている。
2. 168番のアミノ酸残基はアスパラギンである。
3. 171番のArgとピルビン酸との主たる相互作用は、分散力によるものである。
4. 195番のHisはピルビン酸に対してブレンステッド酸としてはたらく。
5. NADHはピルビン酸に対してプロトン供与体としてはたらく。
松廼屋|論点解説 薬剤師国家試験対策ノート問 109-106【化学】論点:アミノ酸 / 静電相互作用 / 分散力 / 酵素-基質相互作用 / プロトン供与 / 酸塩基触媒|matsunoya
こんにちは!薬学生の皆さん。
Mats & BLNtです。
matsunoya_note から、薬剤師国家試験の論点解説をお届けします。
苦手意識がある人も、この機会に、薬学理論問題【化学】を一緒に完全攻略しよう!
今回は、第109回薬剤師国家試験|薬学理論問題 / 問106【化学】 、論点:アミノ酸 / 静電相互作用 / 分散力 / 酵素-基質相互作用 / プロトン供与 / 酸塩基触媒を徹底解説します。
薬剤師国家試験対策ノート NOTE ver.
matsunoya_note|note https://note.com/matsunoya_note
Here; https://note.com/matsunoya_note/n/ndc8d2c377f67
松廼屋|論点解説 薬剤師国家試験対策ノート問 109-106【化学】論点:アミノ酸 / 静電相互作用 / 分散力 / 酵素-基質相互作用 / プロトン供与 / 酸塩基触媒|matsunoya
薬剤師国家試験対策には、松廼屋の eラーニング
「薬剤師国家試験対策ノート」
マガジン|薬剤師国家試験対策ノート on note
👉マガジンをお気に入りに登録しよう!
このコンテンツの制作者|
滝沢 幸穂 Yukiho Takizawa, PhD
https://www.facebook.com/Yukiho.Takizawa
お友達や知り合いに、matsunota_note で学習したeラーニングを勧めてみたい方は、いいね!、口コミ、おススメなど、よろしくお願いします!
設問へのアプローチ|
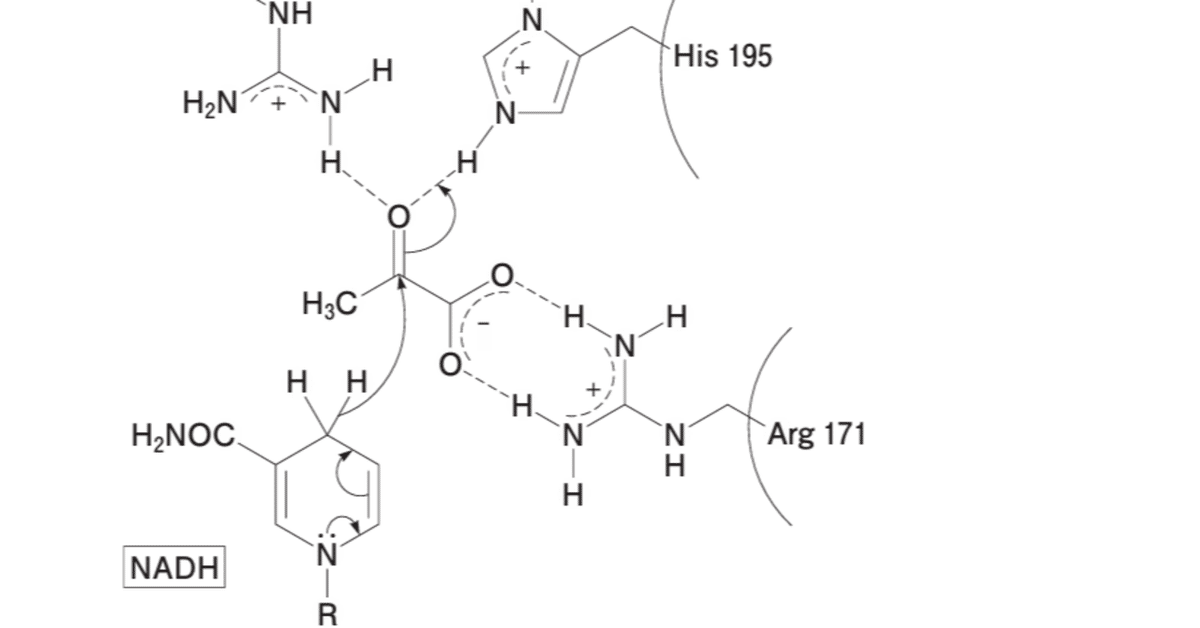
第109回薬剤師国家試験の問106【化学】(問109-106)では、化学構造からアミノ酸 / 静電相互作用 / 分散力 / 酵素-基質相互作用 / プロトン供与 / 酸塩基触媒などが問われました。
一見複雑そうですが、乳酸脱水素酵素(乳酸デヒドロゲナーゼ)の活性中心で、酸素と水素との静電相互作用(クーロン力)が働いている部分を確認できれば大丈夫です。(R-O … H-R')
また、矢印の動きで、電子の移動先を確認しよう。

第109回薬剤師国家試験|薬学理論問題 / 問106
今回、アミノ酸の構造について問われました。
アスパラギンとアスパラギン酸とグルタミン酸を区別できますか。

File:L-aspartic-acid-skeletal.png - Wikimedia Commons
File:Kwas glutaminowy.svg - Wikimedia Commons
アルギニンの構造の特徴は何ですか?炭素数は?

ヒスチジンの化学構造の特徴は何ですか?官能基は?

まず基本的な知識について復習しておきましょう。
■■GPT4o
アミノ酸の基本的な特性と化学構造の特徴
1. アスパラギン (Asparagine, Asn)

IUPAC名: 2,4-diamino-4-oxobutanoic acid
構造的特徴:
側鎖にはアミド基(CONH₂)が含まれています。
アミド基は非イオン化性で、水素結合を形成する能力があります。
中性pHでは電荷を持たない極性分子です。
特性:
極性が高く、主に水素結合を介してタンパク質の構造を安定化します。
グリコシル化の付加点として重要です。
2. アスパラギン酸 (Aspartic acid, Asp)
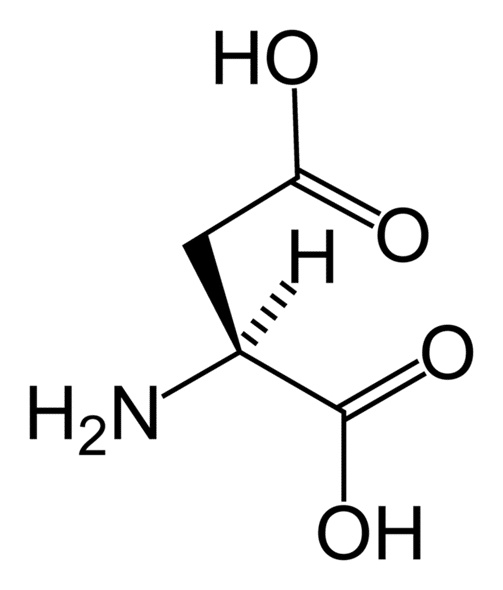
IUPAC名: 2-aminobutanedioic acid
構造的特徴:
側鎖にはカルボキシル基(COOH)が含まれています。
側鎖は中性pHで脱プロトン化し、負電荷を帯びます(COO⁻)。
特性:
酸性アミノ酸で、金属イオンと配位結合を形成することができます。
酵素の活性中心でプロトン供与体または受容体として機能します。
3. グルタミン酸 (Glutamic acid, Glu)

IUPAC名: 2-aminopentanedioic acid
構造的特徴:
側鎖にカルボキシル基(COOH)が含まれ、Aspと同様に中性pHで負電荷(COO⁻)を持つ。
Aspと比較して側鎖が1炭素長い。
特性:
酵素反応においてプロトン移動を補助する重要な役割を持つ。
グルタミン酸受容体のリガンドとして神経伝達に関与。
4. アルギニン (Arginine, Arg)

IUPAC名: (2S)-2-amino-5-(diaminomethylideneamino)pentanoic acid
構造的特徴:
側鎖にグアニジニウム基(C(NH₂)₃⁺)が含まれています。
強い塩基性で、生理的pHで正電荷を帯びる。
特性:
イオン性相互作用や水素結合を通じて分子認識や結合に寄与。
酵素活性中心で基質と相互作用することが多い。
5. ヒスチジン (Histidine, His)

IUPAC名: 2-amino-3-(1H-imidazol-5-yl)propanoic acid
構造的特徴:
側鎖にイミダゾール環が含まれており、中性pHで一部がプロトン化します。
側鎖のpKaは約6.0で、pHに依存してプロトン供与体または受容体として機能可能。
特性:
酵素反応において特に重要で、酸塩基触媒作用を担う。
金属イオンと配位結合を形成可能。
引用文献リスト
"Principles of Biochemistry" (Lehninger, Nelson, Cox)
特にアミノ酸の構造と特性に関する章。
"Biochemistry" (Stryer)
酵素反応におけるアミノ酸の役割の説明。
PubChem Database (各アミノ酸の構造情報)
分散力と静電相互作用
分散力(Dispersion Force)
分散力は、ファンデルワールス力の一種で、分子間に働く弱い引力です。分散力は、分子や原子が持つ電子の動きに起因して瞬間的に生じる双極子(瞬間双極子)間の相互作用によって発生します。これは、分極率(分子が電場によりどの程度変形するか)と関係があります。
特徴:
非極性分子や希ガス原子間でも働く。
距離の6乗に反比例して強さが減少(∝1r6\propto \frac{1}{r^6})。
他の相互作用(静電相互作用、共有結合)に比べて非常に弱い。
化学的意義: 分散力は、非極性分子の凝集や疎水性相互作用の形成に寄与し、タンパク質の立体構造や疎水性相互作用の安定化に重要です。
静電相互作用(Electrostatic Interaction)
静電相互作用は、電荷を持つ粒子(イオンや双極子)の間に働くクーロン力(クーロンの法則に基づく力)です。電荷間の距離と誘電率に応じて引力または斥力として働きます。
F=ke⋅q1⋅q2 / (ϵ⋅r2)

ここで:
F: 力の大きさ
q1,q2: 相互作用する電荷
r: 電荷間の距離
ϵ: 誘電率
ke: クーロン定数
特徴:
イオン間や双極子間において発生。
力の強さは距離の2乗に反比例(∝1r2\propto \frac{1}{r^2})。
引力または斥力として働き得る。
化学的意義:
酵素-基質間の結合、タンパク質のイオン対形成、DNAのリン酸基と陽イオン間の安定化に重要な役割を果たします。
分散力と静電相互作用の比較

文献リスト
Atkins PW, de Paula J. (2017). Physical Chemistry (11th Edition). Oxford University Press.
分子間力と静電相互作用に関する詳細な記載があります。
McQuarrie DA, Simon JD. (1997). Physical Chemistry: A Molecular Approach. University Science Books.
分散力および静電相互作用の物理化学的説明を含む。
Voet D, Voet JG, Pratt CW. (2016). Principles of Biochemistry (5th Edition). Wiley.
生化学における静電相互作用の役割を説明しています。
Israelachvili JN. (2011). Intermolecular and Surface Forces (3rd Edition). Academic Press.
分散力と静電相互作用の理論的背景が網羅されています。
NADHの化学構造およびその基本的な特性について
化学構造の特徴

ファイル:NAD+ phys.svg - Wikipedia
全体構造
NADH(ニコチンアミドアデニンジヌクレオチド、還元型)は、補酵素として機能する有機分子で、以下の3つの主要な部分から構成されます:
ニコチンアミドリボース部
ビタミンB3(ニコチン酸/ナイアシン)に由来するニコチンアミド環(ピリジン誘導体)を含む。
アデニンリボース部
プリン塩基であるアデニンと、それに結合したリボース。
リン酸基による橋渡し
ニコチンアミドリボースとアデニンリボースは2つのリン酸基で結ばれ、二リン酸構造を形成している。
還元性部分
還元状態のNADHでは、ニコチンアミド環の窒素に結合した電子を受け取った水素(ヒドリド、H⁻)が存在し、この部分が主に電子供与体として機能します。
基本的な特性

酸化還元特性
NADHは、酸化型(NAD⁺)と還元型(NADH)の間で可逆的に変換され、酵素反応において重要な酸化還元反応の媒体として働きます。
還元型NADHは、電子1対(ヒドリドイオン)を供与することで基質を還元します。
生理的役割
解糖系、クエン酸回路、電子伝達系においてエネルギー生産に寄与します。
ミトコンドリア内では、NADHが酸化されることでATP生成が駆動されます(酸化的リン酸化)。
安定性と活性
NADHは還元状態で不安定であり、酸素や熱によって容易に分解します。そのため、保存や取り扱いには低温および無酸素条件が必要です。
また、特定の酵素反応においては、高い特異性を持つ基質として働きます。
溶解性と親水性
NADHは水溶性であり、細胞内の水相で容易に拡散して様々な酵素反応に関与します。
文献のリスト
Berg, J. M., Tymoczko, J. L., & Stryer, L. (2015). Biochemistry. W. H. Freeman.
NADHの構造と生理的役割についての基礎知識が含まれています。
Voet, D., Voet, J. G., & Pratt, C. W. (2018). Fundamentals of Biochemistry. Wiley.
酵素反応におけるNADHの機能と化学特性が詳述されています。
Nelson, D. L., Cox, M. M. (2017). Lehninger Principles of Biochemistry. W. H. Freeman.
酵素反応における補酵素としてのNADHの重要性を解説。
論点およびポイント
■■GPT4o
化学|問 109-106
論点|アミノ酸 / 静電相互作用 / 分散力 / 酵素-基質相互作用 / プロトン供与 / 酸塩基触媒
ポイント|

第109回薬剤師国家試験|薬学理論問題 / 問106
109番のArg(アルギニン)は、正電荷を持つグアニジニウム基を介してピルビン酸のカルボニル基酸素と静電的に相互作用し、カルボニル炭素の求電子性を高める。
168番のAsp(アスパラギン酸)のカルボキシ基は、195番のHis(ヒスチジン)のイミダゾール基と静電的な相互作用を形成し、活性中心の安定化に寄与する。
195番のHisは、ピルビン酸のカルボニル基にプロトンを供与することでブレンステッド酸として作用し、ピルビン酸の還元を促進する。
酵素反応では、NADHが電子供与体として作用し、ピルビン酸の2位のカルボニル基をアルコール基に還元する。
活性中心では、酵素残基間の立体配置が基質の化学変化を正確に誘導するように設計されている。
酵素-基質間の相互作用の本質は静電相互作用に依存する。
薬剤師国家試験 出題基準
出典: 薬剤師国家試験のページ |厚生労働省 (mhlw.go.jp)
出題基準 000573951.pdf (mhlw.go.jp)
論点を整理します。
■■GPT4o
総合的な論点
この問題では、乳酸脱水素酵素(LDH)が触媒するピルビン酸からL-乳酸への変換において、酵素の活性中心に存在するアミノ酸残基や補因子(NADH)の役割を正確に理解し、酵素反応メカニズムに関する知識を適用する能力が問われています。
反応の基本メカニズム
酵素反応の概要
ピルビン酸の還元:Pyruvate (CH3-C(=O)-COO−) + NADH + H+
⟶ L-Lactate (CH3-CHOH-COO−) + NAD+この反応は、ピルビン酸の2位カルボニル基がNADHから供給される水素を受け取ってアルコール基(-OH)に変化することで進行します。
活性中心のアミノ酸残基の役割
活性中心のアミノ酸残基は、基質であるピルビン酸を適切に位置づけ、電子の流れを誘導する触媒作用を担います。
また、補因子NADHが効率的にプロトンと電子を供与するために重要な役割を果たします。
電子の動きとプロトン移動
電子の流れ:
NADHから水素が供与され、ピルビン酸の2位のカルボニル基の酸素に電子が移動します。プロトンの流れ:
His195のイミダゾール環がプロトンの供与体または受容体として機能し、プロトン移動を促進します。アミノ酸残基間の相互作用:
Arg109やArg171は、ピルビン酸のカルボニル基およびカルボキシ基と静電的相互作用を形成し、基質の固定や反応の誘導を支えます。

第109回薬剤師国家試験|薬学理論問題 / 問106
重要な論点
基質の位置づけと活性化
Arg109がピルビン酸のカルボニル炭素の求電子性を高め、反応を促進します。
プロトン移動の媒介
His195が酸塩基触媒として機能し、反応中間体を安定化します。
NADHの役割
NADHが電子とプロトンの供与体として反応に直接関与します。
各選択肢の論点および解法へのアプローチ方法

第109回薬剤師国家試験|薬学理論問題 / 問106
選択肢1: 109番のArgはピルビン酸のカルボニル炭素の求電子性を高めている。
論点:
Arg109のグアニジニウム基がピルビン酸のカルボニル炭素と静電的に相互作用します。
この相互作用により、カルボニル炭素が求電子性を帯び、NADHから電子が供与されやすくなります。
アプローチ方法:
Arg109の位置と機能を模式図から確認します。
ピルビン酸のカルボニル基に対する電子密度の影響を検討します。
Arg109の静電引力がカルボニル炭素を正電荷に近づけ、求電子性を高めると判断します。
電子供与を促進する反応経路と対応付けて考察します。
選択肢2: 168番のアミノ酸残基はアスパラギンである。
論点:
図中で168番のアミノ酸は2つのカルボキシル基を持つことから、アスパラギン(アミド基を持つ)が該当しない。
アスパラギン酸(Asp)が正しい可能性があります。
アプローチ方法:
図中の化学構造から側鎖の特徴を確認します。
カルボキシル基が2つ含まれていることを注目します。
アスパラギンとアスパラギン酸の側鎖構造を比較します。
アスパラギン酸(Asp)が該当すると判断します。
他の文献や模式図を確認して最終的な検証を行います。
選択肢3: 171番のArgとピルビン酸との主たる相互作用は、分散力によるものである。
論点:
Arg171のグアニジニウム基はピルビン酸のカルボキシ基と強い静電的相互作用(N-H…O)があるため、分散力が主ではない。
分散力は分子間力として弱く、静電相互作用に比べ影響が小さい。
アプローチ方法:
Arg171とピルビン酸の相互作用を化学式および模式図から確認します。
分散力と静電相互作用の相対的な寄与を比較します。
主たる相互作用が静電的なものであると結論します。
選択肢4: 195番のHisはピルビン酸に対してブレンステッド酸としてはたらく。
論点:
His195のイミダゾール環は、反応中にプロトンを供与するため、ブレンステッド酸として機能します。
反応過程でのHisの役割は図の矢印からも確認できます。
アプローチ方法:
His195がピルビン酸の2位のカルボニル基に関与する様子を模式図から確認します。
イミダゾール環の酸塩基特性(pKa ≈ 6.0)を考慮し、プロトン供与の可能性を検討します。
反応メカニズムにおけるHis195の役割を分析し、正しい記述と判断します。
選択肢5: NADHはピルビン酸に対してプロトン供与体としてはたらく。
論点:
NADHは電子供与体として働きますが、プロトン供与体としては直接作用しません。
プロトン供与体としてはH⁺(溶液中のプロトン)やHis195が機能します。
アプローチ方法:
NADHの役割を化学反応式および模式図から確認します。
NADHが水素(H⁺ではなくH⁻)を供与することを強調します。
プロトン供与がHis195や溶液中のH⁺に由来することを明確にし、選択肢が誤りであると結論します。
引用文献のリスト
これらの文献は、乳酸脱水素酵素(LDH)の構造、生化学的特性、触媒メカニズム、および活性中心におけるアミノ酸残基の役割に関する情報を網羅しています。
Berg JM, Tymoczko JL, Gatto GJ, Stryer L. (2021). Biochemistry (9th Edition). W.H. Freeman.
酵素触媒反応の基本メカニズムとLDHの詳細な構造と機能に関する章。
アミノ酸残基の役割や相互作用の詳細が説明されています。
Garrett RH, Grisham CM. (2017). Biochemistry (6th Edition). Cengage Learning.
酵素活性中心のアミノ酸と補因子の相互作用に焦点を当てた記述が含まれます。
Voet D, Voet JG. (2020). Fundamentals of Biochemistry: Life at the Molecular Level (6th Edition). Wiley.
酵素反応の酸塩基触媒のメカニズムやプロトン移動の具体例について詳述。
Bugg TDH. (2012). Introduction to Enzyme and Coenzyme Chemistry (3rd Edition). Wiley-Blackwell.
補因子(NADH)の機能と、LDH反応における電子移動のメカニズムに関する記載。
Kumar S, Nussinov R. (2002). "Relationship between ion pair geometries and electrostatic strengths in proteins." Biophysical Journal, 83(3), 1595-1612.
アルギニンの静電相互作用と酵素反応の効率への影響を取り上げています。
深掘り

第109回薬剤師国家試験|薬学理論問題 / 問106
選択肢1: 109番のArgはピルビン酸のカルボニル炭素の求電子性を高めている。
論点:
ここでの鍵は、109番のアルギニン残基(Arg)が持つグアニジニウム基とピルビン酸のカルボニル炭素の相互作用です。
ピルビン酸のカルボニル炭素(C=O)は、電子密度が酸素に偏っており、元来求電子性を持ちます。
Argは正電荷を持つ側鎖(グアニジニウム基)がカルボニル基の酸素と静電的に引き寄せられることで、カルボニル基の酸素に電子が引き寄せられ、カルボニル炭素の電子密度がさらに低下します。
この結果、カルボニル炭素の求電子性が増加し、後続の反応、特に核攻撃を受けやすくなります。
アプローチ方法:
静電相互作用の確認:
109番のArgの正電荷を持つグアニジニウム基と、ピルビン酸のカルボニル基(C=O)の酸素との静電的引力を考慮します。
→ 酸素の電子がArg側に偏ることでカルボニル炭素がより求電子的になる。酵素-基質の立体構造解析:
ピルビン酸とLDHの結晶構造(X線結晶構造解析データ)を確認することで、109番Argとカルボニル基との空間的近接性およびその相互作用が明らかになります。化学的視点での影響:
Argがプロトン供与体や酸塩基触媒としてはたらいていない場合も、静電的効果による基質の反応性調整が重要であることを論述します。
結論:
109番Argの静電相互作用により、ピルビン酸のカルボニル炭素の求電子性が高まり、反応が促進されるという記述は正しい。
選択肢4: 195番のHisはピルビン酸に対してブレンステッド酸としてはたらく。
論点:
195番のヒスチジン(His)は、ピルビン酸からL-乳酸への変換を触媒する過程で重要な役割を果たします。
ブレンステッド酸としてはたらくとは、プロトン(H⁺)供与体として機能することを意味します。
図の説明では、195番Hisの1H-イミダゾール基の窒素(N-H)がピルビン酸の2位のカルボニル基(C=O)にプロトンを供与する描写がされています。
このプロトン移動により、ピルビン酸のカルボニル基がアルコール基(CH-OH)に変化し、最終的にL-乳酸が生成されます。
アプローチ方法:
プロトン移動の確認:
Hisが持つイミダゾール基は、pKaが約6.0であり、中性付近のpHでプロトンの供与・受容が可能です。この性質が反応の進行に寄与します。電子移動の検討:
図で示される電子移動経路では、ピルビン酸のカルボニル基酸素に電子が移動する一方で、Hisのイミダゾール基からプロトンが供与されることが示唆されています。
反応式でこれを以下のように表現できます:C = O + H⁺ → C-OHブレンステッド酸としてのHisの役割:
Hisがプロトン供与体としてはたらくことで、ピルビン酸の還元がスムーズに進行するメカニズムを詳細に説明します。特に、酵素活性中心の配置や周囲のアミノ酸残基の影響も考慮する。
結論:
195番Hisは、ピルビン酸のカルボニル基へのプロトン供与を通じてブレンステッド酸として作用するため、選択肢4は正しい。
選択肢3
171番のArgとピルビン酸との主たる相互作用は、分散力によるものである。(選択肢3)
論点:
この選択肢の論点は、酵素活性中心での静電相互作用と分散力の区別、およびピルビン酸の官能基が関与する相互作用の特性を理解することにあります。
解法へのアプローチ方法:
酵素-基質相互作用の特定
171番のArg(アルギニン)は、正電荷を持つグアニジニウム基を含む塩基性アミノ酸であり、主に静電相互作用を介して基質と結合します。
ピルビン酸のカルボキシ基(-COO⁻)は負電荷を帯びており、Argとの間でクーロン力(静電引力)を形成します。
相互作用の種類を検証
分散力(ロンドン分散力)は、分子間に働く一時的な双極子-誘起双極子間の力であり、主に非極性分子や疎水性分子間で発生します。
一方で、ピルビン酸とArg間の相互作用は、極性分子間の明確な静電引力であり、分散力が主たる力となる可能性は低いと判断できます。
分子構造の確認
Argのグアニジニウム基とピルビン酸のカルボキシ基が近接しており、この相互作用が触媒活性に重要な役割を果たしていることを考慮します。
選択肢5 NADHはピルビン酸に対してプロトン供与体としてはたらく。(選択肢5)
論点:
この選択肢の論点は、NADHの触媒サイクルにおける電子供与体としての役割、およびピルビン酸のプロトン供与・受容メカニズムを明確にすることです。
解法へのアプローチ方法:
NADHの役割を特定
NADHは還元剤として作用し、電子対を供与してピルビン酸のカルボニル基をヒドロキシ基へと還元します。
プロトン供与体として機能することはなく、還元の過程でプロトンの付加は別の供与体(例: Hisのプロトン供与)によって行われます。
電子とプロトンの動きを分離して検討
NADHの水素原子のうち、一つは電子を伴いヒドリド(H⁻)として供与され、ピルビン酸のカルボニル基に結合します。
プロトン(H⁺)は、Hisのイミダゾール基から供与されるため、NADHがプロトン供与体であるとする主張は誤りです。
反応機構の確認
還元反応は次のように進行します:
NADH → NAD⁺ + H⁻(ヒドリド供与)
ヒドリドがピルビン酸のカルボニル炭素に結合し、これが中間体を生成。
最終的にHisからプロトン供与を受け、ヒドロキシ基(-OH)が生成される。
選択肢3: 誤り。
171番のArgはピルビン酸と静電相互作用を形成しており、分散力が主たる相互作用となるわけではありません。
選択肢5: 誤り。
NADHは電子供与体(還元剤)であり、プロトン供与体としては機能しません。プロトン供与はHisのイミダゾール基が担っています。
以上で、論点整理を終わります。
理解できたでしょうか?
大丈夫です。
完全攻略を目指せ!
はじめましょう。
薬剤師国家試験の薬学理論問題【化学】からアミノ酸 / 静電相互作用 / 分散力 / 酵素-基質相互作用 / プロトン供与 / 酸塩基触媒を論点とした問題です。
なお、以下の解説は、著者(Yukiho Takizawa, PhD)がプロンプトを作成して、その対話に応答する形でGPT4o & Copilot 、Gemini 1.5 Pro、またはGrok 2 (beta) が出力した文章であって、著者がすべての出力を校閲しています。
生成AIの製造元がはっきりと宣言しているように、生成AIは、その自然言語能力および取得している情報の現在の限界やプラットフォーム上のインターフェースのレイト制限などに起因して、間違った文章を作成してしまう場合があります。
疑問点に関しては、必要に応じて、ご自身でご確認をするようにしてください。
Here we go.
第109回薬剤師国家試験|薬学理論問題 /
問106
一般問題(薬学理論問題)【物理・化学・生物】
化学|問 109-106
Q. 下図に示したように、乳酸脱水素酵素(乳酸デヒドロゲナーゼ)はピルビン酸からL-乳酸への変換を触媒する。この酵素の活性中心に関する記述のうち、正しいのはどれか。2つ選べ。

■選択肢
1. 109番のArgはピルビン酸のカルボニル炭素の求電子性を高めている。
2. 168番のアミノ酸残基はアスパラギンである。
3. 171番のArgとピルビン酸との主たる相互作用は、分散力によるものである。
4. 195番のHisはピルビン酸に対してブレンステッド酸としてはたらく。
5. NADHはピルビン酸に対してプロトン供与体としてはたらく。
■■GPT4o
化学|問 109-106
■論点|アミノ酸 / 静電相互作用 / 分散力 / 酵素-基質相互作用 / プロトン供与 / 酸塩基触媒
この問題の論点は、酵素活性中心におけるアミノ酸残基の役割およびピルビン酸からL-乳酸への還元反応メカニズムを特定することです。
■解説1|

第109回薬剤師国家試験|薬学理論問題 / 問106
109番のArgはピルビン酸のカルボニル炭素の求電子性を高めている。(選択肢1)[正しい]
109番のArg(アルギニン)の正電荷を持つグアニジニウム基は、ピルビン酸のカルボニル基酸素と静電相互作用を形成します。
この相互作用は、カルボニル炭素の求電子性を高め、NADHからの電子供与を促進する役割を果たします。
結果として、ピルビン酸の還元反応が進行します。
195番のHisはピルビン酸に対してブレンステッド酸としてはたらく。(選択肢4)[正しい]
195番のHis(ヒスチジン)は、イミダゾール基のプロトンをピルビン酸のカルボニル基に供与します。
これにより、カルボニル基がヒドロキシ基に変換されるプロセスが促進されます。
このプロトン供与は、ブレンステッド酸としての役割を示しています。
■解説2|
選択肢1:
Argの役割は、酵素-基質間の適切な立体配置を保持することにも寄与しています。これにより、触媒活性の効率が最大化されます。
選択肢4:
Hisのイミダゾール基はpKa値が酵素環境によって調節されており、プロトン供与と受容の両方に関与できる点で触媒的に重要です。
■結論|
正しい選択肢は、選択肢1と選択肢4です。
酵素活性中心では、各アミノ酸残基が化学的および物理的な役割を果たし、基質の変換を促進しています。
■補足|

第109回薬剤師国家試験|薬学理論問題 / 問106
168番のアミノ酸残基はアスパラギンである。(選択肢2)[誤り]
実際の168番の残基はアスパラギン酸(Asp)であり、Hisのイミダゾール基と静電相互作用を形成しています。アスパラギン(Asn)ではそのような静電相互作用を適切に行うことはできません。
171番のArgとピルビン酸との主たる相互作用は、分散力によるものである。(選択肢3)[誤り]
相互作用の主因は静電相互作用であり、分散力は非極性分子間で主要な相互作用となることから、本反応には該当しません。
NADHはピルビン酸に対してプロトン供与体としてはたらく。(選択肢5)[誤り]
NADHはプロトン供与体ではなく、電子供与体として作用し、還元反応を引き起こします。プロトン供与はHisが担っています。
必須問題の解説は、こちらからどうぞ。
薬剤師国家試験対策ノート|論点解説 必須問題 第106回-第109回 一覧 powered by Gemini 1.5 Pro, Google AI Studio & GPT4, Copilot|matsunoya (note.com)
薬学理論問題の解説は、こちらからどうぞ。
薬剤師国家試験対策ノート|論点解説 薬学理論問題 第106回-第109回 一覧 powered by Gemini 1.5 Pro, GPT4o, Copilot, and Grok 2|matsunoya
お疲れ様でした。
🍰☕🍊
では、問題を解いてみましょう!
すっきり、はっきりわかったら、合格です。
第109回薬剤師国家試験|薬学理論問題 /
問106
一般問題(薬学理論問題)【物理・化学・生物】
化学|問 109-106
Q. 下図に示したように、乳酸脱水素酵素(乳酸デヒドロゲナーゼ)はピルビン酸からL-乳酸への変換を触媒する。この酵素の活性中心に関する記述のうち、正しいのはどれか。2つ選べ。

■選択肢
1. 109番のArgはピルビン酸のカルボニル炭素の求電子性を高めている。
2. 168番のアミノ酸残基はアスパラギンである。
3. 171番のArgとピルビン酸との主たる相互作用は、分散力によるものである。
4. 195番のHisはピルビン酸に対してブレンステッド酸としてはたらく。
5. NADHはピルビン酸に対してプロトン供与体としてはたらく。
楽しく!驚くほど効率的に。
https://note.com/matsunoya_note
お疲れ様でした。
🍰☕🍊
またのご利用をお待ちしております。
ご意見ご感想などお寄せくださると励みになりうれしいです。
note からのサポート、感謝します。
今日はこの辺で、
それではまた
お会いしましょう。
Your best friend
Mats & BLNt
このコンテンツ
松廼屋|論点解説 薬剤師国家試験対策ノート問 109-106【化学】論点:アミノ酸 / 静電相互作用 / 分散力 / 酵素-基質相互作用 / プロトン供与 / 酸塩基触媒|matsunoya
Here; https://note.com/matsunoya_note/n/ndc8d2c377f67
よろしければこちらもどうぞ
薬学理論問題の論点解説 一覧です。
走る!「基本骨格」Twitter Ver.|薬剤師国家試験対策ノート @YouTube
このコンテンツの制作者|
滝沢幸穂(Yukiho.Takizawa)phD
■Facebook プロフィール
https://www.facebook.com/Yukiho.Takizawa
■X (Former Twitter) プロフィール 🔒
https://twitter.com/YukihoTakizawa
CONTACT|
mail: info_01.matsunoya@vesta.ocn.ne.jp (Matsunoya Client Support)
tel: 029-872-9676
日々の更新情報など、Twitter @Mats_blnt_pharm 🔒から発信しています!
🔒🐤💕 https://twitter.com/Mats_blnt_pharm
https://note.com/matsunoya_note
note.com 右上の🔍で
( matsunoya_note 🔍 )
松廼屋 Mats.theBASE
https://matsunoya.thebase.in/
サポート感謝します👍
最後までお読みいただきましてありがとうございました。
Here; https://note.com/matsunoya_note/n/ndc8d2c377f67
松廼屋|論点解説 薬剤師国家試験対策ノート問 109-106【化学】論点:アミノ酸 / 静電相互作用 / 分散力 / 酵素-基質相互作用 / プロトン供与 / 酸塩基触媒|matsunoya
ここから先は
¥ 1,000
医療、健康分野のリカレント教育における「最強コンテンツ」を note で誰でもいつでも学習できる、 https://note.com/matsunoya_note はそんな場にしたい。あなたのサポートがあれば、それは可能です。サポート感謝します!松廼屋 matsunoya
