
2023年度 大学入学共通テスト 問題解説 「化学」
注釈者コメント
第1問
問1と問2は基本的な問題です.問3は「圧縮前と圧縮後でそれぞれの気体に含まれる水の物質量を求めて,その差が液体の水の物質量になる」ことに気がつけば大丈夫ですが,問題を解くのに不要な情報(気体の全圧)が提示されているので余計な混乱を招きやすいです.問4(c)は初見の受験生に説明文だけで意味が伝わるでしょうか.トピックとしては教科書の「発展」に記載されている限界イオン半径比そのままで,難関大志望者にとっては類題は既知と思われるし,その場合は一瞬で解答できてしまいます.結局,問題数をどれだけこなしたかで得点が決まるのなら思考力と関係のない世界です.
第2問
問2は電解槽が2個直列に結合されていますが,それぞれ別個の電気分解として扱いましょう.問3は真面目に解こうとすると平衡定数Kを求めて…ですが,この反応式では圧力を変えても平衡は移動しないことに気がつけばすぐに解答できます.
第3問
問1はフッ化水素の性質に関する問題です.フッ化水素は毒物で極めて危険な物質なので実験室で使うことはほぼありません.問2は金属イオンの系統分離の問題です.教科書や参考書に載っているフローチャートを参照すれば解答できますが,これを覚えるのはたいへんです.こういう暗記問題を出題するのはもうやめませんか.刺激性や毒性のある試薬を使うので再現実験もたいへんです.問3(a)はパズルの要素があります.
第4問
問4は不斉炭素と鏡像異性体の知識が必要ですが,それ以外は基本的な問題です.ところで,問4(c)のトリグリセリドXには鏡像異性体が存在するとあります.たしかに立体化学的には鏡像異性体ですが,長い脂肪酸鎖の構造の違いがグリセロール骨格部分の不斉炭素にどれだけの影響があるか疑問が残るところです.
第5問
問2はとにかく実験の流れがわかりにくいです.また,窒素は関係ないので受験生を惑わせるだけです.「ヨウ素を含むヨウ化カリウム水溶液「「4.80mL滴下したところでデンプン水溶液を加えた」という余計な文もはじめから問題文に加えないほうがいいと思います.電子の授受を含む反応式を見て,酸化還元反応においては電子の収支はトータルでゼロになるという原理にしたがって解くといいでしょう.問3は2023年度の化学で最低の問題です.紫外吸光は高校化学の教科書に記載がありません.初見のトピックでグラフを書かせて...というのは試験問題として適しているとは言えないでしょう.
総評
とにかく問題設定が複雑で,問題文中に,解答するのに関係の無い無駄な値やわかりにくい表現があり,問題の意味を理解するのに時間がかかります.また,問題数が多く,考える時間が足りません.こうなると,問題をざっと見て,解けそうな問題を素早く見極めて確実に得点を稼ぐことが重要になりますが,それは受験テクニックの範疇です.思考力を測定したいのなら,問題数を少なくして,1問にじっくり取り組んでもらうことが重要だと思います.
第1問
次の問い(問1 ~4)に答えよ。
問1
すべての化学結合が単結合からなる物質として最も適当なものを、次の1~4のうちから一つ選べ。
1.CH3CHO
2.C2H2
3.Br2
4.BaCl2

答:(3)Br2
問2
次の文章を読み、下線部(a)・(b)の状態を示す用語の組合せとして最も適当なものを、後の1~8のうちから一つ選べ。

「流動性を失ったかたまり」のことをゲルといい,「乾燥したゲル」のことをキセロゲルという.
答:(6) ゲルとキセロゲル
問3
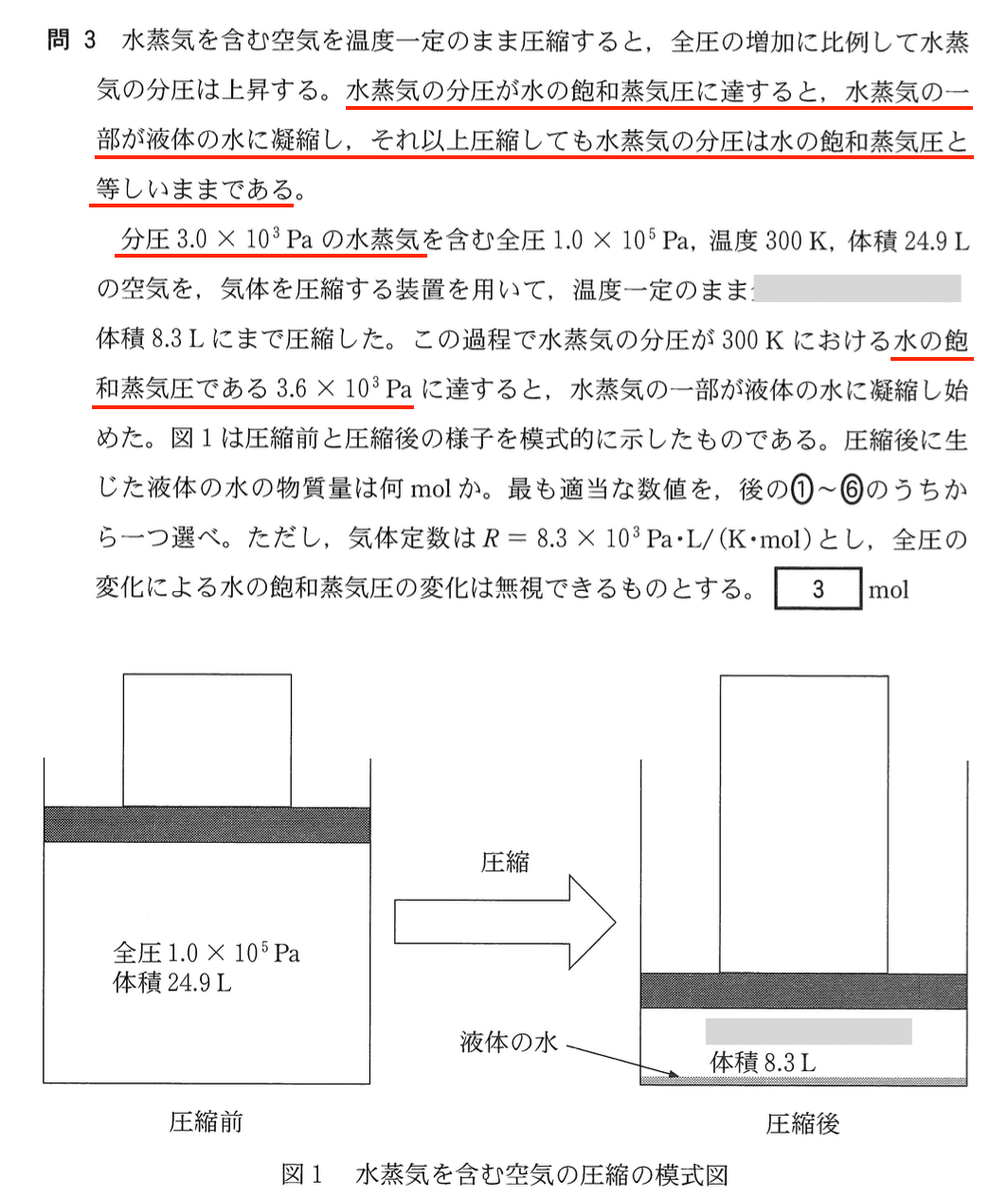
圧縮前と圧縮後でそれぞれの気体に含まれる水の物質量を求めて,その差が液体の水の物質量になる.理想気体の状態方程式より,気体の水の物質量 n = (pV)/(RT)である.分圧の法則より,この式は混合気体における気体成分の物質量と分圧についても同様に成り立つ.
圧縮前の気体の水の物質量を nA,圧縮後の気体の水の物質量を nB とすると
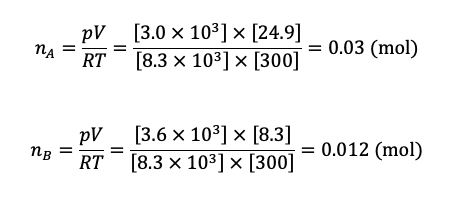
したがって,圧縮後に生じた液体の水の物質量は
nA – nB = 0.03 – 0.012 = 0.018 (mol)
(注)アンダーライン部によると,空気を圧縮し続けても水の分圧は飽和蒸気圧以上にはならないことがわかる.また,圧縮前の気体の全圧(1.0 x 10^5 Pa)は問題を解くには不要な情報である.
答:0.018 (mol)
問4
硫化カルシウム CaS (式量72)の結晶構造に関する次の記述を読み、後の問
い(a ~ c) に答えよ。

a 空欄(ア)・(イ)に当てはまる数字または式として最も適当なもの
を、それぞれの解答群の1~5のうちから一つずつ選べ 。
配位数とは,結晶中の1個の原子に着目し,この原子からもっとも近いところにある原子の数のことである.CaS の結晶構造でCaイオンに着目すると,その周囲にはSイオンが上・下・左・右・手前・奥の計6個が接している.Sイオンについても同様である.
答:(ア)6
単位格子の1辺(赤い線であらわした部分)の長さは,
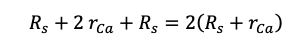
である.体積は1辺の長さの3乗なので,
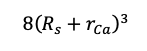
答:(イ)1
b エタノール 40 mL を入れたメスシリンダーを用意し、CaS の結晶 40 g をこのエタノール中に加えたところ,結晶はもとの形のまま溶けずに沈み、図 3に示すように,40の目盛りの位置にあった液面が55の目盛りの位置に移動した。この結晶の単位格子の体積 V は何 cm^3 か。最も適当な数値を、後の1~5のうちから一つ選べ。ただし、アボガドロ定数を6.0 x 10^23 /mol とする。

単位格子とは結晶構造の最小単位のことである.問題リード文に示されているとおり,CaS の単位格子には Ca2+ と S2– がそれぞれ4個ずつ含まれている.
CaSの分子量は 40 + 32 = 72 である.したがって,CaS 40 g の物質量は
(40/72) mol となり,CaS の個数は (40/72) x 6.0 x 10^23 個である.
CaS の単位格子は CaS 4個ぶんなので,単位格子の個数は,
((40/72) x 6.0 x 10^23) / 4 = (10/72) x 6.0 x 10^23 個である.
エタノールに加えた CaS の体積は 55 - 40 = 15 cm^3 なので,単位格子1個あたりの体積は,

答:上の式のとおり
c 図2に示すような配列の結晶構造をとる物質は CaS 以外にも存在する。そのような物質では、下線部 a に示すのと同様に,結晶中で陽イオンどうし、および陰イオンどうしが互いに接していないものが多い。結晶を構成する2種類のイオンのうち、イオンの大きさが大きい方のイオン半径を R,小さい方のイオン半径を r として結晶の安定性を考える。このとき、Rが (√(ウ)+(エ))r 以上になると、図2に示す単位格子の断面の対角線(破線)上で大きい方のイオンどうしが接するようになる。その結果,この結晶構造が不安定になり、異なる結晶構造をとりやすくなることが知られている。
空欄(ウ) ・(エ)に当てはまる数字として最も適当なものを選べ。
いわゆる限界イオン半径比のことである.大きい方のイオン=陰イオン(S2–)同士が接する条件を作図すればわかりやすい.
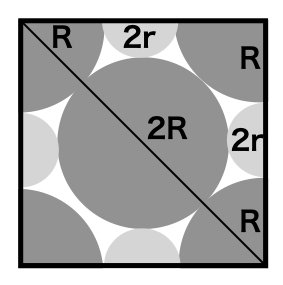
正方形では √2 x(辺の長さ)=(対角線の長さ)なので,上の図より,
√2 x (2R + 2r) = 4R
が成り立つ.この式を変形して,
R = (√2 + 1)r
が得られる.
答:上の式のとおり
第2問
次の問い(問1~4)に答えよ。
問1
二酸化炭素 CO2 とアンモニア NH3 を高温・高圧で反応させると、尿素 (NH2)2CO が生成する。このときの熱化学方程式(1)の反応熱 Q は何か 。ただし,CO2(気),NH3(気) ,(NH2)2CO(固),水 H2O(液)の生成熱は、それぞれ 394 kJ/mol, 46 kJ/mol, 333 kJ/mol, 286 kJ/mol とする。
CO2(気) + 2NH3(気) = (NH2)2CO(固) + H2O(液) + Q kJ (1)
ヘスの法則より,
反応熱Q =(生成物の生成熱の和)ー(反応物の生成熱の和)
なので,
Q = (333 + 286) - (394 + 2 x 46) = 133 (kJ)
答:133 (kJ)
問2
硝酸銀 AgNO3 水溶液の入った電解槽Vに浸した2枚の白金電極(電極A,
B)と,塩化ナトリウム NaCl 水溶液の入った電解槽Wに浸した2本の炭素電 極(電極C,D)を,図1に示すように電源に接続した装置を組み立てた。この装置で電気分解を行った結果に関する記述として誤りを含むものを、次の1~5のうちから 二つ選べ。

(電解槽Vでの反応)
・陰極 Ag(イオン化傾向小)に電子が与えられて(還元)金属として析出する.
Ag+ + e– → Ag
・陽極 H2Oから電子が引き抜かれて(酸化)O2が発生する.
2H2O → O2 + 4H+ + 4e–
(電解槽Wでの反応)
・陰極 H2Oに電子が与えられて(還元)H2が発生する.
2H2O + 2e– → H2 + 2OH–
・陽極 Cl–から電子が引き抜かれて(酸化)Cl2が発生する.
2Cl– → Cl2 + 2e–
1.電解槽Vの水素イオン濃度が増加した.
陽極でH+が発生しているので 正
2.電極Aに銀 Ag が析出した.
正
3.電極Bで水素 H2 が発生した.
誤
4.電極Cにナトリウム Na が析出した.
ナトリウムはイオン化傾向が大きいので金属として析出しない 誤
5.電極Dで塩素 Cl2 が発生した.
正
問3
容積一定の密閉容器Xに水素 H2 とヨウ素 I2 を入れて,一定温度Tに保ったところ、次の式(2)の反応が平衡状態に達した。

平衡状態の H2, I2, ヨウ化水素 HI の物質量は,それぞれ 0.40 mol, 0.40 mol, 3.2 mol であった。
次に、Xの半分の一定容積をもつ密閉容器Yに 1 .0mol の HI のみを入れて,同じ一定温度Tに保つと、平衡状態に達した。 このときのHI の物質量は何mol か。ただし、H2, I2, HI はすべて気体として存在するものとする。
この反応式では左辺と右辺の気体分子の総数は同じなので,圧力を変えても(圧力を変える=容積変化または物質量変化)温度が一定ならば平衡は移動しない.したがって,平衡状態における反応物と生成物の物質量比は不変である.容器Xに HI のみを入れたとき,反応前,変化量,平衡状態における H2, I2, HIの物質量は以下のとおりになる.

容器Yに HI のみ 1.0 mol を入れた場合,反応前の HI の物質量は容器Xの 1/4 なので,平衡状態における HI の物質量も容器Xの 1/4,つまり 0.80 mol になる.
答:0.80 (mol)
問4
過酸化水素 H2O2 の水 H2O と酸素 O2 への分解反応に関する次の文章を読
み,後の間い(a ~ c )に答えよ。
H2O2 の分解反応は次の式(3)で表され、水溶液中での分解反応速度はH2O2 の濃度に比例する。H2O2 の分解反応は非常に遅いが、酸化マンガン (IV)MnO2 を加えると反応が促進される。
2 H2O2 → 2 H2O + O2 (3)
試験管に少量の MnO2 の粉末とモル濃度 0.400mol/L の過酸化水素水 10.0 mL を入れ、一定温度 20°C で反応させた。反応開始から1分ごとに、それまでに発生した O2 の体積を測定し、その物質量を計算した。10分までの結果を表1と図2に示す。ただし、反応による水溶液の体積変化と、発生した O2 の水溶液への溶解は無視できるものとする。


a H2O の水溶液中での分解反応に関する記述として誤りを含むものはどれ
か。最も適当なものを、次の1~4のうちから一つ選べ
1.少量の塩化鉄(III) FeCl3 水溶液を加えると、反応速度が大きくなる。
塩化鉄は触媒としてはたらくので反応速度が大きくなる 正
2.肝臓などに含まれるカタラ ーゼを適切な条件で加えると,反応速度が大
きくなる。
カタラーゼは酵素(生体分子触媒)なので,反応速度が大きくなる 正
3.MnO2 の有無にかかわらず、温度を上げると反応速度が大きくなる。
通常,化学反応は温度を上げると反応速度が大きくなる 正
4.MnO2 を加えた場合、反応の前後でマンガン原子の酸化数が変化する。
触媒を加えても反応式は変わらないのでマンガンの酸化数は変わらない 誤
b 反応開始後 1.0 分 から 2.0 分 までの間における H2O2 の分解反応の平均反応速度は何 mol/(L・min) か.
表1より,反応開始後 1.0 分から 2.0 分までの間における O2 の物質量の増加量は, 0.747 – 0.417 より 0.330 x 10^(–3) mol/min
式(3)より,酸素が1分子生成すると過酸化水素が2分子分解するので,H2O2の物質量の減少量は
0.330 x 10^(–3) x 2 = 0.660 x 10^(–3) mol/min
この実験では,10 mL の過酸化水素を用いているので,1 L あたりでは生成量と分解量は100倍になる.
0.660 x 10^(–3) x 100 = 66 x 10^(–3) mol/(L•min)
答:6.6 x 10^(–2) mol/(L•min)
c 図2の結果を得た実験と同じ濃度と体積の過酸化水素水を、別の反応条件 で反応させると,反応速度定数が2.0倍になることがわかった 。このとき発 生した O2 の物質量の時間変化として最も適当なものを、次の1~6のうちから一つ選べ.

問題文より,H2O2 の分解反応速度は H2O2 の濃度に比例する,とあるので,反応速度 v は
v = k[H2O2]
であらわされる.ここで k は反応速度定数である.反応速度定数 k が2.0倍になるということは,同じ H2O2濃度のときに反応速度が2倍になるということなので,同じ生成物濃度に到達するのに半分の時間で済むことを意味する.図2では,O2 の物質量が 1.5 になるのに 6 min かかっているが,同じ O2 の物質量に 3 min で到達しているグラフは 5 である.
答:5
第3問
次の問い(間1~3)に答えよ。
問1
フッ化水素 HF に関する記述として誤りを含むものはどれか。
1.水溶液は弱い酸性を示す.
フッ素はハロゲンなので水溶液中でH+を解離して酸性を示す.フッ素はほかのハロゲン(Cl)とは異なり,H-Fの結合が強いので水溶液は強酸ではなく弱酸である. 正
2.水溶液に銀イオン Ag+ が加わっても沈殿は生じない.
フッ化銀 AgF は水に溶けやすいので沈殿しない. 正
3.他のハロゲン化水素よりも沸点が高い。
H-Fは水素結合を形成し,他のハロゲン化水素よりも分子間相互作用が強い.したがって沸点が高い. 正
4.ヨウ素 I2 と反応してフッ素 F2 を生じる。
ハロゲンの酸化力を強い順に並べると,F2 > Cl2 > Br2 > I2 である.つまり,周期表の上にある原子のほうが酸化力が強い.酸化力が強いということは他の原子を酸化しやすいということである.したがって,酸化力の弱いI2 が HF から水素を奪って(=酸化),酸化力の強い F2 を生成することはできない. 誤
問2
金属イオン Ag+, AI3+, Cu2+, Fe3+, Zn2+ の硝酸塩のうち二つを含む水溶 液Aがある。Aに対して次の図1に示す操作I~IVを行ったところ、それぞれ図1 に示すような結果が得られた。Aに含まれる二つの金属イオンとして最も適当なものを、後の1~5のうちから二つ選べ。
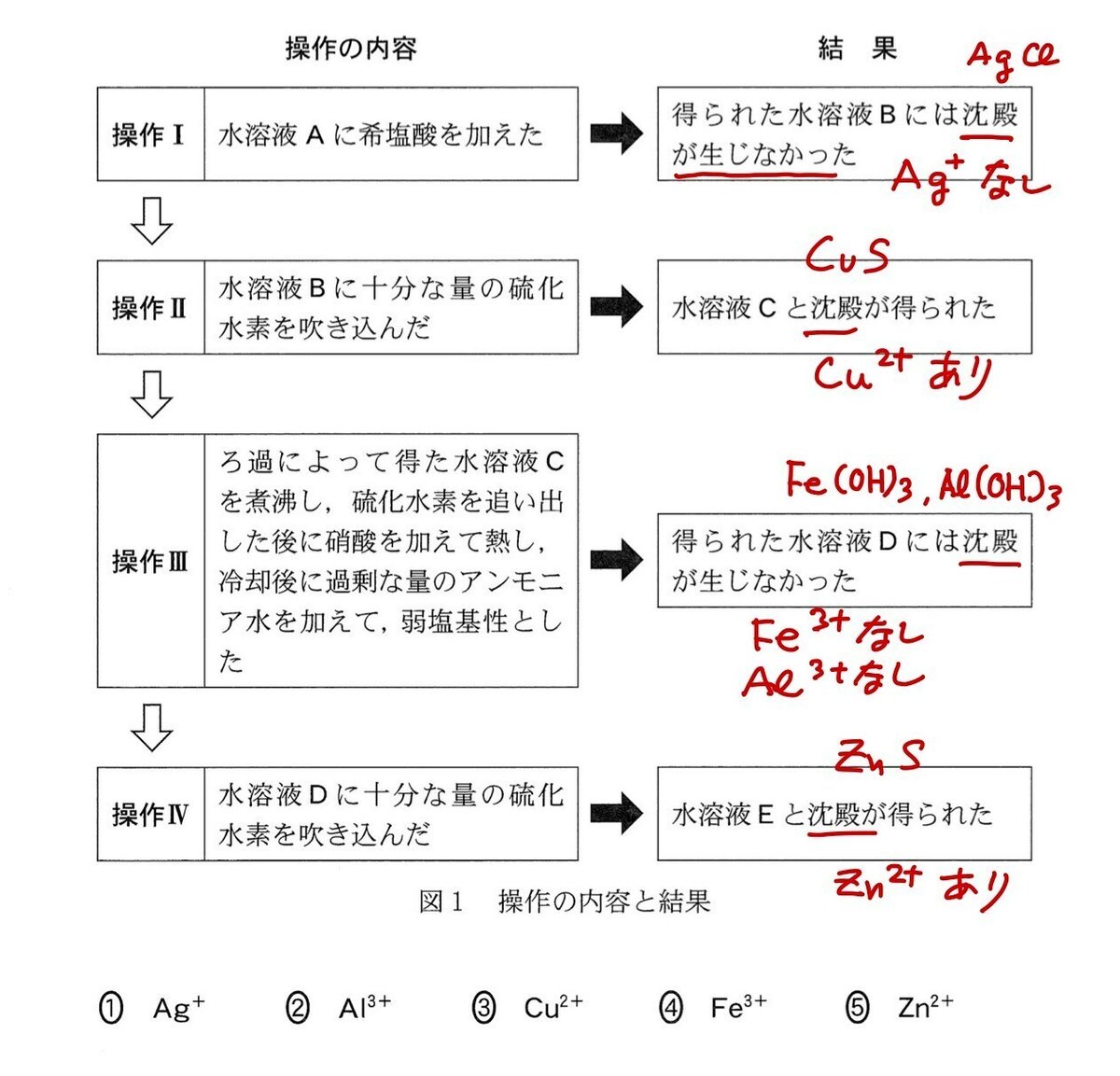
教科書に掲載されている金属イオン系統分離のフローチャートそのままです.
答:Cu2+とZn2+
問3
1 族 ,2族の金属元素に関する次の問い (a~c)に答えよ 。
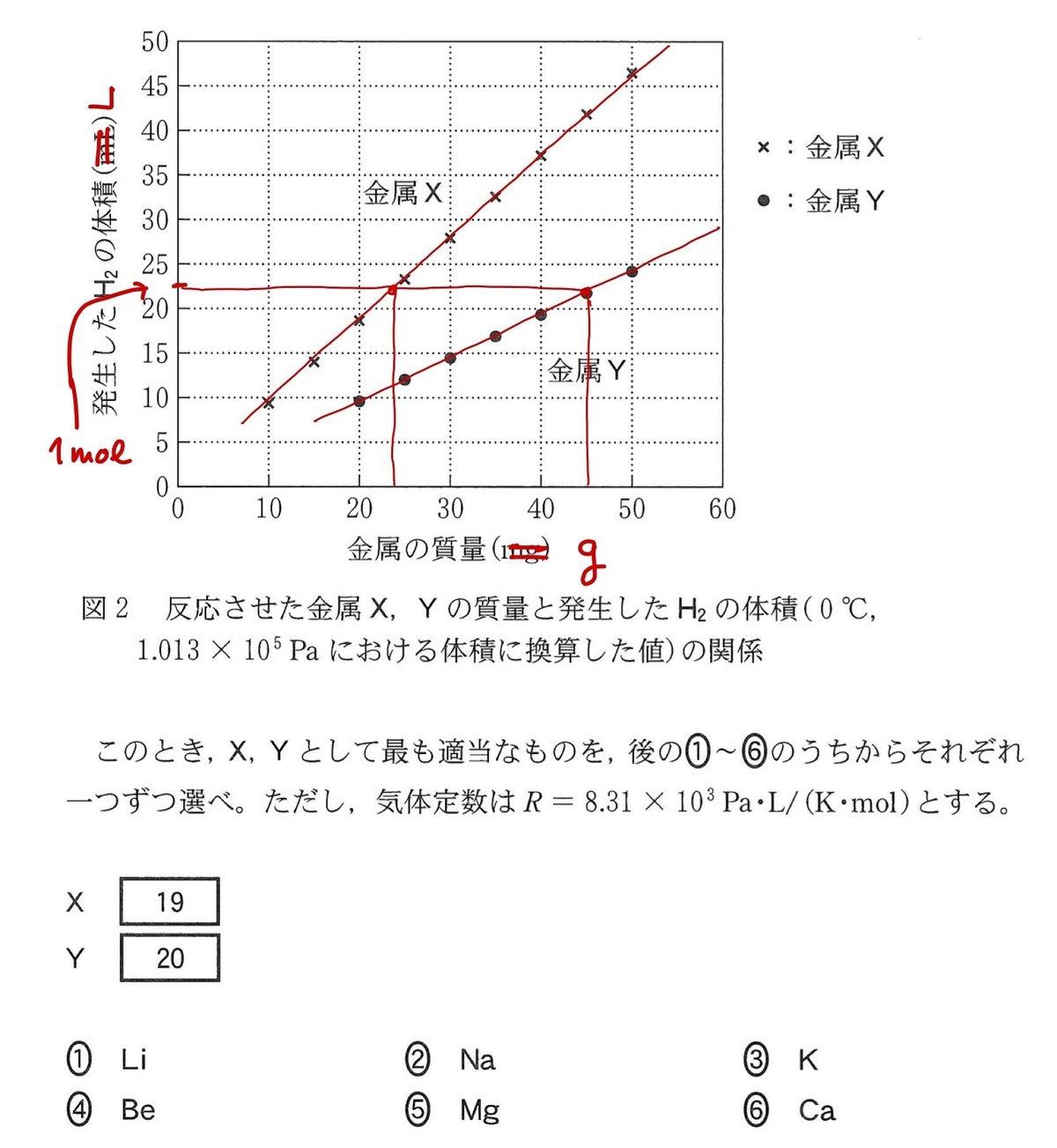
a 金属X,Yは,1族元素のリチウム Li, ナトリウム Na、カリウム K, 2族元素のベリリウム Be,マグネシウム Mg,カルシウム Ca のいずれかの単体である。Xは希塩酸と反応して水素 H2 を発生し、Yは室温の水と反応して H2 を発生する。そこで,さまざまな質量のX,Yを用意し、Xは希塩酸と、Yは室温の水とすべて反応させ,発生した H2 の体積を測定した。反応させたX,Yの質量と、発生した H2 の体積( 0°C,1.013✕10^5 Pa における体積に換算した値)との関係を図2に示す。
1族元素(仮にMとする)と希塩酸の反応式は以下のとおりである.
2M + 2HCl → 2XCl + H2
1族元素(M)と水の反応式
2M + 2H2O → 2XOH + H2
2族元素(M)と希塩酸の反応式
M + 2HCl → XCl2 + H2
2族元素(M)と水の反応式
M + 2H2O → M(OH)2 + H2
上の反応式より,1族元素 2 mol から水素 1 mol が生成し,2族元素 1 mol から水素 1 mol が生成する.グラフより,金属Xは金属Yと同じ質量で金属Yの約2倍の水素を生成しているので,金属Xは2族,金属Yは1族と見当をつけておく.グラフの単位は横軸 mg,縦軸 mL なので,どちらも1000倍して見やすくしておく.グラフより,水素の体積 22.4 L が 1 mol に相当するので,1 mol の水素を生成するために必要な金属Xは約 23 g,金属Yは約 45 g である.金属Xは2族なので約 23 g が 1 mol になる2族は Mg と推定される. また,金属Yは1族なので約 45 g が 2 mol になる1族(原子量は約 22.5になる)は Na と推定される.この推定が正しいかどうかは次の反応式でそれぞれの金属の質量と水素の物質量から確認できる.
Mg + 2HCl → MgCl2 + H2
2Na + 2H2O → 2NaOH + H2
(注)XとYが K,Ca,Li,Be のいずれか場合,それらの原子量の値から,1 molの水素を生成するための金属の質量は 23 g にも 45 g にも該当しない.
答:Xは Mg,Yは Na
b マグネシウムの酸化物 MgO,水酸化物 Mg(OH)2, 炭酸塩 MgCO3 の混合 物Aを乾燥した酸素中で加熱すると,水 H2O と二酸化炭素 CO2が発生し、 後に MgO のみが残る。図3の装置を用いて混合物Aを反応管中で加熱し、発生した気体をすべて吸収管Bと吸収管Cで捕集する実験を行った。

選択肢のなかで,CO2 を吸収するのはソーダ石灰,H2O を吸収をするのはソーダ石灰と塩化カルシウムである.BとCにそれぞれ1種類の気体を捕集したいので,Bに塩化カルシウムを入れて H2O を捕集し,Cにソーダ石灰を入れて CO2 を捕集する.
答:3
c bの実験で、ある量の混合物Aを加熱すると MgO のみが 2.00 g 残った。また捕集された H2O と CO2 の質量はそれぞれ 0.18 g, 0.22 g であった。加熱前の混合物Aに含まれていたマグネシウムのうち、MgO として存在していたマグネシウムの物質量の割合は何%か。
加熱による反応式は以下のとおりである.
Mg(OH)2 → MgO + H2O
MgCO3 → MgO + CO2
MgO の式量は40なので,加熱後に残った MgO の物質量は 2.00/40 = 0.05 molである.
H2O の分子量は18なので,加熱前の Mg(OH)2 の物質量は 0.18/18 = 0.01 mol である.
CO2の分子量は44なので,加熱前の MgCO3 の物質量は 0.22/44 = 0.005 mol である.
加熱前の MgO の存在比は (0.05 - 0.01 - 0.005) / 0.05 x 100 = 70%
答:70(%)
第4問
次の問い(問1~4)に答えよ。
問1
次の条件(ア・イ)をともに満たすアルコールとして最も適当なものを、後の 1~4のうちから一つ選べ。
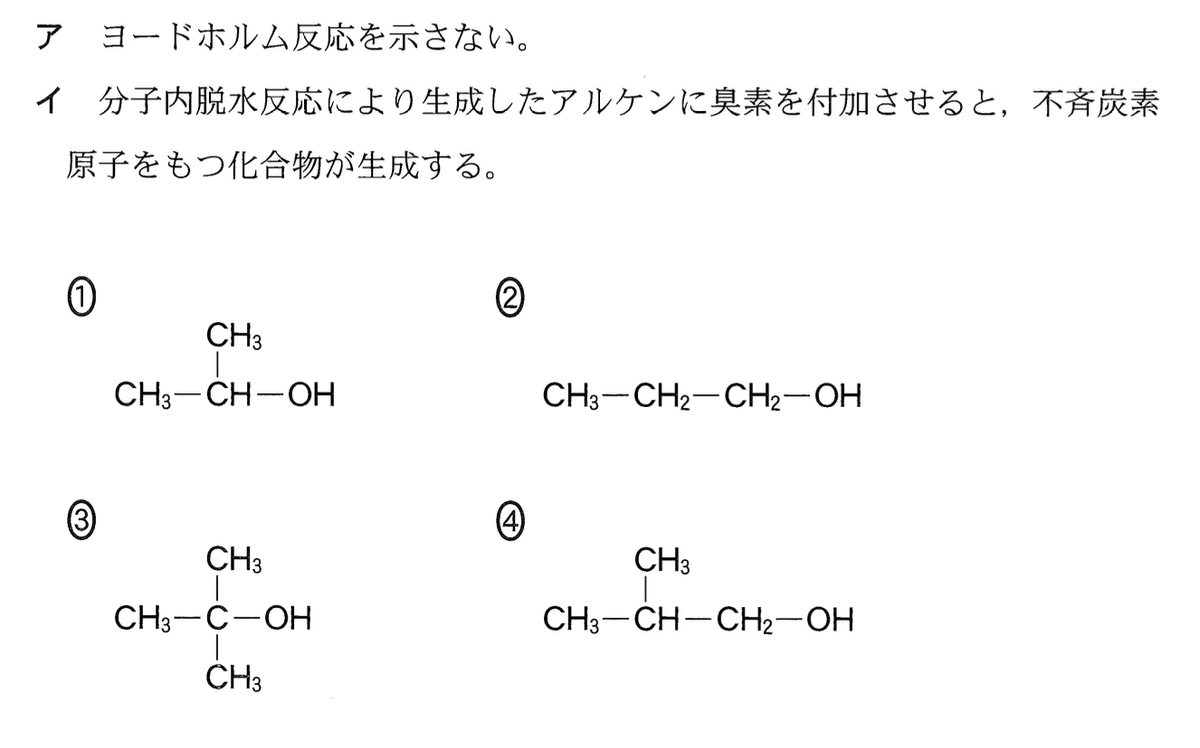
ヨードホルム反応を示す化合物はCH3–C–O–またはCH3–CO–の構造をもつ.(1)と(3)はその構造を含んでおり,(2)と(4)は含まない.したがって,(2)か(4)のいずれか.(2)と(4)を分子内脱水してアルケンにして,その後,臭素Br2を付加する反応の流れは下図のとおり.したがって,不斉炭素原子をもつ化合物が生成するのは(2)のみである.

答:2
問2
芳香族化合物に関する記述として誤りを含むものはどれか。最も適当なもの を、次の1~4のうちから 一つ選べ。
1.フタル酸を加熱すると、分子内で脱水し、酸無水物が生成する。
正
2.アニリンは、水酸化ナトリウム水溶液と塩酸のいずれにもよく溶ける。
アニリンは塩基性なので,塩酸と反応して塩を形成して溶けるが,水酸化ナトリウムとは反応しない. 誤
3.ジクロロベンゼンには、ベンゼン環に結合する塩素原子の位置によって3種類の異性体が存在する。
オルト,メタ,パラの3種類の異性体がある. 正
4.アセチルサリチル酸に塩化鉄(III)水溶液を加えても呈色しない。
塩化鉄(III)水溶液で呈色反応を示すのはフェノール類である.アセチルサリチル酸はフェノール類ではないので呈色しない. 正
答:2
問3
高分子化合物の構造に関する記述として誤りを含むものはどれか。最も適当
なものを,次の1~4のうちから一つ選べ。
1.セルロースでは、分子内や分子間に水素結合が形成されている。
正
2.DNA分子の二重らせん構造中では,水素結合によって塩基対が形成され
ている。
正
3.タンパク質のポリペプチド鎖は、分子内で形成される水素結合により二次構造を つくる。
正
多糖類(セルロース),DNA,タンパク質といった生体高分子は,基本的に水素結合を形成する.
4.ポリプロピレンでは、分子間に水素結合が形成されている。
ポリプロピレンの重合単位の構造式は –CHCH3–CH2– であり,水素結合を形成する官能基(–OH, –NH2など)が存在しない. 誤
答:4
問4
グリセリンの三つのヒドロキシ基がすべて脂肪酸によりエステル化された化
合物をトリグリセリドと呼び、その構造は図1 のように表される。
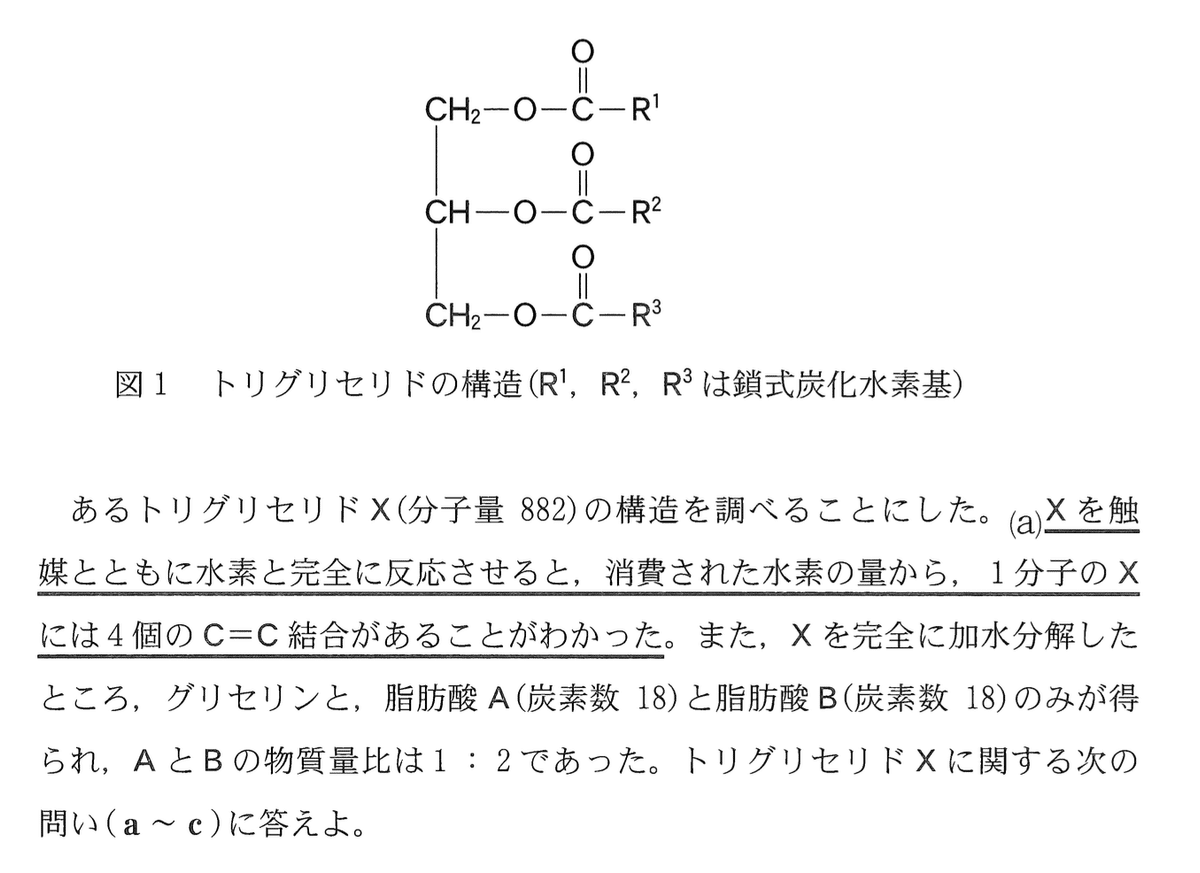
a 下線部aに関して、44.1 g のXを用いると,消費される水素は何molか。その数値を小数第2位まで次の形式で表すとき、26~28に当てはまる数字を,後の1~0 のうちから一つずつ選べ。ただし、同じものを繰り返し選んでもよい。また、XのC=C結合のみが水素と反応するものとする。
Xの分子量は882なので,44.1 gのXの物質量は (44.1/882) = 0.05 mol である.1分子のXには4個のC=C結合があるので,1分子のXは4分子のH2が反応する.したがって,消費される水素は 0.05 x 4 = 0.20 mol
答:0.20 (mol)
b トリグリセリドXを完全に加水分解して得られた脂肪酸Aと脂肪酸Bを,硫酸酸性の希薄な過マンガン酸カリウム水溶液にそれぞれ加えると、いずれも過マンガン酸イオンの赤紫色が消えた。脂肪酸A(炭素数 18)の示性式として最も適当なものを、次の1~5のうちから一つ選べ。

トリグリセリドXに結合している脂肪酸は3個であり,Xを加水分解すると脂肪酸Aと脂肪酸Bの物質量比が1:2であることから,XにはAが1個,Bが2個結合していることがわかる.また,Xには4個のC=C結合があることから,Aには2個のC=C結合,Bには1個のC=C結合があることがわかる(逆にするとXのC=C結合の数と合わなくなる).示性式のうち2個のC=C結合を含むのは(3)のみである.
答:3
c トリグリセリドXをある酵素で部分的に加水分解すると、図2のように脂肪酸A,脂肪酸B,化合物Yのみが物質量比1:1:1で生成した。また,Xには鏡像異性体(光学異性体)が存在し、Yには鏡像異性体が存在しなかった。AをRA–COOH, BをRB–COOHと表すとき,図2に示す化合物Yの構造式において、(ア)(イ)に当てはまる原子と原子団の組合せとして最も適当なものを、後の1~4のうちから一つ選べ。

前問より,トリグリセリドXにはAが1個,Bが2個結合していることがわかっているので,化合物Yの(ア)と(イ)は水素とBのいずれかである.したがって,(2)または(4)である.Xには鏡像異性体が存在し,Yには存在しないので,下図のとおりになる.

したがって,(ア)はH,(イ)はBである.
答:4
第5問
硫黄Sの化合物である硫化水素H2Sや二酸化黃 SO2を,さまざまな物質と反応させることにより、人間生活に有用な物質が得られる。一方、H2S とSO2 はともに火山ガスに含まれる有毒な気体であり、健康被害を及ぼす量のガスを吸い込むことがないように、大気中の濃度を求める必要がある。次の問い( 問1~3) に 答えよ。
問1
H2SとSO2が関わる反応について、次の問い ( a ・ b ) に答えよ。
a H2SとSO2の発生や反応に関する記述として誤りを含むものはどれか。
1.硫化鉄(II)FeSに希硫酸を加えると,HSが発生する。
正
2.硫酸ナトリウムNa2SO4に希硫酸を加えると,SO2が発生する。
誤
3.H2S の水溶液にSO2を通じて反応させると、単体のSが生じる。
正
4.水酸化ナトリウムNaOHの水溶液にSO2を通じて反応させると,亜硫
酸ナトリウムNa2SO3が生じる。
正
b 酸化バナジウム(V)V2O5を触媒としてSO2とO2の混合気体を反応させると、正反応が発熱反応である,次の式(1)の反応が起こる。SO2とO2の混合気体と触媒をピストン付きの密閉容器に入れて反応させるとき、式(1)の反応に関する記述として下線部に誤りを含むものはどれか.

1.反応が平衡状態に達した後,温度一定で密閉容器内の圧力を減少させる
と,平衡は右に移動する。
圧力を下げるとルシャトリエの法則より圧力を上げる方向に平衡は移動する.この反応式では,左辺の分子数3に対して,右辺の分子数は2.したがって,圧力を上げるために分子数が多い方向(左)に平衡が移動する. 誤
2.反応が平衡状態に達した後,圧力一定で密閉容器内の温度を上昇させる
と,平衡は左に移動する。
この反応は発熱反応なので,系の温度を上げるとルシャトリエの法則より温度を下げる方向(吸熱反応)に平衡は移動する 正
3.SO2の濃度を2倍にしたとき、正反応の反応速度が何倍になるかは、反応式中の係数から単純に導き出すことはできない。
反応速度の次数は反応式の係数からは決定できないので 正
4.平衡状態では、正反応と逆反応の反応速度が等しくなっている。
正
問2
窒素とH2Sからなる気体試料Aがある。気体試料Aに含まれるH2Sの量を次の式(2)~(4)で表される反応を利用した酸化還元滴定によって求めたいと考え,後の実験を行った。

硫化水素とチオ硫酸イオンがヨウ素に作用するという実験である.
H2S + I2 → S + 2HI
硫黄Sが沈殿した
2Na2S2O3 + I2 → 2NaI + Na2S4O6
ヨウ素デンプン反応が無色になった=すべてのI2がNaIに変化した
酸化還元反応なので電子の収支はトータルでゼロになる.したがって,電子について考えると,式(2) + 式(4) = 式(3) の関係が成り立つ.
式(4)で失った電子の物質量は,滴下したNa2S2O3が5.00mLなので,
[5.00x10^(-3) L] x [5.00×10^(-2) mol/L] = 0.25x10^(-3) mol
式(3)で受け取った電子の物質量は,元のヨウ素が0.127gなので,
[0.127 / 254 mol] x 2[ヨウ素1個あたり電子2個] = 1.0x10^(-3) mol
電子の収支では,式(2) = 式(3) - 式(4)なので,式(2)で失った電子の物質量は,
1.0x10^(-3) mol - 0.25x10^(-3) = 0.75x10^(-3)mol
式(2)では,1個のH2Sが2個の電子を失っているので,H2Sの物質量は,
[0.75x10^(-3)mol] / 2 = 0.375 mol
気体のH2Sは,1 molあたり22.4 Lの体積を占めるので,
[0.375x10^(-3) mol] x [22.4 L/mol] = 8.40x10^(-3) L
が得られる.
答:8.40 mL
問3
火口周辺でのSO2の濃度は,SO2が光を吸収する性質を利用して測定できる。光の吸収を利用して物質の濃度を求める方法の原理を調べたところ,次の記述が見つかった。

次の問い(a・b)に答えよ。


与えられた表を使ってグラフを作成する.通常は,log(10)Tではなく,符号マイナスをつけたーlog(10)Tを吸光度と呼んで,透過率ではなく,「吸光度は物質の濃度に比例する」というかたちで使用するのが一般的である.これはランベルト・ベールの法則といって,大学の実験ではよく使う法則である.

透過率が0.8なので,
log(10)0.8 = log(10)[8×10^(1)] = log(10)[10^(-1)] + log(10)[2^3]
= -1 + 3×0.3 = -0.1
グラフより,縦軸が-0.1に相当する横軸の値は約0.3である.
答:3.0×10^(-8) mol/L

長さLのとき透過率が0.8なので,長さ2Lのときは透過率0.8が2回かかることになる.したがって,0.8×0.8 = 0.64
答:0.64
