
PCR検査における『Ct値』について
こんにちは。翡翠です。
私生活が忙しく、更新が滞ってしまい申し訳ありませんでした!!
以前、ツイートで「デマに対するファクトチェックには即効性が大事!」と言っておきながら、恥ずかしいです...。(泣
今回のテーマは『Ct値』です!(お待たせしました!)
現在では、このCt値という単語が、非専門家の間でも当たり前のように使われるようになり、新型コロナは存在しない派やノーマスク派などの感染症対策に協力しない人・できない人たちのPCR検査批判の材料として使われるようになりました。
しかしながら、その批判するために使っている情報は本当に正しい情報でしょうか?この記事を読んで、今一度自分の知識を確認して欲しいと思います。
それでは長くなりますが、ぜひ最後まで読んでいただければ幸いです。
まず、最初に言いたいのは、日本における『Ct値=45サイクル』は間違った知識であるということです。
国立感染研究所が推奨するCt値=遺伝子増幅回数は45回ですが、(略)
...
科学的に不適切なPCR検査基準を見直し、正しい基準に改めるよう、日本政府に強く要望します。(発信者:PCR正常化プロジェクト事務局)
http://chng.it/Kd4jrQW5
※ Change.orgの最大出資者はビル・ゲイツ氏ですよ。「ワクチン=人口削減計画!」と言っている人たちは、そんなサイトに個人情報を入力して大丈夫なんですか!?心配です。
これを信じてしまい、署名までしている人は一番ダメなパターンです。
『Ct値』と『PCRの機械(検出器)の設定としてのサイクル数』の違いを全く理解できていません。
これが日本に1万人以上いるようです。困り者たちですね。
PCRの原理については、『PCR』の凄さを嘗めるな!の記事に詳しく書いてありますので、今回は大事な部分をピックアップして紹介します。
理系院卒の怒り #8:『PCR』の凄さを嘗めるな!
https://note.com/kawasemi_no_hina/n/n5361fa19cc53
2020/09/03
現在、新型コロナウイルスのPCR検査で使われている手法は、正しくは『蛍光プローブを用いたリアルタイムRT-PCR法』と言います。
蛍光プローブはPCRで使われるプライマーに似た20塩基前後の短いDNAで、その端に『レポーター(Reporter; R)』と呼ばれる蛍光物質、もう一方の端には、その光を吸収する『クエンチャー(Quencher; Q)』が付いています。(クエンチャーは日本語では『消光剤』を意味します。)

レポーターは、このプローブの状態では光りません。クエンチャーが光を吸収してしまうからです。そういう化学物質が付いています。
このプローブは特異的な遺伝子配列に結合しますが、PCRの伸長反応の際に、DNAに結合したこの蛍光プローブが分解されます。
蛍光プローブが分解されてレポーターとクエンチャーの距離が離れると、レポーターが光ることができるようになります。

そのレポーターの光を、超高感度カメラの付いた特殊な機械『リアルタイムPCR装置』で検出します。(画像はApplied Biosystems社のStepOnePlus)

実際にサンプルを装置にセットしている様子。
https://www.fukuishimbun.co.jp/articles/gallery/1027215?ph=1
DNAが1本から2本になる1サイクルで、プローブから1個のレポーターが分離します。2本から4本になるときには2個のレポーターが分離します。4本から8本になるときには4個の...、というように、PCRでDNAの本数が増える毎にレポーターが増え、どんどん強く光るようになります。

これをリアルタイムPCR装置で検出し、縦軸に光の強さ、横軸がサイクル数のグラフで表すと、下のような図になります。サイクル数が増えると光の強さが上がっていきます。
この曲線を、(蛍光の)増幅曲線と呼びます。

https://www.nature.com/articles/s41586-020-2008-3/figures/7
ただし、ある一定のサイクル数以上になるとそれ以上光が強くならず、頭打ちになってしまいます。これがプラトーと呼ばれる状態で、こうなってしまう原因については『PCR』の凄さを嘗めるな!の記事で解説しました。
下の図のように、蛍光の強さを示す増幅曲線は、最初からサンプル中の検出対象となるDNAの本数が多ければ少ないサイクル数で立ち上がります。
一方、DNAの本数が少なければサイクル数を増やさないと立ち上がりませんので、この曲線は右側にシフトします。

したがって、実際にあるサンプルを10倍ずつ希釈していくと、このように等間隔で並んだ増幅曲線が得られます。

https://www.thermofisher.com/blog/learning-at-the-bench/qpcr-basic37/
この増幅曲線の指数関数増幅期(直線になった部分)から、リアルタイムPCR装置のソフトウェアが自動的に『Threshold(しきい値)』を決めます。(※ 自動的に決められたThresholdが適正ではない場合には、手動でThresholdの赤色の線を上下に移動させることも可能です。)
そして、そのThresholdと増幅曲線の交点のサイクル数を”Threshold Cycle”の意味で、そのCとTを使い『Ct値』と呼びます。
Ct値のCは大文字、tは小文字です。中には区別せずに使っている人もいますが、私は「何も分かってないなコイツ」という感じで見てしまいます。笑
これは、その情報を発信しているのが研究者かどうかを見分ける指標にもなると思います。
研究者は、そういう表記には細心の注意を払います。例えば、アポトーシスに関与する『Fas』と、脂肪酸合成酵素Fatty acid synthase『FAS』は全くの別物です。文脈から分かる場合もありますが、読者の混乱を避けるためには正しい表記をしなければなりません。
ちなみに、PCRも略語なので全部大文字が正しい表記です。

「Ct値」「解離曲線」って何? リアルタイムPCR解析で用いられる用語まとめ
https://www.thermofisher.com/blog/learning-at-the-bench/qpcr-basic37/
現在では、タカラバイオ社の新型コロナウイルス(SARS-CoV-2)検出キットが広く使われています。

https://www.takara-bio.co.jp/medical/pcr_kit.htm
※ 体外診断用医薬品と研究用の2種類があります。ウェブサイトが異なりますので、参考にされる際は注意してください。
※ 未だに研究用の説明書を引用して「診断には使えない!」と言う人がいます。笑
今更な情報ですが…
— 翡翠の比奈 (@KawaseminoHina) December 21, 2020
🤪←バカがバカを晒しているのが目についたので紹介します。
試薬には『研究用試薬』と『体外診断用医薬品』の2種類があって、研究用試薬の方の説明書からそんな文章を引用してもそれは全く意味のないことです。
新型コロナウイルス検出キットhttps://t.co/ETD8EMga08 https://t.co/ozAsoptRdU pic.twitter.com/dUIKu6hZRc
その添付文書を見ると、サイクル数の欄に『45』と書いてあります。

https://www.takara-bio.co.jp/medical/pdfs/SARS-CoV-2_2002K.pdf
これを『Ct値』と混同してはいけません!!
この45サイクルは機械の設定上のサイクル数で、Ct値はその45サイクルが終わった後に得られた増幅曲線から算出される数値です。
そして、Ct値の算出に必要なのは、増幅曲線の指数関数的増幅期だけです。
極端なことを言ってしまえば、機械の設定上のサイクル数は50サイクルでも構いません。(ただプラトーの状態が延々と続くだけです。)

https://www.thermofisher.com/blog/learning-at-the-bench/qpcr-basic37/
この増幅曲線から導き出されたCt値が、40以下なら陽性、それより上なら陰性と分けられます。

日本だけでなく、アメリカでも陽性・陰性を分けるCt値は40に設定されていますが、台湾では35に設定されています。
このことが混乱を生み、日本において「陽性・陰性を分けるCt値40サイクルが適切かどうか?」について議論が行われるようになりました。
PCR「陽性」基準値巡り議論、日本は厳しめ?(2020年11月8日)
https://www.nikkei.com/article/DGXMZO65910480W0A101C2CE0000
この議論に『45サイクル』は持ち込まないでください!
40〜45サイクルというのもダメです。陽性・陰性を分けるCt値はワンポイントです(範囲のあるものではありません)。「40サイクルという文字を見た。45サイクルという文字も見た。だからその間だろうと考えて『〜』で繋げてみた。」
全く何も分かっていない証拠です。笑
間違った情報を信じ、完全に議論に乗り遅れてしまっています。頭のアップデートをしましょうね。
衆議院議員の青山まさゆき氏や、参議院議員のやながせ裕文氏が厚労省関連の委員会で取り上げたことも話題になりました。
11月11日 厚生労働委員会で質疑を行いました!(青山まさゆき)
https://www.aoyama-masayuki.com/11月11日%E3%80%80厚生労働委員会で質疑を行いました!/
確かに青山氏の指摘の通り、Ct値が40のように高い場合には、『その検体に含まれる新型コロナウイルスを培養細胞に感染させても感染が見られない(感染が成立しない)』ことが知られています。
検体に含まれる新型コロナウイルスが培養細胞に感染できないレベルであるということは、人体においても感染できない可能性が十分に考えられ、感染を拡げる可能性が低いにもかかわらず、隔離されるというのは理不尽に思われる気持ちも分かります。(ただし、『PCR陰性=感染力なし』ではないことは、先日の報道でも示された通りです。これを忘れてはいけません!)
ロイター記者のA氏は12月中旬に休暇をとって、イギリスへ一時帰国。日本へ12月22日に戻り、空港でPCR検査を受けたところ、結果は陰性だった。
...
ロイター記者、待機期間のパーティー参加でコロナ変異株が感染拡大
https://bunshun.jp/articles/-/43357
2021/02/09
青山氏がドヤ顔で引用したのはこちらのClinical Infectious Diseasesに掲載された、ジョンズ・ホプキンズ大学の研究チームの論文の図です。

Clin Infect Dis. 2020 Oct 27;ciaa1616. doi: 10.1093/cid/ciaa1616.
Repeat COVID-19 Molecular Testing: Correlation with Recovery of Infectious Virus, Molecular Assay Cycle Thresholds, and Analytical Sensitivity
https://academic.oup.com/cid/advance-article/doi/10.1093/cid/ciaa1616/5940589
※ medRxivに投稿されたのが8月6日
確かに、この論文の図では、感染力のあるウイルスの検出(Culture Positive)はCt値30未満に集中し、Ct値が30を超える場合には、ほぼ感染力がないことが示されています。
ただし、この図を正しく理解するためには『時間軸』について考える必要があります。
SARS-CoV-2感染後、体内のウイルス量(Viral Load)は発症後3~5日でピークに達し、その後は減少していきます。

https://www.nejm.org/doi/full/10.1056/NEJMp2025631
したがって、あるウイルス量を基準としたとき、ピークを挟んで増加と減少の2つのタイムポイントがあります。
同じウイルス量(=同じCt値)であっても、どちらのタイムポイントの話であるかはきちんと区別しないと議論になりません。
この論文では、主にピーク後のウイルスが減少していく過程を長期的に調べています。

表のオレンジ色は、培養細胞への感染が見られたことを示しています。
ここで一度、この論文の結論を見てみましょう。
2つの文章があります。
Conclusions
Low Ct values in SARS-CoV-2 diagnostic tests were associated with virus growth in cell culture. Symptomatic patients with prolonged viral RNA shedding can also be infectious.
訳)結論
SARS-CoV-2診断テストでの低いCt値は、細胞培養でのウイルス増殖と関連していました。 症状があり、ウイルスRNAの放出が長引く患者も『感染性』である可能性があります。
https://academic.oup.com/cid/advance-article/doi/10.1093/cid/ciaa1616/5940589
1つ目の文章について、
表の左端、ピーク周辺でウイルス量が多い場合(Ct値が低い場合)には、そのウイルスに感染力があるというのは専門的な知識がなくても納得できる話だと思います。
2つ目の文章について、
これは要するに、ピーク後、ウイルス量の減少とともに培養細胞への感染はほとんど見られなくなりますが、「この赤色で囲んだ人たちは長期に感染力を持っていますよ。注意しましょう!」ということです。

特に、24番は『入院不要(Ambulatory)』と判断された、ということに注意する必要があると思います。(Ct値は32.06でした。)
Ct値の図を見るときに、時間軸について考えましたか?
ピーク周辺とピーク後(7日目以降)のウイルスのCt値と感染性を比較することは、果たして適切でしょうか?
この論文の投稿の2ヶ月前の論文で、「35より高いCt値であっても、SARS-CoV-2感染による『細胞変性効果(cytopathic effect, CPE)』が見られた」ことが既に報告されています(引用文献の62番)。
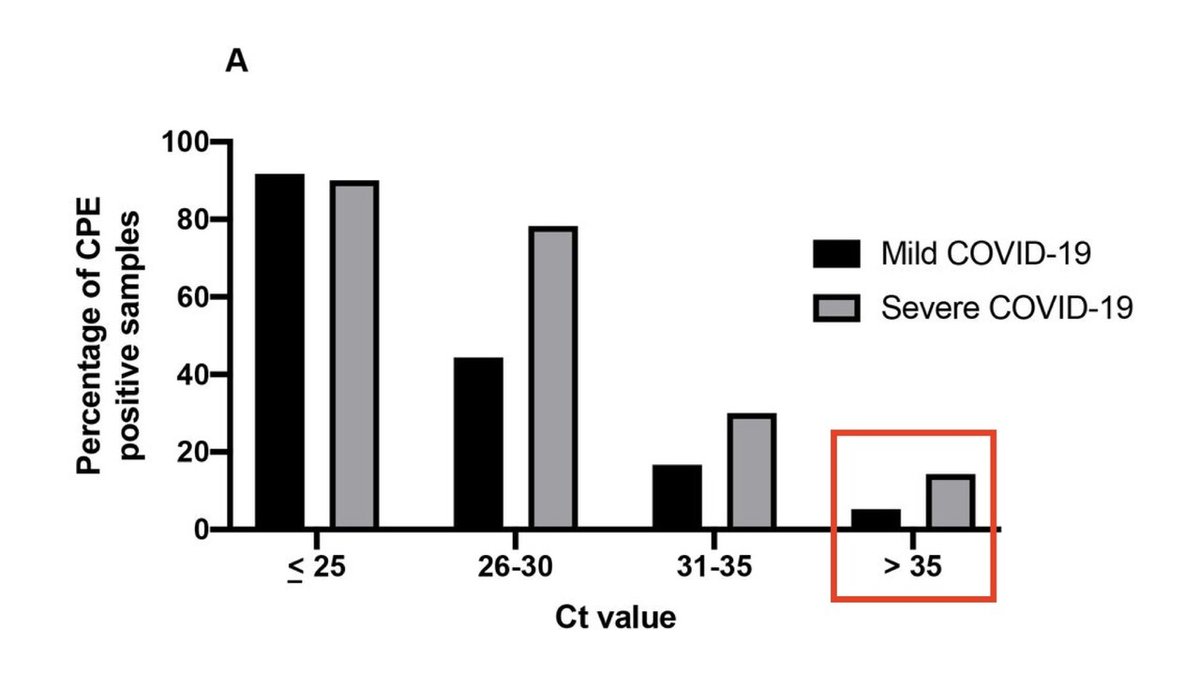
Persistent SARS-CoV-2 replication in severe COVID-19
https://www.medrxiv.org/content/10.1101/2020.06.10.20127837v1
Posted June 12, 2020.(medRxivに投稿されたのが6月12日という意味)
これらの結果は、高いCt値であっても、その検体の中には感染性を持つウイルスが存在していることを示しています。
青山氏は、Clinical Infectious Diseasesに掲載された論文を引用し、「Ct値が高ければ感染力がない」と主張しました。
確かにその通りで、ピーク後、ウイルス量の減少(Ct値の増加)とともに培養細胞への感染はほとんど見られなくなります。
しかしながら、引用した論文に記載され、その2ヶ月前の論文でも報告された「Ct値が高くても感染力のあるウイルスが存在する」という事実も認め、これをきちんと併記すべきでしょう。
情報のキリトリをしていませんか?(「知らなかった」とは言わせません。知らなかった=論文を読んでいないということです。誰から聞きかじった情報でしょうね?笑)
また、Clinical Infectious Diseasesに掲載される前、すなわち査読前のmedRxivに投稿された論文(プレプリント)には、以下の記述があります。
【査読前】
A recent report showed recovery of infectious virus for a prolonged time in severely ill COVID-19 patients which could correlate with high Ct values (56). This indicates that neither the Ct values nor cell culture results should be used to make clinical decisions, or infection control decisions, due to the lack of sufficient clinical outcome studies.
訳)最近の報告では、重症のCOVID-19患者では感染性を持つウイルスが長期的に回収されることが示され、これは高いCt値と相関する可能性があります(引用文献56, 査読後の62番と同じ論文)。 これは、十分な臨床研究が不足しているため、Ct値も細胞培養(感染実験)結果も臨床的決定または感染管理の決定に利用されるべきではないことを示しています。
https://www.medrxiv.org/content/10.1101/2020.08.05.20168963v1
Posted August 06, 2020
この太文字で示した文章だけを読んだコロナはチャバンダネゴキブリが、どれほど喜んだことか。笑
(後述しますが、「『Ct値』が使用されるべきではない。」という文章はある意味正しいです。ただし、これはイコール「臨床診断に『PCR検査』が使用されるべきではない。」を意味する文章ではありません。)
しかしながら、Clinical Infectious Diseasesに掲載された論文(査読後)ではこの記述は消え、「Ct値と細胞培養(感染実験)の結果を用いた臨床または感染管理の決定は、慎重に行う必要がある」という記述に変わっています。
【査読後】
A recent report showed successful recovery of virus in culture for a prolonged time in severely ill COVID-19 patients which could correlate with high Ct values (62). This indicates that the interpretation of Ct values and cell culture results should be used to make clinical or infection control decisions with caution, due to the lack of sufficient clinical outcome studies. This is especially important due to variabilities with specimen collection, assays used for diagnosis, the lack of a standardized quantification assays, and inconsistencies in cell culture protocols between different laboratories.
訳)(略)これは、十分な臨床研究が不足しているため、Ct値と細胞培養の結果を用いた臨床または感染管理の決定は、慎重に行う必要があることを示しています。 これは、検体採取のばらつき、診断に使用されるアッセイ(PCR)、標準化された定量PCRの欠如、そして、異なる検査室間での細胞培養法の不一致のために特に重要です。
https://academic.oup.com/cid/advance-article/doi/10.1093/cid/ciaa1616/5940589
現時点で、PCR検査でCt値が判定に使用されていることを考えると、当然、こちらの記述の方が論理的です。(これを「”支配層”の圧力によって変えられたんだ!」、「陰謀ガー!」と言う人は、論理的思考力が欠落しているアホです。笑)
論文に掲載された図は、行われた実験の結果を簡潔に表しています。
ぱっと見で理解するには便利ですが、今回のように、ただそれを引用・提示するのはダメです。
どのような実験で得られた結果なのか(条件は?患者の情報や使用した試薬など)、これまでの論文と比較して、この論文では何が新しく分かったことなのか(『新規性』)、この論文の『主張』とは何か。
論文は単なる結果のまとめではありません。
著者らが『論じたもの』を理解して初めて「その論文を読んだ」と言うことができます。
難しいでしょう?
そうなんです。論文をきちんと読むことは難しいんです!
日々論文を読み漁り、時にはジャーナルクラブで専門家の最たる教授をはじめとするラボメンバーの前で、読んだ論文を自分の研究であるかの如く紹介し、厳しい質問に答えていく訓練をしなければできません。
学部生の頃は論文1報読むのに1週間かかった。今は分野の論文なら15分で読める。これが大学院の教育のたまものでなくしてなんなのか。教育大事でしょ。
— Kenichi Tsuda 津田賢一@Wuhan 武漢 (@KenichiTsuda4) February 9, 2021
Kenichi Tsuda 津田賢一@Wuhan 武漢 @KenichiTsuda4
学部生の頃は論文1報読むのに1週間かかった。今は分野の論文なら15分で読める。これが大学院の教育のたまものでなくしてなんなのか。教育大事でしょ。
午後0:13 · 2021年2月9日·Twitter Web App
これが研究者と、平気でデマを流すトンデモ素人との決定的な『差』です。
ちなみに、厚生労働委員会で青山氏は、PCR検査に加え、新型コロナウイルスの培養検査を並行して行うといった対応の検討を求めたそうです。
PCR検査に加え、ウイルスの培養検査を並行して行うといった対応の検討を求めました。
https://www.aoyama-masayuki.com/11月11日%E3%80%80厚生労働委員会で質疑を行いました!/
バカなことを言い始めましたね...。
確かに、PCR検査だけではなく『ウイルスの培養検査(感染実験)』を行えば、感染性を持つウイルスの存在を証明でき、より確実な検査になることは間違いありません。
しかしながら、本当にそんなことが可能でしょうか?
実験が「どのような方法で行われたか?」というのは、その結果を解釈する上で非常に重要です。そして、それは論文の『Methods(方法)』の欄に必ず記載されています。
...
Fifty μL of the clinical specimen was added to one well and the cells incubated at 37°C for one hour. The inoculum was aspirated and replaced with 0.5 ml IM and the cells cultured at 37°C for 4 days.
訳)臨床検体50 μLを1つのウェルに加え、VeroE6細胞を37℃で1時間インキュベートしました(=感染させました)。 その後、そのウイルスを取り除き、細胞を37℃で4日間培養しました。
https://academic.oup.com/cid/advance-article/doi/10.1093/cid/ciaa1616/5940589
※ 50 μL=およそ目薬一滴
PCR検査では検体と試薬を混ぜて装置にセットしてから約2時間で結果が出ますが、培養細胞にSARS-CoV-2を感染させた後、その結果が出るまで4日も待つつもりですか?
仮に行うとしても、必要なバイオセーフティーレベル3の実験室、汚染回避のための設備(UVランプ、HEPAフィルターなど)、感染性ウイルスの管理、培養液やディスポーザブルの実験器具の経済的な問題など、SARS-CoV-2の培養検査を拡充させるためにはいくつものハードルがあります。
論文を読む能力もないバカな政治家が、聞きかじっただけの中途半端な専門知識を披露して日本をダメにしていく様子を目の当たりにしてウンザリしました。(日野市議会議員とかも。笑)
本当に迷惑な話です。

(厚生労働委員会で、「議員!感染実験の結果が出るまでに4日かかりますが、それでもこれをやれということですか!?」と即座に返し、ボケ議員を一発でバシッと黙らせることのできる厚労省の職員がいないというのも問題だとは思います。私を雇え!笑)
では、最大の疑問!
Ct値40で陽性と陰性を分けることは適切なのでしょうか?
議論の前提を崩すようで申し訳ありませんが、「Ct値が出たから何?」、「どうしてそんなに(非専門家如きが)Ct値にこだわるの?」というのが、研究者の『本音』です。笑
解説していきます。
現在、PCR検査で使われているリアルタイムRT-PCR法は、本来、RNAを『定量する』方法です。つまり、検体の中のSARS-CoV-2のゲノムRNAが、1本だったり、100本だったり、数えることができる解析手法になります。(専門的には本ではなくコピーcopyと数えます。)
例えば、こちらの唾液を用いたPCR検査に関する初期の2020年2月の論文に掲載された図の縦軸は「copies/ml(唾液1 mlあたりのコピー数)」です。
Ct値ではありません。

Consistent Detection of 2019 Novel Coronavirus in Saliva
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7108139/
The New England Journal of Medicineに掲載された論文でも、図の縦軸は「copies/ml」です。

Saliva or Nasopharyngeal Swab Specimens for Detection of SARS-CoV-2
https://www.nejm.org/doi/full/10.1056/NEJMc2016359
どうして、これらの論文の図で縦軸がCt値ではなく、本数(コピー数)で示されているかと言えば、「その方が正確だから」です。
上の論文の図は、SARS-CoV-2のS遺伝子の配列を、Qiagen社のQuantiNova SYBR Green RT-PCR Kit という試薬と、Roche Diagnostics社のLightCycler 480 Real-Time PCR System という装置で検出した結果です。
一方、下の論文の図は、 N遺伝子の配列を、New England Biolabs社のLuna Universal Probe One-step RT–qPCR kit という試薬とBio-Rad社のCFX96 Real-Time PCR Detection System という装置で検出した結果です。
検出する塩基配列、使用する試薬が異なれば、PCRの増幅効率は変わります。
リアルタイムPCRにおいて、PCRの増幅効率は増幅曲線に影響し、それは最終的にCt値に影響します。(下の図のように、赤色の線をThresholdとしたとき、Ct値に差が生じます。)

同じ曲線でも、手動でThresholdの位置を変えるだけでCt値も変わります。

下の表では、医薬品医療機器総合機構(PMDA)が審査を行い、厚生労働省が承認した体外診断用医薬品が並んでいます。

多いですね!PCR検査に使用する『核酸キット』は20個以上あります。
iPhoneの縦長のスクリーンショットでも収まりきりませんでした。(まだ下に続きます。)
https://www.pmda.go.jp/about-pmda/news-release/0012.html#2
新型コロナウイルス感染症の体外診断用医薬品(検査キット)の承認情報
https://www.mhlw.go.jp/stf/newpage_11331.html
これらの検査キットの試薬ごとにPCRの増幅効率は変わります。
同じ感染者でも、唾液と鼻咽頭スワブでウイルス量が異なることは言うまでもありませんが、たとえ同じ部位から採取した検体を比較しても、違う試薬とPCR装置を使っている別の検査機関とCt値が完全に一致するとは限りません。
また、同じ検体、同じ試薬に同じPCR装置を使っていたとしても、PCR装置のソフトウェアのThresholdの設定が一致していなければ、もちろんCt値は一致しないでしょう。
これが、Ct値を基準にして議論することが難しい理由です。
実は、Ct値は正確にウイルス量を示すものではないのです。
本来、リアルタイムPCRでは、あらかじめ決められた本数の入ったチューブを測定し、例えば、下の図のように1800本のCt値は32.5、18000本のCt値は29...と、その紫色の点を繋げて、検量線(Standard Curve)を作製します。この検量線を用いて検体のCt値から逆算することにより、検体に含まれるウイルスゲノムの本数が分かります。
使う試薬やPCR装置ごとに異なる増幅効率の違いは、この検量線から算出される本数には影響しません。

https://www.nature.com/articles/s41586-020-2008-3/figures/7
少し難しい話になりましたが、これをものすごーーくざっくり言ってしまえば、どんな試薬を使おうと『1本は1本』です。
これがCt値との大きな違いです。本数であれば、試薬などの条件の違いに左右されることなく、正しい比較ができます。
検量線を作製するには、ある程度のコツ(溶液を均等に希釈するテクニック)が必要ですが、初めて研究室に配属された学生でも2,3回やれば綺麗な直線が引けるようになります。そんなに難しいことではありません。

https://catalog.takara-bio.co.jp/product/basic_info.php?unitid=U100009037
したがって、査読後に消された文章ではありますが、Clinical Infectious Diseasesに掲載される前のプレプリントに書かれていた「陽性・陰性の判定に『Ct値』が使用されるべきではない」というのは、ある意味正しいです。
正しい比較のできる『本数』が判定にも使用されるべきだと思います。
【査読前】
This indicates that neither the Ct values nor cell culture results should be used to make clinical decisions, or infection control decisions, due to the lack of sufficient clinical outcome studies.
訳)これは、十分な臨床研究が不足しているため、Ct値も細胞培養(感染実験)結果も臨床的決定または感染管理の決定に利用されるべきではないことを示しています。
https://www.medrxiv.org/content/10.1101/2020.08.05.20168963v1
Posted August 06, 2020
そもそも、世界各国、その中でも様々な企業の検査キットが使われている中で、陽性・陰性を分けるCt値を統一させるという議論自体バカげていると言っても過言ではありません。
PCRの増幅効率の良い検査キットは、判定基準のCt値が40より低くても良いかもしれません。一方で、値段が安い、”粗悪”とまでは言いませんが、増幅効率を犠牲にしたような検査キットであれば、他の検査キットよりも判定基準のCt値を高くする必要があるでしょう。
日本臨床検査医学会で新型コロナ対策を担当する柳原克紀・長崎大教授は「ウイルスが極めて微量だから感染性がないとは現状では言えない。使う機械や試薬によってもCT値(※ Ct値)は異なる。この値だけで断言するのは難しいだろう」と指摘する。
...
PCR「陽性」基準値巡り議論、日本は厳しめ?(2020年11月8日)
https://www.nikkei.com/article/DGXMZO65910480W0A101C2CE0000/
まさにこの発言の通りです。
トンデモ連中が「大手メディアの報じていることだから」と切り捨てる情報の中に”真実”があるんですよ。幅広く情報を集めましょう。そして、それを理解するための知識をつけましょう。
個人的に、Ct値の結果しか示されていない論文は「検量線を作製する能力もないのか...?」と、正直あまり読む気になりませんし、その論文を基にした議論をする気にもなりません。笑
私は、Ct値ではなく『本数』に基づいた議論をすべきだと思います。
ただ現状、検量線を作製せずに、Ct値だけが判定に用いられていることを考えると、「判定にCt値が使用されるべきではない。」と言うのは現実的ではありません。それは、この文章が査読後に消されたことからも明らかです。
したがって、「Ct値がウイルス量を正確に示していない!?そんな検査なら止めてしまえ!」と言うのはあまりに暴論で、「PCR検査を止めれば、感染者はいなくなる!」と言う人には、おねしょを隠して体裁を取り繕っているような気持ち悪ささえ感じます。
予定通りです。検査を止めれば、感染者は1人も出てきません。病院がガラガラになったら、また検査しますから。 https://t.co/gwp4SA1zzF
— dadajiji39 (@dadajiji) February 11, 2021
dadajiji39 @dadajiji
予定通りです。検査を止めれば、感染者は1人も出てきません。病院がガラガラになったら、また検査しますから。
引用ツイート
午後10:47 · 2021年2月11日·Twitter Web App
こういう人に、私が「では、代わりになる検査はなんですか?」と聞いてもまともな答えが返ってきた試しがありませんね。笑
では、ウイルスの『本数』で陽性と陰性を分けることは適切なのでしょうか?
本数であれば、世界各国のデータの比較がしやすくなり、基準の見直しが必要であると判断される可能性もあります。
こういうデータがもっともっと欲しいんですよ!!

https://www.nature.com/articles/s41467-020-20568-4/figures/1
PCR検査を批判する人にも、ここまではきちんと理解してもらいたいと思います。
PCR検査を批判する人の中には「PCR検査を支持するコロナ脳は思考停止!」と言う人がいますが、Ct値にこだわって批判をしているのもまた『思考停止』の状態です。気付いていますか?
「Ct値は比較には向いていない・判定基準の統一は難しい。」
→「では、どうしたらいいのか?」
思考を進めましょう!
より本質的な議論をするためには、PCR検査の特性を正しく理解し、『何のために行うのか?』を考えることが重要だと思います。
基本的にどんな検査でも、その結果で行動が変わるならば、行う意味があります。しかしながら、行動が変わらないならば、その検査はやるだけ無駄になってしまいます。
私は、PCR検査が最もその能力を発揮するのは、積極的疫学調査による『濃厚接触者』の検査だと思います。つまり、『クラスター対策』です。
濃厚接触した相手(”陽性者”)と同じタイミングで感染したのでなければ、より早いタイミングで、ウイルス量が増える前・感染力が強くなる前に気付くことができ、感染拡大を防ぐことができる可能性があります。
しかしながら、発症前のPCR検査は、ウイルス量が増える前であることから、ウイルスを検出できない、すなわち『偽陰性』の可能性が高くなります。
取りこぼしなく検出するためには、上限いっぱいCt値40以下(数本以上)を『陽性』と判定することが適切だと思います。(「偽陽性が多くなる!」と言う人は、『PCR』の凄さを嘗めるな!の記事を読んでください。)

Presymptomatic SARS-CoV-2 Infections and Transmission in a Skilled Nursing Facility
https://www.nejm.org/doi/full/10.1056/NEJMoa2008457
それでも確実な診断が難しいことから、濃厚接触者であると分かった時点でその後の症状が出る・出ないにかかわらず、自主隔離・他人との接触を極力控え、感染拡大防止策を徹底することが大事だと思います。
ウイルス感染から症状が出るまでの潜伏期間は4〜8日、周囲に感染を広げる可能性があるのは発症の2日前から発症後7〜10日程度です。

感染症疫学の用語解説
https://jeaweb.jp/covid/glossary/index.html
これをきちんと理解して、感染を拡げる可能性のある期間だけ我慢できないものでしょうか?
濃厚接触者がPCR検査を拒否することは言語道断です。「じっとしていられない!」、「会食や旅行の約束があるから...。」、そんな理由で他人を危険に晒す人間がいることにも怒りを覚えます。PCR検査を無駄しているのは自分自身です。
池袋で自動車暴走事故を起こした飯塚幸三被告と同じ人種ですよ。
そんな奴らは檻の中に入れておけば良いと思います。隔離もできて一石二鳥ですね。笑
基本的人権の尊重?
危険に晒された人の人権は?『公共の福祉』って知っていますか?
中学社会【現代社会】 公共の福祉とは?
日本国憲法は第12条の後半で次のように定めています。
「国民は,これを濫用(らんよう)してはならないのであって,常に公共の福祉のためにこれを利用する責任を負ふ。」
「これ」とは,憲法で保障されている自由や権利(基本的人権)のことです。基本的人権は自分ひとりだけのものではないので,わたしたち国民は,他人の権利を侵害するような権利の使い方(=権利の濫用)をしてはいけません。国民には,社会全体がよくなる(=公共の福祉)ように,権利を利用する責任があります。
https://benesse.jp/teikitest/chu/social/social/c00780.html
『正しい知識』で社会を良くしていきましょう。
久しぶりの投稿で、書きたいことを詰め込んだら長くなってしまいました。笑
また次回から、「デマに対するファクトチェックには即効性が大事!」を肝に銘じて、noteの記事を書いていけたらと思います。
ではまた。
補足)「高いCt値で検出されたものは細胞に感染しないからウイルスの死骸だ!」と言っている人は、ウイルスの感染実験を知らないド素人です。
ウイルスが細胞に感染するためには、ある程度まとまった数を必要とします。
下の図はある感染実験の結果で、ウイルスに感染した細胞が緑色で標識されています。

https://www.cosmobio.co.jp/product/detail/lenti-orf-viral-particle-org.asp?entry_id=17370
ウイルスの感染実験では、培養細胞数あたりのウイルス量の意味で、MOI(multiplicity of infection)やGEq/cell(genome equivalents per cell)という単位を使います。
右端の『35 MOI』は、例えば、100個の培養細胞に3,500個のウイルスという比率で感染させた結果になります。
そして、ウイルスをMOI 17.5、8.8...と段階的に希釈していくと、感染細胞の減少が見られます。
さらに希釈していけば、緑色の感染細胞は、ウイルスが希釈されただけ・壊れていないにもかかわらずほとんど見えなくなるでしょう。
前述のClinical Infectious Diseasesの論文のSARS-CoV-2感染実験では、目薬一滴と同量の50 μLの検体を細胞に添加していました。
当然、その量を例えば1 mlにすればウイルス量は20倍になり、SARS-CoV-2の感染が見られるようになる可能性はあります。
したがって、『細胞に感染しなかった=ウイルスの死骸』は正しくありません。
あくまで、その感染実験の条件では、培養細胞へのSARS-CoV-2の感染が見られなかったということです。(『Nonculturable(培養不可)』と表記します。)
ちなみに、この台湾の研究チームの論文は、Ct値、コピー数、感染性について細かく調べているのでおすすめです。この資料を持ち出して議論している人には私は一目置きます。
(こういう正確なデータを基に議論できるからこそ、台湾のCt値は低く設定されているのかもしれません。日本も頑張って欲しいですね。)

https://jcm.asm.org/content/58/8/e01068-20
以下、池田正行とかいう口の悪い医者(まぁ私も大概ですが)のブログより引用。
...
英オックスフォード大学の研究チームはPCR検査が死んだウイルスの残骸を検出している可能性があると報告(*2)。
...
*2. Wellcome Open Research 2020, 5:181 Last updated: 13 OCT 2020。この論文のAbstractには、PCR-positive sera inoculated into cell culture did not produce any cytopathic effect or yield an increase in detectable SARSCoV-2 RNA. Viral RNA was detectable at low viral loads in a minority of serum samples collected in acute infection, but was not associated with infectious SARS-CoV-2 と明記されている。
https://square.umin.ac.jp/massie-tmd/bakano_pcr.html
論文の文章を引用して「死んだウイルスの残骸を検出している可能性がある」と書いていますが、どこにそんなことが書いてありますか?
思い込みって怖いですね。笑
しかも、悪質なキリトリです。原文は以下の通りです。
Conclusions:
vRNA (Viral RNA) was detectable at low viral loads in a minority of serum samples collected in acute infection, but was not associated with infectious SARS-CoV-2 (within the limitations of the assays used).
訳)結論
ウイルスRNAは、急性感染期に採取された少数の血清サンプルでは低ウイルス量で検出可能でしたが、(使用したアッセイ(感染実験)の範囲で、)感染性を持つSARS-CoV-2とは無関係でした。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7689603/
カッコ書きだから大事ではないと思ったのでしょうか?
この一文があるとないでは大違いですよね?
他人をバカにする前に、バカを晒しているのはあなたであることを自覚してくださいね。笑
補足)こちらは『時間軸』も考慮できていない例です。
はい、Scienceからもどうぞ。全く論文読めて無かったよね。
— Mami (@Mami38796588) February 6, 2021
↓
high CT values, suggesting the PCR has identified genetic material from noninfectious viral debris. pic.twitter.com/UEFs9pgkjY
Mami @Mami38796588
返信先: @Mami38796588さん、@YpaFYrHLXE2Z6WAさん、他2人
はい、Scienceからもどうぞ。全く論文読めて無かったよね。
↓
high CT values, suggesting the PCR has identified genetic material from noninfectious viral debris.
午後10:12 · 2021年2月6日·Twitter for iPhone
まず、『CT values』と書いてあることから「あっ…(察し」となって欲しいところですね。笑
論文ではありません。日経新聞の記事もそうでしたが、世の中まともな記者はいないのでしょうか?
キリトリをされていますが、全文は以下の通りです。
Conversely, people often test positive for weeks or even months after they recover but have high CT values(※ Ct values), suggesting the PCR has identified genetic material from noninfectious viral debris.
訳)逆に、患者は回復後、数週間~数ヶ月間陽性となることがよくありますが、Ct値は高く、そのPCR(RT-PCR)は、非感染性のウイルス断片由来の遺伝物質(RNA)を検出したことを示唆しています。
One number could help reveal how infectious a COVID-19 patient is. Should test results include it?
By Robert F. Service
https://www.sciencemag.org/news/2020/09/one-number-could-help-reveal-how-infectious-covid-19-patient-should-test-results
Sep. 29, 2020 , 3:15 PM
時間軸!大事!!
これも『Viral debris(ウイルス断片)』は、培養細胞に感染しない=ウイルスの死骸という記者の思い込みから来たものです。
繰り返しになりますが、『Nonculturable(培養不可)』です。
それ以上でも以下でもありません。
補足)This Week in Virology - Microbe.TVというYouTubeチャンネルの動画にDr. Anthony Fauciの『Dead nucleotide』という発言があります(5:07)。
これは主催者のDr. Vincent Racanielloの以下の質問を受けての回答です。
Host: Dr. Vincent Racaniello(3:50〜)
There have been number of reports of patients who shed viral RNA for weeks as determined by PCR, doesn't seem to be infectious virus. And the real question is "Are they a threat for transmission?" and I'm wondering if you think we could use a cut off of viral loads determined by PCR to say this patients is no longer infectious, ...
訳)PCRにより、ウイルスRNAを数週間検出される患者の報告が多数ありますが、感染性ウイルスではないようです。 ここで私が聞きたいのは、「彼らが感染拡大の脅威となるのか?」ということです。 そして、PCRによりウイルス量のカットオフを使用して、この患者はもはや感染性ではないと言うことができると思いますか? ...
時間軸!!!!!
現役のSARS-CoV-2研究者ではなく、80歳のおじいちゃんの発言を”切り取って”大騒ぎって...バカみたいですね。笑
この動画をあちこちに貼っている人って、ちゃんと観たの?
次、私へのリプにこの動画が貼られたら、何分何秒からどういうことを言っていたか聞いていいですか?笑
補足)Beckman Coulter(Cepheid)社の『Xpert Xpress SARS-CoV-2』という検査キットでは、Ct値45以下で陽性となっています。(これは私もつい先日知りました。)
測定結果の判定方法
...
各標的RNAに対応するプローブは、それぞれ以下の範囲内にCt値(Threshold Cycle)があるとき、標的RNAが検出されたとみなされます。
COV2 E : 10~45、 COV2 N2 : 10~45

http://www.beckmancoulter.co.jp/product/product02/Xpert_SARS_CoV_2.html
このBeckman Coulter(Cepheid)社の『GeneXpertシステム』と呼ばれるシリーズは、短時間で・簡便に検査ができるというのが最大の特徴です。
リアルタイムPCRにかかる時間は、最大45分です。短い!

https://jcls.or.jp/wp-content/uploads/2020/09/6b0a89dc51a95145ff49c6949e7f3b46.pdf
ただし、その分、95℃→60℃→95℃→60℃..というPCRの温度の上げ下げの間隔も短くなり、ポリメラーゼの結合、伸長反応が不十分になる可能性があります。
PCRにかかる時間と増幅効率はシーソーの両端です。
時間の短縮を追求した場合、増幅効率は犠牲となり、他の検査キットよりもCt値は高く設定しなければ釣り合いません。これがこの検査キットでは、Ct値45以下(10~45)で陽性としている理由でしょう。
このGeneXpertシステムは、1検体のカートリッジ(青色の容器)が約2,000円で、ランニングコストが非常に高いことが指摘されています。

国境なき医師団
新型コロナウイルス:4倍も過度に高い価格 検査キットが途上国で供給不足
https://www.msf.or.jp/news/detail/headline/ac20200805mt.html
2020年08月05日掲載
現在、どれだけの民間の検査機関がこのGeneXpertシステムを採用しているかは分かりませんが、あまり一般的ではないことは確かだと思います。
多数の検体を一度に解析することはできません。

http://www.beckmancoulter.co.jp/product/product02/GeneXpert.html
かなり特殊な部類のPCR検査システムです。
それでも、装置とカートリッジがあれば検査自体は非常に簡便にできることを考えると、自費診療一回1万5千円のような野良PCR検査では普及しているかもしれません。(カートリッジ1個2,000円でも十分に儲けは出るでしょう。笑)

(クイック検査で『最短3時間』と書かれています。GeneXpertシステムであれば、もっと短い時間で結果が出るので違うかも?)
もしかすると、他にもCt値45以下で陽性と書かれた検査キットがあるかもしれません。しかしながら、時間の短縮のためにPCR効率を犠牲にしたGeneXpertシステム(Xpert Xpress SARS-CoV-2)のように、何かしらの理由があるはずです。
繰り返しなりますが、使用する検査キットの特性を理解することが大事です。
安易に「Ct値45」の文字に飛びついて大はしゃぎしないようにして欲しいと思います。
ではまた。
