
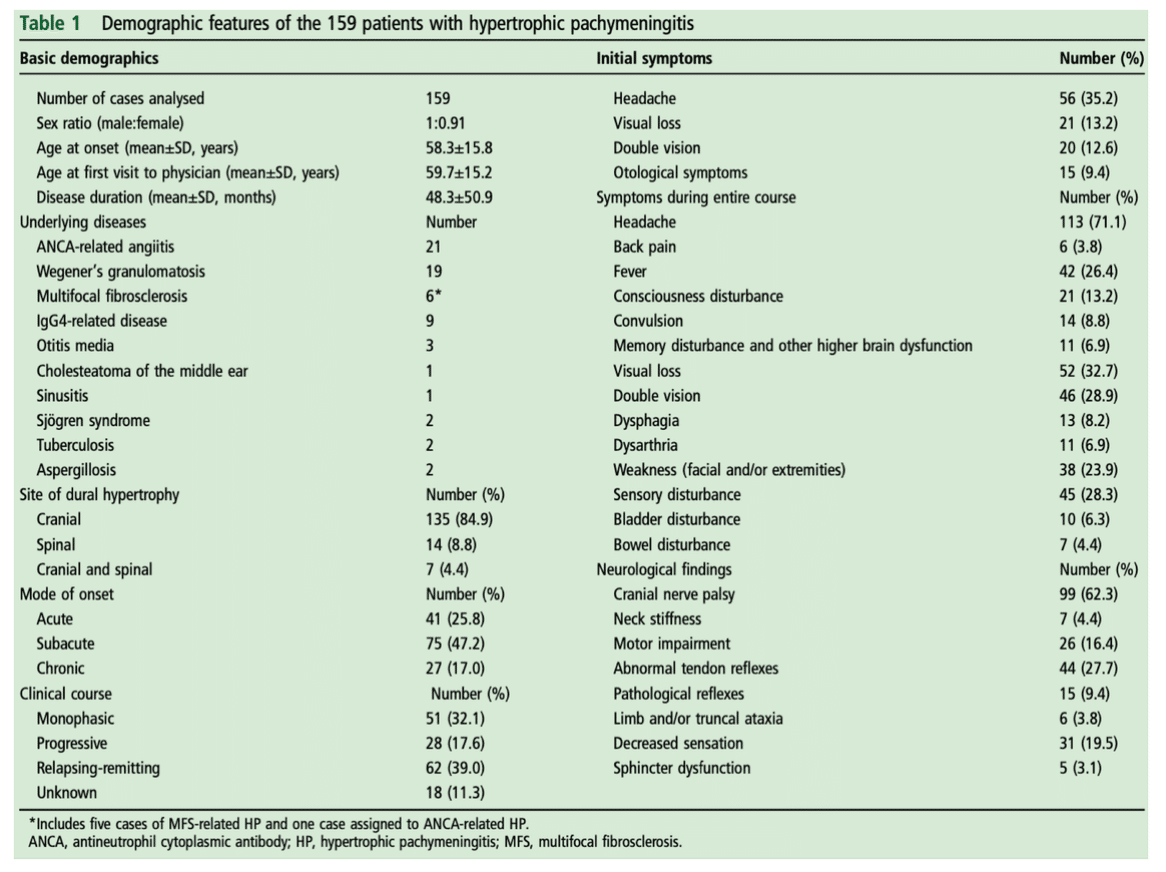
OMAAV 297例@Japan
Auris Nasus Larynx. 2021 Feb;48(1):2-14.
PMID: 32768313
Introduction
■ OMAAVはGPA、MPA、EGPAのどれでも起きうる
■ 初期症状or晩期症状として出うる
■ GPA、MPA 、EGPA に起因する中耳炎は、顔面神経麻痺や肥厚性硬膜炎を併発しやすい
■ 難治性中耳炎患者の初期症状/徴候は、GPA 、MPA 、EGPA の全て同じような症状で区別がつかない
■ そのため初診時にAAVによる難治性中耳炎がGPA、MPA、EGPAのどの疾患かは判断できない
■ しかもAAVに起因する中耳炎患者の約15%は、初診時にANCA陰性で、特徴的病理組織学的所見は得られず、その他のAAV関連臓器病変を示さない
■ これらの患者は全身性AAVの診断基準を満たさない
■ そのためこのような疾患を "ANCA関連血管炎性中耳炎(OMAAV)"として分類することを提案した
■ したがって、OMAAVにはGPA、MPA、EGPAによる中耳炎のほか、通常の全身性AAVの診断基準を満たさない中耳炎も含まれることとなっている

■ OMAAVは放置しておくと永続的な聴力低下の後遺症を残してしまう
■ そのため早い正確な診断が求められる
■ 今回297例を集積した
Character

■ ANCAともに陰性:17%
■ 聴力低下の症状は両側性74%
■ 他の血管炎徴候は41%しか認めず
■ タイプ別に以下の通りに分けられた
▫️中耳(80%;n=235)
▫️内耳(4%;n=11
▫️鼻や喉頭などの上気道型(5%;n=15)
▫️肺や腎臓などのその他の臓器(11%;n=33)
ANCA status

■ MPO-ANCA陽性:164人(56%)
■ PR3-ANCA陽性:66人(22%)
■ ANCA陰性:49人(17%)
■ 両方陽性:14人(5%)
■ ANCA陰性群は発症ー診断までの時間(8ヶ月)が長く、、肥厚性硬膜炎の割合(43%)、死亡率(6%)が高かった
Eardrum findings
■ 鼓膜の所見から滲出性中耳炎型(OME)と肉芽腫による鼓膜の腫脹を示す肉芽腫を伴う中耳炎OMG)型(図2b)に分類される。
■ OME型:鼓膜は発赤し、鼓膜を通じて液貯留がみれる

■ OMG型:鼓膜の発赤、腫脹、混濁を認める
鼓膜切開部から肉芽組織が観察される

■ 外耳道が腫れて鼓膜が見えない患者もいる
■ OME49%、OMG44%で臨床症状/徴候、ANCAの状態、後遺症、予後は群間で有意な差は認めず
Histopathological findings
■ AAVの病理組織学的所見は耳以外の部位から生検を受けた179人の患者のうち58人(32%)で認めた
■ しかし、中耳に病理組織学的所見を認めた患者は1例のみ
■ 中耳または乳様腔からの採取したものは、非特異的な炎症性細胞浸潤と壊死組織を示しただけであった
■ 外耳道から採取した小さなサンプルや、中耳腔を開けたり乳様突起を切除して得た大きな組織でも非特異的な炎症しか得られず
Computed tomography (CT) and magnetic resonance imaging (MRI) findings
■ CTでは鼓膜や乳様突起洞に骨破壊を伴わない軟部組織の影が認められる

■ しかし病気が進行したり感染を合併すると骨破壊が起きる
■ Zycinskaらは、PR3-ANCA陽性のGPA患者35人中7人(20%)がCT画像上で乳様突起の破壊を認めたと報告している
■ 造影MRIにおける硬膜、外耳、中耳および内耳の造影効果は、肥厚性硬膜炎および血管炎に伴う炎症部位の診断に有用である
■ MRIの特徴的な所見として、脳硬膜と蝸牛に強い造影効果を認める(Auris Nasus Larynx 2018;45(5):922–8)

■ MPO-ANCA陽性OMAAVの3テスラ3D FLAIR画像では、蝸牛と顔面神経の信号強度の増加が、感音難聴と顔面神経麻痺の重症度と関連している
■ ガドリニウム造影T1強調画像は、肥厚性中耳炎の診断に最も有用である

Hearing outcomes and vestibular function
■ 284人480 earsの聴力データ
▫️ 正常聴力は9例(2%)
▫️ 伝音性難聴は33例(10%)
▫️ 混合性難聴は329例(69%)
▫️ 感音性難聴は109ears(23%)に認められ、うち17ears(3.5%)が完全難聴であった
▫️ 両側性完全難聴は4例(1.4%)に認められた。
■ 追跡調査期間中央値24ヵ月間の聴力回復は以下の通り
▫️ 完全回復CR(30%)、部分回復PR(30%)、非回復NR(40%)
▫️ 聴力低下は初診時の聴力レベルに影響されなかった
▫️ 完全難聴は治療に関わらず不可逆的であった
■ 臨床経過中、35例(7.2%)の耳で完全難聴が進行し、10例(3.5%)では両耳性完全難聴であった
■ 顔面神経麻痺または肥厚性中耳炎を有する患者では有意に不良であった
■ ステロイド+免疫抑制剤の方がステロイド単剤よりも予後はよかった
■ めまいは25%で認められた
■ 森田先生らは、OMAAV患者31人中11人に前庭症状がみられた
前庭症状のなかった患者9人中6人に前庭症状が出現したと報告している
Facial palsy and hypertrophic pachymeningitis
■ 顔面神経麻痺は受診時18%で経過中32%出現した
■ 肥厚性硬膜炎は受診時15%で経過中24%出現した
■ これら合併症は全身性AAVよりも遥かに多い
▫️GPAにおいて顔面神経麻痺5-8%、肥厚性硬膜炎6.7%と推定されている
▫️AAVに関連した肥厚性硬膜炎患者21人のうち66%に中耳炎が認められたが、肺、鼻、腎の病変はそれぞれ29%、10%、10%にしか認められなかった
▫️ANCA陽性肥厚性硬膜炎100例において最も多い初発部位は耳(49%)であり、次いで眼(27%)、腎臓(7%)、鼻(3%)、肺(1%)であった
■ 顔面神経麻痺と肥厚性中耳炎の頻発がOMAAVの最も特徴的な症状である
■ 肥厚性硬膜炎の頭痛は90%で認め、毎日慢性的に生じる(J Neurol Neurosurg Psychiatry. 2014 Jul;85(7):732-9.)
■ 肥厚した硬膜による圧迫、硬膜周囲への炎症性細胞の浸潤、脳圧亢進、および硬膜肥厚によって循環障害が生じる
■ そのため脳神経障害をきたす

■ 病理では、膠原線維の増殖、リンパ球および形質細胞の浸潤、肉芽腫の形成を生じる
■ 脳脊髄液中のB細胞活性化因子(BAFF)と増殖誘導リガンド(APRIL)の上昇も病態に関与している可能性がある
■ MRIでは、肥厚した硬膜はT1強で低~等信号、T2で高信号強度を示し、ガドリニウム造影では著しい造影効果を示す
■ 小脳テントと頭蓋底に局所的な肥厚が起きやすい

■ 顔面神経麻痺は、炎症性肉芽が顔面管に広がることによって引き起こされることがある
■ 再発性または両側顔面神経麻痺は、OMAAV患者では珍しくない
■ したがって臨床経過中に再発性または両側の顔面神経麻痺がみられる難治性中耳炎患者は、OMAAVを疑うべきである
Prognostic factors
■全国調査のデータを分析した結果、OMAAV患者の聴力と生命予後を悪化させる5つの予後因子は以下の通り
▫️顔面神経麻痺
▫️肥厚性硬膜炎
▫️MPO-ANCAとPR3-ANCAの両方が陰性
▫️再発
▫️ステロイド単独治療

■ 肥厚性硬膜炎の早期診断は聴力および生命予後改善に不可欠である
■ 激しい頭痛は肥厚性硬膜炎の一般的な臨床症状であるが、感染性中耳炎の急性期にはほとんどみられない
■ したがって、初発症状や臨床経過中に激しい頭痛を訴える難治性中耳炎患者ではガドリニウム造影MRIを用いて硬膜肥厚の有無を確認すべきである
Diagnostic criteria for OMAAV
■ 全身性AAVの診断には、JMHLW基準 またはEMEAアルゴリズム が一般的に用いられている
■ しかしANCA陽性、病理組織学的所見、耳以外の臓器への浸潤を示さないOMAAV患者の診断には有用ではない
■ 実際、初診時にそのような患者の割合は17%であった
■ 患者の半数がANCA陰性を示し、生検標本で病理組織学的証拠を示すのは患者の3分の1であることから、上気道に限局したAAVの診断基準が必要であることがすでに示唆されている
■ したがって、OMAAVの診断には、JMHLW基準やEMEAアルゴリズムとは異なる専門的な診断基準が必要である
■ OMAAVの診断基準は、早期診断のために考案されたもので、臨床経過、臨床的特徴、診断の違いからなる3つの要件に基づいており、この3つの要件がすべて満たされたときに診断が成立する
■ 診断基準

Clinical course
■ 患者の大多数は浸出液や肉芽を伴う難治性の中耳炎であり、抗生物質や鼓膜チューブの挿入といった通常の治療には反応しない
■ 聴力は、中耳の浸出液または肉芽による空気伝導障害から始まり、そこに骨伝導障害が加わることがある
■ 4%の少数の患者は進行性の骨伝導難聴を発症してから難治性中耳炎を併発する
■ そのため経過としては以下の通り
① 抗生物質または鼓膜切開チューブに抵抗性の浸出性または肉芽形成を伴う難治性中耳炎
② その後骨伝導聴力の進行性の悪化
Histopathological and clinical features
■ OMAAVはGPA、MPA、EGPAおよび分類不能のAAVを含むAAVによる中耳炎と定義されているため、浸潤細胞の種類は病理組織診断に問わない
■ あくまで以下の位置付けである
「生検組織で血管炎として矛盾しない所見(①②のいずれか)がみられる。
①巨細胞を伴う壊死性血管炎 ②小・細動脈の壊死性血管炎」
■ 血清MPO-ANCAまたはPR3-ANCA陽性とAAVの病理は、AAVの診断に重要である
■ しかし、全国調査で確認された297人の患者を分析した結果、MPO-ANCAとPR3-ANCAにともに陰性は17%でAAVと一致する病理組織所見を示した患者は32%に過ぎなかった
■ これらの患者のうち、中耳腔に壊死性血管炎の病理組織学的所見を示したのは1人だけであった
■ さらに15%は初診時にANCA陽性でもAAVの病理組織学的所見も認められなかった
■ これらの結果は「ANCA陽性」や「病理組織学的証拠」はOMAAVの全症例の診断に適用できないことを示唆している
■ 中耳生検でAAVの病理組織学的エビデンスが得られないからといって、鼓膜切開や実験的乳様突起手術による生検を繰り返すことはできない
■ このような行為は診断の遅れや病気の進行につながってしまう
■ 全国調査では上気道病変44%、、強膜炎6%、肺病変38%、腎臓病変26%、多発性単神経炎5%とAAV関連の症状を認めた
■ さらに顔面神経麻痺と肥厚性中耳炎の頻発は、OMAAVの最も特徴的な徴候である
■ そのためにAAVに関連するこれらの随伴徴候・症状をOMAAVの診断基準に含められている
■ したがってANCA陽性もAAVの病理組織学的証拠も示さない患者でも、上記のAAVに関連する徴候・症状を示すか、すでに他の臓器を含むAAV(GPA、MPA、EGPA)と診断されていれば、OMAAVと診断することができる
■ 初診時にANCA陰性、AAVの組織病理学的証拠がない、耳以外の臓器のAAV関連病変を認めない患者の場合 は他の臓器にAAVに関連する徴候・症状が現れるまで、 OMAAVの診断は非常に困難となる
■ 提案された診断基準の目的は「早期診断」である
■ この調査では、GCのみを投与された患者は症状/徴候の一過性の改善を示し、しばしば疾患の再発を経験することがわかった
■ そこで、以下の基準を追加したためステロイドの投与が検討される
「副腎皮質ステロイド(プレドニゾロン換算で 0.5-1mg/kg)の投与で症状・所見が改善し、中止すると再燃する」
Differential diagnoses
■ 以上のような臨床経過と臨床的特徴の要件を満たし、鑑別診断が終了すれば、OMAAVの診断が確定する
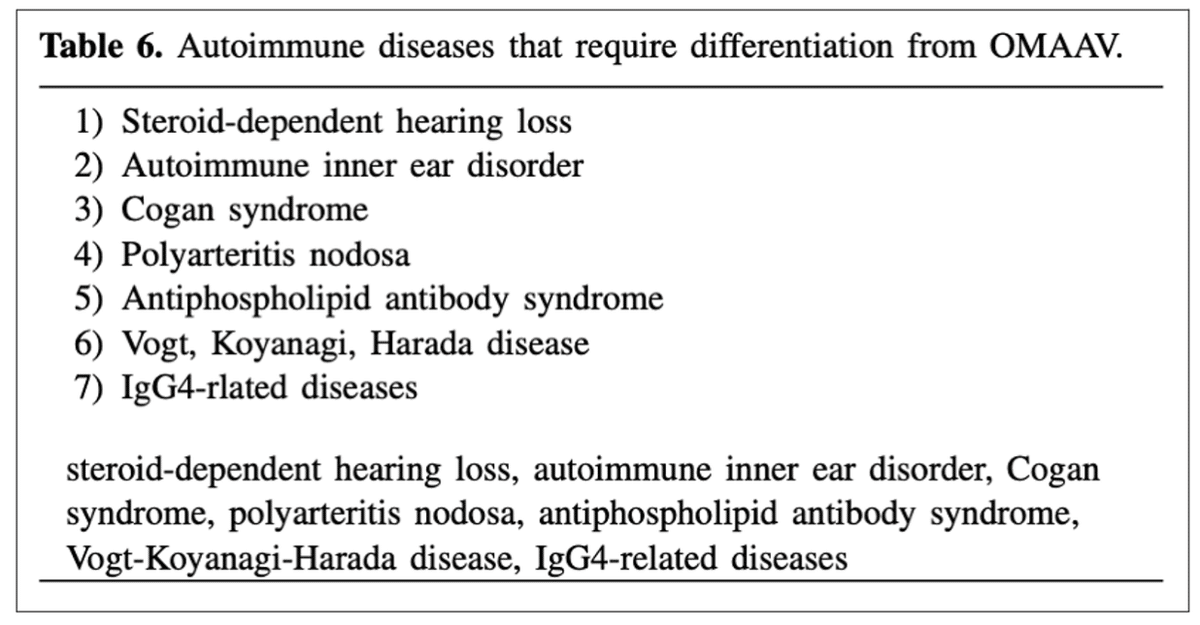
■ OMAAVと鑑別すべき疾患としては、以下の通り
中耳真珠腫、コレステロール肉芽腫、好酸球性中耳炎(EOM)、結核、悪性外耳道炎(頭蓋底骨髄炎)、新生物(悪性腫瘍、炎症性筋線維芽細胞腫瘍など)、AAV以外の自己免疫疾患(ステロイド依存性難聴、自己免疫性内耳障害、Cogan症候群、結節性多発動脈炎、抗リン脂質抗体症候群、Vogt-小柳-原田病、IgG4関連疾患)など
■ これらの疾患のうち、好酸球性中耳炎、頭蓋底骨髄炎を引き起こす悪性外耳道炎、IgG4関連疾患はしばしばOMAAVとの鑑別が困難である
■ EOM
▫️中耳に好酸球が浸潤し、糊のような濃厚な中耳滲出液を伴う難治性の中耳炎である
▫️抗生物質、鼓膜チューブ挿入、手術などの従来の治療に抵抗性を示す
▫️OMAAVと同様にEOMの鼓膜所見はOME型とOMG型に分けられる
▫️OMAAVとEOMの鑑別には診断基準が有用である
▫️好酸球浸潤の有無を確認する必要がある
▫️しかしEGPAによるOMAAVもEOMと同様に気管支喘息と中耳液中の好酸球浸潤を伴う
▫️したがって、EGPAによるOMAAV患者は最初にEOMと診断されることが多く、末梢神経炎の後発性に基づいて確定診断がなされる
■ OMAAVと頭蓋底骨髄炎に移行する悪性外耳道炎との鑑別は困難である
▫️診断基準が提案されている

▫️特にOMAAVが感染を合併すれば鑑別は厳しい
▫️両疾患とも、耳痛、耳漏、外耳道の腫脹と肉芽形成、治療抵抗性、顔面神経麻痺と肥厚性真珠腫炎を示す
▫️悪性外耳炎との鑑別は、細菌検査や真菌検査による病的微生物の検出、抗生物質に対する反応性、糖尿病の合併、ANCA陰性などである
▫️CT所見では、錐体炎と溶骨性病変が頭蓋底部から反対側へ広がっていく
▫️顎関節、耳下腺、傍咽頭腔、円錐頂点、中頭蓋窩にまで及ぶ
▫️しかしOMAAVの進行したケースでは悪性外耳道炎のCTとMRIで同様の所見を示す
▫️有効な抗生物質が投与され、患者が奏効すれば悪性外耳炎が疑われる
▫️抗生物質治療に反応を示さずステロイド治療に反応すればOMAAVが疑われる
▫️OMAAVも悪性外耳道炎も、早期介入の欠如が疾患の進行や致命的な転帰につながる可能性がある
■ 他にOMAAV同様にステロイドに反応する自己免疫性疾患は以下の通り
▫️IgG4関連疾患は血清IgG4濃度が高く、1つ以上の臓器にIgG4陽性形質細胞が浸潤し、局所の腫大、線維化、腫瘤、結節、肥大性病変を生じるのが特徴でありしばしばOMAAVとの鑑別が困難である
▫️OMAAVと同様に、IgG4関連疾患は、肥厚性硬膜炎や乳突蜂巣炎を引き起こすことがある
▫️MPO-ANCA陽性で混合性難聴を伴う中耳炎を発症したIgG4関連疾患患者の報告や、AAVとIgG4関連疾患が関連または重複してい症例報告もある
▫️IgG4関連疾患はGC単独治療によく反応するが、OMAAVはGC単独治療では再発することがある
Management of patients with negativity for both MPO-ANCA and PR3-ANCA
■ MPO-ANCAとPR3-ANCAの両方が陰性であった、あるいは臨床経過中に血清陽性となったOMAAV患者の症例報告はかなり多い
■ これらの報告はANCA陰性のOMAAVの型が存在することの証拠となる
■ 2012年のChapel Hill Consensus Conferrenceでは、ANCA陰性のAAVは3つの可能性のある要因によって引き起こされると提唱されている
①現在の方法では検出できないANCA
②まだ発見されていないMPO-ANCAとPR3-ANCA以外のANCA
③そしてANCAが関与しない発症機序である
■ ANCAの検査は間接免疫蛍光法(IIF)による検査が主体であるが、陰性の患者にはイムノアッセイ検査を考慮すべきであると勧告されている
■ IIF検査とイムノアッセイ検査を組み合わせることにより、臨床的に疾患が疑われる症例では診断の感度を高め、抗体価が低い症例では特異度を高めることができる
■ Tateyama先生達は、OMAAVのANCA陰性患者17例中8例が、色々なANCA検出法を組み合わせて解析し、ANCA陽性患者に再分類されたことを報告している
■ また化膿性肺疾患を伴う全身性血管炎に伴うbactericidal/permeability increasing protein (BPI)-ANCAと、壊死性半月体形成性糸球体腎炎に伴うエラスターゼ-ANCAが、MPO-ANCAとPR3-ANCAの両方で血清陰性の患者で検出されたという報告もある
■ これらの結果はANCAがたとえ陰性であっても疾患活性が高いことを示唆している
■ 好中球細胞外トラップ(NET)は、プログラムされた好中球細胞死の結果として放出されるNETosisとして知られている
■ NETは、MPO、PR3、ヒストン、好中球エラスターゼなどのさまざまな酵素で修飾された細胞外DNA線維で構成されており、AAVの病因に関与している
■ NETの形成は血管壁の炎症を誘発し、病原性ANCAを産生し、好中球の反応性と広範な血管炎の悪循環をもたらす
■ 中耳リザーバー中のNET(MPO-DNA複合体)がOMAAVのバイオマーカーとして非常に有用であることが報告された
■ ANCA陰性患者で免疫抑制療法を受けている状態でも検査でMPO-DNA複合体が高値を示した報告あり
Treatment
■ 全身性AAVの治療ガイドラインはいくつかあるが、上気道に限局したAAVやOMAAVの治療法はまだ標準化されていない
■ 上述したようにOMAAVの治療では、GCと免疫抑制剤を併用することで、GC単独での治療よりも効果的に再発や難聴の進行を予防することができる
■ 全国的な調査結果、過去の報告、最近の治療ガイドラインによると、OMAAVの寛解導入療法として、GCと免疫抑制剤の併用投与が推奨されている
Remission induction therapy
■ 耳に限局した病変を有するOMAAVに対しては、寛解導入療法の薬剤としてプレドニゾロン(PSL;0.3~1mg/kg/日)と経口シクロホスファミド(CY;25~75mg/体/日)が推奨される
■ 免疫抑制剤としては、最近の臨床ガイドラインで推奨されている月1回のシクロフォスファミドパルス療法(15mg/kg/月)または経口アザチオプリン(AZA;0.5-1.5mg/kg/日)、上気道に限局した疾患に対しては厚生労働省で推奨されているメトトレキサート(MTX;15-25mg/週)隔週投与も推奨される
■ PSLの減量は、局所および聴力レベルが寛解を示した1-2週間後に開始し、15-20mg/日まで毎週5-10mgずつ漸減し、少なくとも3ヵ月間維持する
■ リツキシマブ(RTX)は、全身性AAVの症例だけでなく、難治性のMPAやGPAの症例でも寛解導入に有効であることが再確認されている
■ EULARは、重要臓器を脅かすかor生命を脅かすAAVの寛解導入でGC+RTXによる治療を推奨している
■ またステロイドパルスやCY静注療法で寛解を示さない難治性のOMAAVに対しては、GC+RTX(375mg/m2を週1回、2~4週間)が有効かつ安全であると報告されている
■ 肺や腎などの全身臓器に病変を伴うOMAAV患者に対しては、日本における全身性AAVの診療ガイドライン 、EULARガイドライン、BSR/BHPRガイドラインに従い、重症度に応じた治療を行う
■ OMAAVと肥厚性硬膜炎の患者には、メチルプレドニゾロンパルス療法(500-1000mg/body、3日間)を行い、その後PSLと免疫抑制剤による寛解導入療法を行う
Remission maintenance therapy
■ PSLを15-20mg/日で少なくとも3ヵ月間維持した後、寛解維持療法を開始する
■ PSLを4-8週ごとに1.25mgまたは2.5mgずつ減量し、その後10mg/日で一定期間維持する
■ その後4-8週ごとに1mgまたは10%ずつ慎重に減量する
■ 治療開始から12ヵ月以内にGCを中止すると、再発のリスクが有意に増加する
■ CYは4~8週ごとに5mgずつ減量し、その後は12.5~25mg/日で一定期間維持する
■ さらに減量する場合は、隔日投与や2日間投与後1日間休薬するなどのレジメンで治療する
■ PSL+CY療法は有効であり、中耳に限局した疾患であればほとんどの患者で1回で寛解が得られる
■ しかし、CYの長期投与は感染、造血、不妊、膀胱出血などの副作用を引き起こしやすく、発癌(特に膀胱癌)のリスクもある
■ これらの毒性の発生率は累積投与量に比例する
■ したがってCYの投与期間は6ヵ月を超えてはならず、最近の診療ガイドラインではCYをAZA(0.5~1.5mg/kg/日)に置き換えることが推奨されている
■ リツキシマブ維持療法も選択肢の一つである
Surgery
■ 乳様突起切除術や鼓膜形成術のような、炎症を抑え難聴を改善するための耳の手術は、OMAAVの活動期には行うべきではない
■ 効果がないだけではなく、病気を悪化させる可能性があるためである
■ さらに病理組織を得るために鼓膜切開術や実験的乳様突起切除術による生検を繰り返すことは避けるべきである
■ 中耳および乳様突起腔に病理組織学的な証拠が認められるのは、きわめてまれなケースである
■ 経過、症状、鑑別診断に基づき、診断基準を満たせば診断が確立される
■ 両側性重度難聴に進行したOMAAVの治療として、人工内耳植え込みを考慮すべきである
■ Abou-Elhmd先生らは、全難聴を特徴とするGPA関連OMAAV患者に人工内耳を植え込んだところ、自由音閾値が40dBになり、Bamford-Kowal- Bench(BKB)音声認識テストで20%のスコアが得られたと報告している
■ 渡辺先生らは、人工内耳植え込み後に良好な聞き取りができたは、4人のうち1人だけであったと報告している
▫️残りの3人の患者は耳症状の発現後すぐに完全難聴となり、造影MRIで蝸牛の明らかな増強を認めた
▫️このMRI所見は蝸牛内の大量出血または蝸牛神経節を含む蝸牛構造の破壊の可能性を示している
▫️したがって、難聴になるまでの時間と造影MRI所見は、全難聴を伴うOMAAVに対する人工内耳植え込み術の予後を予測する上で重要である。
Future perspective
■ 以上のことから、OMAAVは中耳に限局して発症する疾患であり、進行すると肺や腎臓など他の臓器も侵される可能性が高いことが明らかになった
■ また顔面神経麻痺、肥厚性硬膜炎、完全難聴、さらにはくも膜下出血などの重篤な後遺症が生じ、死に至ることもあることが明らかになった
■ 治療には耳鼻咽喉科医と血管炎を専門とする医師の協力が必要である
■ 今後、本報告で提案した診断基準や治療戦略の有用性に関するエビデンスを蓄積しながら、OMAAVの概念を世界に広める必要がある
■ そのためには、診断基準や治療戦略に基づいた前向き追跡調査が必要である
■ 我々は現在、全国規模の前向き追跡調査の準備を進めている
■ さらに、より高感度なANCA検出法の開発やANCA以外の特異的マーカーの発見による早期診断・早期治療が今後の大きな課題となる
