
【量子化学】液体酸素はなんで青いの?
液体酸素はキレイな青色
液体酸素って実はめっちゃキレイな青色をしてます。自然科学に抵抗がない方には理科の資料集か何かで見覚えがあるかもしれませんね。youtubeで「液体酸素」と検索すると、液体酸素が青いことと磁石にくっつく性質が紹介されている動画は結構でてくるんですよ。自分は中学校の頃から「それは分かったから、なんで空気中の酸素が透明で液体酸素は青いの?」と疑問に思ってたことを、最近ふと思い出しました。今回はそうなる理由を量子化学を通して理解しようというNOTEです。良かったら最後までお付き合いください。
【伏線1】原子価結合法
高校化学で習う酸素の二重結合の表記はルイス構造式とか単にO=Oとかで充分だったと思いますけど、化学科の方に行くと二重結合の表記がリアルガチ(専門的)になっていきます。
有機化学の最初の方では原子価結合法っていう、主に炭素の混成軌道の表記法を習います。このとき結合は点や線ではなくて、原子からにょきにょき生えてる原子軌道(ローブ)の重なりで表現します。

ローブの形はシュレディンガー方程式を解いて得た電子の存在確率の広がりを表しています。有機化学では主に目的物を合成するための反応や反応メカニズムの方を重要視するので、ローブの形を求める膨大な計算はまずやりません(量子化学っていう授業で別個にやります)。
さてさて、酸素分子の結合は、結合軸上で向かい合ったローブの重なり σ 結合(水色;共有結合)と結合軸に対して垂直に立っている弱いローブの重なり π 結合(緑色)の2種類があります。ローブの重なりが結合の強さに直結するので σ結合の方が π結合よりも強いです。酸素分子はこれら2つをあわせて二重結合を形成しています。ローブの塗り潰しの有無は位相の違いを表していて、同じ位相同士が重なり合うと結合を形成したり、相互作用を起こします。
注意しないといけないのは、σ 結合の見やすさを重視したために酸素原子間の距離をリアルより長く表現していることです。実際は緑で描いている垂直方向のローブが少しだけ重なり合って π結合を形成しています。これについてはWikipediaの図を見ていただくと分かりやすいでしょう。
【伏線2】分子軌道法
分子軌道は複数の原子軌道(ローブ)を重ね合わせたものと考えよう、っていうのが分子軌道法です。個人的な印象は「原子価結合法のようにローブの絵を描きましょう」というより、エネルギーレベルごとの軌道に矢印 ↑↓ で表現する電子を書き入れていく下のような「分子軌道ダイヤグラムを描きましょう」っていうイメージが強いですね。

両サイド(青エリア)にある 2s と 2p は酸素の原子軌道で、これは電子殻のL殻に相当します。んで、センター(黄エリア)にある 2σ やら 1π は σ結合と π結合の形成に関わる分子軌道の名前です。数字は「低エネルギー側から数えて何番目か?」を意味します。残念ながら、スペースが足りなくて酸素分子の 1σ、1σ*軌道は描けませんでした。これを見れば酸素分子の結合本数が分かるので計算してみることにしましょう。

軌道名の肩には、”*”(スター)っていう記号が付いているものと付いていないものがあります。*が付いていない青い方は結合を形成するのに寄与する軌道で、これを結合性軌道(Bonding Orbital;BO)と呼びます。また、*が付いている赤い方は結合を解消するのに寄与する軌道で、これを反結合性軌道(Antibonding Orbital;AO)と呼びます。酸素分子の結合本数はスライドの右側の数式を使えば2になるんで、二重結合を形成するっていうことが分かります。
【いよいよ】液体酸素が青い秘密は1π*軌道にあり
長いこと2つの二重結合の表記をしてきましたが、いよいよ液体酸素の青さの秘密に迫ります。

酸素分子の電子が配置されている中で最もエネルギーレベルの高い軌道は1π*軌道で、そのローブは上スライドのような形をしています。反結合性軌道なので隣り合う位相が(白と緑になっていて)揃っていませんね。
気体酸素とは違って、液体酸素中では酸素分子同士が接近した状態になっています。とりわけ、酸素2分子が上下逆方向から接近すると下のスライドのように 1π*軌道のローブが重なって弱い相互作用をします。

液体酸素が青い秘密は実はここに隠されていました。この相互作用のエネルギーは主に波長634nmの赤色光に相当するので、白色光(太陽光)から赤色光が吸収された結果、液体酸素は青っぽく見えていたんです。一方、空気中(気体)で飛び回っている酸素分子だと分子間の平均距離が大きくなりすぎて、相互作用がほとんど起こらないため色がつかないわけです。
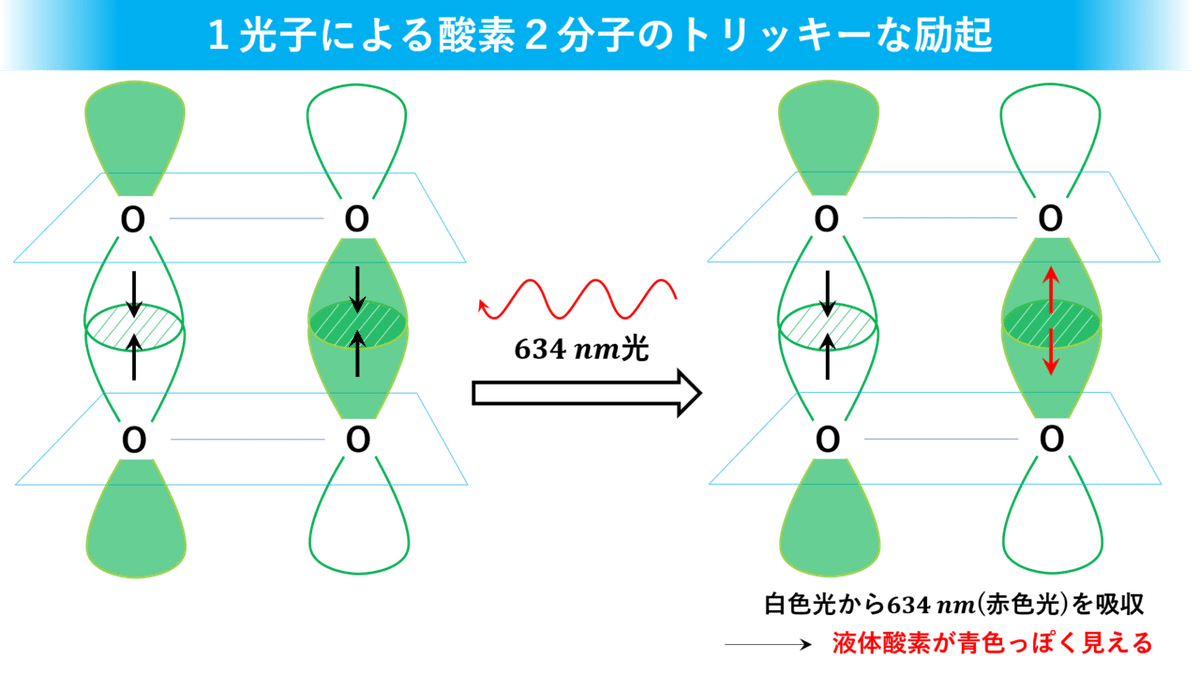
さて、液体酸素が赤色光を吸収したら何が起こるかというのも、光化学的にめちゃくちゃ興味深いですよ。1光子によって酸素2分子が同時に励起(=光エネルギーを吸収して活性化)されて、それぞれの酸素分子にある 1π*軌道の電子1個のスピンの向きが逆転します。
本来、量子力学のルール――スピン禁制則――では、励起前後で電子のスピンが逆転することは禁じられているんです。でも、この場合は特別でスピンが逆向きの2電子がスピン逆転して、トータルで見たら変化なし(±0)になるっていう超絶トリッキーな方法でこのルールをクリアしていたんです。これを初めて知った時は「液体酸素、マジパねぇっす」って思いましたね。
【ちなみに】液体酸素が磁石にくっつく秘密も1π*軌道にあり

物質が磁石の性質を示すのは、不対電子(=1つの軌道に1個だけ配置された状態の電子)を持っている場合です。例えば、鉄原子は不対電子を4個持っているので磁石になりますし、酸素分子も 1π*軌道に不対電子を2個持っているので弱いながら磁性を示します。先ほどの青く見える2分子相互作用とは違って、これは1分子単独で示すので液体・気体関係なく磁性を示しますよ。
【せやかて】液体酸素は危険物っす
液体酸素が危ない理由はこの 1π*軌道の(スピンが逆転している)電子に由来していて、世の中の多くの物質と化学反応を起こしやすくなっています。極低温とは言っても化学的に活性化している酸素がぎゅっと濃縮されているので、酸化しやすい有機物とかを近づけると急激に反応が進んで爆発する危険性があります。
このことを知らずに液体窒素を取り扱うとエライ目に合うかもしれません。よくイベントとかで①カーネーションを凍らせたり、②口に含んで見せたりするサイエンスショーがありますよね。液体窒素は非日常感を演出したり、ビジュアルが良くて映えるんですけど、凍傷と液体酸素による口内の酸素酸化のダブルリスクがあるので②は余りおススメできません。液体窒素の表面では空気が冷やされて危ない液体酸素が刻々とできているってことは覚えておいた方がいいでしょう。
【一言まとめ】
液体酸素が青い理由は、太陽光のうち赤色光を液体酸素が吸収した結果として青みを帯びるからでした。
【参考サイト】
リンク先の「PDFをダウンロード」から閲覧し、参考にさせていただきました。自分は自分の解釈した感じをそのままNOTEにしたので、厳密には違う点やら間違いやらが多々あると思います。興味を持たれた方、もっとガチで知りたい方はこちらを参考にしてみてはいかがでしょうか。
いいなと思ったら応援しよう!

