
119)ケトン・サプリメントの健康作用(その1):内因性ケトーシスと外因性ケトーシス
体がみるみる若返るミトコンドリア活性化術119
ミトコンドリアを活性化して体を若返らせる医薬品やサプリメントを解説しています。
【米国ではケトン・サプリメントがバカ売れしているらしい】
血中のケトン体が増えた状態をケトン症(ケトーシス)と言います。人間の健康に対するケトーシスの利点が数多く報告されているため、ケトン体を増やす方法にかなりの関心が寄せられています。
伝統的に、ケトーシスは低糖質・高脂肪のケトン食(ケトジェニック・ダイエット)に従うことによって達成されてきましたが、そのような食事法を順守することは困難な場合があります。脂肪の摂取を増やすと、腹痛や下痢などの消化器症状が高頻度で発生するためです。
ケトン食以外でケトン体のβ-ヒドロキ酪酸の血中濃度を上昇させる別の方法としてケトン・サプリメントがあります。ケトン・サプリメントとして、β-ヒドロキ酪酸そのもの、ケトン塩(β-ヒドロキ酪酸のナトリウム塩やカルシウム塩)、ケトンエステル、R-1,3-ブタンジオール、中鎖トリグリセリド(MCTオイル)などがあります。これらケトン・サプリメントを使用すると、糖質制限を行わないで血中ケトン体濃度を高めることができます。
米国では、これらのケトンサプリメントの人気が高まっています。日本でも、MCTオイルやケトン塩は販売が増えています。
ケトーシスを起こす外来性ケトンの有用性を理解するためには、ケトーシスの健康作用を理解する必要があります。
【人類は肉食として進化した】
人類の祖先の類猿人から初期人類にかけての数百万年間は主に森林に生息して木の葉や果実などの植物性食糧が主体であったため、栄養素としては糖質が主体でした。
約250万年前から氷河期に入って森林が縮小すると、人類は森を離れ、狩猟採集によって食糧を得るようになり、動物性の食事が主体になって糖質摂取量は減っていきました。
約1万年前に最後の氷河期が終わり、農耕や牧畜が行われるようになり、人類は再び糖質の多い食事に戻りましたが、それまでの約250万年の間に人類は、低糖質食に適応するように代謝系が遺伝的に変化したと思われます。

図:人類の祖先の類猿人から初期人類にかけての数百万年間は主に森林に生息して木の葉や果実などの植物性食糧が主体であったため、栄養素としては糖質(植物性食事)が主体であった。約250万年くらい前から氷河期に入ると森林が縮小し人類は狩猟採集によって食糧を得るようになり、動物性の食事が主体になって糖質摂取量は減っていった。約1万年前に最後の氷河期が終わると農耕や牧畜が行われるようになり、人類は再び糖質の多い食事に戻った。産業革命後(19世紀以降)は精製した糖質の摂取が増え、さらに1970年代以降は砂糖や異性化糖などの単純糖質の摂取量が増加した。
動物は食事の内容によって肉食や草食や雑食と分けられていますが、消化管の構造や体の代謝系はその食事の内容に適応するように進化しています。
例えば、肉食動物のネコには唾液にアミラーゼ(デンプンを分解する酵素)が無く、腸や膵臓の消化液も糖質を分解する酵素の活性が低くなっています。肝臓ではアミノ酸などからブドウ糖を作り出す酵素の活性が高くなっています。さらに、タンパク質を分解して得られるアミノ酸からミトコンドリアでエネルギー(ATP)を産生できるような代謝系が発達しています。このように肉食の動物は肉が多く糖質の少ない食事に適応するように消化管の構造や体の代謝系が進化しています。
人間はアミノ酸からミトコンドリアでエネルギーを産生する代謝系や、アミノ酸から肝臓でブドウ糖を合成する代謝系も発達しています。つまり、タンパク質を分解してエネルギー産生と物質合成を行う代謝系が肉食動物と同じように発達しています。
人間は、ブドウ糖(グルコース)の血中濃度(血糖)を下げるのはインスリンだけですが、血糖を上げるホルモンはグルカゴン、エピネフリン(アドレナリン)、糖質コルチコイド 、成長ホルモン、甲状腺ホルモンがあります。高血糖を防ぐホルモンより低血糖を防ぐホルモンを多く持っていることは、人間ではもともと血糖が上がらない食事(糖質の少ない食事)が基本であることを示唆しています。
ペットの猫は糖質の多いペットフードを与えるので、糖尿病やがんが増えています。本来肉食の動物に糖質を与えると代謝的に適応できないためです。人間も同様で、糖質の多い食事でがんや認知症や循環器疾患が増えています。
【人類は脳が発達したために進化の過程でケトン体産生能を高めた】
インスリンは骨格筋と脂肪組織におけるグルコース(ブドウ糖)の取込みを促進し、肝臓での糖新生を抑制することによって血糖を低下させます。
糖質の少ない食事では、脳や胎児へのグルコースの供給を減らさないために、骨格筋や脂肪組織へのグルコースの取込みを低下させることや、タンパク質や脂肪から肝臓でグルコースを作る糖新生の能力を高めることことが必要です。人類が氷河期に生き残るために、インスリンの働きを低下させるように進化しました。
インスリンは食事から吸収されたブドウ糖を血中から早く消失させる作用がありますが、食事からの糖質摂取量が少ない状況では、血中からブドウ糖が早く消失すると脳の働きや胎児の発育に支障をきたします。少ない血糖を脳や胎児に多く確保するために、インスリンの標的組織である筋肉や脂肪組織や肝臓でのインスリンの働きを弱める体質、すなわちインスリン抵抗性の体質を持つ方が生存に有利になります。
インスリンの働きが低下することを「インスリン抵抗性」と言います。つまり、インスリン抵抗性の形質を獲得することによって低糖質の食事に適応していったのです。このインスリン抵抗性が、近代になって糖質摂取が増えてから人類に様々な病気(糖尿病やメタボリック症候群など)を起こす原因となっています。
このようなインスリン抵抗性の獲得は人類以外の動物はあまり関係ないようです。脳の重量が小さい動物は、脳が使用するエネルギーも少ないからです。
チンパンジーの脳容積は400cc程度で、現代人の成人男性の脳容積の平均は約1350ccです。チンパンジーと同程度の脳容積しかなかった初期人類から、高度の知能をもった現生人類に進化する過程で脳容積は3倍以上に増えました。動物性の栄養素が増えたことが、人類の脳を大きく成長させ、知能の発達に大きく寄与したと言えます。人類が肉食になり、脳が発達したことによって、知能が高まり、文明を発達させることができました。
一方、脳が発達したことによって脳のエネルギー消費が増え、低酸素や低血糖によってダメージを受けやすくなるという問題が出現しました。これを解決する進化的圧力によって、人類ではケトン体の利用を増やすように進化することになったのです。
すなわち、脳内で絶えず発生する基本的なプロセス、つまり神経伝達(ニューロン間で発生する電気通信)は、多くのエネルギーを費やします。ブドウ糖は、成人の脳の標準的な条件下で主要な燃料として機能します。ケトン体は脳の主要な代替燃料であり、断食、飢餓、極端な運動、またはカロリーや炭水化物の制限など、低グルコースおよび低インスリンの条件下では、肝臓で代謝される脂肪の一部がケトジェニック経路に切り替えられます。 この経路は、まとめてケトンと呼ばれる 3 つのケトン体(β-ヒドロキシ酪酸、アセト酢酸、およびアセトン)を生成します。
β-ヒドロキシ酪酸とアセト酢酸は、β-ヒドロキシ酪酸デヒドロゲナーゼという酵素を介して相互に変換でき、おおよそ 2:1 (β-ヒドロキシ酪酸:アセト酢酸) の比率で循環血液中に存在し、β-ヒドロキシ酪酸を血中の主要なケトン代謝産物にします。アセト酢酸の一部は自発的に アセトンに脱炭酸され、肺から急速に吐き出されます。
アセトンは、ケトーシスのときに発生する可能性のあるフルーティーな呼気の原因です。β-ヒドロキシ酪酸とアセト酢酸は血液中に放出され、肝外組織に運ばれ、エネルギー源として利用されます。脳、心臓、腎臓、骨格筋などの一部の組織は、特に大量のケトン 体を使います。
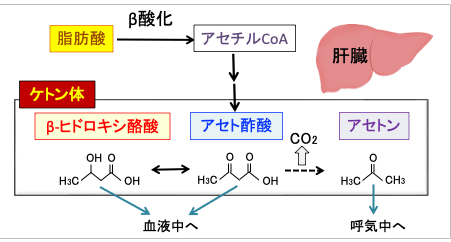
図:グルコースの供給が少ない状況では、肝臓では脂肪酸の燃焼(β酸化)で産生されたアセチルCoAからアセト酢酸の合成が亢進する。アセト酢酸は脱炭酸によってアセトンへ、還元されてβ-ヒドロキシ酪酸へと変換される。このアセト酢酸、βヒドロキシ酪酸、アセトンの3つをケトン体と言う。アセトンは呼気に排出され、アセト酢酸とβ-ヒドロキシ酪酸は肝臓以外の組織の細胞に運ばれ、ミトコンドリアのTCA回路と電子伝達系でATP産生に使われる。
人間の場合、脳の重量は体全体の2%しかありませんが、脳が使用するエネルギーは体全体のエネルギー量の20%前後です。体の全心拍出量の15%は脳に行きます。神経細胞はエネルギー源としてグルコースを使います。
脳は脂肪酸をエネルギー源として使用できないようになっています。脂肪酸をエネルギー源にすると低酸素や酸化傷害のリスクが高くなるからです(詳細は後述)。
健常な成人の脳では、脳組織100g当たり1分間に6〜7mgのグルコースが消費されています。これは1日に120〜130gに相当します。(成人の脳重量は1300〜1400g、1日は1440分なので、6mg x 14 x 1440 =約120g)
1日のカロリーを2000キロカロリーとして60%を糖質から摂取すると1200キロカロリーでこれは約300グラムの糖質になります。つまり、通常では、摂取したグルコースの40〜50%を脳が消費していることになります。したがって、飢餓などで食事からグルコース摂取が無くなると、脳のエネルギー源が不足します。
体内では肝臓と腎臓でグルコースが産生されます。これを糖新生といい、乳酸やグリセロールやアミノ酸などからグルコースを作ります。
長期間の絶食時には、肝臓で60%、腎臓で40%の比率で糖新生が行われます。ただし、糖新生で産生されるグルコースの量は1日に80グラム程度です。
1日の糖新生の量は、乳酸やピルビン酸から35-40g、脂肪由来のグリセロールから20g、たんぱく質由来のアミノ酸(主にアラニン)から15-20g、ケトン体から10−11gと報告されています。(Annu. Rev. Nutr. 2006. 26:1-22)
つまり、糖新生で産生されるグルコースだけでは、脳が必要とする1日120〜130gのグルコースは供給できないのです。
そこで、肝臓でケトン体が産生されることになります。1日に100から150グラム程度のケトン体が産生できるので、グルコースに代わる脳のエネルギー源となります。
ケトン体は水溶性で細胞膜や血液脳関門を容易に通過し、骨格筋や心臓や腎臓や脳など多くの臓器に運ばれ、これらの細胞のミトコンドリアで代謝されてブドウ糖に代わるエネルギー源として利用されます。特に脳にとってはグルコースが枯渇したときの唯一のエネルギー源となります。
血中のケトン体濃度が上昇するに比例して、脳のエネルギー産生におけるケトン体の依存度は増えます。たとえば、2~3日間の絶食で達する1.5mMのケトン体濃度では、脳のエネルギー産生の18%がケトン体に依存します。8日間の絶食で達する5mMでは脳が消費するエネルギーの60%がケトン体由来になります。20日間以上の絶食で達せられる7mMでは、60%以上がケトン体由来になります(下表)。
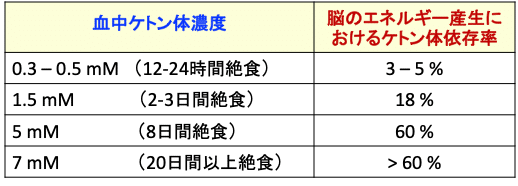
表:血中ケトン体濃度による、脳のエネルギー産生におけるケトン体依存の割合。(出典:J. Lipid Res. 2014. 55: 1818-1826)
【神経細胞は脂肪酸を取込むがエネルギー源として利用しない】
血管と神経細胞は直接接していません。血管はアストロサイトによって包まれるようになっており、血管内皮細胞とアストロサイトが「血液脳関門」を形成しています。血液脳関門はアストロサイトが神経細胞を守るための仕組みで、神経細胞への危険な分子の接触を妨げる「関所」の働きをしているのです。「脂肪酸は血液脳関門を通過できないので脂肪酸をエネルギー源にできない」と一般に言われています。
しかし、「脂肪酸は血液脳関門を通過できない」という記述は間違いです。正確に言うと、「脂肪酸は血液脳関門を通れるが、神経細胞は燃料(エネルギー源)として脂肪酸を利用できなくなっている」のです。脳を低酸素や酸化傷害から守るため、進化の過程で脂肪酸を燃料(エネルギー源)として利用しないように進化したのです。
脂肪酸には、そのまま細胞に取込まれて、細胞膜などを構成するリン脂質や化学伝達物質(プロスタグランジンや内因性カンナビノイドなど)の材料になる役割と、燃料(エネルギー源)になる役割の2つがあります。
脳組織の50%以上は脂肪で構成されており、リノール酸(ω6)やアラキドン酸(ω6)やαリノレン酸(ω3)のような必須脂肪酸は合成できないので、当然のことながら食事からの脂肪酸が神経細胞に取込まれます。また、DHA(ドコサヘキサエン酸)やEPA(エイコサペンタエン酸)も体内での合成が少ないので、神経細胞の細胞膜を構成するリン脂質や化学伝達物質を合成するために、これらの脂肪酸を特殊な結合たんぱく質やトランスポーターを使って積極的に取込んでいます。
つまり、脂肪酸が血液脳関門を通過するメカニズムは存在し、神経細胞は構造と機能の維持のために、食事からの脂肪酸を積極的に取込んでいます。しかし、神経細胞は脂肪酸をエネルギー源として使用しません。以下のような論文があります。
Why does brain metabolism not favor burning of fatty acids to provide energy? - Reflections on disadvantages of the use of free fatty acids as fuel for brain.(なぜ脳は、エネルギー源として脂肪酸の燃焼を好まないのか? - 脳のための燃料としての遊離脂肪酸の使用の欠点の考察) J Cereb Blood Flow Metab. 2013 Oct; 33(10): 1493–1499.
【要旨の抜粋】
脳において水素分子が豊富な脂肪酸がエネルギー源としてほとんど利用されていないのは不思議である。長く信じられている「脂肪酸は血液脳関門の通過が遅い」というのが理由なのかもしれない。しかしながら、この事実は実験結果によって確認されなければならない。この論文においては、3つの問題点に焦点を合わせる。
(1)脂肪酸のβ酸化によるATP産生はグルコースよりも酸素消費が多いので、神経細胞がより低酸素になるリスクを高める。
(2)脂肪酸のβ酸化は活性酸素(スーパーオキシド)の産生を増やし、神経細胞の抗酸化システムは脆弱なので、神経細胞は強い酸化ストレスを受ける。
(3)脂肪酸の分解によるATP産生の速度はグルコースを燃料とする場合よりも悪い。したがって、神経活動を持続的かつ活発に行うのに必要なATPの産生には脂肪酸の酸化は適しない。
以上の観点から、神経細胞が脂肪酸を燃料として使用するには問題が多いため、それが神経細胞のミトコンドリア内での脂肪酸のβ酸化に関与する酵素の発現を低下させるような進化的圧力となり、脳内ではグルコースがエネルギー源として好まれるようになり、脂肪酸のβ酸化は行われなくなったと推測される。
炭素数16個のパルミチン酸を二酸化炭素と水までに完全に分解すると、1分子のパルミチン酸あたり106個のATPが産生されます。一方、グルコース1分子を完全に分解すると32個(30〜38個といわれているが、最近は32個が多い)のATPが産生されます。
ミトコンドリアは水素を燃焼させてATPを作るので、水素分子が多い脂肪酸の方がグルコースよりもエネルギー産生量が多いのに、なぜ神経細胞は脂肪酸を燃料にしないのかという疑問があります。
心臓や腎臓などエネルギー消費の多い他の臓器では、脂肪酸が主なエネルギー源として利用されています。心臓や腎臓ではエネルギーの60から80%が脂肪を酸化して産生しています。
神経細胞のシナプス伝達に神経細胞のエネルギーの80%が使用されています。脳の神経活動に大量のエネルギーが必要とされています。
脳で産生されるATPの90%はミトコンドリアでの酸化的リン酸化で産生されていますが、神経細胞ではエネルギー源として脂肪酸はほとんど使用されません。
神経細胞は解糖系酵素が低下しており、そのため、アストロサイトがグルコースを解糖系で乳酸にして、その乳酸を神経細胞に供給するという経路が存在します。
脳組織全体のエネルギーの約20%は脂肪酸を燃焼して産生していますが、脂肪酸を燃焼するのはアストロサイトです。神経細胞(ニューロン)はほとんど脂肪酸を燃焼しません。
最近の研究によると「脂肪酸が血液脳関門を通過できない」という記述は間違いのようです。DHAやEPAにアイソトープで標識した実験などでは、DHAやEPAが血液脳関門を容易に通過して神経細胞に取込まれていることが示されています。しかし、エネルギー源としては利用できない状況になっています。
同じ量のATPを産生するときに、グルコースの燃焼(解糖+TCA回路+酸化的リン酸化)よりも脂肪酸のβ酸化による燃焼の方が酸素消費は多く、活性酸素の産生も多くなります。酸素消費量は脂肪酸酸化の場合はグルコース酸化の場合より15%程度多くなります。
その結果、脂肪酸を燃料にすると、神経細胞は酸素不足になりやすく、さらに酸化傷害を受けやすくなるので、グルコースを主な燃料にするように進化したという考えです。
実際に、神経細胞のミトコンドリアでは脂肪酸を分解するβ酸化に関与する酵素の発現が少なくなっているので、脂肪酸を燃料にできにくくなっています。それは、脂肪酸をエネルギー源に使わない方が生存に有利になるので、進化の過程で神経細胞が脂肪酸を使わないように進化的圧力が作用としたと考えられます。
ケトン体(アセト酢酸とβヒドロキシ酪酸)はATP産生における酸素消費がグルコースより少ないことが知られています。したがって、神経細胞に脂肪酸を燃焼させるより、肝臓やアストロサイトで脂肪酸を分解してケトン体にして神経細胞に供給すると、神経へのダメージが軽減できます。
ケトン体はモノカルボン酸トランスポーター(monocarboxylate transporters)の MCT1と2を使って、細胞質とミトコンドリアに入ることができます。
このように、神経細胞がダメージを受けるリスクを下げるという進化的圧力が、神経細胞では脂肪酸は燃料として使わずに、グルコースとケトン体が燃料になったという考えは、進化論的には十分に納得できる説明です。

図:脂肪酸は血液中ではアルブミンと結合して循環している。脂肪酸は特殊なトランスポーターなどを使って血液脳関門を通過できる。取込まれた脂肪酸の多くは細胞膜のリン脂質など細胞構成成分の合成に使用される。神経細胞のミトコンドリアでは脂肪酸のβ酸化に関与する酵素の発現が低下しており、脂肪酸を燃料(エネルギー源)として利用できなくなっている。その理由は、脂肪酸の酸化はグルコースの酸化よりも酸素消費が多く、活性酸素の産生が多く、ATP産生に時間がかかるため、進化の過程で脂肪酸を燃料に利用しないようになったためと考えられている。
【ケトン体は脳を守る働きがある】
ケトン体の産生は、飢餓を生き延びるために進化の過程で獲得した代謝系です。発達して大きくなった脳を守るために、特に人類で発達した代謝系と言えます。
人類は二足歩行を開始し、両手を使い、脳が発達し脳の体積は大きくなります。二足歩行は骨盤を狭くし、脳が大きくなると、出産のときに産道を通過するのに時間がかかります。その結果、動物の中で人類が最も出産時に脳の低酸素や低血糖で脳障害を起こしやすくなっています。
人間の胎児は他の動物に比べて太っている(体脂肪が多い)のは、出産時や出産後の脳へのケトン体の供給を増やして脳がエネルギー不足にならないように適応するためだという意見があります。
新生児では、脳は全エネルギー必要量の最大 70% を消費します。そのエネルギーのほぼ半分は、出生後にグルコースレベルが急激に低下し、β-ヒドロキシ酪酸レベルが自然に 2 ~ 3 mM に上昇するため、β-ヒドロキシ酪酸から得られます。ヒトの母乳にはケト原性脂肪である中鎖脂肪酸トリグリセリド(MCTオイル)が多く含まれているため、通常、乳児は授乳期を通して軽度のケトーシス状態のままです。
動物の中で絶食時にケトン体の生成が最も増えるのが人間です。熊は冬眠している間は絶食状態で体脂肪が燃焼していますが、4〜5ヶ月絶食している間もケトン体は0.5mM以上に増えないと報告されています。猿も人間ほどケトン体は上昇しません。イルカはどんな状況でもケトン体は増えません。
人間は体が使うエネルギーの20%くらいを脳が使っています。他の動物は5%以下です。
絶食したときに、脳が小さい動物はケトン体を作らなくでも肝臓や腎臓の糖新生だけで脳のエネルギーを十分に賄えるからです。
しかし、脳が大きく進化した人間の場合は、糖新生だけでは脳のエネルギーを満たせない状態になったので、ケトン体を懸命に作るように進化したと考えられています。
脂肪酸を燃焼すると神経細胞がダメージを受けやすくなるので、肝臓や腎臓やアストロサイトで脂肪酸を分解させてできたケトン体を神経細胞に運ぶという代謝系を作り出したと言えます。つまり、ケトン体の産生は人類の進化に必要な代謝系と言えます。
小児や新生児はケトン体産生能が高いことが知られています。成人が絶食してβヒドロキシ酪酸の血中濃度が3mMになるのに2〜3日間かかります。一方、新生児や乳幼児は4〜8時間の絶食で2〜3mMに達します。6歳の子供では24時間の絶食で4mMに達すると報告されています。(下図)

図:絶食後のβヒドロキシ酪酸の血中濃度(mM)。新生児や乳幼児や小児は数時間でケトン体の濃度は顕著に上昇する。体全体に対して脳が消費するエネルギー比率が高いほどケトン体は産生されやすい。(出典:Annu. Rev. Nutr. 2006, 26: 1-22)
これは、新生児や乳幼児や小児は成人に比べて、体に対する脳の重量比が大きく、エネルギー消費率も高いので、絶食によってグルコースが減少すると脳のダメージを受けやすいので、ケトン体を合成する能力が高くなっているためと思われます。
妊婦もケトン体産生量が高いことが知られています。妊婦は胎児が存在する分のグルコース消費が高いので、ケトン体の産生も高める必要があるからです。
絶食で体内に増えるケトン体が有毒であるのであれば、狩猟採取で食糧を得ていた氷河時代の人類が生き延びることはできなかったはずです。ケトン体はエネルギー消費量が大きくなった脳を飢餓時に守るために作られるようになったのです。
神経組織はグルコースよりケトン体を好んで使います。最近は、アルツハイマー病など神経変性疾患で、中鎖脂肪酸(MCTオイル)を積極的に摂取したり、ケトン体のサプリメントを補充する治療が注目されています。
【血液中にケトン体が増えている状態をケトーシス(ケトン症)と言う】
通常は血中のブドウ糖濃度は4~5 mmol/L(mM)程度に対して、ケトン体の血中濃度は0.3mmol/L(mM)以下と極めて低値です。しかし、絶食すると数日で増え始め、10日くらいするとブドウ糖濃度を超え、脳の神経細胞もケトン体が主なエネルギー源になります。
絶食時にケトン症が起こるのは、脳の神経細胞にエネルギー源を供給するための生理的な現象で、生理的ケトーシスと言います。一般に、血液中のβヒドロキシ酪酸の濃度が0.5 mM以上に増えている状態をケトーシス(ケトン症)と言います。
ケトーシスには内因性ケトーシスと外因性ケトーシスがあります。
内因性ケトーシスは飢餓、断食、ケトン食(低糖質+高脂肪食)、糖質摂取が少ない状況での激しい運動の後に発生します。これらの状態では、ブドウ糖(グルコース)の利用可能性は制限され、体脂肪が燃焼することによってケトン体が産生され、ケトン体を脳やその他の末梢組織に代替燃料源として提供します。人間は、長期間の断食中に毎日約 150 g のケトン体を生成することができます。

図:飢餓、断食、ケトン食(低糖質+高脂肪食)などの状態では、ブドウ糖(グルコース)の利用が制限され、体脂肪(脂肪酸)が燃焼することによって肝臓でケトン体(アセト酢酸とβ-ヒドロキシ酪酸)が産生され、ケトン体は血中に移行し、脳やその他の末梢組織に代替燃料源として提供する。このように体脂肪の燃焼が亢進してケトン体が増えた状態を内因性ケトーシスと言う。
外因性ケトーシスは、ケトン体またはケトン体前駆物質を含む化合物を摂取した結果、血中ケトン体濃度が上昇した状態です。糖質制限は必要とせずに血中ケトン体濃度を高めることができます。
内因性ケトーシスの場合は、糖質摂取を減らし、インスリン分泌が低下し、体脂肪の燃焼が亢進する必要があります。一方、外因性ケトーシスでは、糖質制限は必要なく、血糖上昇やインスリン分泌が存在してもケトン体が増えた状態です。
がん治療の場合は、血糖上昇とインスリン分泌亢進はがん細胞の増殖を促進する要因になるので、外因性ケトーシスだけでは効果が期待できません。糖質制限が重要です。しかし、内因性ケトーシスと外来性ケトーシスを同時に実行すると、ケトン体濃度を高め、抗腫瘍効果を増強できます。
アルツハイマー病などの神経変性疾患の治療の場合は、外因性ケトーシスだけで効果が期待できます。脳神経にケトン体というエネルギー源を与えることになるためです。
脳神経は、ブドウ糖よりケトン体を好んで利用します。
【外因性ケトンには複数の種類がある】
外因性供給源を使用して血中ケトン濃度を上昇させることは、人間の健康に複数の潜在的な用途があると報告されています。
外因性ケトンの例には、中鎖トリグリセリド (MCTオイル)、ケトン塩、およびケトンエステル、R-1,3-ブタンジオールが含まれます。これらはケトン食の代替として、食事制限なしで軽度のケトーシスを達成できます。
中鎖トリグリセリド (MCTオイル)は炭素数 8 と 10 の脂肪酸の混合物で構成され、遊離脂肪酸に効率的に分解され、門脈を経由して肝臓に取り込まれて、肝臓で急速に代謝されてケトン体を生成します。摂取量が多いほどケトン体濃度は上昇しますが、胃腸に対する刺激症状(腹痛や下痢など)によって使用量は制限されます。
通常のMCTオイルは「カプリル酸(炭素数8):カプリン酸(炭素数10)=6:4」で構成されていることが多いです。ココナッツオイルは中鎖脂肪酸を約60%含みますが、その組成はC8(10%以下)、C10(5〜6%)、C12(41〜42%)です。残りは長鎖飽和脂肪酸です。つまり、ココナッツオイルを多く摂取しても、ケトン体産生をわずかしか増やしません。ココナッツオイルを30g摂取してもβヒドロキシ酪酸はほとんど上昇しないという報告されています。
カプリル酸(炭素数8)が最もケトン体産生能が高く、カプリル酸が100%のMCTオイルも販売されています。
例えば、12時間以上空腹にした状態、あるいは糖質を含まない食事の後で、20gから30gのMCTオイルを摂取するとβ-ヒドロキシ酪酸の濃度を1mMから1.5mM程度に数時間高めることができます。糖質を摂取するとβ-ヒドロキシ酪酸の濃度上昇はやや低下します。
何回か同じ実験を行った結果、MCTオイルを20g摂取後3時間くらいでβ-ヒドロキシ酪酸の濃度は1.0mM程度に上昇します。MCTオイルを30g摂取すると1.5mM程度まで上昇します。
この実験条件ではMCTオイル服用して3時間から4時間後をピークにして、その血中濃度は1.5mM程度まで上昇します。5時間後以降は次第に低下して10時間後にはほぼベースに戻ります(下図)

MCTオイルの場合は、小腸でリパーゼで脂肪酸とグリセロールに分解されて、門脈から肝臓に吸収され、肝臓で分解されてβヒドロキシ酪酸が産生されて血中に移行するので、血中濃度がピークになるのに3〜4時間程度かかります。
ケトン塩というのはβヒドロキシ酪酸のミネラル塩(ナトリウム、カリウム、カルシウム塩)です。βヒドロキシ酪酸のカルシウム/ナトリウム塩を製品化したものや、βヒドロキシ酪酸のナトリウム/カリウム塩を製品化したものなどがあります。
カルシウム/ナトリウム塩やナトリウム/カリウム塩はナトリウムなどの摂取量が増えるのでβヒドロキシ酪酸の摂取量は10〜30グラムが限界です。一度に多く摂取すると、塩類による下痢が起こります。しかし、尿がアルカリになるので、βヒドロキシ酪酸の尿中排泄量が増えて酸性になる尿を中和してくれるメリットはあります。
ケトン塩を摂取すると、ケトン食を実行しなくても血中のβヒドロキシ酪酸濃度を高めることができます。

図:ケトン・サプリメントのKetoCaNaを20g(βヒドロキシ酪酸として約12g)摂取 すると、βヒドロキシ酪酸の血中濃度は、1~2時間後をピークに1mM(mmol/L)前後に上昇する。
ケトンエステルはβ-ヒドロキシ酪酸に1,3-ブタンジオールなどがエステル結合したものです。
エステル結合とは酸と水酸基の脱水縮合によって形成される共有結合です。 狭義ではカルボン酸とアルコールによって形成された結合を意味します。消化管などでエステル結合が分解されてフリーのβ-ヒドロキシ酪酸ができます。1,3-ブタンジオールも肝臓で代謝されてβ-ヒドロキシ酪酸になります。
ケトンエステルは特許によって製造・販売が制限されており、日本ではまだ普及していませんが、米国などでは運動パフォーマンスを高めるサプリメントなどとして販売されています。β-ヒドロキシ酪酸濃度を高めるので、認知症など神経変性疾患やがんの治療などにも利用されています。ただ、まだ価格が高いようです。
ケトンエステルの合成に使われるR-1,3-ブタンジオールは物質特許が無いので、比較的安価に利用できます。ただ、R体とS体のラセミ体だと生理活性のあるD体のβ-ヒドロキシ酪酸は半分しかできません。R-1,3-ブタンジオールについては次回詳しく解説します。

ケトン食または外因性ケトンのいずれかによって血中ケトン体レベルが上昇すると、脳は優先的にケトンを利用します。脳のケトン代謝は、広い濃度範囲で血漿ケトンレベルに正比例します。脳のケトン代謝の増加は、軽度認知障害やアルツハイマー病の脳全体のエネルギー供給を増加させる可能性があります。
実際に、MCTオイルやケトンエステルは認知症の治療に使用され、その有効性が認められています。ケトン体には抗老化作用や寿命延長作用が知られています。外因性ケトンのサプリメントは今後需要が増えると思われます。
