
DeepBody:新規論文から考える⑥脳内Dopamineをin vivoで評価する蛍光発色モニタ- dLight (1)
Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors(遺伝子コード化センサーによる超高速ドーパミン動態の神経イメージング) Open access
Science. 2018 Jun 29; 360(6396): eaat4422. DOI: 10.1126/science.aat4422
脊椎動物の祖先、ヤツメウナギのundulation(くねり前進運動)は大脳基底核のGABA抑制システムに、黒質緻密部(SNC)由来のドーパミンが作用して、運動の開始となる。
西野流呼吸法における「対気」シグナルによる特徴的な身体反応は、この進化的に古い系が作動する可能性を仮説として報告した。
「対気」において、受け手(シグナルに反応する側)は、不思議なエネルギー感覚(元気が湧く感覚)を持つ。これを説明するものとして、大脳基底核のドーパミンが注目される。そうした方向の研究はどういう状況か?
まずは、ドーパミンは実測し得るのか?
運動とドーパミンの関連はどうなのか?
今回は少し以前2018年のドーパミン受容体を蛍光タンパク質と組合わせた、遺伝子改変受容体センサーで、マウス脳におけるドーパミン変化をモニターする論文を紹介しよう。
神経細胞活動モニター(受容体蛍光発色複合体)をデザインする
この論文の提示する方法は、ドーパミンを直接測定するものではない。
ドーパミン受容体を使って、しかも受容体にドーパミンが結合すると、立体構造が変化し蛍光を発する蛍光タンパク質(fluoresence protein; FP)を遺伝子工学で人工的に作製し、ドーパミン動態を評価するという方法論である。
長年こうした論文に慣れていても、「えっ」と驚く論文の方法論ではある。
こうした蛍光タンパクを遺伝子工学的に組み込んで、神経細胞の活動を蛍光発色でモニターするという方法論は、2001年日本人研究者の発想から始まり、GCaMP(GFP+カルモデュリン+ミオシン軽鎖キナーゼ由来ペプチド)と呼ばれている(その実際は、本note、Project DeepBody記事を参照、リンク。後根神経節DRGにおける感覚神経細胞活動を記録している)。
この遺伝子改変神経活動モニターはその後改善され、最近では蛍光発色の感度、ダイナミック・レンジが良くなっている。ドーパミンの測定ではこの一部cpGFPという蛍光タンパクが転用されている。
もう一つの必要基礎知識は、ドーパミンなど多くのNeuromodulator(神経修飾物質)あるいはホルモン、電磁波の光などの受容体は基本構造としてのGタンパク質共役型受容体(G protein-coupled receptor; G-PCR)である(詳細は脳科学辞典参照リンク)。
G-PCRは細胞膜を7回貫通する立体構造で知られている。そのためタンパク質の構造として、細胞内の部分が三カ所存在する。その三番目の部分に先ほどのcpGFPを遺伝子改変技術で導入するという複雑な構造をとっている。
こうした遺伝子操作への基礎知識のない一般の方は驚かれると思う。実際の模式図が図1Aである。緑色部分が蛍光タンパク(cpGFP)、紫色部分が受容体タンパクの立体構造であり、TM5(膜貫通五)とTM6の間にcpGFPが挿入されていることを示す図が図1Bである。
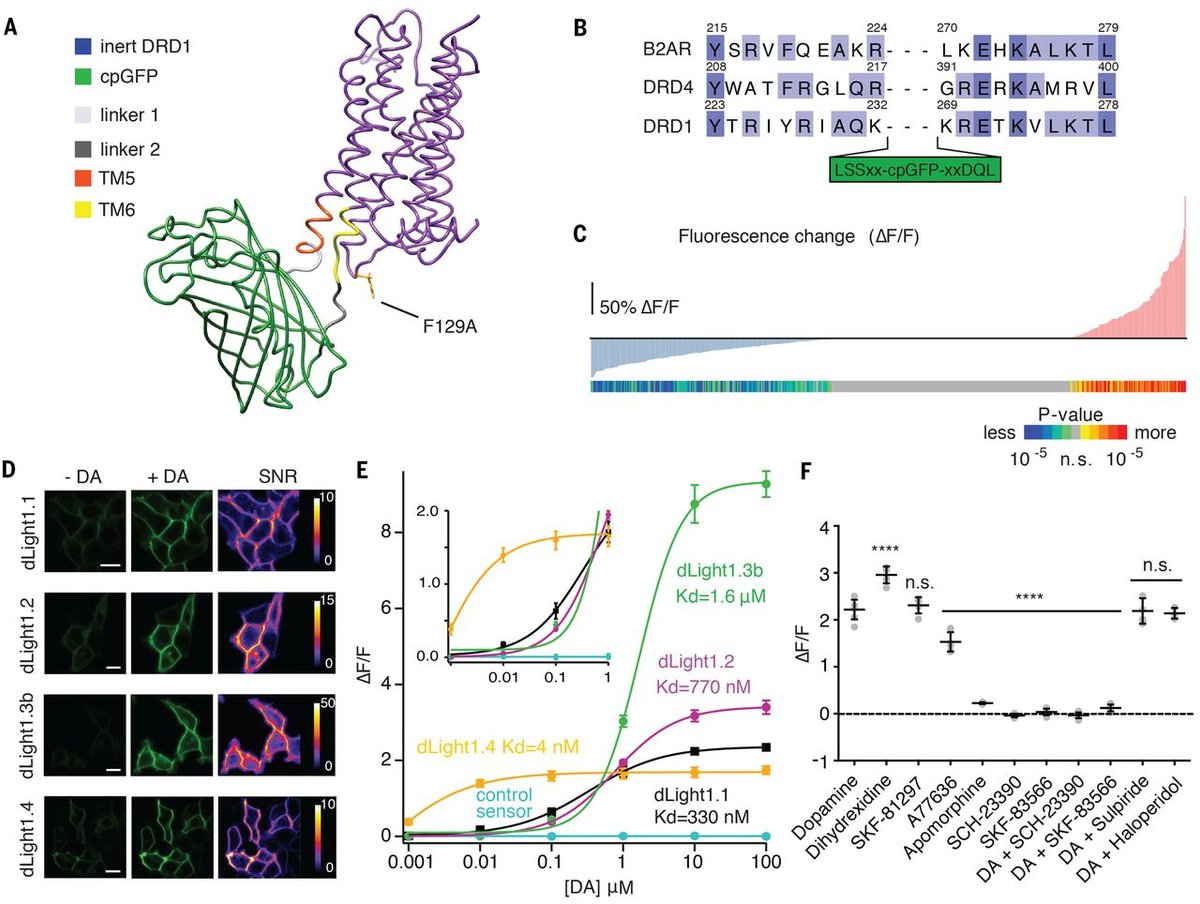
図1Bには、DRD1(D1様ドーパミン受容体)やBR2AR(β2アドレナリン受容体)の関連部分アミノ酸配列が示されている。ということは、ほかのG-PCRにも蛍光モニタータンパク質を加えて測定できるという可能性がある。実際セロトニン(5HT)に関してもモニター蛋白が補足部分に示されている。
遺伝子組換え操作によるDopamine受容体蛍光発色モニターの特性
ではドーパミン・センサーの特性・能力はどうか?
具体的には構成アミノ酸配列の変更やcpGFP挿入部位調整等がなされた。
実際にはヒト胎児腎臓上皮由来HEK293細胞にセンサー受容体を発現させ、蛍光を見たものが図1Dである。ドーパミン(DA)添加で緑色発色、そのSN比(SNR)が示されている。
蛋白酵素学的Kdが1mM以下のもの、dLight 1.1(Kd=330uM)、dLight 1.2(Kd=770uM)などが実際に使われた(図1E)。
dLight 1.1と名付けられたドーパミン受容体蛍光発色モニターを用いて、作動薬、阻害薬などを調べると(図1F)、DAや作動薬(Dihydrexidine、SKF8129、A77636)では蛍光発色が見られ、阻害薬(SCH-23390、SKF-83566)などでは蛍光発色が見られない。一方、ドーパミンの別の受容体であるDRD2阻害薬(Sulpiride、haloperidol)は蛍光に影響を与えない。
Dopamine受容体蛍光発色モニターを遺伝子導入した脳線条体切片での評価
では実際の神経組織(脳線条体切片)で計測できるか?
マウスの背側線条体にアデノ随伴ウィルス(AAV9. hSynapsin1. dLight 1.2)を注入し、導入遺伝子の発現をまって2-4週後、この部分のスライス標本を用いて、単回の電気刺激をすると(図2.A)、局所的ならびに視野全体の蛍光(図2.C)を認めた。

高速スキャンでは、蛍光の急速な立ち上がり、150msまでのプラト-、約400msでベースラインに減衰(図2D)。このドーパミン放出の推定濃度は10-30uMである(図2I)。
コカインを用いたDA再取り込み阻害では、蛍光減衰が延長された(図2G, H)。この脳切片にドーパミン阻害剤を投与すると電気刺激でも蛍光発色せず、逆にドーパミントランスポーター阻害のアンフェタミンでは、蛍光発色が遷延化した(補充データ)。
次回はこの続きとして、マウス脳でのOptogenetic刺激によるin vivoドーパミンの計測を紹介する。
