
解剖時の人体と脳におけるSARS-CoV-2感染と持続性(論文の重要部分の翻訳)
https://www.nature.com/articles/s41586-022-05542-y#citeas
シドニーR。スタイン、サブリナC。Ramelli、Alison Grazioli、Joon-Yong Chung、Manmeet Singh、Claude Kwe Yinda、Clayton W.ウィンクラー、ジュンフェン・サン、ジェームズ・M。ディッキー、クリス・イラヤ、ソン・ヒ・コ、アンドリュー・P.プラット、ピーターD.ブルベロ、マーサ・ケサド、ステファニア・ピッタルーガ、マドレーヌ・パーセル、ヴィンセント・J.マンスター、フリーダ・ベリンキー、マルコス・J.ラモス・ベニテス、イーライA.ボリッツ、イザベラA。ラッハ、ダニエル・L.ヘル、ジョセフ・ラビン、カピル・K.サハリア、NIH COVID-19剖検コンソーシアム、...ダニエルS.チェルトー 著者を表示する
【要旨】
コロナウイルス病2019(COVID-19)は、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)の急性感染中に多臓器機能障害1,2,3を引き起こすことが知られており、一部の患者はSARS-CoV-2の急性後後遺症と呼ばれる長期症状を経験します(refs.4,5)。しかし、気道外の感染の負担とウイルスクリアまでの時間は、特に脳3,6,7,8,9,10,11,12,13,14で十分に特徴付けられていません。ここでは、COVID-19で死亡した44人の患者に完全な剖検を実施し、これらの患者のうち11人の中枢神経系の広範なサンプリングを行い、急性感染から症状発症後7か月以上まで、脳を含む人体全体のSARS-CoV-2の分布、複製、細胞型特異性をマッピングおよび定量化しました。私たちは、SARS-CoV-2が広く分布しており、主に重度のCOVID-19で死亡した患者の間で、ウイルスの複製が感染の初期に脳を含む複数の呼吸器系および非呼吸器系に存在することを示しています。さらに、1つの症例で症状の発症後230日後、脳全体を含む複数の解剖学的部位で持続性SARS-CoV-2 RNAを検出しました。SARS-CoV-2 RNAが全身に広範囲に分布しているにもかかわらず、気道外の炎症または直接ウイルス細胞病理の証拠はほとんど観察されませんでした。私たちのデータによると、一部の患者では、SARS-CoV-2は全身感染を引き起こし、体内で数か月間持続する可能性があります。
【メイン】
COVID-19には、重度で致命的な疾患を持つ患者の間で多臓器不全やショックを含む、呼吸器および非呼吸器症状1,2,3があります。生き残った一部の個人は、長いCOVID4,5としても知られるSARS-CoV-2の急性後遺症を経験します。致命的なCOVID-19症例の剖検研究は、SARS-CoV-2が複数の臓器3,7,8,9,10,11,12に感染する能力を支持していますが、肺外臓器は、ウイルス媒介損傷または炎症の組織病理学的証拠を欠いていることがよくあります10,11,12,13,14。損傷や炎症のない気道外の感染のパラドックスは、多くの病原体や宿主に関連する問題を提起します。
ヒトにおけるSARS-CoV-2の細胞栄養、複製能力、持続性、進化を調査し、感染した組織における関連する組織病理学を探すために、44例のCOVID-19症例の剖検を実施しました。私たちのアプローチは、タイムリーで体系的で包括的な組織サンプリングと補完的な分析のための保存に焦点を当てました。SARS-CoV-2ヌクレオカプシド(N)遺伝子標的の検出と定量化のための液滴デジタルポリメラーゼ連鎖反応(ddPCR)とin situハイブリダイゼーション(ISH)を実施し、ddPCR所見を検証し、SARS-CoV-2の細胞栄養素性を決定しました。免疫蛍光(IF)と発色性免疫組織化学(IHC)は、脳内のSARS-CoV-2の存在をさらに検証するために使用されました。最近のウイルス複製15を示唆するマーカーであるサブゲノムRNAを検出するために、逆転写(RT-qPCR)を伴う定量的リアルタイムPCRを実施し、伝統的および修正されたVero E6細胞培養でウイルス分離することにより、脳を含む選択された呼吸器および非呼吸器組織で複製能力のあるSARS-CoV-2を実証しました。6人の個人で、高スループット、単一ゲノム増幅とシーケンシング(HT-SGS)を使用して、個人内SARS-CoV-2スパイク遺伝子変異体の多様性と解剖学的分布を測定しました。
剖検症例は、死亡時の病気日(d)ごとに早期(n = 17)、中期(n = 13)、または後期(n = 14)に分類し、それぞれ≤d14、d15–30、または≥d31でした。持続性は、後期症例におけるSARS-CoV-2 RNAの存在と定義しました。呼吸器系と非呼吸器系の観点から結果を分析および記述し、組織と症例全体でSARS-CoV-2 RNAレベルを定量化し、統計的に比較しました。
【検死コホートの概要】
2020年4月26日から2021年3月2日までの間に、COVID-19で死亡したワクチン未接種の個人を対象に、44件の剖検を実施しました。SARS-CoV-2 PCR陽性は、42例で死前、2例で死後が確認されました(P3およびP17;拡張データ図。1)。合計38例がSARS-CoV-2血清陽性(補足データ1a)、3例が血清陰性(P27、P36、P37)、3例(P3、P4、P15)で血漿が利用できませんでした。脳のサンプリングは11例で達成されました(図。1)。コホートは人種的にも民族的にも多様でした。30パーセントは女性で、年齢の中央値は62.5歳でした(四分位間範囲(IQR):47.3-71.0;拡張データ表1a)。合計61.4%が3つ以上の併存疾患を持っていた。症状の発症から最終入院、その後の死亡までの間隔の中央値は、それぞれ6日(IQR:3–10)と18.5日(IQR:11.25–37.5)でした(拡張データ表1b)。死後の間隔の中央値は22.2時間でした(IQR:18.2–33.9)。個人レベルの症例データは、補足データ2aで見つけることができます。
図。1:人体と脳全体のSARS-CoV-2の分布、定量化、複製。
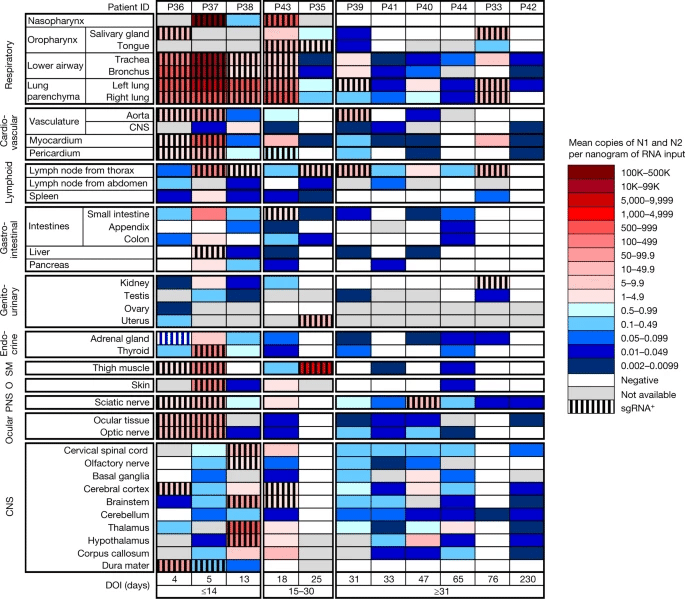
ヒートマップは、COVID-19で死亡し、全身および脳のサンプリングを受けた11人の患者の剖検組織に存在するddPCRによるSARS-CoV-2 RNA(N)の最高平均定量化を示しています。患者は、死亡前の最短から最長の疾患期間(DOI)まで並び、図の下部にリストされ、早期(≤14日)、中期(15-30日)、後期(≥31日)に分類されます。組織は、上部に呼吸器組織、下部にCNSから始めて、組織グループごとに組織されています。ウイルスRNAレベルは、RNA入力のナノグラムあたり0.002から500,000 N遺伝子コピーの範囲で、最低レベルの濃い青から最高レベルの濃い赤へのグラデーションとして描かれています。リアルタイムRT-qPCRを通じてサブゲノムRNA(sgRNA+)に陽性であった組織は、黒い縦棒で陰影を付けます。O、その他;PNS、末梢神経系;SM、骨格筋。
【広範囲にわたる感染と持続性】
SARS-CoV-2 RNAは、84の異なる解剖学的位置と体液(補足データ1b-d)で検出され、早期(RNAナノグラムあたり2.04 ± 0.10 log10[N遺伝子コピー])、中期(RNAナノグラムあたり1.36 ± 0.12 log10[N遺伝子コピー])および後期(RNAナノグラムあたり0.67 ± 0.11 log10[N遺伝子コピー];拡張データ図2a)の症例で非呼吸器組織と比較して、呼吸器系で有意に(P < < 0.0001)高い負担が検出されました。連続変数として、病気の日ごとにSARS-CoV-2 RNAレベルの線形傾向を比較し、呼吸器系におけるSARS-CoV-2 RNAレベルの負の傾斜が著しく急勾配を観察しました(-3.14、s.e.0.39)非呼吸器(-1.62、s.e.0.38; P < 0.0001) 組織 (拡張データ図 2b,c)。
11人の早期症例と1人の中期症例の死期血漿でSARS-CoV-2 RNAを検出しました(補足データ1b、d)。SARS-CoV-2 RNAは、選択された早期および中期の症例から末梢血単核細胞で検出できないか、検出限界をわずか超えていました(補足データ1a)。RNAのナノグラムあたりのSARS-CoV-2 N遺伝子コピーの中央値とIQR、および各組織群と流体で検出されたRNA症例の割合は、拡張データ表2にまとめられています。SARS-CoV-2 RNA持続性は、どの後期症例でも血漿では検出できないにもかかわらず、すべての後期症例の複数の組織群で検出されました(補足データ1b–d)。SARS-CoV-2 RNAは、D230で死亡したP42を含む、5/6後期症例で評価されたほとんどの脳領域を含む、10/11症例(90.9%)の中枢神経系(CNS)組織で検出されました(図。1)。
血漿、胸水、硝子体を含むすべての組織群および複数の体タイプにわたってSARS-CoV-2サブゲノムRNAを検出しました(補足データ1a-c)。 ddPCRとサブゲノムRNA RT-qPCRの結果は、特に呼吸サンプル(n = 369、ρ = 0.86; 95% CI:0.84–0.89)、早期症例(n = 496、ρ = 0.88; 95% CI:0.85–0.89)、および両方のアッセイで陽性反応を示したサンプル(n = 302、ρ = 0.91; 95% CI:0.88–0.93;拡張データ図2d、および拡張データ図2d、e)で、すべての組織グループおよび非常に関連しました。感度と特異性を等しく重み付けすると、RNAのナノグラムあたり1.47 Nコピー≥1.47 NコピーのddPCR値は、93.0%の感度と91.6%の特異性を持つ正のサブゲノムRNA結果を予測し、曲線(AUC)下の受信機動作特性(ROC)面積は0.965(95%CI:0.953–0.977;拡張データ図2f)です。
初期症例から、心臓、リンパ節、消化管、副腎、眼を含む気道内外の多様な組織から、Vero E6細胞培養中のSARS-CoV-2を単離しました(拡張データ図3a)。合計で、4つのSARS-CoV-2サブゲノムRNA定量サイクル(Cq)値間隔でテストされた25/55(45%)検体からウイルスを分離し、Cq間隔が増加すると収量が減少しました。ウイルス分離のためにテストされた55サンプルのうち、感度と特異性を等しく加重した状態で、RNAのナノグラムあたり758 Nコピー以上のddPCR値は、76%の感度と90%の特異性を持つ複製有能ウイルスを予測しました(ROC AUC = 0.887; 95% CI: 0.795–0.978)、およびRNAのマイクロリットルあたり≥25,069コピー(約Cq 22.40)のサブゲノムRNA値は、72%の感度と100%の特異性を持つ複製有能ウイルスを予測しました(ROC AUC = 0.915; 95% CI:0.843–0.987;拡張データ図3b、c)。
Vero E6-TMPRSS2-T2A-ACE2細胞16のP38視床および視床下部からウイルス分離を再試行し、P38からの視床組織均質化による接種後48時間で細胞障害効果を観察しました。SARS-CoV-2エンベロープ(E)ゲノムRNAのRT-qPCRは、細胞障害効果の時点でウイルス分離プロセスの組織ホモジネートと上清で実施され、それぞれ27.33と13.24のCt値が得られました。
【ウイルスゲノムシーケンシング】
HT-SGSを使用して、6人の個人の合計46の組織からSARS-CoV-2スパイク遺伝子変異配列を分析しました(拡張データ図。4)。P27(D1)、P19(D7)、およびP18(D9)では、単一分子サンプリングの深さが高いにもかかわらず、呼吸器および非呼吸器部位で非同義ウイルスの遺伝的多様性は検出されませんでした。P27では、左右心室、縦隔リンパ節を含む非呼吸部位で、それぞれ単一の同義語置換を持つ2つのウイルスハプロタイプが優先的に検出されました。P38(D13)では、D80F残基が31/31肺0/490脳配列で同定され、G1219V残基は脳変異体に限定されました。Vero E6-TEMPRS2-TA2-ACE2細胞培養を通じてP38の視床から分離され、短読の全ゲノムシーケンシングを受けたSARS-CoV-2ウイルスは、P38 RNA後期保存視床から検出されたマイナーハプロタイプとP38 RNA後保存視床下部の主要なハプロタイプと一致しました。非同義置換は、非CNS組織と比較して、非常に低いサンプリング深さ(n = 2シーケンス)にもかかわらず、P36(D4)硬膜でも非同義置換が検出されました。
【ISHはSARS-CoV-2の細胞性向性を明らかにする】
ISHによるddPCR結果は、35以上の細胞タイプとヒアリン膜にわたる選択された早期、中期、後期の症例で、呼吸器および非呼吸器組織におけるSARS-CoV-2スパイクRNAのddPCR結果を検証しました(図2および図3、拡張データ表3および補足データ3)。複数の脳領域を含む組織別のSARS-CoV-2スパイクRNA ISH陽性細胞の詳細な注釈は、図2と図3および補足データ3に示されています。
図。2: 肺外組織におけるSARS-CoV-2のRNA in situ(RNAscope)検出。

a–h、SARS-CoV-2ウイルスはゴルジと内質網に局在し、外観は核周囲、次の臓器と細胞タイプ(×500倍率、スケールバー、2μm、すべてのパネル):P19の甲状腺、卵胞細胞(a)にウイルスの存在を示す、P18の食道、層状扁平上皮(アステリスク)にウイルスの存在を示す、および間質(ハッシュ)(b)内の毛細血管のシグナル、P19の脾臓、白果肉(c)の単核白血球にウイルスの存在を示す、P19の付録、結腸上皮(アスタリスク)と単核白血球の両方にウイルスの存在を示す間質(ハッシュ)(d)、P19の副腎、内分泌分泌細胞(e)、P18の卵巣、閉経後の卵巣の卵巣の間質細胞にウイルスの存在を実証する(f)、P20の精巣、セルトリ細胞(アスタリスク)と精巣の精管(ハッシュ)(g)の成熟生殖細胞の両方にウイルスの存在を実証し、P35の子宮内膜、閉経前子宮内膜サンプル(h)における子宮内膜上皮(アステリスク)と間質細胞(ハッシュ)にウイルスの存在を示す。画像は、20バッチのISH染色中にSARS-CoV-2 N RNA陽性であった肺外組織の例です。
図。3:ヒトCNS組織におけるSARS-CoV-2タンパク質とRNA発現。

a、SARS-CoV-2 Nタンパク質(緑)とニューロン核(NeuN)タンパク質(マゼンタ)に標識されたP38からの視床下部の高拡大可視化、IFによるニューロン(白い矢印)におけるウイルス特異的タンパク質発現を示しています。 の右下部のzスタック直交ビューは、核のNeuNラベリングと細胞質(赤い矢印)のSARS-CoV-2タンパク質を示しています(赤い矢印)。 b–d、ISHによるSARS-CoV-2スパイク(S)(b)およびN(c)RNA(茶色)およびP38の視床下部の発色IHCによるSARS-CoV-2 N(d)タンパク質(茶色)。 e、感染したニューロンはIFによってP42の頸部脊髄で発見され、白い矢印関連するウイルスタンパク質を持つNeuN陽性ニューロンを示します。ウイルスタンパク質標識は、ニューロン投影(黄色の矢印)を示唆する神経細胞体から放射する線形構造でも同定されました。 f、ニューロン関連ウイルスタンパク質標識のより高い倍率。 g、ウイルスタンパク質は、P42(白い矢印)の頸椎レベルの脊髄の神経節のニューロンでIFによっても検出されました。 h–j、ISHによるSARS-CoV-2 S(h)およびN(i)RNAおよびP42の頸椎の発色IHCによるSARS-CoV-2 N(j)タンパク質。 k–m、ISHによるSARS-CoV-2 S(k)およびN(l)RNA、発色IHCによるSARS-CoV-2 N(m)タンパク質、発色IHCによるSARS-CoV-2 N(m)タンパク質、すべてP38の小脳の分子レベル(ML)と比較して、主に粒状層(GL)に見られます。WM、白質。 n,o、ISHによるSARS-CoV-2 S(n)およびN(o)RNAおよびP40の基底神経節の発色IHCによるSARS-CoV-2 N(p)ウイルスタンパク質。Hoechst 33342は、すべてのIF画像の核(青)を識別するために使用され、IF画像は共焦点顕微鏡で取得されました。ヘマトキシリンはカウンターステインとして使用され、すべてのISHおよび発色IHC画像は明視野顕微鏡で取得されました。スケールバー、15μm(a)、10μm(b–d、g–p)、25μm(e、f)。
ddPCRによって検出されたSARS-CoV-2 N RNAとISHによって検出されたSARS-CoV-2スパイクRNAとの関係を決定するために、RNA ddPCR値のナノグラムあたりのSARS-CoV-2 N遺伝子コピーの4対数範囲をカバーする16例から心室間中隔組織の画像分析を実施しました。一貫した組織形態により、この分析のために心室中隔が選択されました。RNAのナノグラムあたりの平均SARS-CoV-2 N遺伝子コピーは、30×40フィールド(ρ = 0.704、95%CI:0.320–0.889、P = 0.002;補足データ3)にわたる中央値SARS-CoV-2スパイクRNA陽性細胞と有意に相関しています。
【中枢神経系におけるSARS-CoV-2 N RNAとタンパク質】
CNS組織におけるSARS-CoV-2の検出と分布をさらに検証するために、N RNAを標的とする2番目のISHアッセイ、およびNタンパク質を標的とするIFおよび発色IHCベースのアッセイを使用しました。これらのアッセイの特異性を適切な陽性および陰性のコントロール(補足データ3、パネルyy-bbb)で確認し、ddPCRによってSARS-CoV-2陽性である選択されたCNS組織に適用しました。早期症例(P38)の視床下部と小脳、後期症例(それぞれP42およびP40)の頸部脊髄および基底神経節でSARS-CoV-2 RNAとタンパク質が観察され、ニューロン染色と一致するパターン(図。3)。
【COVID-19組織学的所見】
私たちのコホートからの組織病理学の所見は、他の症例シリーズで報告されたものと類似していました(拡張データ図。5)。44例のうち、38例はCOVID-19で死亡したと判断され、そのうち35例(92.1%)は死亡時に急性肺炎またはびまん性肺胞損傷のいずれかを患っていました(補足データ2)。びまん性肺胞損傷の段階は、明確な時間的進行を示した(拡張データ図。6)。肺血栓塞栓症合併症は10例(23%)で認められ、1例の実質性心筋炎17(P3)を含む4例で心筋浸潤が観察された。リンパ節と脾臓では、リンパ節の枯渇と濾胞および副皮質過形成の両方が観察されました。
その他の非呼吸器組織学的変化は、主に治療の合併症または既往症に関連していました。5人の症例には古い虚血性心筋瘢痕があり、3人は冠動脈バイパス移植を受けました。糖尿病性腎症と脂肪性肝炎は、それぞれ10例(23%)と5例(12%)で観察されました。1例は肝硬変を伴うC型肝炎が知られていましたが、進行した肝線維症の他の症例はおそらく脂肪肝疾患に関連していました。肝壊死(13例、30%)および急性腎障害と一致する変化(17例、39%)は、これらの非常に病気の患者の低酸素虚血性損傷に関連していた可能性があります。
11の脳の検査では、かなりのウイルス負荷にもかかわらず、組織病理学的変化はほとんど見つかりませんでした。血管のうっ血は、病因が不明瞭であり、感染によって生じる血行動態の変化に関連している可能性がある珍しい所見でした。世界的な低酸素虚血性の変化は2例で見られ、そのうちの1例は発作障害を持つ少年(P36)で、入院時にSARS-CoV-2陽性であることが判明したが、おそらくウイルス感染とは関係のない発作合併症で死亡した。
【議論】
ここでは、私たちの知る限り、脳を含む人体全体のSARS-CoV-2の細胞栄養、定量、持続性に関するこれまでで最も包括的な分析を提供します。短い死後間隔、組織採取への包括的な標準化されたアプローチ、固定前の脳の解剖、RNAlater内の組織の保存、新鮮な組織のフラッシュフリーズに焦点を当てることで、ddPCRとISHによる高感度でSARS-CoV-2 RNAレベルを検出して定量化することができ、細胞培養中のウイルスを脳を含む複数の非呼吸器組織から分離することができ、これは他の研究と比較して顕著な違いです。
SARS-CoV-2は、非呼吸器系組織よりも呼吸器系のウイルス負荷が著しく高い一部の患者で感染の早期に播種することを示しています。症状発現後最初の2週間に複数の非呼吸器部位でウイルス複製を実証し、D14を超える27例のうち14例で少なくとも1つの組織でサブゲノムRNAを検出し、ウイルス複製が数か月間非呼吸器組織で発生する可能性があることを示しました。他の人は、非呼吸器組織でのSARS-CoV-2の検出は、組織内の残留血液8、18または組織調達中の肺からの交差汚染8による可能性があると提案していますが、私たちのデータはそうでないことを示しています。具体的には、死体周血漿サンプルでSARS-CoV-2 RNAを検出できる症例は12例のみで、SARS-CoV-2サブゲノムRNAが血漿で検出された症例は2例のみで、代表的な症例からバンク末梢血単核細胞でRNAが検出された場合は無視できる。さらに、ISH、IHC、およびIFによる細胞内のウイルスの直接細胞識別、細胞培養によるSARS-CoV-2の分離、および非呼吸器部位での明確なSARS-CoV-2スパイク配列変異体の検出により、気道外のSARS-CoV-2の検出を検証しました。
他の人は以前に心臓、リンパ節、小腸、副腎内のSARS-CoV-2 RNAを報告しています6,8,9,10,11,12,18。私たちはこれらの発見を再現し、SARS-CoV-2がこれらおよび脳を含む他の多くの組織内で感染および複製できることを決定的に実証します。具体的には、ACE2とTMPRSS2を安定的に発現する修飾されたVero E6細胞株を使用して、D13のP38視床から複製能力のあるSARS-CoV-2の回復を報告します。これは、PCRによるゲノムRNAとサブゲノムRNAの検出、CNSの細胞内のSARS-CoV-2 RNAとタンパク質を示す複数のイメージングモダリティ、およびCNSのシーケンシングを通じて検出された明確なマイナー変異体とともに、SARS-CoV-2が人間の脳内で感染し、複製できることを明確に証明しています。
SARS-CoV-2スパイクのHT-SGSは、多くの組織で均質なウイルス集団を示すと同時に、他の組織で有益なウイルス変異体も明らかにします。SARS-CoV-2配列の個人内多様性の低さは、以前の研究19,20,21で頻繁に観察されており、おそらくウイルスの本質的な突然変異率とウイルスの進化を促進するための早期免疫圧力の欠如に関連しています。私たちのHT-SGSアプローチは、各サンプル内のマイナーな変異体に対して高い精度と高い感度の両方を備えており、ウイルスの多様性が低いという発見を非常に信頼できるものにすることに注意することが重要です22。複数の個人の呼吸器組織と非呼吸器組織間のSARS-CoV-2の遺伝的区画化は、これらの部位でのウイルスの独立した複製をサポートしていますが、部位間の区画化の欠如は、独立したウイルス複製を除外しません。脳由来のウイルススパイク配列が、他の非CNS組織からの配列と比較して非同義の変化を示したいくつかのケースに注目します。他の人が示唆しているように、これらの症例がCNSの確率的播種またはCNSの抗ウイルス抗体によるスパイクに対する差動選択圧を表すかどうかを理解するには、さらなる研究が必要です23,24,25。
私たちの結果は、SARS-CoV-2の最大の負担は呼吸器組織にあるが、ウイルスは体全体に広がる可能性があることを示しています。他の人は、このウイルスの拡散は、血液からSARS-CoV-2を培養できなかったと報告されたため、細胞の輸送11を介して発生すると仮定しています3,26、私たちのデータは、気道の感染後にウイルスを体全体に播種する初期のウイルス性フェーズを支持しています。SARS-CoV-2ビリオンをペレット化し、急性COVID-19患者の血漿から画像化した最近の研究26は、このウイルス拡散メカニズムを支持しています。私たちのコホートは、主に深刻で最終的に致命的なCOVID-19症例で構成されています。しかし、2人の症例(P36とP42)は、軽度または呼吸器症状のみを報告し、COVID-19ではなく、SARS-CoV-2 RNAが体と脳全体に広く検出されました。さらに、P36は基礎となる神経疾患を持つ若年児でしたが、小児における多系統炎症症候群の証拠はなく、小児が全身性炎症反応を発症することなくSARS-CoV-2の全身感染を発症する可能性があることを示唆しています。
最後に、私たちの仕事は、SARS-CoV-2 RNAが持続できる期間と場所を明らかにし始めます。気道はSARS-CoV-2 RNAが持続する最も一般的な場所でしたが、後期症例の50%以上は、心筋、頭頸部、胸部、坐骨神経、眼組織、および硬膜を除くCNSのすべてのサンプル領域に持続性RNAを持っていました。特に、初期の非呼吸器組織と比較して呼吸器系のSARS-CoV-2 RNAが100倍以上高いにもかかわらず、後期症例ではこの差が大幅に減少しました。非呼吸器組織における効率の低いウイルスクリアランスは、SARS-CoV-2がウイルスmRNAの細胞検出を変化させたり、インターフェロンシグナル伝達を妨害したり、ウイルス抗原処理と提示を混乱させたりする能力の組織特異的差異に関連している可能性があります27,28,29。SARS-CoV-2が免疫検出を回避するメカニズムを理解することは、ウイルスクリアランスを促進するための将来の治療アプローチを導くために不可欠です。
D99の症例の複数の組織を含む、コホートの60%以上の組織でサブゲノムRNAを検出しました。サブゲノムRNAは活発なウイルス複製中に生成されますが、サブゲノムRNAは、ヌクレアーゼ耐性と即時のウイルス複製を超える長寿に寄与する二重膜小胞によって保護されているため、複製有能なウイルスを示す細胞培養よりも決定的ではありません30,31,32,33。しかし、複数の粘膜経路を介して高いサブゲノムRNAコピー数を持つγ照射されたSARS-CoV-2接種に曝露された非ヒト霊長類は、SARS-CoV-2ゲノムRNAを検出可能でしたが、接種後1日目までに呼吸サンプルでサブゲノムRNAレベルを検出できません15。これらのデータは、SARS-CoV-2サブゲノムRNAの検出は、おそらく最近のウイルス複製を反映していることを示唆しています。しかし、私たちの症例のサブセットにおけるサブゲノムRNAの長期検出は、生産的ではなく欠陥のあるウイルス複製を表す可能性があり、亜急性硬化性汎脳炎34の場合、麻疹ウイルス(別の一本鎖エンベロープRNAウイルス)の持続感染で記述されています。
私たちの研究にはいくつかの重要な限界があります。まず、私たちのコホートは、重度のCOVID-19で死亡した既往症の病状を持つワクチン未接種の高齢の個人を主に代表しており、より若く、より健康な、またはワクチン接種を受けた個人に調査結果を外挿する能力を制限しています。第二に、私たちの症例は、懸念される変異体が広く流通する前のパンデミックの最初の年に発生したため、調査結果は現在および将来のSARS-CoV-2変異体に一般化できない可能性があります。最後に、SARS-CoV-2の急性後遺症で観察された臨床所見をウイルスの持続性に帰したいと思われますが、私たちの研究はこの問題に対処するようには設計されていません。これらの制限にもかかわらず、私たちの発見は、人体と脳におけるSARS-CoV-2の細胞分布と持続性の理解を根本的に向上させ、SARS-CoV-2の持続性のメカニズムとSARS-CoV-2の急性後遺症への寄与を定義するための将来の同様の研究を追求するための強力な根拠を提供します。
