
核酸医薬品とゲノム編集技術
近年新たに拡大している核酸医薬品・ゲノム編集技術についてまとめる。まず前提として、この2つの用語と混同されやすい遺伝子治療との違いについて明確にしたい。
遺伝子治療とは:遺伝子を標的とした治療の総称を表す。代表的なものとしては2つの手法があり、1つ目は核酸医薬品等を用いることで体内に外部から遺伝子を導入する手法(in vivo)、2つ目は体外において細胞内で遺伝子改変を行いそれを体内に移植する手法(ex vivo)である。現状具体的にどのような医薬品・治療が遺伝子治療にあたるかの共通認識は存在しないが、主にmRNAやオリゴヌクレオチド等を用いた治療のことを示す場合が多い。
核酸医薬品とは:低分子医薬品、抗体医薬品等と並ぶ医薬品のモダリティの一種でありDNAやRNAを構成する核酸を用いることで、他のモダリティとは異なり細胞内分子を標的とできるようになった。
ゲノム編集技術:遺伝子治療に包含されるもののうち、体内あるいは体内に移植される細胞の遺伝子に直接改変を加えるもののことを指す。つまり遺伝子治療においては、体内の遺伝子を直接書き換えるのではなく外部から遺伝子を挿入することにより体内でその遺伝子由来のタンパク質を作ることができるが体内の遺伝子自体には影響を及ぼさない:遺伝子補充療法も含まれるが、これはゲノム編集には当たらない。
遺伝子治療の概要と代表例
遺伝子治療とは上述の通り、遺伝子を加えるか改変することにより治療を行うこと、であるが、仕組みによって分類すると下記のように大別される。
1. 機能不全遺伝子の代替として機能を追加する(遺伝子補充療法)
例:血友病Bに対するBAX326(Rixubis)、脊髄性筋萎縮症(SMA)に対するゾルゲンスマ等
2. 異常な遺伝子を抑制・修正する
例:脊髄性筋萎縮症(SMA)に対するスピンラザ、レーバー先天性黒内障(LCA)に対するOPTIRPE65等
3. 新規の機能を追加する
例:血液腫瘍に対するCAR T-cell治療(遺伝子改変によりCARを過剰発現させたT細胞を体内に投与することでより効率的に腫瘍細胞を除くことができる療法)等
核酸医薬品の種類
核酸医薬品とは、その名前の通り核酸(DNAやRNA等を構成する分子)を用いた医薬品のことで、これまでの低分子医薬品や抗体医薬品などでは標的にできなかった細胞内の標的に対してアプローチすることができること、またCRISPR技術等における飛躍的な技術の躍進により少しずつ市場に出るようになってきており、COVID-19に対するワクチンとしてmRNAワクチンが製造されたことにより医薬品の中での割合は一気に拡大している。
1. 一本鎖mRNA, DNA
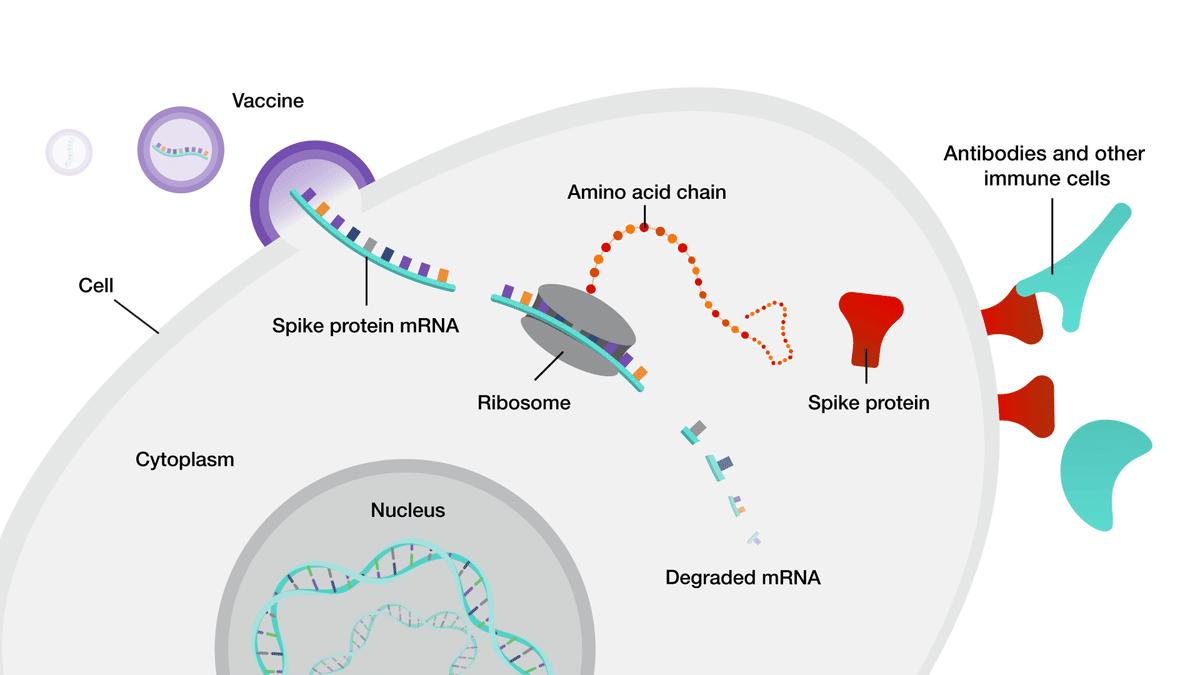
古典的な遺伝子補充療法に近いものであり、COVID-19ワクチンの場合も後述のLNPに内包されたmRNAが用いられている。DNAが機能を発揮するためには、細胞に入った後核内への移行を要し、また核内に入ったDNAはオフターゲット変異(本来の治療過程では意図しない遺伝子改変)が起こる可能性がある一方で、mRNAは通常の機能において核外(細胞質内)で修飾・翻訳を受けるため核内移行の必要がなく、一般的にはmRNAが用いられることが多い。またmRNAの方が細胞内において比較的短期間で分解されるのに対し、DNAは比較的長期間安定して存在することもオフターゲットリスクの増加につながる。細胞内へ運ばれたmRNAは細胞に本来備わっている翻訳機能によりタンパク質を製造、ワクチンの場合は対象となる疾患に関わる物質を製造し、これに対して免疫応答を行うことにより免疫が獲得される。
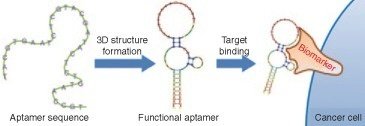
2. アプタマー、リボザイム、DNAザイム
基本的には一本鎖DNA, RNAであるが遺伝子補充の目的ではなく、3次元構造をとることで特定配列に対し抑制的に機能する。
3. アンチセンスオリゴ(ASO)
通常の標的はpre-mRNAであり、特定配列に対する相補的なshort RNAもしくはDNAである。ASOは特に、a) 細胞内DNA/RNA2本鎖を認識し切断するRNase H依存型と、b) RNase H非依存型に大別される。RNase H依存型はRNase Hを誘導することで標的mRNAの分解を目的としており、ギャップマー型ASOとも呼ばれる。一方でRNase H非依存型はSSO: Splicing-switching oligoncleotieとも呼ばれ、細胞内スプライシング関連因子との相互作用を阻害することで、エクソンスキッピング(特定のエクソンのスプライシング促進)、エクソンリテンション(スプライシング抑制)を誘引する。その他リボソーム結合部位を塞ぐことで翻訳を抑制するものもある。

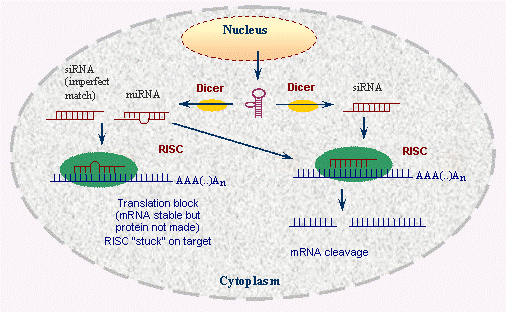
4. RNA interference (RNAi)
mRNAに対しある程度相補的な構造をとり、RISC: RNA-inducued silenced complexを誘引し、翻訳を阻害することで機能を抑制する。siRNAは完全な相補鎖であり、miRNAは部分的な相補鎖として標的mRNAに結合する。
核酸医薬品のDDS: Drug Delivery System
DDS: Drug Delivery Systemとは「望ましい濃度で、望ましい期間、望ましい部位へ薬物をデリバリーするシステム」つまり薬物の体内動態を最適化する創薬・創剤技術と定義されます。一般的には経口投与、皮下投与、静脈投与、局所投与、舌下投与、等のように表されます。核酸医薬品の場合、標的となる遺伝子の発現がある特定の部位に医薬品を到達させる必要があり、医薬品自体の開発と共にDDSの開発も不可欠です。

1. Naked
医薬品をそのまま体内に静脈投与・皮下投与などの方法で投与するが、中枢神経系を標的としている場合は髄腔投与や硝子体投与を行う。投与されたASOはエンドサイトーシスにより細胞内に取り込まれ、細胞内のヌクレアーゼにより分解・代謝される。医薬品の種類にもよるが、大凡1週間に一度の頻度で投与される場合が多い。

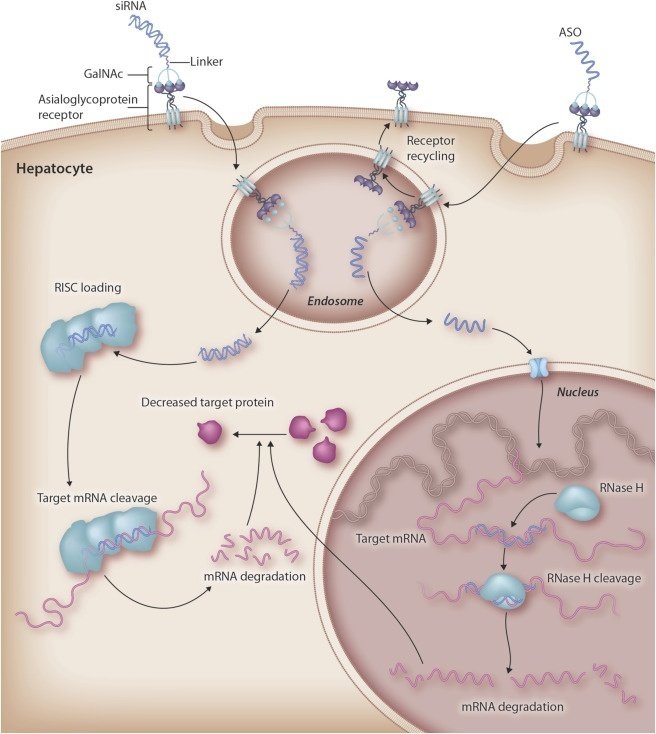
2. LNP (Lipid nano particle): 脂質ナノ粒子で囲む
RNA等の核酸をナノ粒子分子で囲むことで血清中ヌクレアーゼによる分解を防ぎ、オリゴ数の長い医薬品において効果を上げることができる。またナノ粒子は体内において肝臓で代謝され腎臓から排泄されるため、LNPを用いる治療薬においてはこの何れかを標的としている場合が多い。一方でLNP自体が投与時に炎症反応を起こすため、投与前に抗ヒスタミン薬等の前投薬が必要であり、臨床においては手間のかかりがちな方法となる。近年はLNPに更にApoE分子をつけることにより、ApoE分子が肝細胞表面の受容体と反応してエンドサイトーシスを促進するという手法も開発された。

右:Y. Kim Experimental & Molecular Medicine volume 54, pages455–465 (2022)
3. GalNAc: 肝臓を標的とする
siRNAやASOに対しGalNAcと呼ばれる分子構造を結合させることにより、肝臓に対する局在性を高めることができる。GalNAc構造のC末端残機は肝細胞表面に発現するASGPR: asialoglycoprotein receptorに結合し、エンドサイトーシスを誘引する。肝臓を標的としたsiRNA治療として最適な手法である。
4. AAV (Adeno-associated virus): ウイルスに乗せて
ウイルスはそもそも感染した細胞にカプシド内の自身の遺伝子を注入する性質があり、ウイルスベクターを用いた核酸導入の研究は以前より進められている。ex vivoにおいてはレンチウイルス等の使用が主流となっているが、in vivoにおいてはAAV: アデノ随伴ウイルスが多く使用される。AAVは何れの細胞種にも感染し得るが、カプシドのタイプにより様々な種類の細胞に対して趣向性を持たせることができ、これはトロピズムと呼ばれる。AAVは元となったウイルスからは改変されており、ヘルパーウイルスなしでは自身を複製することができないため、病原性がない。またその特性により内在因子がゲノムに組み込まれるリスクが低く、オフターゲット等による毒性も低い。AAVには12種のセロタイプがあり、数百を超えるバリアントが存在すると言われており、今後まだまだ開発が進められる領域である。欠点としては、内包できる核酸サイズに制限があり、あまり大きい医薬品を内包することができない。
現在承認されている核酸医薬品一覧
2023年3月時点で承認を受けている核酸医薬品は下記の通りである。何を持って核酸医薬品と呼ぶかについてはしばしば意見の分かれるところであるが、可能な限り広義の意味での核酸医薬品について並べる。

核酸医薬品を用いた臨床例1:ATTRアミロイドーシス
臨床において具体的に核酸医薬品がどのように用いられているか、核酸医薬品の開発によりどのようなことが可能になったかの例を述べる。
ATTRとはトランスサイレチン型アミロイドーシスと呼ばれ、肝臓において産生されるTTRタンパク質に異常を来たし、異常なアミロイドタンパクが末梢神経・心臓・網膜等に蓄積することで発症する。症状としては、末梢神経に異常タンパクが蓄積することで起こる末梢神経痛、心臓に蓄積することで起こる心筋症に分けられる。家族歴を伴う遺伝型(ATTRvt)と、家族歴を伴わない野生型に分かれ、遺伝型においては国内の特定の集積地において比較的若年(40~50代)で発症するが、野生型には集積地がなく高齢発症が多い。多くの遺伝子多型が報告されており、多型の種類により心筋症を主徴とするタイプと末梢神経痛を主徴とするものがある。またアミロイドタンパクの蓄積と言うとアルツハイマー病を思い浮かべる方も多いかもしれないが、TTRタンパクは脳内へは到達せず、ATTRはアルツハイマー病とは異なるメカニズムによるものである。
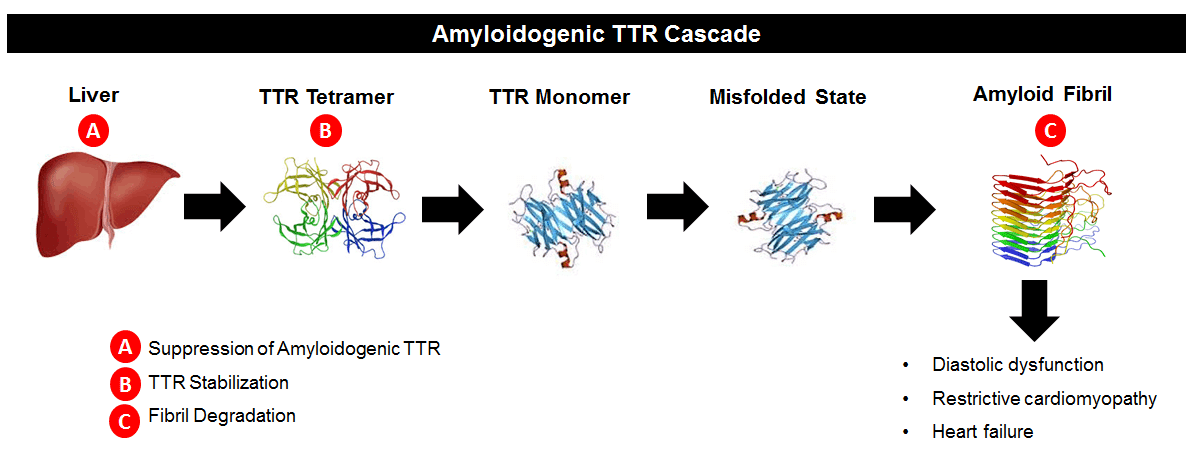
ATTRは、肝臓で作られるTTRタンパクに異常が生じ、ミスフォールドされた異常タンパクが蓄積することで起こる。正常なTTRタンパクは4量体(テトラマー)の形をしているが、異常タンパクは4量体を不安定化させ単量体(モノマー)となり、これが異常な重合を重ねアミロイドフィブリル(繊維)として組織に蓄積する。従来の治療法では、肝移植をすることで異常TTRタンパクの産生を抑制していたが、4量体安定化薬:タファミディスの登場により症状の進行を抑制できるようになった。しかし4量体安定化薬は、進行を抑えることはできるものの症状の改善を目指すことはできず、疾患修飾薬の開発が望まれていた。
Patisiran(オンパットロ)は、核酸医薬品におけるリーディングカンパニーであるAlnylam社により開発された末梢神経痛を伴うATTRvtおいて認められた初めてのsiRNA医薬品であり、第三相試験:APOLLO試験においては3週間に一度の静脈投与により主要評価項目である18ヶ月時点でのmNIS+7スコア(ニューロパチーに関する複合スコア)を有意に改善させたことが示されました。Patisiranは二本鎖siRNAをPEG-conjugated LNPにより包含しており、PEG-conjugationが体内においてApoEの結合を誘引し、肝細胞に発現するApoE結合受容体(LDL受容体など)によりエンドサイトーシスを起こし、肝細胞内でRISC活動を促進、異常TTRタンパクの産生を阻害することで、アミロイドタンパクの蓄積を防ぎます。更に臨床からの声では、Patisiranを使用することで更なる異常タンパクの蓄積を防ぐだけでなく、既に組織に沈着した異常タンパクを取り除き症状を改善させる効果があることも報告されています。一方でPatisiranはinjection site reactionと呼ばれる、投与時における生体反応の副作用が指摘されており、毎回の投与1時間前には抗ヒスタミン薬等の前投与が必要とされるため一回の投与に4時間かかり、医療資源への負担が指摘されていました。
上記のPatisiranにおける欠点を改善した医薬品が、やはりAlnylam社から上市されました。Vutrisiran(アムヴトラ)はGalNAc-conjugatedのsiRNA製剤であり、3ヶ月に一回の皮下投与によりPatisiranと同様の効果を発揮します。無作為割り付け試験において直接的な比較はなされていませんが、第三相試験:HELLIOS-A試験において、プラセボ群と比較して有意にmNIS+7スコアを改善することが報告されており、APOLLO試験との比較、また臨床からの声からもPatrisiranと同等の効果があることが報告されています。
上記のような新規医薬品の開発によりATTRの知名度が高まったことで、ほとんどが診断されず診断されたとしても肝移植しかなかった状況が、現在では毎年約100人程の新たに患者が特定されるようになり、適切な治療により肝移植に至るケースも減少しました。
これに続く医薬品の開発も進んでいます。ATTRアミロイドーシスは単一遺伝子の異常による疾患であるため、遺伝子治療の最適な対象疾患となります。PatisiranやVutrisiranのようにsiRNAにより継続的に遺伝子発現を抑制するのではなく、一度のゲノム編集により肝細胞における遺伝情報を書き換えるための医薬品開発も進められています。Intellia Therapeutics社はCRISPR-Cas9技術を使ってこれを行う医薬品開発を進めており、まだPhase1の段階ではありますが、濃度依存的にTTRのmRNAならびにタンパク質発現量を低下させることを報告しています。

核酸医薬品を用いた臨床例2:脊髄性筋萎縮症(SMA)
脊髄性筋萎縮症もSMNという遺伝子の欠失または変異により発症する疾患です。脊髄および下位脳幹における進行性の運動ニューロンの脱落を特徴とする疾患であり、重症で進行性の筋萎縮や筋無力を引き起こします。最も重篤なタイプのSMAの患者さんは最終的に麻痺状態となり、呼吸や嚥下など生命維持のための基本的な身体機能に支障をきたす恐れがあります。乳幼児期に発症し、重症の場合は2歳までに呼吸困難により亡くなってしまいます。
2017年にBiogen/Ionis社が合同で開発したNusinersen(スピンラザ)が承認を受けました。NusinersenはASOであり、変異を持つSMN1の重複遺伝子であるSMN2のスプライシングを変更することにより、SMA患者において欠損しているタンパク質の産生を補うことで運動ニューロンの障害を防ぎます。第三相試験:ENDEAR試験において(濃度安定後は)4ヶ月に一回の髄腔内投与により、主要評価項目のmotor-milestone responseにおいて有意に改善を認めることが中間解析の段階で報告されました。
ヌシネルセンに続き、2020年にはNovartisファーマにより開発されたOnasemnogene abeparvovec(ゾルゲンスマ)が承認を受けました。ゾルゲンスマはヒトcDNAをAAV9ベクターに内包しており、単回の静脈投与によりAAV9ベクターが血液脳関門を通過、運動ニューロンに到達して、運動ニューロン内において持続的に欠損しているSMNタンパクを産生します。外部から投与した遺伝子により直接タンパク質を産生するメカニズムですが、体内のゲノムには組み込まれず、あくまでも遺伝子補充療法として機能します。スピンラザと異なり一回の投与により持続的効果が認められるため、ゾルゲンスマにはなんと1億6700万円の薬価がつけられ注目を浴びました。スピンラザの薬価は約1000万円ほどであり、4ヶ月に一度投与の必要なスピンラザと比較して単回投与により効果を発揮できることが算定の根拠となったようです。第三相試験:SPR1NT試験、STR1VE試験においては患者の坐位・立位を保つ能力が主要評価項目とされ、有意に効果を示すことが報告されています。AAVベクターにより補充された遺伝子が必ずしも持続的な効果を示すか否かについては明瞭ではなく、ゾルゲンスマが単回投与により開発されている背景としては、初回投与時にAAVベクターへの抗体を獲得するため複数回投与することができないということも議論されています。

ゾルゲンスマに引き続き2021年には更に、中外製薬・Rochグループにより開発されたEvrysdi(リスジプラム)という医薬品が承認を受けました。リスジプラムもヌシネルセン同様SMN2遺伝子のスプライシングを修正する医薬品ですが、核酸医薬品ではなく低分子医薬品に分類されます。かつSMAを対象とした医薬品としては初の在宅での経口投与が可能となり、ヌシネルセン・ゾルゲンスマとはまた異なる価値を提供しました。
核酸医薬品の今後の動向

上述の通り核酸医薬品の開発は着実に進んでおり、今後も新規の医薬品が更に市場に出て、これまでの低分子医薬品や抗体医薬品では治すことのできなかった疾患へのアプローチが可能となるかもしれない。市場における核酸医薬品の割合は2021年COVID-19ワクチンの開発により一気に広がったが、モダリティにおける規模としては今後も暫くは抗体医薬品の拡大が続くと予想されている。しかしその後に核酸医薬品が広がりを見せる時代が来るのではないかとも期待がされる。
