メタアナリシスの魅力と可能性
「この治療、本当に効果あるの?」
臨床現場で生まれる数えきれない疑問。
メタアナリシスなら、あなたのその問いに科学の力で答えます!
医療の現場には、本当にたくさんの疑問があふれています。さまざまな研究結果が次々と報告される中、それらをまとめて答えを見つけ出す「メタアナリシス」は、こうした疑問を解決するための頼れる味方です。
でも、こんな声を耳にしたことはありませんか?
「他人の研究を寄せ集めただけの研究なんて、オリジナルな研究と言えるの?」
確かに、メタアナリシスは個別の実験や臨床試験とは異なるアプローチです。しかし、メタアナリシスでしか答えられない疑問もあるんです。
これまでメタアナリシスを聞いたことがある方も、全く初めてという方も、今日はその魅力をお伝えできればと思います。臨床医が取り組む研究にもぴもってこい!最後にはNetwork 、dose-response 、ベイズ・メタアナリシスまで触れたいと思っていますので、ぜひお付き合いくださいね。
メタアナリシスとは?
「メタアナリシス」という言葉を聞いたことはありますか?難しそうに聞こえるかもしれませんが、実はこれ、「過去の研究データを統合して、より信頼性の高い結論を導き出す方法」です。「解析の解析」とも定義されます。医療や科学の分野で、個別の研究では答えられない疑問に取り組むための強力なツールとして使われています。
例えば、個々の研究結果だけでは「この治療が本当に効果的か?」と結論を出すのが難しい場合があります。複数の研究が異なる結果を示している可能性もありますし、膨大な量の研究が日々発表されているため、すべてを個別に検討するのは容易ではありません。
なんとPubMedには2024年1年間で、150万論文が新規に登録されています!
そのような中、メタ解析の目的は、特定のリサーチクエスチョンに関連するすべての利用可能な証拠を集め、要約し、統一的な解釈を行うことです。つまり、複数の研究から得られるエビデンスを合成する方法なのです。
メタアナリシスが臨床現場でどう役立つの?
メタアナリシスが特に役立つのが、診療ガイドラインの作成です。診療ガイドラインは、医療従事者が患者に最適な診療を提供するための指針であり、日々の臨床現場で重要な役割を果たしています。
例えば、次のような場面を考えてみましょう:
複数の治療法があるけど、どれが一番効果的?
診断検査の選択肢は?どれが患者にとってベスト?
これらの疑問に答えるため、ガイドライン作成者はメタアナリシスを実施し、現在手に入るすべてのデータを吟味します。そして、最も信頼性の高い情報を基に治療や検査の推奨事項を決定するのです。
MINDSってなに?診療ガイドラインを支えるプラットフォーム
日本では、診療ガイドラインの多くがMINDS(Medical Information Network Distribution Service)を活用して作成されています。このMINDSは、日本医療機能評価機構が運営するプラットフォームで、次のような役割を担っています:
エビデンスに基づいた医療情報の提供
MINDSは、最新の研究成果やメタアナリシスを基に、医療従事者が適切な診療を行えるよう支援します。
診療ガイドライン作成の支援
ガイドライン作成者は、「MINDS診療ガイドライン作成マニュアル」に基づき、メタアナリシスを行い、推奨内容を検討します。このプロセスにより、質の高い診療指針が作られるのです。
医療現場での活用促進
作成されたガイドラインはMINDSを通じて広く共有され、若手医師や看護師など、幅広い医療従事者が利用しています。
「メタアナリシスは他人のふんどし」ではない?だからこそ解き明かせる疑問
メタアナリシスの強みは、個々の研究では解明できないテーマにも取り組める点にあります。例えば、複数の治療法の効果を比較したい場合や、最適な投与量を決定したい場合に役立ちます。
例1: どのタイプの抗うつ薬が最も効果的なのか?
例2: 投与量が効果にどのように影響するのか?
これらの課題は、時間やコスト、倫理的な制約からランダム化比較試験(RCT)だけでは解決が難しいことも多いですが、既存の研究データを統合するメタアナリシスなら答えを導けるのです。
メタアナリシスは他の研究データを活用する手法ですが、単なる「他人のふんどし」ではありません。むしろ、「研究者たちの知見を結集する壮大なプロジェクト」とも言えます。実際に手がけてみると、自分自身で新たなエビデンスを生み出す感覚が得られるのです。メタアナリシスは、個々の研究の力を最大化し、科学の発展に貢献する特別な手法なのです。
メタアナリシスの種類
メタ解析には、大きく分けて以下の3種類があります。
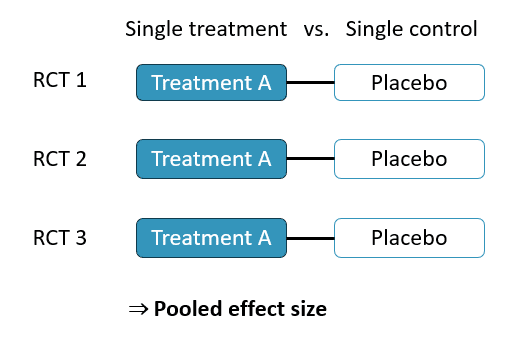
ペアワイズ・メタアナリシス(Pair-Wise Meta-Analysis)
2つの治療法や介入を直接比較する研究を統合します。例えば、「ステロイドを使用したグループ」と「ステロイドを使用しないグループ」の予後を比較する場合に使用されます。この手法は、従来のメタ解析の主流であり、単純な比較に適しています。
メタアナリシスのほとんどがこれです!
ネットワーク・メタアナリシス(Network Meta-Analysis)
直接比較されたデータが不足している場合でも、複数の治療法を間接的に比較できます。この方法は、特に治療選択肢が多岐にわたる場合に威力を発揮します。

倫理的な問題や、時間やコストなどのさまざまな制約から、すべての治療法を直接比較することが難しい場合があります。例えば、新しい治療法同士の比較試験を実施するには、膨大なリソースが必要だったり、患者への負担が大きかったりすることがあります。このような場合、**ネットワークメタアナリシス(NMA)**を用いることで、間接的な証拠を活用して治療効果を比較することが可能になります。
NMAでは、共通の比較対象を介して、直接比較データが存在しない治療法同士の効果を推定できます。この手法を活用することで、より包括的かつ効率的に治療法の有効性を評価できるのです。
例:糖尿病治療薬の比較
例えば、2型糖尿病の治療では、さまざまな薬剤クラス(SGLT2阻害薬、GLP-1受容体作動薬、DPP-4阻害薬など)が存在します。しかし、すべての治療法が直接比較されているわけではありません。
直接比較: 「SGLT2阻害薬 vs GLP-1受容体作動薬」という研究は存在していても、
不足している比較: 「SGLT2阻害薬 vs DPP-4阻害薬」や「GLP-1受容体作動薬 vs DPP-4阻害薬」については、データが揃っていない場合があります。
ネットワークメタアナリシスでは、このような場合に間接的なつながりを利用して比較が可能になります。たとえば:
「SGLT2阻害薬」と「DPP-4阻害薬」がどちらも「通常治療」と比較されているデータをもとに、両者の相対的な効果を推定することができます。
結果として、すべての治療法を一つの枠組みで統一的に評価でき、どの治療法が最も効果的であるかを明確にすることが可能になります。
用量反応・メタアナリシス(Dose-Response Meta-Analysis)

従来のペアワイズ・メタアナリシスでは、単一の治療と別の単一の治療を比較する方法が主流です。このアプローチでは、例えば異なる用量の治療薬が試された場合でも、それらを同じ治療としてひとまとめにして解析することが一般的でした。
しかし、現実にはどうでしょう?
治療の用量によって、効果の大きさが変化することはよくある話です。同じ薬でも、低用量では効果が不十分だったり、高用量では効果が大きくなる一方で副作用のリスクが高まったりする可能性があります。
こうした用量の影響を考慮するために注目されているのが、用量反応解析です。異なる治療用量ごとの効果量をモデル化することで、用量反応を視覚的に示したり、最適な治療用量を導き出すことができる。
RCTデザインの限界を超えて
ランダム化比較試験(RCT)は、エビデンスのゴールドスタンダードとされています。しかし、複数の用量を直接比較するデザインは、実質的に不可能です。試験ごとに用量が異なるため、複数のRCTデータを統合して解析することが必要になります。
詳しくはこちら
ベイズ・メタアナリシス
通常、メタアナリシスは頻度論的手法(頻度主義)で行われることが一般的です。しかし、上で紹介した3つのメタアナリシス(ペアワイズ、ネットワーク、用量反応)は、いずれもベイズ的アプローチで実施することが可能です。そして、ベイズメタアナリシスには、頻度論的手法にはない柔軟性と強みがあります。
ベイズメタアナリシスのメリットとは?
柔軟性が高い
ベイズでは、モデル構築の際に前提条件を比較的自由に設定できるため、複雑な状況でも対応可能です。例えば、ネットワークメタアナリシスや用量反応メタアナリシスのように、多数の治療法や異なる用量を比較する場合、ベイズ的アプローチが特に有効です。事前情報(Prior)の活用
ベイズメタアナリシスでは、過去の研究や専門家の知識を「事前分布」としてモデルに組み込むことができます。これにより、限られたデータセットでも信頼性の高い推定が可能になります。不確実性の定量化が容易
ベイズの結果は「事後分布」として得られるため、不確実性(不確定性)を直感的に理解しやすい形式で表現できます。例えば、「この治療法が最も効果的である確率は80%」といった形で、意思決定に役立つ情報を提供できます。
なぜベイズがネットワークメタアナリシスや用量反応メタアナリシスに適しているのか?
ネットワークメタアナリシスでは、多くの治療法間の直接比較と間接比較を統合する必要があります。このとき、頻度論的手法では複雑なネットワーク構造を扱うのが難しい場合があります。一方、ベイズでは柔軟にモデルを設定できるため、こうした状況に強みを発揮します。
用量反応メタアナリシスでは、異なる用量による効果を滑らかな曲線としてモデル化する必要があります。ベイズでは、事前分布を活用してモデルを強化することで、用量反応関係を精密に推定できます。
まとめ
メタアナリいかがでしたでしょうか?メタアナリシスの魅力や可能性について、少しでも興味を持っていただけたなら嬉しいです。
もし、この記事を通して「自分もメタアナリシスを使って研究してみたい」「今ある疑問を解決するためにデータをまとめたい」と感じていただけたなら、ぜひその一歩を踏み出してみてください。次回は、具体的なデータ解析の手法や、研究デザインの工夫、統計ソフトの使い方について詳しくお伝えしていきます。
2025/1/18
いいなと思ったら応援しよう!