
大脳基底核回路と基底核変性疾患
とっつきにくい大脳基底核回路と基底核変性疾患をなるべく分かりやすく説明したいと思います。
■ 大脳基底核回路

まずは直接路、間接路とハイパー直接路について、大まかなイメージを知ることから始めます。
直接路(Direct pathway) : 運動を「やりやすくする(開始しやすくする)」回路 → 「アクセル」のようなもの
間接路(Indirect pathway) : 運動を「抑えたり止めたりしてブレーキをかける」回路 → 「ブレーキ」のようなもの
ハイパー直接路(Hyperdirect pathway) : 素早く強力なブレーキをかける「緊急停止スイッチ」のような回路 → 「即座に強力なブレーキ」
💡大脳基底核回路を理解するポイント
大脳基底核回路を理解する上では、回路の後側(視床)からみて、働きをイメージしながらどのように調節されていくのかを考えたほうがわかりやすいです。
① 線条体も淡蒼球も抑制性
→ 線条体が淡蒼球を抑制することで、淡蒼球の抑制がはずれる「脱抑制」について理解する
② 視床は興奮性
→ 大脳皮質に運動発現の信号をおくるアクセルの働き
③ 淡蒼球内節は抑制性
→ 視床の興奮を抑えるブレーキの働き
④ 視床下核は興奮性
→ 淡蒼球内節のブレーキの利きを強める(抑制を強くする)
⑤ 淡蒼球外節は抑制性
→ 視床下核の働きを抑制
⑥ 線条体は抑制性
→ 淡蒼球の抑制を弱める(脱抑制)
<直接路>
→ 「よっしゃ運動しよう!」

直接路:運動を「やりやすくする(開始しやすくする)
→ 「アクセル」のはたらき
<直接路の経路>
① 大脳皮質からの刺激が線条体に入る
② 線条体が淡蒼球内節を抑制
③ 淡蒼球内節の抑制性出力が抑制される(脱抑制)(ブレーキの力が弱まる)
④ 視床の興奮性出力が高まる(アクセルの力が強まる)
<直接路の意義>
- 望ましい運動を開始・実行しやすくする
- 意図した運動プログラムの実行を促進
- 運動の開始と円滑な遂行に貢献
これらの機能により、私たちは意図した運動を自由に開始し、実行することができます。
<間接路>
→ 「ちょっと待て、そんなに勝手に動くなよ!」

間接路:運動を「抑えたり止めたりする」 → 「ブレーキ」のはたらき
<間接路の経路>
① 大脳皮質からの刺激が線条体に入る
② 線条体が淡蒼球外節を抑制
③ 淡蒼球外節の抑制性出力が抑制される(脱抑制)
④ 視床下核の興奮性出力が高まる
⑤ 淡蒼球内節の抑制性出力が高まる(ブレーキの力が強くなる)
⑥ 視床の興奮性出力が抑制される
<間接路の意義>
- 不要な運動を抑制することで、運動の選択性を高める
- 運動の微調整や円滑な動作の制御に貢献
- 直接路とのバランスを取ることで、適切な運動制御を実現
これらの機能により、日常生活における細やかな動作の調整や、不適切な運動の抑制が可能となります。
<ハイパー直接路>
→ 「危ない!すぐに動きを止めろ!」

ハイパー直接路:素早く強力なブレーキをかける「緊急停止」
<ハイパー直接路の経路>
① 大脳皮質からの刺激が視床下核に入る
② 視床下核の興奮性出力が高まる
③ 淡蒼球内節の抑制性出力が高まる(ブレーキの力が強くなる)
④ 視床の興奮性出力が抑制される
<ハイパー直接路の意義>
- 緊急時の素早い運動停止を可能にする
- 不適切な運動を即座に抑制する
- 状況に応じた運動の素早い切り替えを実現
これらの機能により、危険を察知した際の即座の動作停止や、状況変化への迅速な対応が可能となります。
まとめ
直接路 は視床への抑制を減らし、運動が起こりやすくなり、動作の実行を促進。
間接路 は視床への抑制を強め、過剰な動きを抑えたり運動を微調整したりする。
ハイパー直接路 は、非常に素早く強力なブレーキをかけることで、必要なときに瞬時に運動を止める。
この3つがバランスよく働くことで、私たちはスムーズに運動を開始し、必要に応じて停止や調整を行うことができます。
■ 基底核変性疾患 (運動亢進性)
ヘミバリスム(Hemiballism)
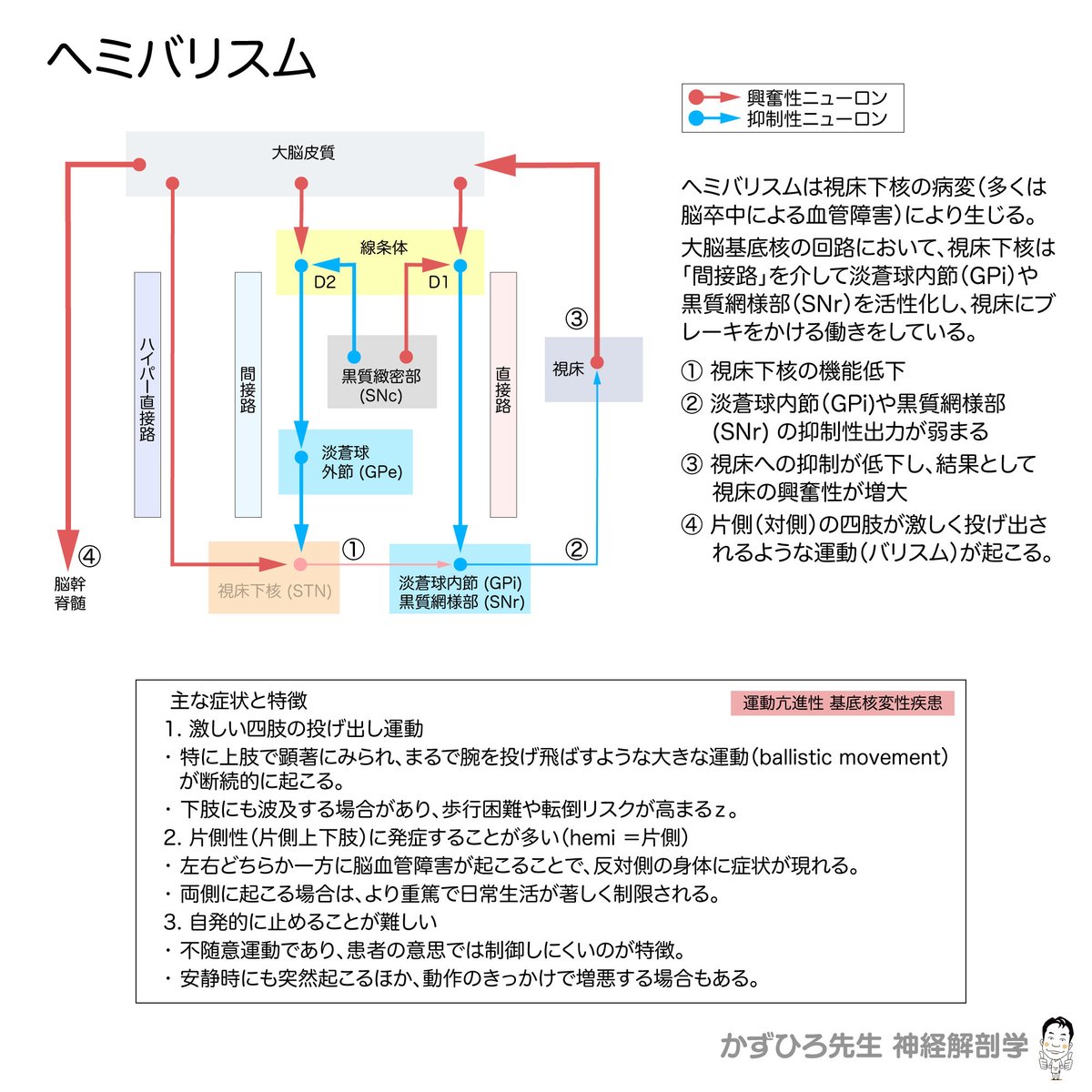
1. 概要
ヘミバリスム(Hemiballismus) とは、主に一側(片側)に生じる激しい不随意運動を特徴とする症候です。「半側性バリスム(hemi = 半分、ballism = 投げる)」の名の通り、投げ出すような大きな振り子様の動きが起こります。通常、対側の上肢や下肢で発症し、動きは非常に急激かつ大きいのが特徴です。
片側だけにみられることが多いですが、両側性に生じる場合を「バリスム(ballismus)」と総称することもあります。
2. 原因・病態生理
原因
視床下核(STN)の病変
ヘミバリスムの多くは、脳卒中(特に 視床下核の梗塞や出血 )によって引き起こされます。
高血圧性小血管障害、動脈瘤破裂なども原因となり得ます。
外傷・腫瘍・感染症
まれに頭部外傷や脳腫瘍、脳炎などで視床下核周囲が損傷された場合、同様の症状を呈することがあります。
病態生理
視床下核(STN)が間接路を担う重要部位
大脳基底核の回路において、視床下核は「間接路(Indirect pathway)」を介して淡蒼球内節(GPi)や黒質網様部(SNr)を活性化し、視床にブレーキをかける働きをしています。
この視床へのブレーキが正常に機能することで、過剰な運動が抑制されます。
STNの機能低下でブレーキが外れる
視床下核が障害されると、GPi・SNrを十分に活性化できなくなり、最終的に視床への抑制が弱まります。
結果として、視床から大脳皮質への興奮性入力が増加し、大きく激しい不随意運動 (バリスム)が生じるのです。
3. 主な症状と特徴
激しい四肢の投げ出し運動
特に上肢で顕著にみられ、まるで腕を投げ飛ばすような大きな運動(ballistic movement)が断続的に起こります。
下肢にも波及する場合があり、歩行困難や転倒リスクが高まります。
片側性(片側上下肢)に発症することが多い
左右どちらか一方に脳血管障害が起こることで、反対側の身体に症状が現れます。
両側に起こる場合は、より重篤で日常生活が著しく制限されます。
自発的に止めることが難しい
不随意運動であり、患者の意思では制御しにくいのが特徴です。
安静時にも突然起こるほか、動作のきっかけで増悪する場合もあります。
4. 診断
臨床症状の観察
片側性の不随意運動が激しく、バリスムに典型的な「投げ出すような運動」があるかどうかを確認します。
画像検査
MRI や CT などの脳画像検査で、視床下核を中心とした病変(梗塞や出血)があるかを調べます。
罹患側(たとえば左STN病変)の場合、右側の手足にヘミバリスムが起こる、というように対側性を確認します。
鑑別診断
他の不随意運動疾患(舞踏病、アテトーゼ、ジストニアなど)と区別する必要があります。
動きの大きさ、急激さ、投射的である点はヘミバリスムを特徴づけます。
5. 治療・対処法
薬物療法
ドーパミン受容体遮断薬(抗精神病薬) :運動過剰を抑えるために用いられる場合があります。
テトラベナジン :ハンチントン病や舞踏運動の治療にも使われる薬で、不随意運動を軽減します。
高齢者などで副作用が懸念される場合は、慎重な投与や用量調整が必要です。
外科的治療
治療抵抗性の重度ヘミバリスムでは、深部脳刺激療法(DBS) が行われることがあります。
GPiやSTN自体への刺激により、不随意運動が抑制されるケースがあります。
支持療法・リハビリテーション
重度のヘミバリスムでは生活動作が困難となるため、作業療法や物理療法 などで安全確保に努め、ADL(日常生活動作)を支援します。
転倒や外傷に注意が必要。
基礎疾患の管理
原因が脳血管障害である場合は、血圧管理や再発予防(生活習慣の見直し、内服治療の継続など)を徹底します。
6. まとめ
ヘミバリスムは、視床下核(STN)の障害 によって、過剰運動のブレーキが失われることが直接的な原因です。
典型的には片側性に激しい不随意運動が生じ、患者のQOLを大きく損なう恐れがあります。
基礎となる脳血管障害への対応をはじめ、症状緩和を目指した薬物療法や場合によっては外科的治療が行われます。
運動療法やリハビリを通じて、日常生活での転倒・外傷予防や活動性の向上にも配慮が必要です。
ハンチントン病(Huntington’s disease)

1. 概要
ハンチントン病 は、常染色体優性(AD)遺伝を示す神経変性疾患で、主に線条体(被殻・尾状核)を中心とする大脳基底核の変性 によって発症します。
不随意運動(舞踏運動:Chorea)や精神症状、認知機能障害が典型的にみられます。進行性であり、発症後は徐々に症状が悪化します。
2. 原因・遺伝的背景
原因遺伝子
第4染色体短腕 にある HTT(Huntingtin)遺伝子 の変異が原因。
HTT遺伝子には、**CAGリピート(グルタミンをコードする部位)**が異常に伸長することで変性タンパク質(ミスフォールドタンパク質)が蓄積し、細胞障害を引き起こす。
CAGリピート数と表現型
健常者:CAGリピート数は通常 35以下(多くは 26以下)。
ハンチントン病患者:36以上、特に 40以上で高い発症率。
CAGリピート数が多いほど、若年発症(10代〜30代)して重症化しやすい(アンチシペーション:世代を経るごとにリピート数が増え、発症年齢が早くなる)。
常染色体優性遺伝(AD)
父または母が変異を保有していれば、子へ 50% の確率で遺伝する。
母親由来よりも父親由来 の方がリピート数が増幅しやすく、若年発症の傾向が強いことが知られている。
3. 病態生理
線条体ニューロンの変性
被殻や尾状核のGABA作動性ニューロン(特に間接路に関わる中型有棘ニューロン)が優先的に変性。
大脳基底核回路において間接路が障害されると、運動を抑制するはずの経路が失活し、**過剰な運動(舞踏運動)**が現れる。
脳全体への影響
病気の進行に伴い、大脳皮質でも神経変性が起こるため、認知機能障害や精神症状が加速。
脳MRIでは被殻の萎縮が顕著となり、側脳室が拡大して見える(尾状核・被殻の萎縮で「箱型脳室」の所見をとることがある)。
4. 主な症状
不随意運動(舞踏運動:Chorea)
体の各部位が、素早く、くねるような動きをするのが典型的。
歩行や動作のぎこちなさ、奇異性が目立つ。進行とともに動きが制御不能となる。
精神症状
抑うつ、気分の変動、易怒性、妄想などがみられることが多い。
人格変化や自傷的行動など、患者本人や周囲への心理的負担が大きい。
認知機能障害
記憶障害、判断力低下、実行機能障害などが徐々に進行し、認知症 へと至る場合も多い。
ADHD様症状、注意力の散漫などが初期症状として現れることもある。
若年発症例(Westphal variant)
発症年齢が10〜20代と早く、舞踏運動よりもパーキンソン症状(硬い、遅い動き)が目立つことがある。
病状の進行が速く、重症化しやすい。
5. 診断
臨床症状
舞踏運動や精神症状、家族歴などを総合的に把握。
罹患者の親や祖父母に同様の症状がなかったか調べる(ただし、突然変異や表現型の多様性もある)。
遺伝子検査
HTT遺伝子のCAGリピート数を測定し、36以上でハンチントン病の可能性が高い。
保因者診断には、慎重な遺伝カウンセリングが必須。
画像検査
MRI・CTで尾状核や被殻の萎縮、側脳室拡大が確認される。
進行とともに前頭葉などの皮質萎縮がみられる場合もある。
6. 治療・対処法
薬物療法
不随意運動に対して テトラベナジン (VMAT2阻害薬)やドーパミン受容体遮断薬(リスペリドンなどの抗精神病薬)を用いる。
精神症状やうつ症状には、抗うつ薬や抗精神病薬を併用。
進行性の病変を止める根治療法は現時点で確立していない。
リハビリテーション・ケア
日常生活動作(ADL)の維持と向上を目的に、作業療法・理学療法など。
運動機能障害だけでなく、認知症状や精神症状があるため包括的なケアが必要。
遺伝カウンセリング
発症前診断(出生前・発症前遺伝子検査)を巡る倫理的課題が大きい。
本人・家族の意思や心理的負担を考慮し、専門的なカウンセリングが不可欠。
研究開発・将来の展望
遺伝子治療やRNA干渉技術など、新規治療法の研究が進行中。
一部の臨床試験で進行速度の抑制を目指す治療が検証されている。
7. まとめ
ハンチントン病 はHTT遺伝子のCAGリピート伸長による中枢神経変性疾患で、舞踏運動、精神症状、認知障害 が三大特徴。
大脳基底核の機能不全(特に間接路の障害)によって運動制御の破綻が生じる。
常染色体優性遺伝をとり、発症年齢や症状の強さが世代を経るごとに変化(アンチシペーション)する。
対症療法や包括的なリハビリテーションが中心だが、新しい治療法の研究が進行しており、将来的に改善・遅延を目指す治療が期待されている。
ジストニア(dystonia)

1. 概要
ジストニア(dystonia) は、筋肉の持続的な収縮や筋緊張の異常により、身体の一部または全体がねじれたり、異常姿勢をとったりする不随意運動症候群の総称です。
「ジス(dys)= 異常、tonia = 筋緊張」を意味し、首をひねる(斜頸)・手足や体幹がねじれる・顔面や咽頭部が引きつる、など多彩な症状を示します。
遺伝要因や中枢神経障害、薬剤性など、さまざまな原因で生じます。
2. 病態生理
大脳基底核(特に線条体や淡蒼球など )の機能異常が大きく関与すると考えられており、主に**運動制御系(直接路・間接路)**のバランスが崩れることで、過剰な筋収縮や持続的な筋緊張が生じるとされます。
遺伝性の一次性ジストニアでは、**TOR1A遺伝子(DYT1型)**などの特定の遺伝子変異が報告されています。
ドーパミン、アセチルコリン、GABAなどの神経伝達物質が不均衡になることも発症に関わるとされています。
3. 症状の特徴
持続的・反復的な筋収縮
ねじれや反り返りといった、異常な姿勢・動きが持続または間欠的に起こる。
症状は意図的に止めにくく、力を抜こうとしても抜けない。
特定の動作で誘発される場合がある
たとえば書字時の「書痙(しょけい)」、楽器演奏時の「ミュージシャンズジストニア」など、特定の動作や姿勢を取るときに症状が強まる。
痛みや疲労を伴うことが多い
筋肉が持続的に収縮しているため、筋痛やこり、関節部の負担が大きく、疲労感を訴えやすい。
姿勢の歪みや見た目の変化
頸部がねじれて固定される(斜頸)、眼瞼痙攣、顔面が歪む、体幹が傾くなど、見た目上も大きな変化を伴い、本人や周囲への心理的影響が大きい。
4. 主な分類
ジストニアは、いくつかの観点で分類されます。
(A) 原因による分類
一次性(原発性)ジストニア
明確な神経系の構造的病変がなく、主に遺伝的要因や不明な要因で生じる。
DYT1型(TOR1A遺伝子変異による)が代表的。
二次性(症候性)ジストニア
脳卒中、脳外傷、中毒、薬剤性(抗精神病薬などによる錐体外路障害)など、はっきりとした器質的・外的要因 が存在する場合。
遺伝性ジストニアプラス
遺伝性のジストニアにパーキンソニズムやミオクローヌスなど別の運動症状を合併する病態(例:DYT5型=セピアプテリン還元酵素欠損など)。
(B) 症状の分布による分類
局所性(focal)ジストニア
からだの一部(頸部、手、眼瞼など)に限局する。
例:眼瞼痙攣、書痙、痙性斜頸など。
分節性(segmental)ジストニア
近接する2つ以上の部位に及ぶ。たとえば頸部と上肢など。
多部位性(multifocal)ジストニア
2カ所以上、互いに離れた部位に発症。
半身性(hemidystonia)ジストニア
体の左右どちらか一側の上下肢にまたがる。
全身性(generalized)ジストニア
両下肢から体幹、上肢にかけて広範囲に及ぶ。
若年発症で多い。
5. 診断
臨床所見
持続性の不随意運動、姿勢異常、誘発動作の存在、身体所見などを確認。
発症年齢や症状の進展パターン、家族歴も手がかりとなる。
神経学的検査・画像検査
MRI、CT:大脳基底核に器質的病変がないか評価(出血、梗塞、腫瘍などの除外)。
薬剤性が疑われる場合は内服歴を詳細に確認。
遺伝子検査
一次性ジストニアを疑う場合はDYT1などの遺伝子変異を調べることがある。
鑑別診断
他の不随意運動疾患(パーキンソン病、舞踏病、アテトーゼなど)や精神疾患との区別を行う。
6. 治療・対処法
6.1 薬物療法
抗コリン薬 (トリヘキシフェニジルなど)
ジストニア症状を軽減することがあるが、高齢者では副作用(認知機能低下、口渇など)に注意。
ベンゾジアゼピン系 (クロナゼパムなど)
筋緊張の緩和や不安感の軽減に有効な場合がある。
バクロフェン
GABA_B受容体作動薬。特に痙性斜頸などで使用される。
髄腔内バクロフェン投与(ポンプ埋め込み)による持続的治療が行われることも。
ドーパミン作動薬 / ドーパミン枯渇薬
一部の遺伝性ジストニア(DYT5など)では L-dopa が劇的に効く場合もある。
逆に過剰なドーパミン活性が原因の薬剤性ジストニアでは、ドーパミン拮抗薬が用いられることも。
ボツリヌス毒素注射 (Botulinum toxin)
局所性ジストニア(眼瞼痙攣、痙性斜頸など)に対して、収縮が強い筋へ注射し、筋活動を抑制する。
症状改善効果が比較的高く、最も一般的な治療のひとつ。
6.2 外科的治療
深部脳刺激療法(DBS)
淡蒼球内節(GPi)や視床などに電極を留置し、電気刺激で神経活動を調節する。
レボドパ抵抗性の重度ジストニアや一次性ジストニアで有効例が報告されている。
6.3 リハビリテーション・作業療法
姿勢改善や日常生活動作(ADL)のサポート、補助具の使用を検討。
特定の動作(書痙、楽器演奏など)に関しては、適切なフォーム指導や反復訓練が行われる場合もある。
6.4 心理的サポート・生活支援
見た目の変化や社会生活への影響から、うつや不安を合併する例が少なくありません。
周囲の理解とサポート体制が重要で、カウンセリングや患者会の活用も有用です。
7. 予後と注意点
ジストニアの経過は多様 で、部分的に自然軽快する例もあれば、進行・拡大していく例もあります。
若年発症の全身性ジストニアは症状が重くなる傾向がありますが、適切な治療介入(ボツリヌス毒素、DBSなど)により症状コントロールが期待できる場合もあります。
二次性ジストニアでは、原因疾患の管理(薬剤性の中止、基礎疾患の治療)が最優先です。
8. まとめ
ジストニア は、大脳基底核や関連回路の機能異常によって生じる不随意運動の一形態で、持続的な筋収縮やねじれが特徴です。
一次性か二次性か、局所性か全身性かなど多彩な分類があり、原因・病態は複雑です。
治療はボツリヌス毒素注射や内服薬、深部脳刺激療法など複合的に行われ、症状緩和を目指します。
患者の生活の質(QOL)を支えるには、身体的支援に加え、心理的・社会的サポートが不可欠です。
■ 基底核変性疾患(運動減少性)
パーキンソン病(Parkinson’s disease)

1. 概要
パーキンソン病 は、中脳の黒質緻密部(Substantia nigra pars compacta, SNc)にあるドーパミン作動性ニューロンが進行性に変性・脱落 することで発症する神経変性疾患です。
高齢化社会の進展に伴い患者数が増加傾向にあり、国際的にも非常に重要な疾患として研究が行われています。
2. 病態生理
ドーパミン神経の脱落
黒質緻密部で生合成されたドーパミンが線条体(被殻・尾状核)へ投射し、大脳基底核回路の「直接路(運動促進)」と「間接路(運動抑制)」のバランスを調整しています。
パーキンソン病では 黒質緻密部のドーパミンニューロンが脱落 し、ドーパミン供給が低下 → 直接路の促進が弱まり、間接路を通じた抑制が相対的に亢進 → 運動開始や遂行が困難 になる。
レビー小体(Lewy body)
患者の病理所見では、神経細胞内にα-シヌクレイン が主成分の封入体(レビー小体)が認められる。
パーキンソン病とともに、認知症の一部(レビー小体型認知症)との関連も示唆されている。
3. 主な臨床症状
パーキンソン病には運動症状 と非運動症状 が存在します。試験や臨床現場でよく取り上げられるのは以下の4大運動症状です。
3.1 運動症状(4大症状)
振戦(Tremor)
特に安静時振戦 が特徴(手指をこすり合わせるような「ピルローリング振戦」)。
動作を始めると振戦が一時的に軽減し、安静時に再び目立つ。
無動・寡動(Bradykinesia / Hypokinesia)
動作の開始が遅く、運動の振りが小さくなる。日常的な所作(歩行、ボタンかけ、歯磨きなど)のスピードが著しく低下。
表情の乏しさ(仮面様顔貌)、小声(低音声)なども含まれる。
筋固縮(Rigidity)
筋肉の抵抗が増大し、まるで「鉛管を曲げるような抵抗(鉛管現象)」や、カクカクとした「歯車現象」を触知。
上下肢だけでなく軸性筋(体幹・首など)にも及ぶ。
姿勢反射障害(Postural instability)
前・後・横方向へのバランスが取りにくく、転倒しやすい。
小刻み歩行(突進現象)やすくみ足(凍りつき現象)などが日常生活を障害する大きな要因。
3.2 非運動症状
自律神経症状 :便秘、起立性低血圧、排尿障害、発汗異常など
精神・認知症状 :うつ病、不安、幻覚・妄想、認知機能低下
睡眠障害 :レム睡眠行動障害(RBD)、不眠、日中の過度の眠気など
非運動症状は運動症状に先行して現れる場合もあり、患者のQOLに大きく影響します。
4. 診断
臨床症状の評価
4大症状(振戦、無動・寡動、筋固縮、姿勢反射障害)の有無を中心に、日常生活動作の観察や神経学的検査で進行度合いを把握します。
画像検査
DATスキャン(ドーパミントランスポーターイメージング) :線条体ドーパミン取り込みの減少を視覚化。
MRI、CTなどでは器質的病変を除外する目的で行うことが多い。
鑑別診断
多系統萎縮症(MSA)、進行性核上性麻痺(PSP)、皮質基底核変性症(CBD)などパーキンソン症候群との鑑別が重要。
一般的に薬剤性パーキンソニズム(抗精神病薬、制吐薬など)も考慮される。
5. 治療・ケア
5.1 薬物療法
レボドパ製剤
パーキンソン病の治療の第一選択薬(ゴールドスタンダード)。
ドーパ脱炭酸酵素阻害薬(カルビドパ、ベンセラジド)との合剤で使用し、末梢での分解を抑える。
ドーパミン受容体作動薬
プラミペキソール、ロチゴチン、ロピニロールなど。
若年発症患者では、レボドパの副作用(wearing-off現象やジスキネジア)を避けるために最初に使用することもある。
COMT阻害薬・MAO-B阻害薬
エンタカポン(COMT阻害薬)、セレギリンやラサギリン(MAO-B阻害薬)など。
レボドパの効果時間の延長・分解抑制を目的に用いられる。
抗コリン薬
振戦を軽減する目的で使用。若年者や振戦が顕著な患者に有用だが、高齢者では認知機能低下のリスクに注意。
アマンタジン
軽度のドーパミン放出促進作用、不随意運動の抑制作用を期待して使われることがある。
5.2 外科的治療
深部脳刺激療法(DBS)
ドーパミン関連の薬剤に対して効果が不十分、または副作用が強い場合に検討される。
淡蒼球内節(GPi)や視床下核(STN)へ電極を留置し、刺激することで症状を軽減。
5.3 リハビリテーション・包括的ケア
運動療法・作業療法
筋力・柔軟性・バランス感覚を維持・向上させるために必須。
歩行訓練や、すくみ足を克服するための特別なリハビリが行われる。
言語療法
声が小さくなる、嚥下障害などに対して発声訓練や嚥下訓練を実施。
心理的サポート・生活支援
うつ症状や孤立を防ぐため、精神科・心理士・ソーシャルワーカーなどと連携。
家族を含む支援体制の構築が重要。
6. 予後と合併症
パーキンソン病は進行性 ですが、早期から適切な薬物療法やリハビリテーションを行うことで、症状の進行を緩やかにし、QOLを比較的長期間保つことが可能です。
治療経過中、ジスキネジア(過剰運動)や「ON/OFF現象」などの合併症(薬剤関連症状)が出現することがあるため、定期的な治療調整が必要です。
7. まとめ
パーキンソン病 は、大脳基底核のドーパミン作動性ニューロンが変性することで「運動が起こしにくい・止めにくい」症状を引き起こす神経変性疾患です。
4大症状(安静時振戦、無動・寡動、筋固縮、姿勢反射障害)に加えて、非運動症状(認知障害、うつ、便秘、睡眠障害など)もみられます。
治療は、薬物療法(レボドパが中心)とリハビリ・外科的治療(DBS)を組み合わせた包括的なアプローチが基本。
進行性疾患であるものの、早期介入と継続的なサポートにより日常生活を保ちながら過ごすことが期待できます。
■ 大脳基底核回路と基底核変性疾患 A4まとめPDF
ここから先は

かずひろ先生の【徹底的国試対策】解剖学
あん摩マッサージ指圧師、はり師・きゅう師をはじめ、柔道整復師、理学療法士・作業療法士や看護師、医師を目指す方々の解剖学国家試験対策のマガジ…
私の知識やスキルなどが、どこかの誰かのお役に立てることはとても嬉しいことです。ありがとうございます。
