
化学基礎演習⑥ モル計算 その四 ~モルステーション~by 茶茶 サティ
さて、いよいよ化学反応式を登場させましょうか。化学反応式の作り方についてはまた後日。いまは計算できるようになることが先決です。最初はプロパンの完全燃焼の反応式から入っていきましょう。
Ⅰ、【モルステーション】
例:プロパンの完全燃焼
C3H8 + 5O2 → 3CO2 + 4H2O
プロパン
この反応式からどれだけの情報を掴めるか、それが勝負の分かれ目です。とにかくありったけ書き出してみます。

どうでしょう… 納得できるでしょうか。
「分子数」は一番素直に納得できる所だと思いますが、しかしここまで。以降は省略することになります。理由は分子1つや2つではgやLなど他の単位で示すときには細かすぎるからです。
だから「モル」という一塊で扱っていくことになります。そして今後は下の示す量的関係図を「モルステーション」と呼ぶことにします。もちろんガチの分子数は除きます。1つだけレベルが異なると厄介ですからね。
(文字が小さいので、あとで左辺と右辺に分けて再掲してあります)

モル比 :今後は「化学式の係数はモル比である」と考えていきます。
分子数(個):アボガドロ数は1モルあたり6.0×10^23(個)。
気体体積(L):1モルあたり22.4(L)。ただし0℃、1.013×10^5Pa。
質量(g):1モルあたりモル質量(g)
上記3つのどれにもモル比を掛けて、その物質全体の量を計算しました。 ちなみに質量については、左辺合計(g)と右辺合計(g)は同じです。 (質量保存の法則)
面倒くさいですが、これがモル計算の基本なのです。逆にこれが書ければモル計算は半分終わったのも同然です。
ただ… 気になっているヒトもいるはずだから触れておきます。
なぜ掛け算の形で書いてあるのか… アホちゃうか? コイツ計算できねぇんじゃなぁのか? 例えば… 3CO2 の質量(g)は3×44gなどはちゃんと計算して132(g)って書いたら?
ぬぬぬ… たしかに得意ではないです。
でも、もちろんわざとやっているのです。計算キライだし、得意ではないし、でも間違えたくないから…。こうして記録しておけば過程もわかるし、計算の手間も省けるのです。
サティが言いたいことはおそらくあとでわかっていただけるでしょう。
敢えてここまで書いたうえで、やや変形と省略、そして見やすくするために分割を入れて再掲します。なお、ア~ノまでのカタカナは、それぞれの枠の場所を示す記号です。例えば枠イはプロパンの分子式を指し、枠二はプロパンの質量を示すことにします。


…ですが、いつまでも必要ではありません。慣れるまでに辛抱辛抱。やり方さえわかれば、もっともっと省略していくことができるようになりますから、今はちょっと頑張ってください。
設問13-1 ただし0℃、1.013×10^5Paとする。
プロパンガス11gを完全燃焼させた。必要な酸素は何gか
設問13-2
プロパンガス11gを完全燃焼させた。必要な酸素の体積は何Lか
設問13-3
プロパンガス8.96Lを完全燃焼させたら、水は何g発生するか。
Ⅱ、【13-1;ユックリ解法】
簡単に解けちゃった方も、1度は御覧いただきたい部分です。
まずはこの問いを分析し、3段階に分けてゆっくりと確実に解いてみます。
「プロパンガス11gを完全燃焼させた。必要な酸素は何gか」
最終回答をX③(g)としておきましょう。
問題はプロパンガス11(g)、解答は酸素X③(g)で要求されています。これを分析して、答までの道筋を1つずつ辿ってみましょう。
ⅰ プロパン(g)をプロパン(モル)に単位変換。
↑枠二から枠キに換算する。答をX①モルとする。
ⅱ プロパン(モル)を、異なる物質である酸素(モル)に換算。
↑枠キから枠クへ換算する。答をX②モルとする。
ⅲ 酸素(モル)を酸素(g)に単位変換。
↑枠クから枠ヌに換算する。答をX③gとする
これでイケるはずです。
では… 例によって左辺にプロパン1モルあたりの「定義」を書き、右辺に出題されている数字と未知数を書いておきます。
ⅰ 44(g):1(モル) = 11(g):X①(g)
X①(g) = 11/44 = 1/4(モル)
= 1/4 (モル) ←プロパン(モル)
ⅱ 1(モル):5(モル) = 1/4(モル):X②(モル)
X②(モル) = 5 ×1/4 = 5/4(モル)
= 5/4(モル) ←酸素(モル)
ⅲ 1(モル):32(g) = 5/4(モル):X③(モル)
X③(g) = 32(g)× 5/4(モル) = 40(g)
酸素(g) ↑
答は御覧のとおり40(g)です。これで良いのです。
これで良いのですが、さすがにいつも3段階っていうのは面倒だし、時間も食ってしまでしょう?
なんとか1段階にならないものか… なりますっ!
Ⅲ、【13-1:チャチャッと解法】
よし、1段階でまとめちゃいましょう。
「プロパンガス11gを完全燃焼させた。必要な酸素は何gか」
答をX③(g)としておきます。
上で見た通り、モルステーションの中で…
問題のプロパンの質量11(g)に対応するのは枠二です。
同様に答の酸素の質量X(g)に対応するのは枠ヌです。
化学反応式に基づいて書いた枠二と枠ヌによると、1×44(g)のプロパンが燃焼するとき、5×32(g)の酸素が必要なはずです。これを「定義」と表現しておきましょう。
定義による比例式は以下のようになります。
枠二 枠ヌ
1×44(g) : 5×32(g) ←これを左辺とします。
一方の右辺は問題で出て来る条件と答の関係から見て、
プロパンの質量 酸素の質量
11(g) : X③(g) ということになります。
これをまとめて比例式を作ってみましょう。
1×44(g):5×32(g) = 11(g):X③(g)
これで式はできました。答はきちんと出るのでしょうか?
このままの順番で数字と単位を下ろして、比例式を作ります。
1×44(g) × X③(g) = 5×32(g) × 11(g)
X③(g) = 5×32(g) × 11(g) / 1×44(g)
次の行は思い切って順番を入れ替えてみます。掛け算と割り算は順序を変えても結果は変わらないですからね。
X③(g)=11(g)/44(g) × 5/1 × 32(g)
= 40(g)
ゆえに… 答 40(g)
で、結果は先ほどの計算結果と同じになりました。だからこのやり方でOKなのです、やったぁー!
ところで… 式1つずつの意味にお気付きでしょうか?
・ 11(g)/44(g)
これはプロパンの質量11(g)をモル質量44(g)で割っていま
す。実はこれ、計算X①と同じなんです。つまり、プロパン11(g)をプ
ロパンの物質量で割ってモルに換算する式そのものです。つまり枠二とキ
の関係でしょ?
・ ×5(モル)/1(モル)
これはプロパン1モルを燃すのに必要な酸素のモル数に換算している式
なのです。これは計算X②と同じ意味があるワケですね。
プロパン1/4モルを燃焼させるためには5/4モルの酸素が必要なのです。
つまり枠キとクの関係でしょ?
・ ×32(g)
これは酸素のモル質量(g)を掛けていますので、計算X③と同じです。
ここまでに算出した酸素の(モル)を酸素の質量(g)に換算する式、
つまり枠クとヌの関係でしょ?
要するに…
はじめにプロパンgをプロパンモルに換算し、それを酸素(モル)に換算し、最後に酸素(g)に換算しているのです。モル計算ができる方でも、こうした関係に気付いていないヒトは意外に多いものなんです 。
また、よくある「問題集の解答例」ではただ単に
Xg = 5×32 × 11 / 1×44 =40(g)
とあるだけで、理屈も愛想もへったくれもなかったりします。筆者も現役のころは「わからん」を連発しながら呆れて眺めていたものでした。
今もときどき思います。
「これじゃわからんだろ。オレは計算苦手なんだぜ、自慢じゃないが…」
Ⅳ、【設問13-2の解法】
「プロパンガス11gを完全燃焼させた。必要な酸素の体積は何Lか」
これも同様に解いてみましょう。
問題はプロパンガス11g、回答は酸素Y(L)で要求されています。
gとLは異なる単位であり、この場合は先ほどと同じような解法は通じるのでしょうか。
結論から言えば全く問題なく通じるのです。
モルステーションの中で、問題のプロパンの質量11gに対応するのは枠二、答の酸素の質量Y(L)に対応するのは枠ツです。
定義から左辺を作ります = 右辺には、出題と答の未知数を入れます。
枠二 枠ツ プロパン質量: 未知数の体積
1×44g : 5×22.4L = 11(g) : Y(L)
1×44g × Y(L) = 11(g) × 5×22.4(L)
Y(L) = 11(g)/44(g) × 5/1 × 22.4(L)
= 28(L)
答 28(L)
・ 11(g)/44(g)は設問13-1の解答例と全く同じ。
・ 5/1は設問13-1の解答例と全く同じ。
・ × 22.4(L)は酸素1モルの体積(L)を掛けて酸素の体積に換算
する式。つまりここまでで算出した酸素の(モル)を酸素の体積(L)
に換算する式なのです。←枠クとツの関係
またこうして実際に計算すると、モルステーションの段階でいちいち計算しなかった理由も分かるはずです。
どうせ最後は分数混じりで計算するのですから、ラクに「約分」をしていくためには、モルステーションを作る段階では「計算しない方が良い」のです。はるかに労少なく、しかも計算ミスを抑えることができると思いませんか? 計算をすればするほどミスの可能性は高くなるものですからね。
Ⅴ、【設問13-3の解法】
「プロパンガス8.96Lを完全燃焼させたら、水は何g発生するか」
モルステーションの中で、プロパンの体積(L)は枠チ、水の質量(g)は枠ノに「定義」が載っています。
枠チと枠ノから左辺を作る = 右辺には出題の数字と答(未知数)
1×22.4 : 4×18g = 8.96(L) : Z(g)
Z(g) = 4×18(g)×8.96(L) / 1×22.4(L)
= 4 × 0.4 × 18 = 28.8(g)
上の場合 8.96/22.4 = 0.4 を経験的に知っていれば、速く正確に答えを導くことができます。(他にも22.4の4を見て、4×4=16だから、これは8.96の6ではないかと推定する等の方法もある)
問題の中に出る数字は、どれかと約分できる可能性が高いのです。考えて見てください。採点する側だって正直ラクをしたいので、スッキリとした答が出るように問題の数字を操作しておくことが多いものでしょ? あなたが問題作って、しかも後で採点しなきゃならないとしたら、当然そのくらいの配慮はするでしょ? だって似たような答案を数百枚見るんですから。
そりゃ超難関校では違うこともあるけど、旧「帝国大学」を除く「一期校」レベルならこの程度で充分です、普通は…
理系学部の入試担当の立場で考えると、「計算に馴れたヒトなら気付くはずだよな…」というありがちなルーティンの数字に気付きもせず、せっせと計算作業に没頭しているヒトを入学させる気はない、というところでしょうか… な~んてね。
しかしサティがこの原稿を書いている意味はそこにあるのです。ちょっとコツが分かれば、計算はさほど怖いものではありません。むしろ自身の得点源になってくれる有難い問題なのです。
さあ、説明はあらかた終わっているので、今回はただ計算してみただけです。しかし式自体には設問13-1や2で解説した要素はしっかり残っています。
ただの「やみくもな計算は時間と労力の無駄に過ぎない」ので、お読みいただいているアナタにはこうした基本をしっかりマスターしたうえでどんどん成功を収めていっていただきたいと思っています。
ここまでが理解できて、自分独りの力で解決できたなら… もう大丈夫、と言っても良いでしょう。あとは化学反応式を書けるようになること、忘れないうちに何回も練習して成功体験を重ねることです。トライして、しかも解けたならきっと嬉しくなります。そしてそれを積み重ねることで、いつの間にかモル計算や化学基礎が得意になっているものなのです。
人間って、そういう動物でしょ?
私の説明が少しでもあなたの役に立ちますように。
もう幾つか問題を遺し、正解を示しておくので、あとは自力でトライしてください。
なお質問やらワカラナイ部分があれば…
いずれSkypeでも使ってWEB家庭教師でも開設しようかと考えていますので、その際はぜひご利用くださいませ。
以下を有料ゾーンに設定します。
受験生応援の一環として、言いたいことはもうたいてい無料ゾーンに書いちゃった… ワケですが、生活に困っているサティとしてはちょっとは商売しないと飢死にしちゃいます(笑)
いや、笑ってる場合じゃない! ショーバイショーバイ…
保護者に「私の受験勉強のため」という魔法の言葉を使えば、100円ならきっと出してくれる… ハズです。
ちなみに「note」様のお支払いは、ログインして、カードかペイペイでイケますよ。
以下のコンテンツは
Ⅵ、モルステーション(5種類)の計算演習と解答例
Ⅶ、Ⅳを用いた計算演習(不純物が含まれる例を含む)、解答例
です。
無料部分が多かっただけに御得感が薄いかもしれない有料ゾーンですが、ここまで書いている問題集や参考書はほぼ無いかと思われます。ぜひご自分の理解の具合を実地で確かめてみてください。
なおnote様の入力方法だと、罫線や小文字(左の肩と腰、右の肩と腰に添える数字や符号等)がうまくはいらないので、以後の部分はここまでのモルステーション同様に画像として張り付けたことを申し添えます。
パソコンとかスクショとかを上手く使って印刷等してみるのも良いでしょう。
不本意ではありますが… 申し訳ありません。
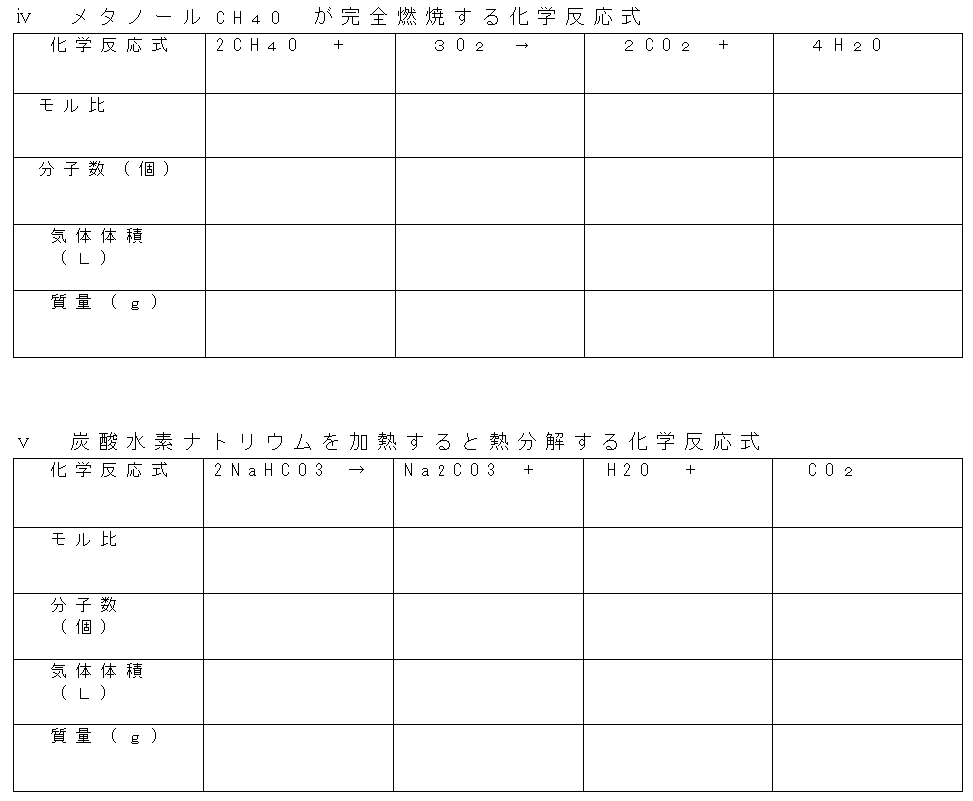
Ⅵ、モルステーションの演習
もうお分かりかと思いますが、実は問題を解く上ですべての項目を埋める必要はありません。実際は問題に即して必要な部分だけを考えればよいのだが、今はまだ慣れないうちの練習なのです。いつでもどこでもしっかりと関係図を埋められるようにしておきましょう。「アボガドロ数」なんていちいち書かず、㋐とかで代用しても充分ですよね。
設問14
以下の化学反応式について、その量的関係を示すモルステーションを完成せよ。


ここから先は
¥ 100
この記事が気に入ったらチップで応援してみませんか?
