
ファイザーワクチンの申請資料がひっそりと差し替えられ、黒塗り部分が公開されていたことが判明
● ファイザーワクチンの申請文書の内容が差し替えられていたことが判明
● 今まで黒塗りとなっていた臨床試験の有害事象データが公開される
PMDA
PMDAのサイト上にはコロナワクチンの申請文書,審査結果,添付文書などがまとめて公開されています。
申請文書
PMDAのサイトからファイザー社が提出した申請文書を確認することができます。この文書は,マウスを用いた薬物動態試験の結果などが掲載されていたこともあり,過去に大きな注目を浴びました。
2021年2月14日に承認されたファイザーワクチンの申請資料概要は、計11個のPDFファイルで構成されています。
PDFが差し替えられていたことが判明
2022年11月下旬,申請文書にワクチンの臨床試験内容が日本語で掲載されていたことが話題となりました。それと同時に,PMDA上のPDFファイルがいつの間にか差し替えられていたことも判明しました。
2022/09/15時点で同ページからリンクされていたのは「672212000_30300AMX00231_G100_1.pdf」であり、いつの間にか「672212000_30300AMX00231_G100_2.pdf」に差し替えられていたらしい。
— 反ワクですが何か?@ワクチン後遺症だいたい治ったけどサプリを減らすと不調が出るのでまだ完治せず (@HanWakuDesuga) November 30, 2022
除外5倍のファーザーデータ。日本語版が出てきましたが、WAYBACKで見ても11月30日のアーカイブしか出てきません。が、大体途中でアドレスが変わるので、これもそうだと思いケツの数字を「1」に変えて検索。ビンゴ、一番古いアーカイブは2021/3/15。
— 苦労人の改 (@5rHxIhQGQnnRSOe) November 30, 2022
この事実、周知してた?https://t.co/bjyClCLTQ0 https://t.co/IciAK7KQWW
いつ差し替えられたのか
インターネットアーカイブのウェイバックマシンは、日々消えゆくウェブ上のコンテンツを記録として残していくためのサービスです。ここからアーカイブとして保存された過去のデータを参照することができます。
新しいバージョンの最古のアーカイブは2022年5月4日(UTC)に保存されたPDFでした。この日よりも前の時点で新バージョンが公開されていたことがわかります。

また、ブラウザの検証ツールで現行ページのレスポンスデータを確認してみると最終更新日は2022年4月14日(GMT)となっていました。各PDFも同様でしたので、この日に差し替えられた可能性が濃厚です。

PDFの変更箇所
旧バージョンのPDFはウェイバックマシンから取得することができます。
旧バージョンアーカイブ (保存日: 2021年2月15日 UTC)
旧バージョンと現行バージョンを比較すると,11個すべてのPDFファイル名の末尾が 「_1.pdf」 から 「_2.pdf」へ変更されています。
また、新バージョンは旧バージョンにあった右上の「マスキング箇所:調整中」の表記が消えていることが確認できます。

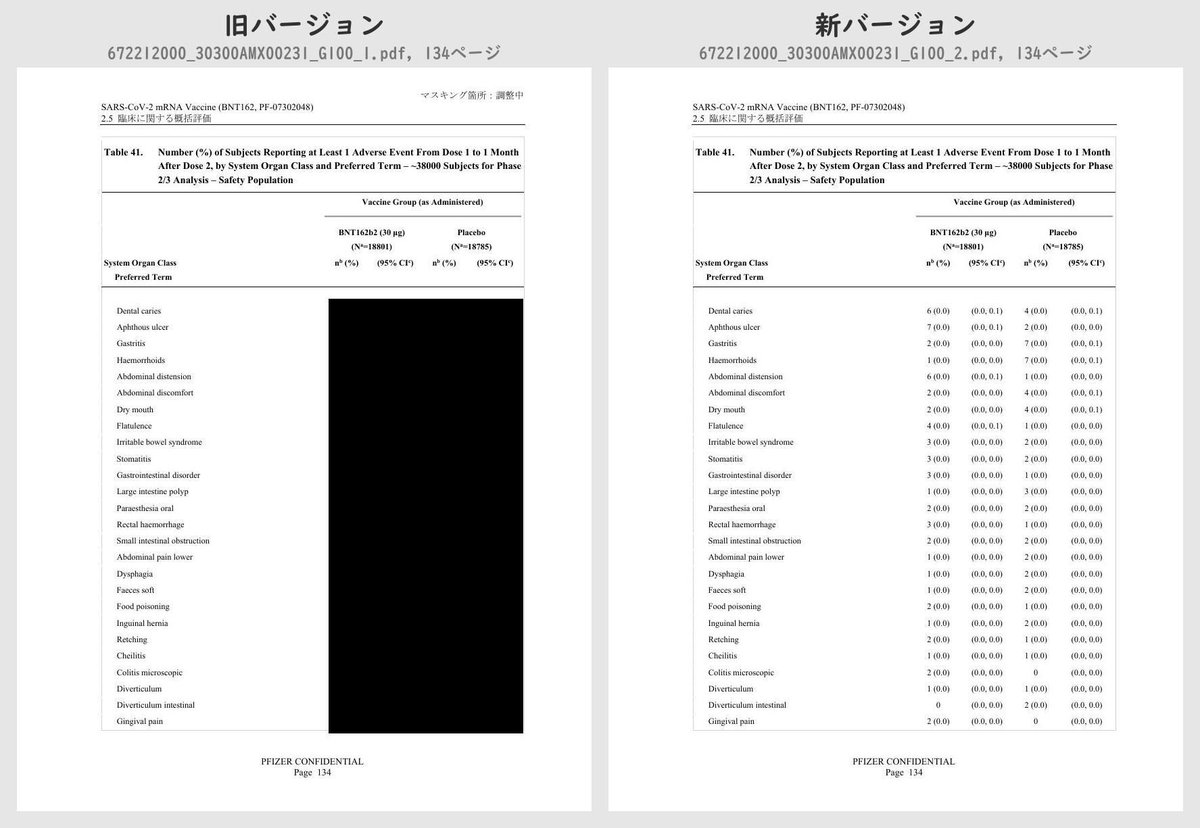
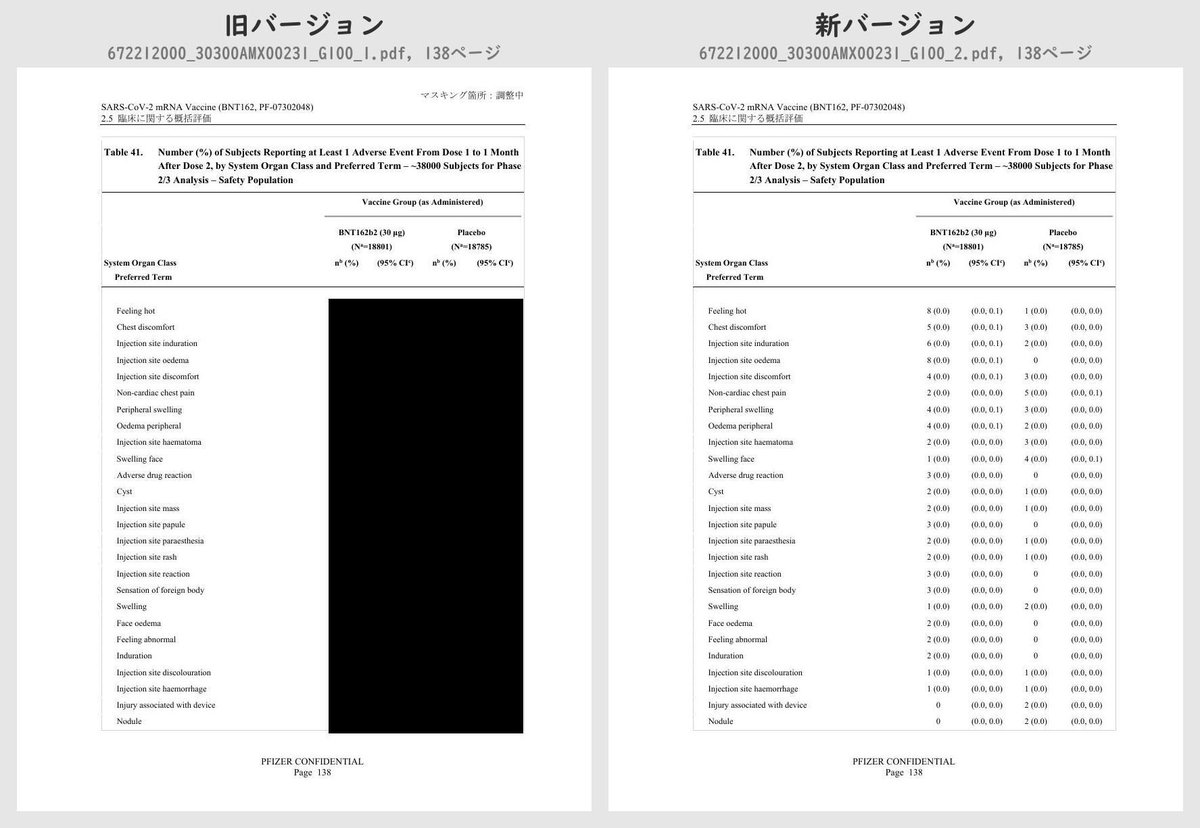
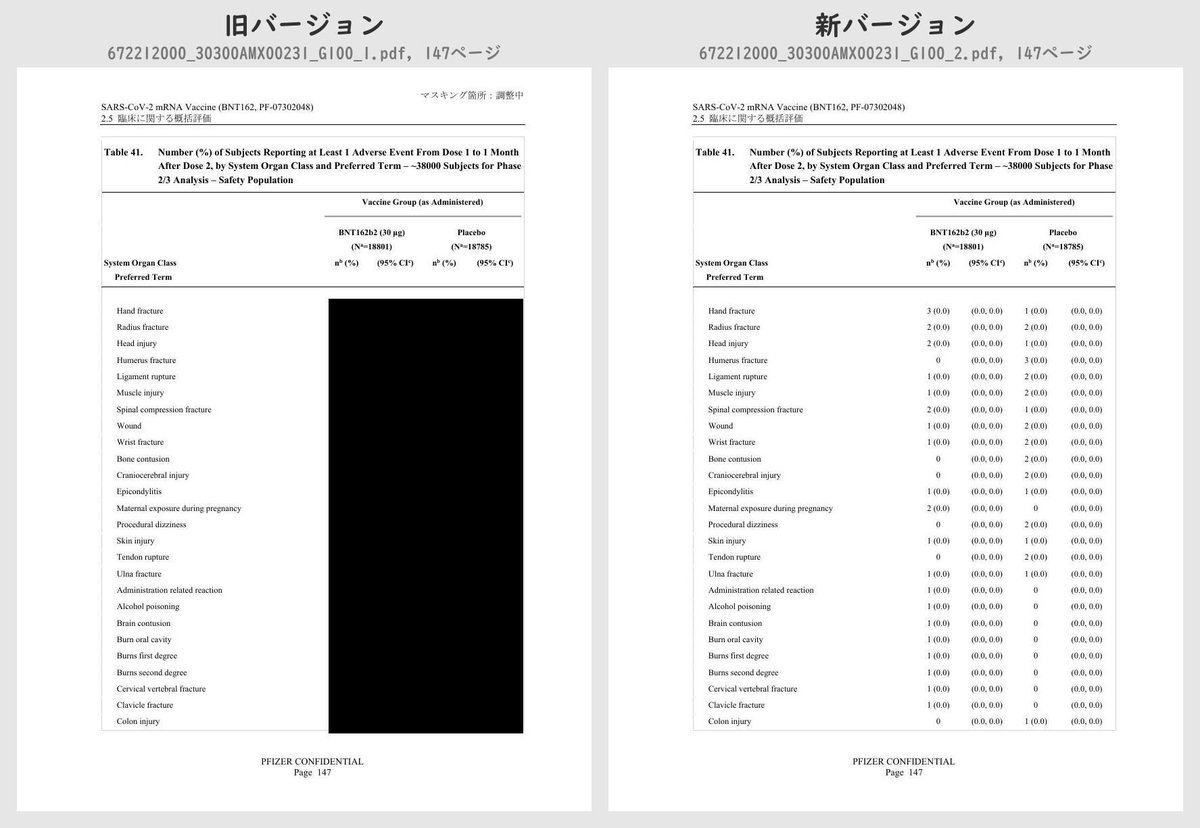
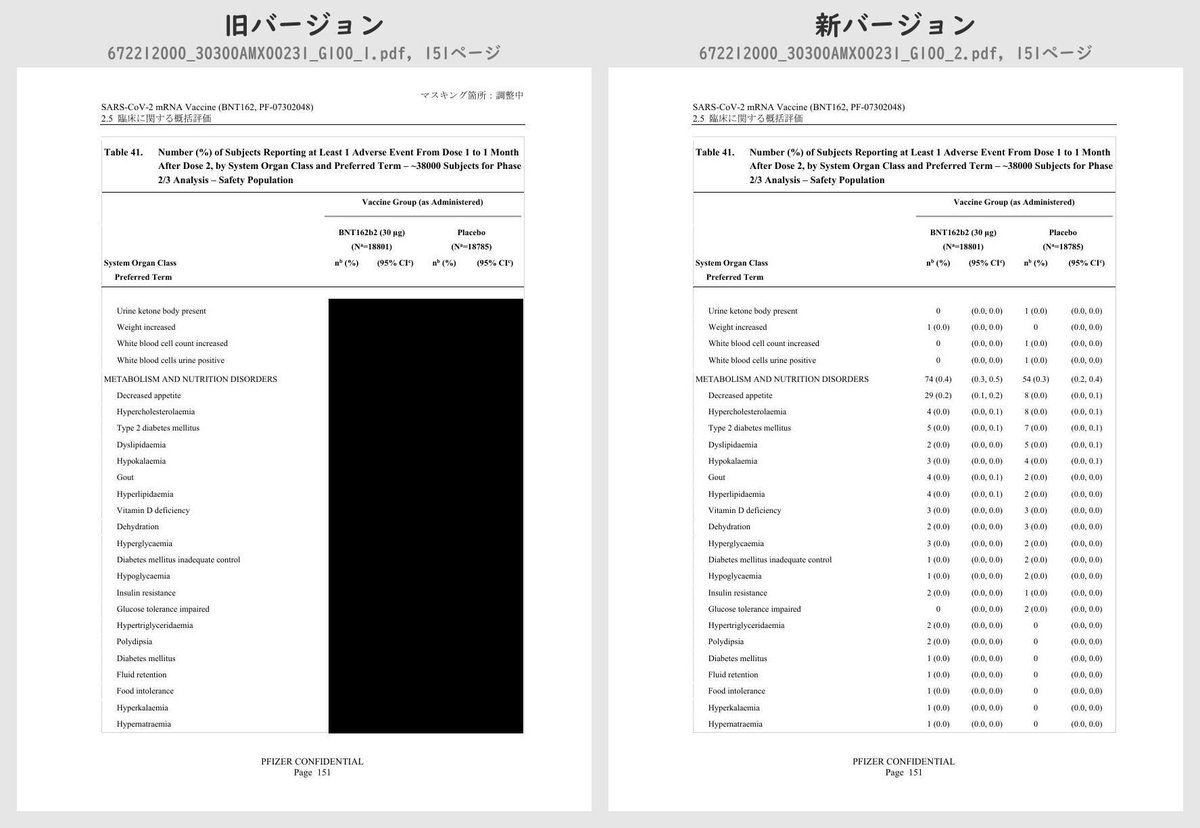
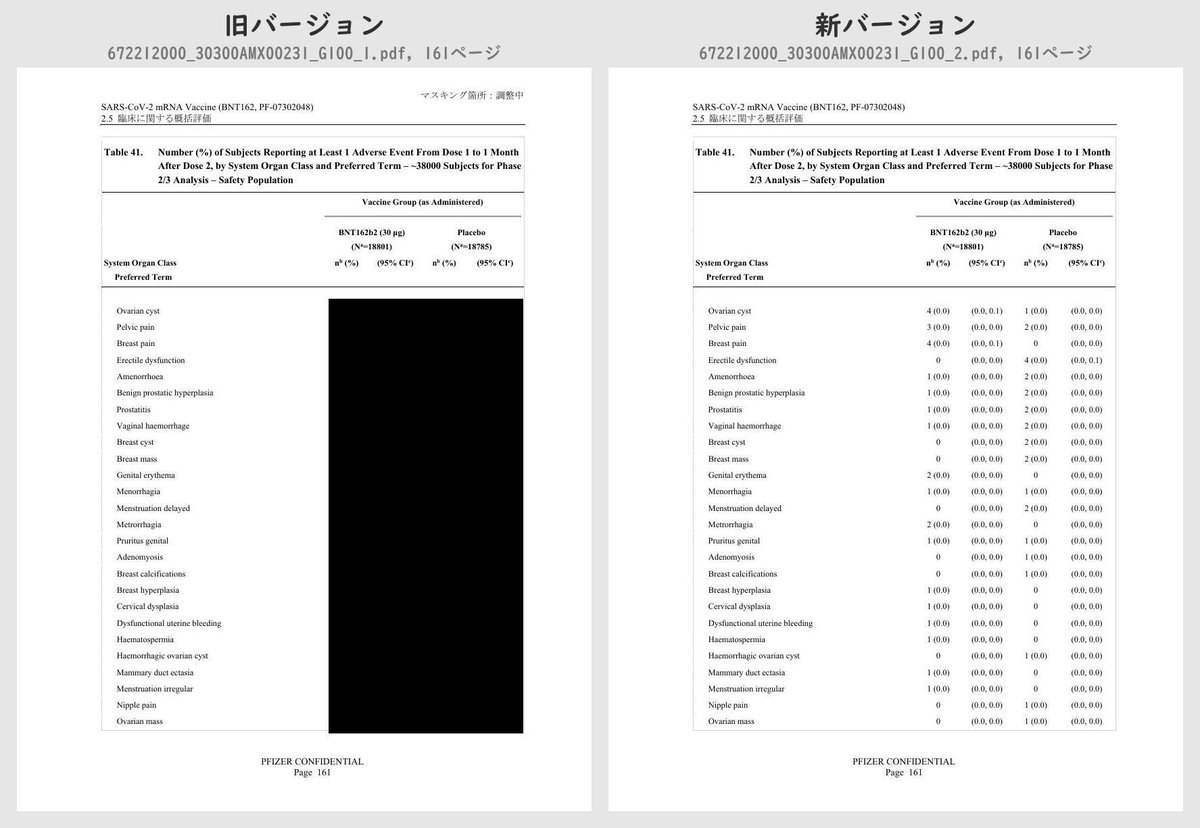
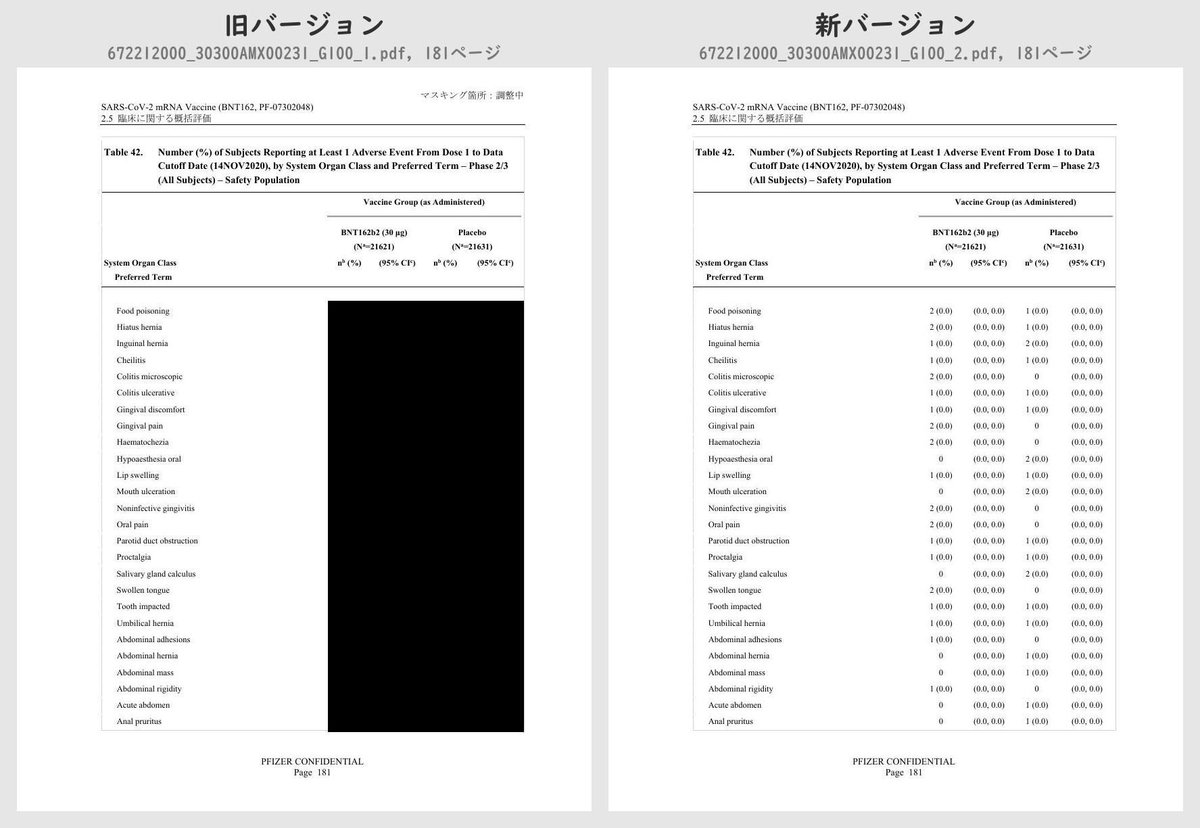
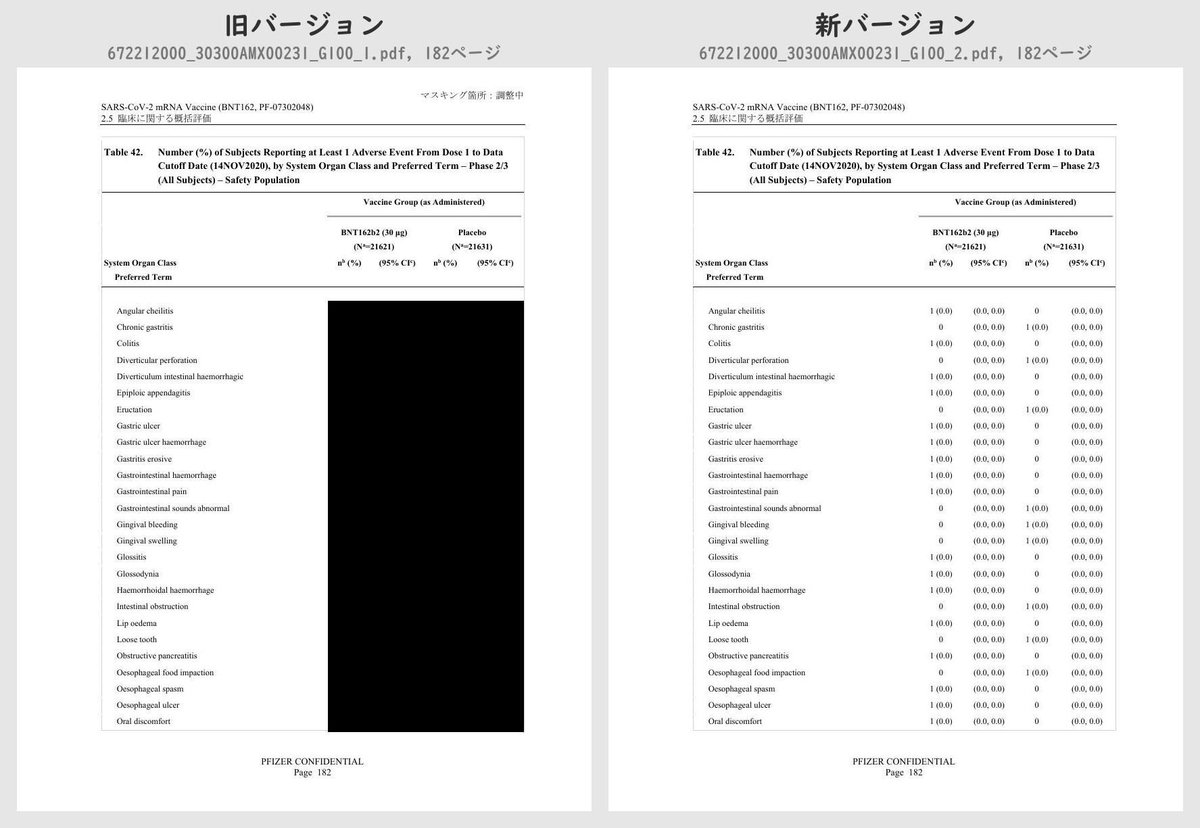
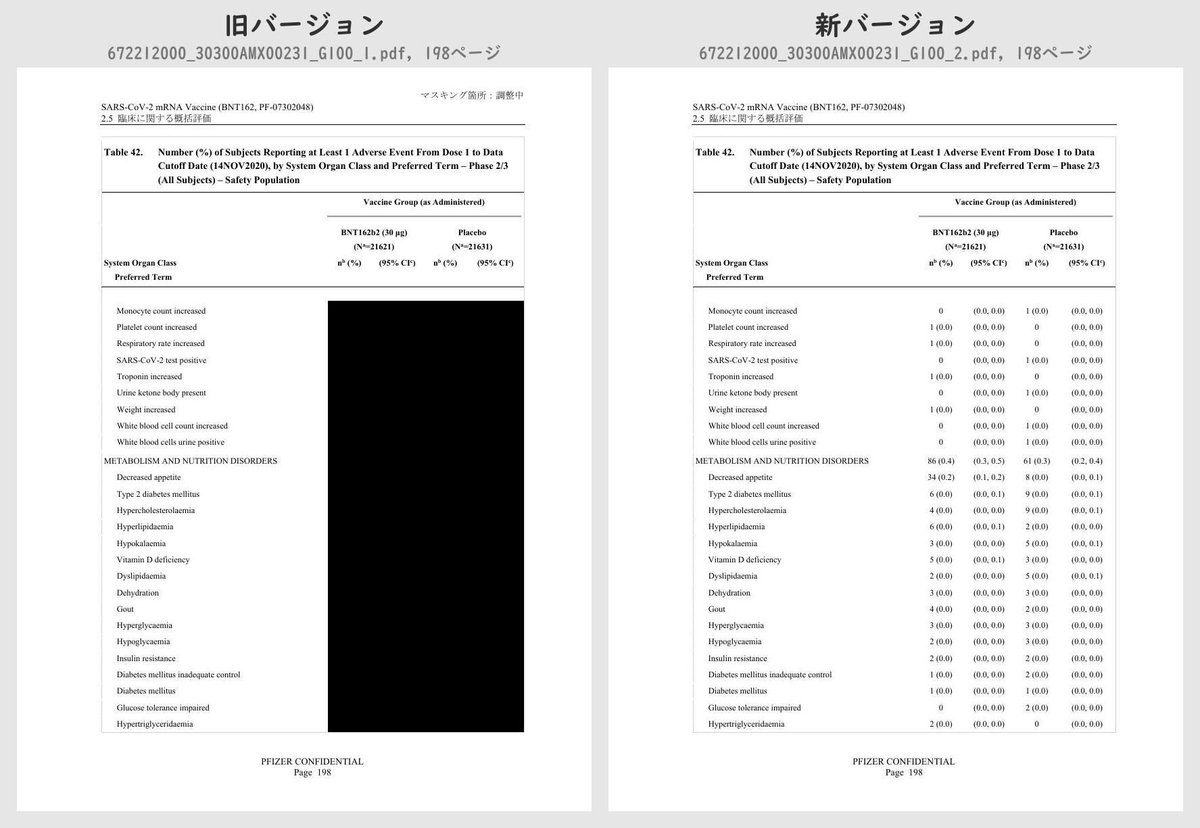
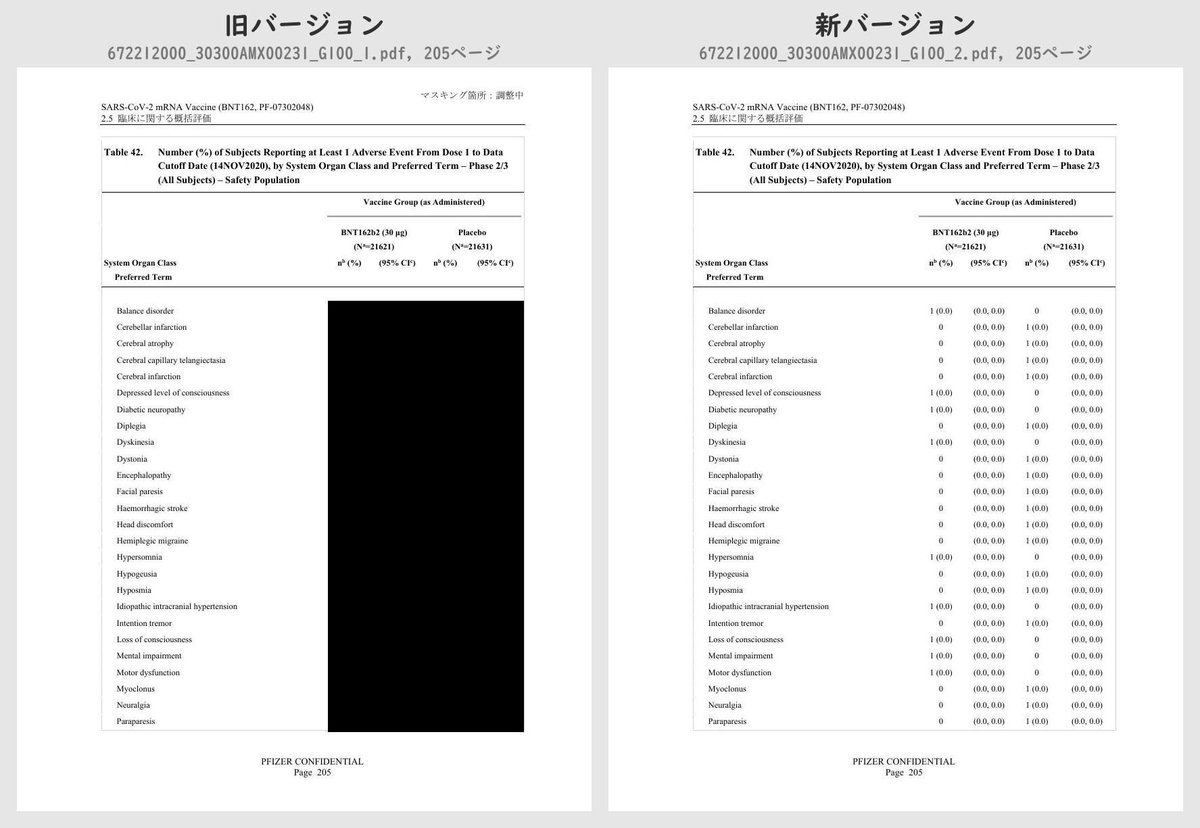
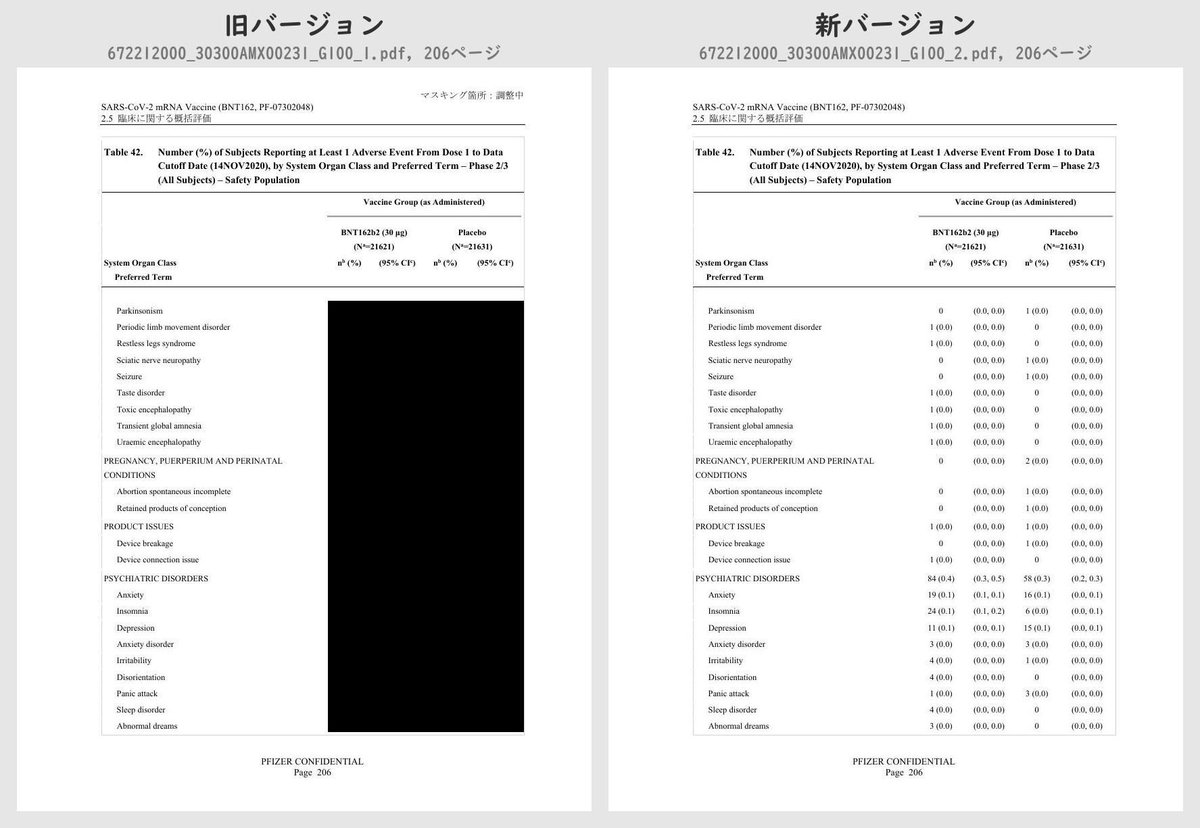
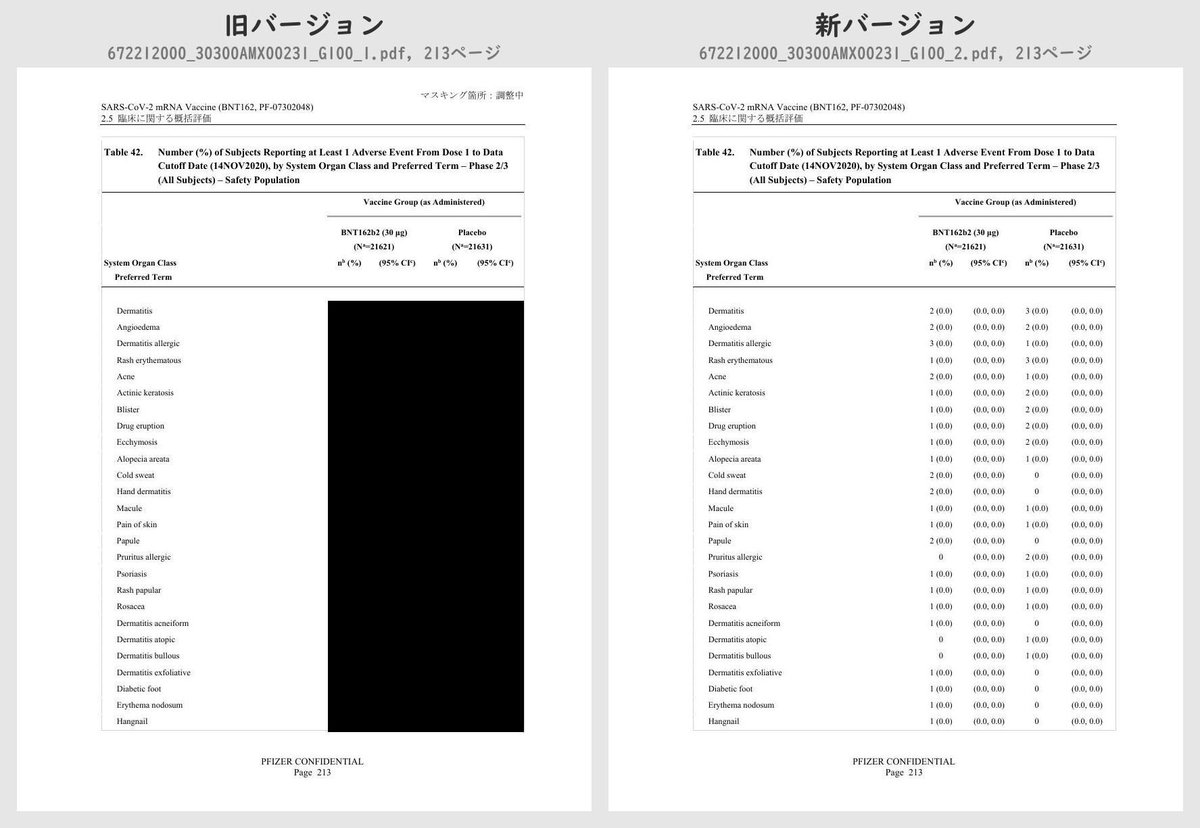
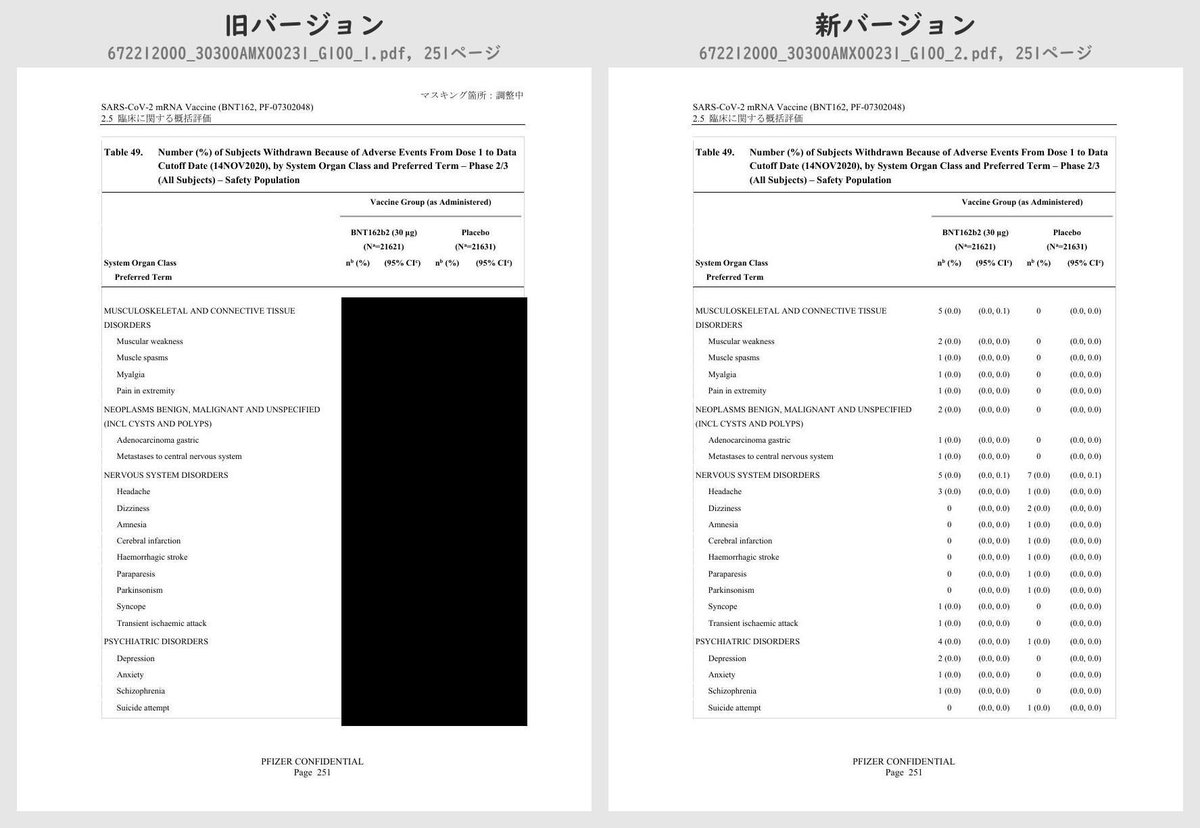
それぞれのPDFを旧バージョン・新バージョンで比較したところ、新バージョンでは計3個のPDFファイルで黒塗りの部分が開示されていることが判明しました。
公開されたのはいずれも臨床試験の有害事象に関する内容で、動物を用いた非臨床試験のPDFなどは現在も黒塗り状態のままでした。
黒塗り開示ページ一覧
黒塗り部分が開示されたページを以下にまとめます。
臨床に関する概括評価(PDF)
Table 41 (p.129 ~ p.170)
Number (%) of Subjects Reporting at Least 1 Adverse Event From Dose 1 to 1 Month After Dose 2, by System Organ Class and Preferred Term – ~38000 Subjects for Phase 2/3 Analysis – Safety PopulationTable 42 (p.175 ~ p.219)
Number (%) of Subjects Reporting at Least 1 Adverse Event From Dose 1 to Data Cutoff Date (14NOV2020), by System Organ Class and Preferred Term – Phase 2/3 (All Subjects) – Safety PopulationTable 43 (p.220 ~ p.221)
Number (%) of Subjects Reporting at Least 1 Adverse Event From Dose 1 to Data Cutoff Date (14NOV2020), by System Organ Class and Preferred Term – 16-17 Years of Age – Safety PopulationTable 44 (p.222)
Number (%) of Subjects Reporting at Least 1 Severe Adverse Event From Dose 1 to Data Cutoff Date (14NOV2020), by System Organ Class and Preferred Term – 16-17 Years of Age – Safety PopulationTable 46 (p.233 ~ p.242)
Number (%) of Subjects Reporting at Least 1 Serious Adverse Event From Dose 1 to Data Cutoff Date (14NOV2020), by System Organ Class and Preferred Term – Phase 2/3 (All Subjects) – Safety PopulationTable 47 (p.243)
Number (%) of Subjects Reporting at Least 1 Serious Adverse Event From Dose 1 to Data Cutoff Date (14NOV2020), by System Organ Class and Preferred Term – 16-17 Years of Age – Safety PopulationTable 48 (p.244 ~ p.247)
Number (%) of Subjects Withdrawn Because of Adverse Events From Dose 1 to 1 Month After Dose 2, by System Organ Class and Preferred Term – ~38000 Subjects for Phase 2/3 Analysis – Safety PopulationTable 49 (p.249 ~ p.252)
Number (%) of Subjects Withdrawn Because of Adverse Events From Dose 1 to Data Cutoff Date (14NOV2020), by System Organ Class and Preferred Term – Phase 2/3 (All Subjects) – Safety Population

































































































臨床概要①(PDF)
Table 9 (p.239 ~ p.266)
Number (%) of Subjects Reporting at Least 1 Adverse Event From Dose 1 to 1 Month After Dose 2, by System Organ Class and Preferred Term – ~38000 Subjects for Phase 2/3 Analysis – Safety PopulationTable 10 (p.269 ~ p.298)
Number (%) of Subjects Reporting at Least 1 Adverse Event From Dose 1 to Data Cutoff Date (14NOV2020), by System Organ Class and Preferred Term – Phase 2/3 (All Subjects) – Safety PopulationTable 11 (p.299)
Number (%) of Subjects Reporting at Least 1 Adverse Event From Dose 1 to Data Cutoff Date (14NOV2020), by System Organ Class and Preferred Term – 16-17 Years of Age – Safety PopulationTable 12 (p.302)
Number (%) of Subjects Reporting at Least 1 Severe Adverse Event From Dose 1 to Data Cutoff Date (14NOV2020), by System Organ Class and Preferred Term – 16-17 Years of Age – Safety Population2.4.4.2.1. 2回目接種後の追跡調査期間(中央値)が2ヵ月の被験者(C4591001試験第3相部分,重篤な有害事象) (p.304)
1回目接種後にリンパ節症が発現した女性の詳細情報Table 14 (p.311 ~ p.316)
Number (%) of Subjects Reporting at Least 1 Serious Adverse Event From Dose 1 to Data Cutoff Date (14NOV2020), by System Organ Class and Preferred Term – Phase 2/3 (All Subjects) – Safety PopulationTable 15 (p.317)
Number (%) of Subjects Reporting at Least 1 Serious Adverse Event From Dose 1 to Data Cutoff Date (14NOV2020), by System Organ Class and Preferred Term – 16-17 Years of Age – Safety Population2.4.4.3.1. 2回目接種後の追跡調査期間(中央値)が2ヵ月の被験者(C4591001試験第3相部分,安全性に関連した治験中止) (p.318)
治験中止に至った有害事象の内訳Table 16 (p.319 ~ p.321)
Number (%) of Subjects Withdrawn Because of Adverse Events From Dose 1 to 1 Month After Dose 2, by System Organ Class and Preferred Term – ~38000 Subjects for Phase 2/3 Analysis – Safety Population








































































臨床概要②(PDF)
Table (p.74 ~ p.89)
Number (%) of Subjects Reporting at Least 1 Adverse Event From Dose 1 to 1 Month After Dose 2, by System Organ Class and Preferred Term, by Age Group – ~38000 Subjects for Phase 2/3 Analysis – Safety Population Age Group: 16-55 YearsTable (p.90 ~ p.104)
Number (%) of Subjects Reporting at Least 1 Adverse Event From Dose 1 to 1 Month After Dose 2, by System Organ Class and Preferred Term, by Age Group – ~38000 Subjects for Phase 2/3 Analysis – Safety Population Age Group: >55 YearsTable (p.105 ~ p.110)
Number (%) of Subjects Reporting at Least 1 Related Adverse Event From Dose 1 to 1 Month After Dose 2, by System Organ Class and Preferred Term, by Age Group – ~38000 Subjects for Phase 2/3 Analysis – Safety Population Age Group: 16-55 YearsTable (p.111 ~ p.114)
Number (%) of Subjects Reporting at Least 1 Related Adverse Event From Dose 1 to 1 Month After Dose 2, by System Organ Class and Preferred Term, by Age Group – ~38000 Subjects for Phase 2/3 Analysis – Safety Population Age Group: >55 Years4.2.3.3 有害事象 (p.121)
在外日本人被験者の1回接種から2ヵ月後までに認められた注射部位疼痛と発熱の有害事象発生数Table 4-30 (p.205)
Number (%) of Subjects Reporting at Least 1 Related Adverse Event From Dose 1 to 1 Month After Dose 2, by System Organ Class and Preferred Term – ~38000 Subjects for Phase 2/3 Analysis – Japanese Subjects – Safety PopulationTable 4-31 (p.206)
Number (%) of Subjects Reporting at Least 1 Related Adverse Event From Dose 1 to 1 Month After Dose 2, by System Organ Class and Preferred Term, by Age Group – ~38000 Subjects for Phase 2/3 Analysis – Japanese Subjects – Safety Population Age Group: 16-55 YearsTable 4-32 (p.207)
Number (%) of Subjects Reporting at Least 1 Related Adverse Event From Dose 1 to 1 Month After Dose 2, by System Organ Class and Preferred Term, by Age Group – ~38000 Subjects for Phase 2/3 Analysis – Japanese Subjects – Safety Population Age Group: >55 Years5.2.2.2. 有害事象 (p.224)
有害事象の内訳、治験中断についての記載














































