
DNA抽出実験〜鶏ムネ肉からのDNA抽出〜
小学校のとき、DNA抽出の実験を行った人は多いと思います。
実験室でもDNA抽出は行われていて、DIYバイオでも、生物のDNA配列を調べ、生物のDNA配列や、遺伝子の有無について調べたりするのに役に立つと思います。
そこで今回は、実験室レベルの動物細胞からのDNA抽出を、自宅で行いたいと思います。
DNA抽出について
小学生と実験室でのDNA抽出方法の違い
DNA抽出は小学生がやるのと大学の実験室でやる場合とで全然違います。

↑学校などで一般的に行なう「DNAの抽出実験」は、DNAを目で見て観察することが目的です。
そのため、DNAかたくさん取れやすいブロッコリーなどを用い、エタノールで析出したDNAを観察します。
一方、研究室では、DNAを回収するためにDNA抽出が行われます。
エタノールの析出だけでなく、さまざまな手順を踏んでDNAを精製するのです。
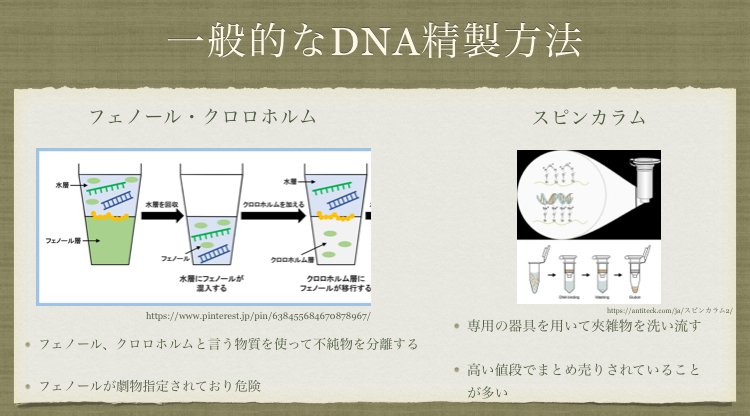
一般的に使われているDNAの精製には、フェノールとクロロホルムを使う方法やスピンカラムを使う方法などがあります。
しかし、フェノールは劇物に指定されており非常に危険であったり、カラムが高い値段でまとめ売りされていたりしており(カラム1個自体はそんなに高くないのですが……)、実験に適しません。
高校教師ののDIYバイオ
そんな中、とある高校の先生が遺伝子実験の授業を行ったという報告を見つけました。
学校では「器材」、「予算」、「経験」の3つの観点から学校単独で遺伝子実験の授業を行うことは難しい状態が続いていました。
しかし、熊谷 篤(くまがい あつし)先生は、生物実験に必要な器具や試薬、実験手法(プロトコルと呼ばれる)を自作・代替する「DIYバイオ」のアプローチで、授業を行ったといいます。

↑その中で、劇物を使わず、安価にDNAを抽出するDIY抽出法が紹介されています。

タンパク質は、高温に晒されるとタンパク質が変性して、水に溶けなくなる性質を持ちます。
例えば、生卵は水状ですが、茹でて加熱すると固形のゆで卵になります。
これは、水に溶けていたタンパク質が、加熱によって変性し、水に溶けなくなって(不溶化)凝集するからです。
同じように、試料中のタンパク質を不溶化し、凝集・沈殿させて、DNAを抽出しているのです。
しかし、溶液の中にも夾雑物は存在しています。

そこで、塩(ここではNaCl)が溶けたDNA溶液に、エタノールを用いてDNAだけを沈殿させ、水に溶かします。これはエタノール沈殿、通称「エタ沈」と呼ばれます。
しかし、エタ沈では、DNAの他にタンパク質が沈殿していたり、試料中に夾雑物が混ざっていたりします。
そこで、タンパク質の沈殿とエタ沈をもう1回行い、DNAの精製を行います。
DNAの抽出を行うための器具たち
それでは、DNAの抽出を行うための器具を見ていきましょう!
①マイクロピペット

液体をマイクロリットル単位で測り取り、移すことができる器具です。
遺伝子実験では日常的に使う、ハシのような存在です。
「マイクロリットル単位」と書きましたが、測れるスケールは種類によって違います。
使う際は、ピペットの本体に「チップ」と呼ばれる使い捨ての器具を取り付け、測り取ります。
②マイクロチューブ

遺伝子実験における「試験管」のようなものです。
1.5ml、0.5mlサイズなどがあります。
上にキャップが付いており、のちに紹介する「遠心分離」を行う際、チューブの中身が漏れ出さないようにできます。
③遠心分離機
遺伝子実験では、溶液に強い遠心力をかけて沈殿物を沈め、分離させます。
これを「遠心分離」と呼びます。
この「遠心分離」を行う装置が「遠心分離機」です。
市販のものは高価ですが(バイオ関係の実験機材では同じことが言える)、玩具である「ぶんぶんごま」の仕組みを応用した「Paperfuge」が開発されています↓
しかし、このPaperfugeにも欠点があります。
それは「細いガラスチューブに入れた溶液しか遠心分離できない」ということ。

そんな中、先ほどのDIY抽出法を開発した熊谷先生は、Paperfugeをマイクロチューブでも使えるように改良しました。
この改良した遠心分離機を、勝手に「Kumagaifuge」と呼んでいます。
熊谷先生が教師用に制作されたガイド↑を参考に、Kumagaifugeを作成して、実験に使っていきたいと思います。
④遠沈管

バイオ実験に必要な試薬の調製や、保管に使います。
遠心分離をするために使われることも多いようですが、バイオ実験ではあまり使うことはないです。
実際にやってみた
ということで、実際にDNAの抽出をやっていきたいと思います。
①試薬の調製
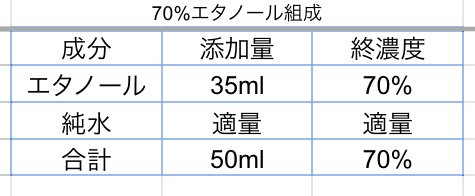
DNA抽出時に使う試薬のうち、DNA抽出液と5M NaCl溶液、そして70%エタノール(通称ナナエタ)は自分で調合して作る必要があります。
組成は↓の通りです。


5M NaCl溶液は、50mlの純水に適切な量のNaClを入れて調製します。
5Mは「モーラー」という溶液の濃度を表す単位で、1Mは1Lあたり1molの物質が入っていることを表します。
詳しい解説は↓に載っています。
NaCl=食塩だと思いがちですが、一般的に販売されている「食塩」は、NaCl以外にさまざまな不純物が入っており、実験に適しません。
しかし、NaCl以外の不純物が入っていない「精製塩」も、鼻うがいの補助剤として別売販売されているので、そちらを使います↓
入れる分量は↓のサイトを参考にしました。
今回の実験では正確な量を量り取れるはかりが無かったので、1袋あたりの重さから計算しました。
↓入れるのは14.61g、1袋に入っているNaClは2.5gだから5袋とちょっと入れればいいか


↑50mlの精製水をドバドバ入れていきます。
本来はあらかじめ一定量の水を加え、NaClを入れ終わったらすぐに残りの水を加えて50mlにするのですが……
DNA抽出液は、この5M NaCl溶液とSDS、純水を加えます。
SDSは界面活性剤のことで、一般的な食器用洗剤で代替できます。
今回は、「ヤシノミ洗剤」を使いました↓

↑ヤシノミ洗剤をキャップ式の容器(写真左下の容器)に移し、遠沈管に5M NaClとヤシノミ洗剤を一定量入れ、純水を加えます。
本来は、DNAを安定させるために純水ではなく、TEを加えます。
↑BIONEERという製薬会社から個人で買えるようなのですが、通関とかの対応が面倒なので今回は純水を使いました。
ナナエタも、エタノールと純水をそれぞれ加えて調製します。
↓ナナエタと無水エタノールは冷やして置く必要があるので冷蔵庫で保管します。

②サンプルからのDNA抽出
次に、サンプルからDNAを抽出します。
使うのは鶏のムネ肉です↓

↓薄く切り、数ミリほどの肉片にします。


↓マイクロチューブに移します。大きい肉片と小さい肉片が2つずつありました。

マイクロピペットのチップの先を使って、肉片を細かく分けます。↓

↓抽出液を加えます。これでうまく組織が溶けると思ったのですが、なかなか組織片が溶けませんでした。この時の写真撮っとけばよかったな。

仕方ないのでそのまま続行します。
③熱処理、遠心分離1回目
次に、サンプルを熱処理することでタンパク質を変性させ、DNAが精製しやすくなるようにします。
↓温度計で75℃以上になるように鍋のお湯の温度を調整します。

↓熱処理をしているところ。初回は鍋に直接チューブを加えていましたが、チューブが鍋に当たることでキャップが開いてしまい、中身が漏れてしまっていました。

そこで、チューブを湯切りに入れながら煮込んで(!?)、熱処理を行いました。
煮えたてホヤホヤのチューブたち↓
Kumagaifugeを使って遠心し、夾雑物を沈殿させます↓

とは言っても沈殿していたのは溶けきってない肉片だけでしたが。。。(これも撮ってないんだよなぁ…)

↑上清を取り出します。Kumagaifugeは遠心力が少し弱めなので上清は少なめにとってあります。
④エタノール沈殿1回目
エタノール沈殿をしてDNAを析出します。
↓キンキンに冷えた冷エタノールをビーカーに入れ、チューブに加えます。

↓チューブに加えたところ。もやっとした白いものが見えますが、それといった沈殿はありません。

そのまま少し放置しても、変わりませんでした。
遠心分離してみます↓

↓おお!沈殿ができてる!

チューブを逆さまにして乾かします。
熊谷先生はチューブラックを使って乾かすと転倒しなくて良いと言ってましたが、そうしなくても普通に立ちます↓

⑤エタノール沈殿2回目
とはいっても、沈殿にはまだ夾雑物が多いので、もう1回エタノール沈殿と遠心分離をして除去します。
純水(ここも本来はTE)を加え、遠心分離します↓

ここから、遠心分離の時間が少しずつ短くなっていきます。
↓遠心分離したところ。底にわずかですが白い沈殿があるのがわかります
再び上清を採取し、5MNaCl溶液を加えて濃度を調整した後、エタノールを加えてDNAを沈殿させます↓

↓遠心分離したところ。下の方に白いもやが見えました。

しかし、エタノール沈殿の時にはDNAの他に塩も沈殿するので、白いモヤはNaClの可能性もあります。
そのため、次の作業が重要になってきます。
⑤ナナエタによる洗浄
↓最後に、ナナエタを加えて溶液中のNaClを除去します。

しまった!
実は、プロトコルに静かに加えなければならないと書かれてありました。
次からはピペットの先をチューブに伝わらせて静かに注ぎます↓

↓遠心分離したところ。白いモヤがまだ残っています。

再び上清を捨てます。
実は、ここで全てのサンプルに置いて、吸い出し中にマイクロチューブのそこに触れてしまっていました(ちょっとだけだけど)
DNAが上清と一緒に吸われていないか、心配です。
↓キッチンペーパー乾燥2回目。吸い出し後のDNA回収が良いもの、まあまあなものに分けます。

↓乾燥させた後のサンプル。光に当ててみると、
意外と…残ってる?

あとは純水を加え、冷凍庫で保管します。
まとめ・改善するところ
ここまでの実験で、改善すべき点を上げていきます。
①正確な量を量り取れるはかりがなかった
次回までに100分の1の位まで量れるはかりを買おう。
②サンプルが悪かった
サンプルをすり潰せばうまくとけると思ったのですが、あまり溶けず、潰すこと自体も手間と時間がかかってしまいました。
次回は鶏のミンチやレバーを試そうかな。
③TEバッファーを使わなかった
TEはDNAを分解から守ってくれるのですが、それを使わなかったことで、DNAが分解されてしまった可能性があります。
しかし、知り合いの大学の先生によると、DNAは頑丈な物質な為、分解されることは少なく、TEなしでも抽出は十分できるそうです。
④溶液の加熱条件が悪かった
タンパク質を変性させる時の条件が悪く、うまく不溶化できなかった可能性があります。
論文なども読んで条件を改善しよう
⑤遠心時間が短かった
遠心分離する時間が短く、タンパク質やDNAをうまく分離できない可能性があります。
次回はもう少し遠心分離の時間を伸ばすことも考えようと思います。
⑥2回目のエタノール添加後の遠心分離の際、少し離席した
エタノールが温まり、DNAが沈殿しにくくなった可能性があります。
しかし、そのおかげでたんぱく質も沈殿しにくくなり、純度が高まっている可能性もあります。
これは、また検討すべきポイントではないかと思います。
⑦記事に載せる写真が少なすぎる
次の実験では各段階のサンプルをそれぞれ、実験をしている様子、途中で失敗したらその時の写真も撮るように心がけよう。
特に④番、⑤番が気になっています。
実験の手順をもう一度見直してみたいと思います。
とこんな感じです。
プロトコルを改善して、また実験を行いたいと思います。
