
孫泰蔵もやらないから自宅でDNA抽出実験をやってみる
前の記事↓で、キットを使わない簡易的な抽出法を試してみました。
一方で、ぼくとは別にDIYバイオ関連のブログ「バイオハッカージャパン」(以下BH)を運営するfetuinさんは、Bioneerという試薬会社からDNA抽出のキットを購入し、抽出を行っています↓
前回、キットは高い値段でまとめ売りされていると書きましたが、Bioneer社では100回分で136ドル(20000円程度)と、頑張れば手が届くほどの値段です。
そこで、キットを使って実験を行おうと考えていたら、fetuin さんが提供してくれました。
今回は、fetuin さんからもらったBioneer社の試薬を使ってDNAの抽出を行いたいと思います。
キットについての説明
今回、fetuinさんから送っていただいたのは韓国にあるBioneer社のものです↓

fetuin さん曰く、日本では地下鉄サリン事件の反省から個人の試薬販売を受け付けていない代理店が多いそうです。
そこで、海外の通販から輸入する必要があり、その中でfetuinさんが主な購入先として使っているのがこのBioneerという会社になります。
↓fetuinさんの記事にある、キットの中身の写真。いくつかの試薬と、乾燥された酵素、そしてプラスチック製の器具が入っています

画像の記事によると、「サンプルにProteinase Kを加えて60度10分でタンパク質部分を分解し、エタノールを入れてDNAを析出させる。吸着カラムにかけてDNA以外を洗い流した後にDNAのみを回収して、水に再溶解させる」という仕組みのようです。
BHでは血液からの抽出でしたが、こちらは鶏肉(組織)からになるので、タンパク質の分解と同時に組織を溶かして分解しやすくするためのバッファーと、DNAとともに混入するRNAを分解するRNaseを加えます。

あと、このキット「使用期限」があります。
基本的に注文した日付から大体1年程度で、届いたキットはとっくに過ぎています。
とはいっても、この使用期限は食品でいう「賞味期限」みたいなもので、品質が少し落ちるものの問題なく使えるようです。
fetuinさんも同時期に購入した同じキットがあり、そちらは現在(2024年)でも問題なく使えているとのこと。
DNA抽出をしてみよう!
それでは、実際にキットでDNAの抽出を行っていきましょう。
試薬の調製
まず最初に、ProteinaseK,RNaseという試薬を調製しておく必要があります。
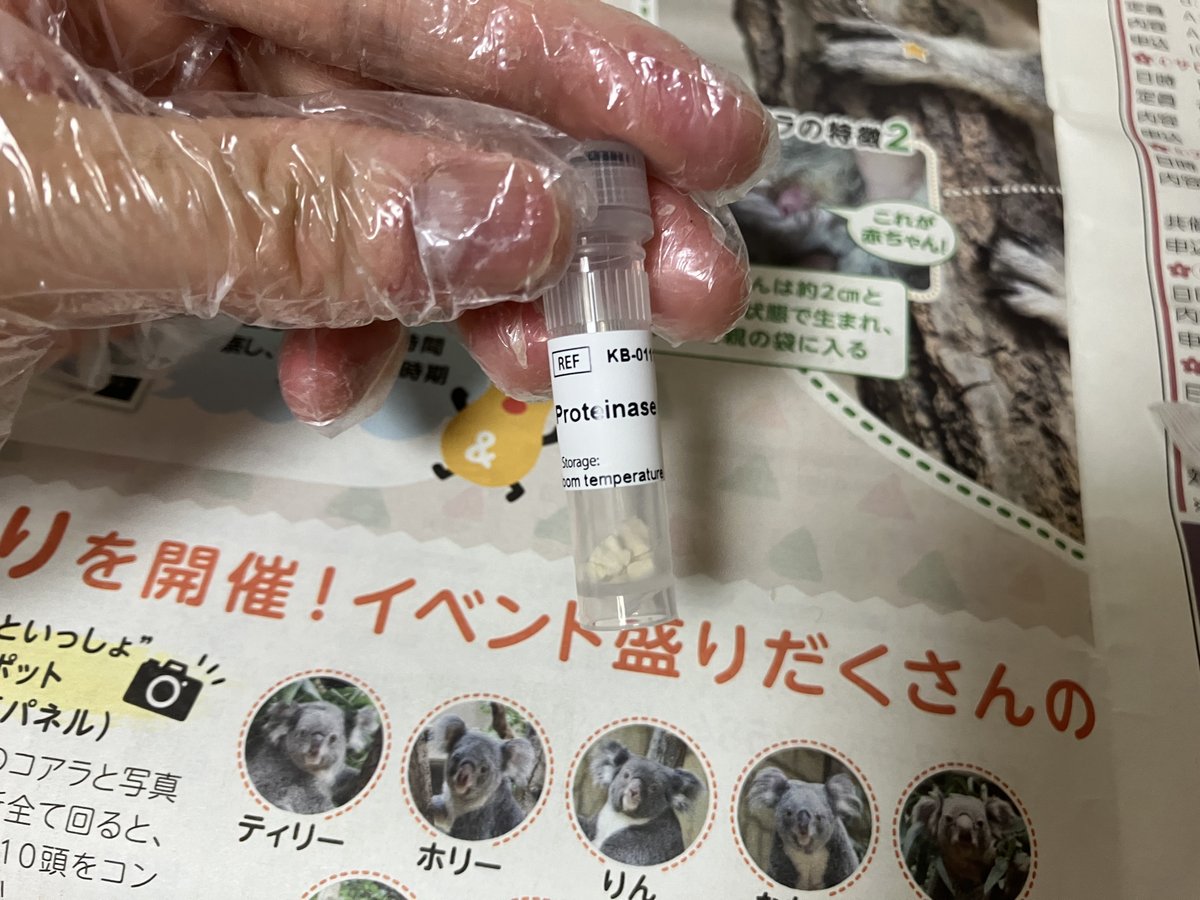
ProteinaseKはタンパク質を分解する酵素で、組織や細胞を溶解するのに使います。

また、組織からのサンプルに混ざったRNAを分解する酵素で、DNAの純度を高めます。

↑マニュアルに従いProteinase Kは1250ul,RNaseは600ulのサンプルを加えます。
RNaseは1本だけを溶解します。
水を入れた瞬間すぐに溶けました。
これらの酵素は冷凍保存するのですが、凍結を繰り返すと活性が下がるのでfetuin さんを真似してマイクロチューブを分注します。
Proteinaseはfetuinさんと同じ50ulを25本↓

↓RNaseは30ulを30個分注します。

↓ProteinaseKは最後の1本がうまい量で入りませんでした。。

↓ラベリングし、各1本を除きジップロックに入れて冷凍保存します。

残りの2本も4℃で保存すると書いてあったので冷蔵保存します。
また、
サンプルの採取
次に、サンプル(鶏肉)を採取します。

前回とは違い包丁ではなく、ハサミとピンセットを使って切り刻んですり潰します。
マニュアルでは乳棒と乳鉢を使えと書かれていましたが、ハサミですり潰します。
↓作った4つのサンプル。それぞれ量が違います。





サンプルの溶解
次に、サンプルを溶解させてカラムで精製できるようにします。
↓TLバッファーを200ul,ProteinaseKを20ul,RNaseを10ul加えます。

↓ただ、加えた時点ではまだ組織が溶けていません。。。




↓そこで60℃で加熱させることで酵素を働かせます。

前回の経験で、ガスでの加熱は難しいのでIHで加熱します。
チューブを熱湯で加熱する際は、ふたをしっかりしめましょう。
↓1時間ちょい加熱したあとのサンプル。まだ組織が残っているものの、量が減っており、順調に組織が溶解されているのがわかります。



プロトコルでは、組織が溶けない際はボルテックスで溶液を混ぜろと書いてあります。
でも、うちにはそんなものはないので、マイクロピペットで溶液を吸ったり吐いたりして混ぜる「ピペッティング」をして、ピペットの先で組織をつつき細かくします。↓

↓ピペッティング後のサンプル。サンプル①以外は白く濁っています。




↓再びIHで15分加熱してみます。

↓加熱後のサンプル。目視でもほとんどが溶けているのがはっきりとわかるようになりました。



↓再び15分加熱。

↓加熱後のサンプル。ほぼ綺麗に溶けています。




↓GBバッファーと無水エタノールを加え、よくピペッティングします。

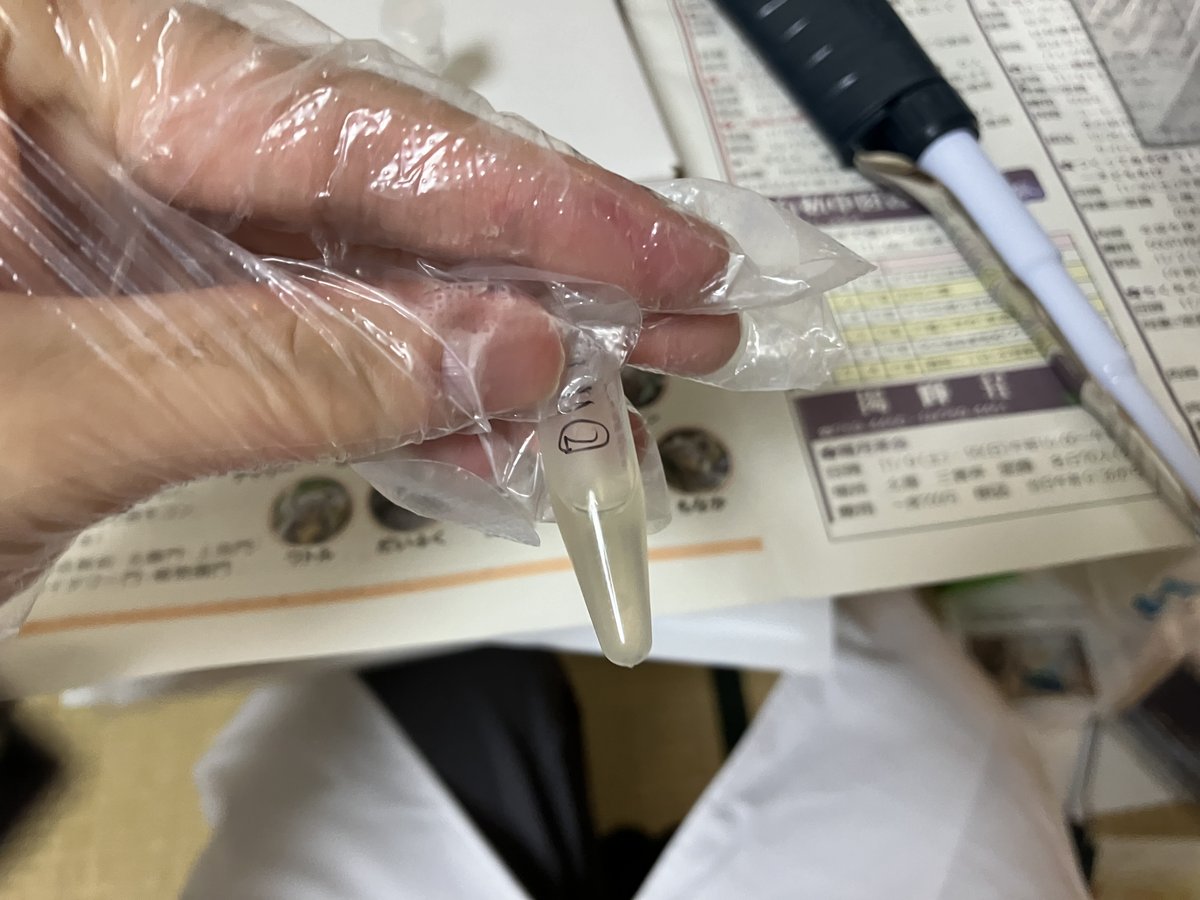
↓入れたあとのサンプル。薄茶色の透明になっています


カラムの精製
次に、カラムを使ってDNAを濾し取り、精製します。

↓カラム(↑写真左)を溶液回収チューブ(↑写真右)にセットして……

↓ラベリングし、それぞれのサンプルを移します。

↓Kumagaifugeを使って遠心分離します。

知らない人のために説明すると、ぶんぶんごまの原理を使って遠心分離をする装置です。
開発した人は高校の先生。生徒にDNA実験をさせる授業を行わせたいという一環で、DIYバイオのアプローチで自作したみたいです。
↓しかし、実際に遠心分離してみると、遠心力が分散してしまい、チューブにかかりません。
↓そこで、底の部分の穴を大きくしてカラムを深くはめます。

↓その状態で遠心分離機を上側に引っ張ることで、遠心力を分散させずに遠心させることができました。
↓しかし、20分ぐらい遠心しても(途中でテープの補強や、管の差し直しをした)、濾過されたのはほんのわずかでした。


今回はここで断念しました。
考察
実験の途中で、カラムをKumagaifugeで遠心分離しても、溶液が通らないという課題にぶち当たりました。
↓KumagaifugeはPaperfugeという、ブンブンゴマ式の遠心分離機をもとに設計されています。
↑のサイトによると、Paperfugeは12000回転以上出るみたいですが、Kumagaifugeはどのくらいの回転数が出るかの検証はされていませんでした。
また、Paperfugeは細いガラスチューブを使っていますが、Kumagaifugeは1.5mlチューブを元に設計されているため、重さなどで回転数が減っている可能性があります。
さらに、ぶんぶんごま式の遠心分離機は回転→静止を繰り返すため、加速が一瞬しか行われていないかもしれません。
要は、Kumagaifugeでは十分な速度での遠心ができなかったことが一番の原因である可能性があります。
他にも、
正確な計量ができていなかったため、本来(10〜40mg)より多い量のサンプルが溶け切れずカラムが詰まった
カラムが劣化して使えなくなった
などの可能性が考えられます。
とりあえず、1mg単位での軽量ができるはかりと、卓上の遠心分離機を購入したいと考えています。
次回の記事はこちら↓
