
構造決定問題(+α) 復習
元素分析による分子式の決定
C,H,Oからなる有機化合物の場合、以下の装置を頭に入れておく。

試料 x (mg)の完全燃焼により得られた CO₂,H₂Oの質量をそれぞれ A(mg),B(mg)とすると、
求めたいCO₂の質量 : A × C(炭素)/CO₂ = A'
求めたいCO₂の質量 : B × 2H(水素)/H₂O = B'
Oの質量 O' = 試料 x -(A' + B')
C : H : O = A'/12 : B'/1 : O'/16 →簡単な整数比にする
※ここで求めたのはあくまで組成式。最も簡単な整数比で表されたものであるため、求めたい分子式とは限らない。なので問題文の条件(与えられた分子量,実験などから判断)に合わせて整数倍する必要がある。
N(窒素)を含む場合も考えることは同じ。(C,H,N,Oからなる有機化合物では分子量と水素、窒素原子数の偶奇は一致する)
とにかく物質量比を出せばいい。
分子量を決定する方法
・気体の状態方程式(試料の沸点が低い時)
PV = nRT
n = w/M
・ファントホッフの法則(高分子の分子量を決定する時)
ΠV = nRT
n = w/M
・凝固点降下の公式(試料が気体になりにくい時)
Δt = km
m = 1000n/W , n = w/M
(w:溶質の質量 W:溶媒の質量)
問題文で与えられている情報が少ない時は、分子量から攻めるしかない。→ 不飽和度の計算(例:不飽和度≧0)
構造決定で注目するのは官能基と異性体!
不飽和結合を持つ化合物の構造異性体は不飽和度を考慮する(共テ頻出)
不飽和度=n → π結合と環構造の和がn
あとは当てはまる組み合わせで場合分けして数え上げる
※二重結合はσ結合+π結合,三重結合はσ結合+π結合×2
元々不斉炭素原子をもっている化合物を加水分解や水素付加した後の化合物に不斉炭素原子がない場合
生成した化合物の中に対称な構造があると予測する
尿素の構造式は必須暗記事項
"ウェーラーが世界で初めて人工的に作った有機化合物"
シアン酸アンモニウムから尿素
NH₄OCN → (NH₂)₂CO
アルケンの付加反応
"臭素(の赤褐色)を脱色" → 炭素間に二重結合or三重結合がある、フェノール
"硫酸触媒で水付加"→炭素間に二重結合がある
(硫酸→加水分解という表記の仕方もある)
アルケンの酸化反応
オゾン分解→炭素間の二重結合にO原子が割り込んで開裂し、アルデヒドorケトンが生成(生成物で大まかな構造予想できる)
オゾン分解の逆算
C=O + O=Cを向かい合わせてO原子引き抜く
※エチレンとのメタセシス反応
C=CをC=CH₂ + CH₂=C形に切断する反応と見なす
大体問題文に説明はついてるが知識としていれておく
エチレンとのメタセシス反応の逆算
C=CH₂ + CH₂=Cを向かい合わせてCH₂を引き抜く
過マンガン酸カリウムで酸化→オゾン分解と同様。アルデヒドが生成している場合、カルボン酸まで酸化
※酸性条件下
※塩基性条件下の場合、ヒドロキシ基が2つ付加
"アルケンを過マンガン酸カリウムで酸化すると気体が発生"→炭素鎖末端に二重結合がある
(ホルムアルデヒド→ギ酸→炭酸→CO₂の変化)
アルキンの付加反応
アルキンに硫酸水銀(Ⅱ)触媒で水付加させると
炭素間の二重結合にOH基がくっついたエノール形の構造が生じるが、不安定な構造なのですぐに転位反応が起こりケト形へと変化(互変異性)
例:アセチレンに水付加→ビニルアルコール→アセトアルデヒド
"硫酸水銀(Ⅱ)触媒で水付加"→炭素間に三重結合がある
(水銀塩触媒と書かれていることもある)
"アンモニア性硝酸銀水溶液加えて白色沈殿"→炭素鎖末端に三重結合がある

※銅(Cu⁺)でも同じ反応を起こす
→アンモニア性塩化銅(Ⅰ)水溶液をアセチレンと反応させると赤褐色沈澱(銅アセチリドCu₂C₂)
アセチレンの製法
・カーバイド(炭化カルシウム)に水

※C₂H₂のカルシウム塩CaC₂が水(強酸)に触れることでC₂H₂(弱酸)が遊離する(弱酸遊離反応)
芳香族化合物
慣用名多いから一個一個覚える!
置換反応
ハロゲン化→"暗所で鉄orハロゲン化鉄(Ⅲ)触媒"
※ベンゼンに塩素を反応させる時、暗所で鉄or塩化鉄(Ⅱ)触媒の時は置換反応、紫外線照射の時は付加反応
ニトロ化
濃硫酸と濃硝酸の混合物をベンゼンと混合して加熱するとニトロベンゼン生成
※濃硫酸は水を取り除くため
スルホン化
ベンゼンと濃硫酸を混合して加熱するとベンゼンスルホン酸生成
酸化反応
・根元からカルボキシ基に置き換わる
トルエン、エチルベンゼン、スチレンを過マンガン酸カリウムで酸化→安息香酸

o-キシレンを過マンガン酸カリウムで酸化→フタル酸
m-キシレンを過マンガン酸カリウムで酸化→イソフタル酸
p-キシレンを過マンガン酸カリウムで酸化→テレフタル酸
・ベンゼン環そのものの酸化(頻出)
ベンゼンの空気酸化→無水マレイン酸
ナフタレンの空気酸化→無水フタル酸
※どちらも酸化バナジウム(Ⅴ)触媒
"昇華しやすい、酸化するとフタル酸"→ナフタレン
※ナフタレンの構造書き方注意
共鳴
共鳴構造を描く時は原子核の位置は固定
アルコール
"金属ナトリウムと反応"→-OH基をもつ
※アルコールに限らず起こる反応
アルコキシドと水素発生
※-OH基2つで水素分子1つ発生
※アルコールの-OHは水中で電離反応起こさない
※NaOHとは反応しない!!(フェノールは反応する)
アルコールの脱水
高温(160〜170℃)→分子内脱水
低温(130〜140℃)→分子間脱水
※エタノールの脱水ではどちらも聞かれるから温度も覚える
アルコールの酸化
アルコールの酸化のされ方で級数がわかる

"酸化できないアルコール"→第3級アルコール
※第1級アルコールの酸化
"二クロム酸カリウムで穏やかに酸化"→アルデヒドまで
"空気中で熱した銅線"→アルコールの酸化(アルデヒドまで)
"エチレングリコール"→ポリエチレンテレフタラートを疑う
アルデヒド
銀鏡反応
アルデヒドが酸化されカルボン酸の塩となる。
"アンモニア性硝酸銀を加えて加熱すると単体の銀が析出"→アルデヒド基
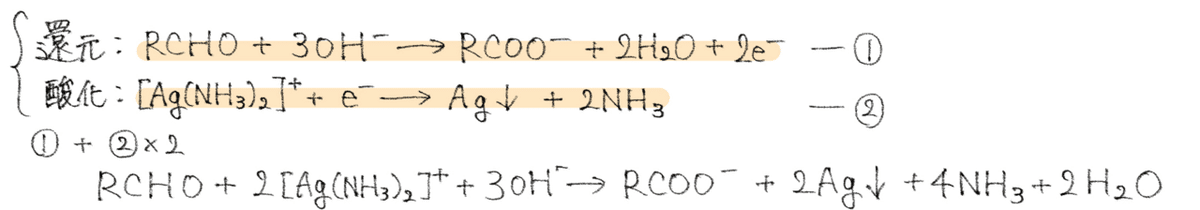
※アルデヒドは塩基性条件下で還元性を示すから硝酸銀をアンモニア性にする
フェーリング反応
"フェーリング液に加えて加熱すると(酸化銅(Ⅰ)の)赤色沈澱"→アルデヒド基

ヨードホルム反応
炭素1個減、酸素1個増
ヨードホルム反応では炭素1個少ないカルボン酸ナトリウム塩生成
試料にヨウ素と水酸化ナトリウム水溶液を加えて加熱すると特異臭をもつヨードホルムCHI₃の黄色沈殿が生じる
(手順覚えておく)
"ヨウ素と水酸化ナトリウム水溶液を加えて加熱すると黄色沈殿"→以下の構造を持つ

※この構造に直結する原子はCかH、それ以外ではヨードホルム反応を示さない
反応式の係数は未定係数法!
ナトリウム塩を記述する際下のように書かなければいけない。(間の結合がイオン結合だから)

フェノール類
フェノール類の-OH基は酸として電離が可能
→中和されてイオン結晶になると水に溶けやすくなる
めちゃめちゃ微弱な酸性を示すため、フェノール塩に酸を加えると、フェノールが遊離(弱酸遊離反応)
※酸の強さ(覚える)

※この場合、"炭酸の塩"→ NaHCO₃ と覚えておく
※強酸 + 弱酸塩 → 強酸塩 + 弱酸
"金属ナトリウムと反応し水素発生"→ -OH基
"塩化鉄(Ⅲ)水溶液を加えると紫色に呈色"→ フェノール性ヒドロキシ基
※この反応はフェノール塩でも起こる
フェノールの製法
・クメン法

・クロロベンゼンの加水分解→弱酸遊離
(OH⁻の求核置換反応)
・ベンゼンスルホン酸ナトリウムのアルカリ融解→弱酸遊離
(OH⁻の求核置換反応)

・塩化ベンゼンジアゾニウムの加水分解
臭素化
"臭素水に加えると白色沈殿"→フェノールの臭素化による2,4,6-トリブロモフェノール生成
ニトロ化
"混酸を加えて加熱すると黄色沈殿"→フェノールの混酸による2,4,6-トリニトロフェノール(ピクリン酸)生成
フェノールに混酸を加えて加熱するとピクリン酸生成
※ニトロ化が3回起こる
o-ニトロフェノール→p-ニトロフェノール→2,4,6-トリニトロフェノール(ピクリン酸)
※混酸 = 濃硝酸 + 濃硫酸
フェノールは置換反応がオルト・パラ位で起こりやすい
→ヒドロキシ基は電子供与性だから
※ヒドロキシ基が電子供与性なのでフェノールはふつうのベンゼンより電子密度が高くなっている→置換反応を活性化
アセチル化
酸無水物 + アルコール → エステル + カルボン酸
※+C₂H₂O (分子量42増)
-OH → -OCOCH₃
-NH₂ → -NHCOCH₃
サリチル酸
エステル化→サリチル酸メチル
アセチル化→アセチルサリチル酸

無水酢酸出てきたらアセチル化の可能性高い
サリチル酸の製法
・コルベシュミット反応
ナトリウムフェノキシドの固体をCO₂と反応
"高温高圧下で二酸化炭素と反応"→サリチル酸の製法
※-ONaが反応後-OHとなりNaは -COONaに移動
"塩化鉄(Ⅲ)水溶液を加えると赤紫色に呈色"→サリチル酸
カルボン酸
水素結合で結びついて二量体になることで安定化する。水素結合を切断する作用のない無極性溶媒中では2分子のカルボキシ基同士で分子間水素結合を形成。→会合して二量体として存在
酢酸や安息香酸の二量化(頻出)
分時間水素結合で結び点線で明示!
"還元性のある酸"→ギ酸(アルデヒド基ももつから)
"レモン果汁"→クエン酸
"還元剤として働きCO₂発生"→シュウ酸
"炭酸水素ナトリウムを加えると発泡"
→カルボン酸 (C,H,Oからなる有機化合物の場合)

酸無水物
"ジカルボン酸を加熱すると容易に脱水"→マレイン酸orフタル酸(の可能性が高い)
※酢酸→無水酢酸にはP₄O₁₀などの脱水剤が必要
※分子内脱水が起こる条件
2つのカルボキシ基が近く、脱水して生成する酸無水物が安定な五員環or六員環
マレイン酸・フマル酸(頻出)
・フマル酸は点対称な分子で無極性だから極性分子であるマレイン酸の方が水に溶けやすい
・マレイン酸は分子内で水素結合を形成するが、フマル酸は分子間で水素結合を形成するためフマル酸の方が分子間力が強く、融点が高い
エステル化
エステル化は可逆反応

"水に溶けないが、水酸化ナトリウム水溶液を加えて加熱すると水と混ざりあって均一"→エステルの加水分解
(アルコールは水溶性アルコールorフェノール類)
"水酸化ナトリウム水溶液を加えて加熱すると均一"→カルボン酸orフェノール類
"酸素とともに加熱すると分子内で脱水"→分子内でエステル形成(-COOHと-OHの位置関係特定)
エステルの加水分解で普通はカルボン酸とアルコールが出てくるはずだが,カルボン酸とケトンorアセトアルデヒド(ケト形)が出てきている場合はケトンorアセトアルデヒドを一度エノール形に直して考える
けん化は不可逆反応
(塩基による加水分解)
アニリン
アニリンの製法
・ベンゼンに混酸を加えて加熱する(ニトロ化)→ニトロベンゼン
・ニトロベンゼンにスズor鉄と塩酸を加える(ニトロベンゼンの還元)→アニリン塩酸塩
・アニリン塩酸塩に水酸化ナトリウムを加える(弱塩基遊離)→アニリン
"スズor鉄と塩酸を加える"→元の化合物は-NO₂ 、生成物は-NH₃Clをもつ
アニリンの検出
・アニリンにさらし粉を加えると赤紫色に呈色
・アニリンに二クロム酸カリウム水溶液を加えて加熱するとアニリンブラック(黒色沈澱)生成
アミド化
エステル化と同様。
アミドの加水分解によってカルボン酸とアミンに戻すことができる
アセチル化
酸無水物 + 第1級アミン → カルボン酸 + アミド
(第2級アミンも同様)
※第3級アミンはアセチル化できない
"アセチル化できない塩基性物質"→第3級アミン
ジアゾ化
氷冷下で亜硝酸ナトリウム水溶液加えるとジアゾニウム塩生成
"亜硝酸ナトリウム水溶液と反応させる"→ジアゾ化

カップリング(ベンゼン環に対する求電子置換反応)
冷やした塩化ベンゼンジアゾニウム水溶液にナトリウムフェノキシドの水溶液を加えると2つのベンゼン環がアゾ基を仲介して連結する

※この生成物の名称は p-ヒドロキシアゾベンゼン(p-フェニルアゾフェノール)、赤橙色
油脂
グリセリンと高級脂肪酸からなるトリエステル
"グリセリン"が出てきたら油脂だと思っていい
油脂に含まれる高級脂肪酸の特徴
・三重結合はない
・炭素鎖は直鎖構造
・二重結合は炭素間のみ
油脂の構造決定で注目するのは不斉炭素原子
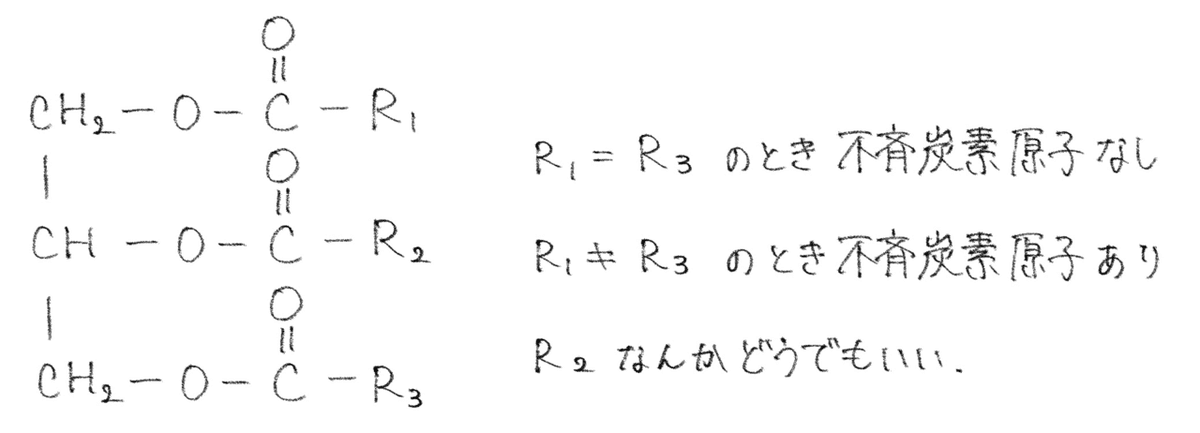
酸からH、アルコールから OH
1つ変わる→モノグリセリド
2つ変わる→ジグリセリド
3つ変わる→トリグリセリド ←油脂

油脂の分子量+3(H₂Oの分子量)=グリセリンの分子量+生じる脂肪酸の分子量の和
覚えるべき高級脂肪酸(この順番で覚えた方がいいかも)
ステアリン酸 C₁₇H₃₅COOH (単結合のみ)
オレイン酸 C₁₇H₃₃COOH (二重結合×1)
リノール酸 C₁₇H₃₁COOH (二重結合×2)
リノレン酸 C₁₇H₂₉COOH (二重結合×3)
※パルミチン酸は覚えなくてもいい
硬化油
水素が付加して硬化した油脂
油脂の硬化
水素付加で二重結合が単結合になり分子間力が強くなる→融点が下がり固体になる
※記述では、空気中に水素はほぼ存在しないから水素の付加反応は起こらない。硬化を起こすには水素と白金触媒で油脂に水素を吹き付ける人工的な操作が必要ということに気をつける
乾性油
乾燥しやすい油脂
※乾燥した後の固体を指すわけではない!
乾燥
ヨウ素価の高い油脂は空気中に放置すると徐々に酸化され分子間に架橋構造が作られ固体になる現象
※記述では、空気中の酸素が二重結合と反応することで油脂と油脂の分子間を架橋構造でつなげるという部分を述べる
架橋構造でつなぐ=共有結合で分子間をつなぐ、≠分子間力
ヨウ素価が高いと二重結合が多い、空気中の酸素が二重結合に付加して酸化、分子間に架橋構造ができる の3点を述べる
硬化油と乾性油の区別!
